Martwicze zapalenie powięzi
| Fasciitis necroticans | |
 43-letni pacjent z rozległymi zmianami na lewej nodze | |
| Klasyfikacje | |
| ICD-10 | |
|---|---|
| DiseasesDB | |
| MedlinePlus | |
| MeSH | |
Martwicze zapalenie powięzi (ang. necrotizing fasciitis, NF) – rodzaj rzadko spotykanego, ostrego zakażenia podskórnej tkanki łącznej, które szerzy się wzdłuż powięzi okrywających grupy mięśni tułowia i kończyn. Chociaż w większym stopniu chorobą są zagrożone osoby z niedoborami odporności, cukrzycą, przyjmujące dożylnie narkotyki itp., może ona rozwinąć się również u całkowicie zdrowych, młodych ludzi.
W przeciwieństwie do zgorzeli gazowej (martwicy mięśni spowodowanej przez Clostridium spp., ang. clostridial myonecrosis) infekcja ma charakter mieszany i we wczesnym etapie nie uszkadza tkanki mięśniowej. Od zwykłego zakażenia tkanki łącznej odróżnia ją gwałtowny przebieg, ciężki stan ogólny pacjenta oraz (w późniejszym okresie) objawy wstrząsu septycznego; zmiany zlokalizowane głębiej mogą nie być dostrzegalne poprzez skórę.
Historia[edytuj | edytuj kod]
Świadectwa przypadków postępującej martwicy tkanki łącznej zapisał około 500 r. p.n.e. Hipokrates. W czasach nowożytnych choroba została po raz pierwszy opisana przez chirurga armii Konfederatów, dr Josepha Jonensa w 1871 r. Francuski lekarz Jean A. Fournier w 1883 r. przeanalizował przypadki podobnych infekcji ograniczonych pierwotnie do obszaru krocza. Dr Franklin L. Meleney zidentyfikował kolejne na terenie Chin, gdzie przyczyną okazały się szczepy hemolityczne paciorkowców. W 1951 dr B. Wilson jako pierwszy użył nazwy „martwicze zapalenie powięzi” i zaproponował spójną definicję tego schorzenia.
W przeszłości posługiwano się wieloma, często niejednoznacznymi terminami na określenie podobnych stanów: róża zmartwiająca (ang. necrotizing erysipelas), zgorzel paciorkowcowa (ang. streptococcal gangrene), wysiękowe zapalenie powięzi (ang. suppurative fasciitis), wrzód Meleneya (ang. Meleney ulcer), ostra gangrena skórna (ang. acute dermal gangrene), zgorzel szpitalna (ang. hospital gangrene).
Chorobą było dotkniętych wiele znanych osób, poczynając od Heroda, króla Judei. Wiele nowszych relacji można znaleźć na stronie amerykańskiej fundacji NNFF oraz w wersji angielskiej tego hasła.
Epidemiologia[edytuj | edytuj kod]
Przyrost wiedzy o przyczynach i metodach leczenia choroby na razie nie przekłada się na spadek śmiertelności, która przez ostatnie 30 lat pozostawała na poziomie 25–30%. Zidentyfikowano wiele czynników ryzyka od których zależy powodzenie terapii; najważniejszym pozostaje długość zwłoki w interwencji chirurgicznej. Trudność w postawieniu właściwej diagnozy jest spowodowana stosunkowo rzadkim występowaniem necrotizing fasciitis; w Stanach Zjednoczonych zapada na nią rocznie ok. 1000 osób. Przyczyny wzrostu liczby notowanych incydentów pozostają niewyjaśnione.
Osoby, które przeżyły martwicze zapalenie powięzi, cierpią często z powodu komplikacji. Do najpowszechniejszych zalicza się: inne zakażenia szpitalne (76%), zespoły niewydolności oddechowej (29%) oraz ostrą niewydolność nerek (32%). Odsetek amputacji kształtuje się na poziomie 15%, jednak w pewnym badaniu u narkomanów stosujących zastrzyki dożylne wynosił aż 30%. Z powyższych powodów pacjenci potrzebują długiego okresu rekonwalescencji.
Klasyfikacja[edytuj | edytuj kod]
Wyróżnia się trzy zasadnicze odmiany martwiczego zapalenia powięzi. Podstawą podziału jest gatunek bakterii odpowiedzialnych za chorobę.
- Typ I: infekcje mieszaną florą bakteryjną; stanowią 55–75% wszystkich przypadków. Przynajmniej jeden gatunek jest ścisłym beztlenowcem (rodzaju Bacteroides lub Peptostreptococcus), towarzyszą mu organizmy fakultatywnie beztlenowe takie jak Streptococcus spp. (inne niż grupy A) czy z rodziny Enterobacteriaceae (E. coli, Enterobacter, Klebsiella, Proteus spp.). Chorują często osoby poddane immunosupresji, cierpiące na cukrzycę, otyłość, niewydolność naczyń obwodowych, zakażenie HIV, różne nałogi itp. U dzieci czynnikiem wyzwalającym zapalenie bywa zapalenie pępka (noworodki) lub przebycie ospy wietrznej (starsze). Zakażenie obejmuje okolicę krocza i tułów.
- Typ II: czynnikiem etiologicznym jest Streptococcus pyogenes (grupa A), samodzielnie albo łącznie z gronkowcem złocistym (Staphylococcus aureus). Cechami wyróżniającymi ten rodzaj zakażenia są: występowanie zespołu wstrząsu toksycznego, możliwość obecności pozaszpitalnych szczepów MRSA o zwiększonej wirulencji, lokalizacja ogniska na kończynie. Ofiarami zostają zdrowi, młodzi ludzie, czasem po przebyciu w bliskiej przeszłości operacji lub drobnego urazu.
- Typ III: niekiedy osobno wyróżnia się infekcje Vibrio vulnificus, bakterii spotykanej w ciepłych zbiornikach wodnych. Oprócz mieszkańców terenów nabrzeżnych na zwiększone ryzyko zakażenia są narażone osoby z niewydolnością wątroby. Piorunujący przebieg nie pozwala na zwłokę w podjęciu interwencji medycznej.
Patofizjologia[edytuj | edytuj kod]
Trudno określić warunki wystarczające, aby wprowadzenie niewielkiej ilości bakterii do tkanki podskórnej zakończyło się śmiercionośnym zakażeniem. Bezpośrednią przyczyną może być trywialny uraz (obtarcie, ukłucie owada, zastrzyk, czyrak) albo perforacja przewodu pokarmowego. Bakterie zaczynają wytwarzać toksyny, bezpośrednio uszkadzające pobliskie tkanki albo upośledzające odpowiedź układu immunologicznego. Do szerzej rozpoznawalnych można zaliczyć: alfa-toksynę (Clostridium spp.); białka błonowe M-1 i M-3, egzotoksyny A, B, C, streptolizynę O i superantygeny (Staphylococcus aureus oraz Streptococcus spp.) Leukocyty w odpowiedzi uwalniają cytokiny (TNF-alfa, IL-1, IL-6), które wywołują objawy stanu zapalnego, a w nadmiarze mogą prowadzić do wstrząsu i zespołu niewydolności wielonarządowej. Stan nadmiernej krzepliwości krwi wynika z aktywacji układu bradykinina-kalikreina oraz kaskady czynników krzepnięcia, prowadząc do zatykania drobnych naczynek przez aktywowane trombocyty (płytki krwi). Przewlekłe niedokrwienie sprzyja rozwojowi martwicy.
Należy zaznaczyć, że kolokwialne wyrażenia w rodzaju „bakterie pożerające ludzkie mięso” (ang. flesh–eating bacteria) są mylące i niepoprawne merytorycznie. Drobnoustroje nie odżywiają się bezpośrednio tkankami człowieka (a w szczególności – mięśniami szkieletowymi); uszkodzenia powodują toksyny wydzielane do środowiska. Sugerowano, że osoby stosujące niesteroidowe leki przeciwzapalne są narażone na nie w większym stopniu. Badania nie potwierdziły takiej zależności i obecnie zakłada się, że ich rola może polegać wyłącznie na czynieniu symptomów reakcji zapalnej trudniejszych do rozpoznania.
Obraz kliniczny[edytuj | edytuj kod]
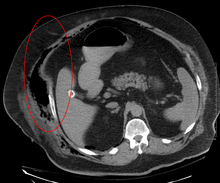
Osoby przechodzące martwicze zapalenie powięzi skarżą się na ból, napady lęku oraz nadmierną potliwość. W wywiadzie podają czasem doznanie w nieodległej przeszłości niewielkiego urazu bądź zabiegu chirurgicznego. Zwykle doświadczane dolegliwości są cięższe niż wskazywałby na to ich stan fizyczny. W miarę postępowania uszkodzeń lokalnie może się pojawić zanik czucia, a opuchlizna prowadzić do zespołu ciasnoty międzypowięziowej (ang. compartment syndrome).
Kluczowymi znaleziskami w badaniu przedmiotowym jest miejscowe zaczerwienienie z bolesnym obrzękiem. Tak mało charakterystyczny obraz choroby utrudnia odróżnienie go od zwykłego zapalenia tkanki łącznej (łac. cellulitis, nie mylić z defektem kosmetycznym skóry kończyn). Objawy ogólnoustrojowe (wstrząs, gorączka, zaburzenia świadomości) są rzadsze. Zmiany nie zawsze przybierają wygląd patognomoniczny, tj. dostrzegalnej martwicy skóry i tkanki podskórnej, owrzodzeń, dużych pęcherzy wypełnionych ciemnym płynem, trzeszczeń wskutek zbierającego się gazu (łac. crepitus). W szczególności przy infekcji Vibrio vulnificus zapaść krążeniowa następuje szybciej od uwidocznienia się rozkładu tkanek. Podejrzliwość co do etiologii schorzenia powinna wzbudzić słaba odpowiedź na podane leki oraz oznaki rozwijającego się wstrząsu czy duszności.
Badania dodatkowe[edytuj | edytuj kod]
Wyniki podstawowych badań laboratoryjnych są przydatne do oceny ciężkości zakażenia. Zwykle w morfologii krwi występuje leukocytoza, obserwuje się wzrost CRP i kreatyniny oraz spadek poziomu sodu i wapnia. Skala Laboratory Risk Indicator For Necrotizing Fasciitis pozwala ocenić łączne prawdopodobieństwo wystąpienia martwiczego zapalenia powięzi u nowo przyjętego pacjenta. Posiew krwi oraz wymaz z rany pozwalają na identyfikację patogenów.
Czujność należy również zachować przy ocenie wyników badań obrazowych. Zdjęcie RTG nie potrafi uwidocznić zmian zachodzących w głębi tkanek. Tomografia komputerowa (bez kontrastu) i MRI są standardami pozwalającymi rozpoznać zakażenie w większości wypadków. USG może ułatwić stwierdzenie przestrzeni płynowych, dostępnych do nakłucia igłą aspiracyjną. Jako niezależne narzędzie diagnostyczne nie przedstawia jednak większej wartości.
Ostatecznie rozpoznanie zostaje potwierdzone po otwarciu chirurgicznym rany. Obszerna martwica, obecność ciemnego płyn o odrzucającym zapachu, plastyczność tkanek i ich podatność na uszkodzenia to typowe obserwacje. Biopsje śródoperacyjne pomagają wyznaczyć granice obszaru resekcji; mikroskopowo widać obecność martwicy, obrzęku, nacieku z granulocytów/makrofagów, zakrzepicy w drobnych naczyniach krwionośnych itp.
Leczenie[edytuj | edytuj kod]
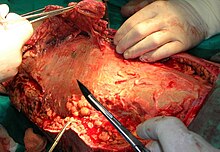
Kluczowym elementem terapii jest szybkie i dokładne opracowanie chirurgiczne rany. Tylko ono w sposób bezsprzeczny obniża śmiertelność i zapobiega dalszemu rozprzestrzenianiu się infekcji. Zabieg wiąże się z doszczętnym usunięciem tkanki nekrotycznej; zwykle ranę rewiduje się 2–3 razy. Amputację zajętej kończyny przeprowadza się w wypadku agresywnego szerzenia się choroby w kierunku tułowia lub krytycznego uszkodzenia struktur mięśniowych.
Nie ma oddzielnych zaleceń regulujących przebieg dalszego leczenia rany. Procedura nie różni się od tych przyjętych dla innych infekcji tkanki łącznej. Niektórzy rekomendują stosowanie opatrunków próżniowych (ang. vacuum-assisted closure devices) po zatrzymaniu się procesu chorobowego. Wśród maści i innych środków do oczyszczania rany wymienia się rozcieńczony roztwór podchlorynu sodu, środki na bazie jodu (w rodzaju Betadine), sole srebrowe sulfonamidów (srebrzan sulfadiazyny, mafenid) itp. Czasem nie udaje się uniknąć przeszczepów skóry lub użycia syntetycznych biopolimerów (Integra, AlloDerm) w celu pokrycia ubytków.
Równolegle do leczenia chirurgicznego wprowadza się antybiotykoterapię. Ilość i rodzaj terapeutyków różni się znacznie w zależności od wyników posiewu i stanu epidemiologicznego rejonu, w którym leży szpital. W przeszłości, przed uzyskaniem antybiogramu, wprowadzało się wysokie dawki penicyliny i klindamycyny oraz jeden ze specyfików przeciw organizmom beztlenowym (np. metronidazol). Obecnie (szczególnie w USA) w podstawowym zestawie uwzględnia się wankomycynę, linezolid, daptomycynę lub streptograminy, aby zatrzymać rozwój gronkowców szczepu MRSA. Klindamycyna nadal jest zalecana ze względu na działanie przeciwko anaerobom oraz hamowanie wytwarzania toksyn bakteryjnych. Chinolony, gentamycyna, ampicylina, karbapenemy są innymi środkami, mającymi potencjalną wartość terapeutyczną. Leczenie trwa co najmniej 10–14 dni, zależnie od szybkości poprawy klinicznej.
Dużą uwagę poświęca się rozwojowi dodatkowych możliwości terapeutycznych:
- preparaty immunoglobuliny do podawania dożylnego (ang. IV immune globulin, IVIG) mają neutralizować działanie egzotoksyn bakteryjnych, zmniejszając wielkość układowej odpowiedzi zapalnej
- terapia hiperbaryczna opiera się na zwiększeniu ciśnienia cząstkowego tlenu, który hamuje proliferację bakterii, zwiększa efektywność komórek żernych oraz przyśpiesza gojenie się ran
Niestety, dowody na skuteczność obu metod są ograniczone i oparte na małych, źle opracowanych badaniach o niskiej wartości merytorycznej.
Przypadki szczególne[edytuj | edytuj kod]
- Zgorzel Fourniera
- ang. Fournier gangrene; rodzaj martwiczego zapalenia powięzi ograniczonego pierwotnie do okolicy męskich narządów płciowych. Sprzyja jej rozwój cukrzycy, lokalne urazy, obecność załupka, nieprawidłowości budowy cewki moczowej, zakażenia i zabiegi chirurgiczne na tej okolicy. Przebieg choroby jest zbliżony do typu I NF; stosunkowo rzadko zachodzi potrzeba usunięcia jąder (mają one oddzielne źródło ukrwienia).
- Martwicze zapalenie powięzi twarzy i szyi
- szczególnie niebezpieczne formy choroby. Zakażenia okolicy głowy odpowiadają typowi II według klasyfikacji etiologicznej (gangrena paciorkowcowa); choroby szyi (trudniejsze w leczeniu) najczęściej przebiegają z rozwojem wielu gatunków bakterii (typ I).
- Synergistyczne martwicze zapalenie tkanki łącznej
- ang. synergistic necrotizing cellulitis; wariant choroby ze znacznym zajęciem skóry oraz mięśni szkieletowych. Czynnikiem etiologicznym pozostają bakterie Gram-(-) oraz anaerobowe. Generalnie przebieg jest zbliżony do typu I.
National Necrotizing Fasciitis Foundation[edytuj | edytuj kod]
National Necrotizing Fasciitis Foundation (NNFF) jest prywatną inicjatywą Donny Batdorff i Jackie Roemmele, które w przeszłości same wygrały walkę z tą chorobą. Fundacja służy pomocą pacjentom oraz nagłaśnia problem w środowisku medycznym. Na stronie internetowej gromadzone są świadectwa byłych chorych i różne publikacje naukowe.
Zobacz też[edytuj | edytuj kod]
Bibliografia[edytuj | edytuj kod]
- 90. Cellulitis, Necrotizing Fasciitis, and Subcutaneous Tissue Infections. W: Mandell, Gerald L., Bennett, John E: Mandell, Douglas, and Bennett’s principles and practice of infectious diseases 7ed. Philadelphia: Elsevier Inc., 2010. ISBN 978-0-4430-6839-3.
- 12. Surgical Infections and Choice of Antibiotics. W: Courtney M. Townsend JR, R. Daniel Beauchamp, B. Mark Evers: Sabiston Textbook of Surgery, 17th ed. Philadelphia: Saunders-Elsevier, 2004. ISBN 0-7216-0409-9.
- Babak Sarani, Michelle Strong. Necrotizing Fasciitis: Current Concepts and Review of the Literature. „J Am Coll Surg”. 2 (208), s. 279–288, February 2009. (ang.).
- Richard F. Edlich, Catherine L. Cross. Modern concepts of the diagnosis and treatment of necrotizing fasciitis. „The Journal of Emergency Medicine”. 2 (39), s. 261–265, 2010. (ang.).
- Michael E. Maynor: Emergent Management of Necrotizing Fasciitis. [w:] Medscape Reference [on-line]. Jun 9, 2011. [dostęp 2011-08-20]. (ang.).
- Robert A Schwartz: Dermatologic Manifestations of Necrotizing Fasciitis. [w:] Medscape Reference [on-line]. Jun 9, 2011. [dostęp 2011-08-20]. (ang.).
- Richard F. Edlich: Necrotizing Fasciitis and Purpura Fulminans. [w:] Medscape Reference [on-line]. Mar 4, 2010. [dostęp 2011-08-20]. (ang.).
Linki zewnętrzne[edytuj | edytuj kod]
- National Necrotizing Fasciitis Foundation – strona fundacji (wersja archiwalna)
- Necrotizing Fasciitis (DMOZ). dmoz.org. [zarchiwizowane z tego adresu (2011-11-28)]. – NF w katalogu Open Directory Project
