Tlenek osmu(VIII): Różnice pomiędzy wersjami
| [wersja nieprzejrzana] | [wersja przejrzana] |
m MalarzBOT: WPCHECK#3: wstawiam brakujący szablon {{Przypisy}} |
Napisanie od nowa |
||
| Linia 1: | Linia 1: | ||
'''Tlenek osmu(VIII)''' - nieorganiczny związek chemiczny z grupy [[tlenki|tlenków]] o wzorze OsO4. Zawiera osm [[wartościowość|ośmiowartościowy]]. Jego charakter chemiczny jest kwasowy<ref>http://www.merckmillipore.com/PL/pl/product/OsmiumVIII-oxide,MDA_CHEM-124505?RedirectedFrom=http%3A%2F%2Fwww.merckmillipore.com%2Fpoland%2Fchemicals%2Ftlenek-osmuviii%2FMDA_CHEM-124505%2Fp_BIeb.s1Ld8UAAAEWY.EfVhTl&ReferrerURL=https%3A%2F%2Fpl.wikipedia.org%2F</ref>. |
|||
{{Związek chemiczny infobox |
{{Związek chemiczny infobox |
||
|nazwa = Tlenek osmu(VIII) |
|nazwa = Tlenek osmu(VIII) |
||
| Linia 10: | Linia 8: | ||
|opis 3. grafiki = |
|opis 3. grafiki = |
||
|nazwa konstytucyjna = tlenek osmu(VIII), tetratlenek osmu |
|nazwa konstytucyjna = tlenek osmu(VIII), tetratlenek osmu |
||
| |
|nazwa Stocka = tlenek osmu(VIII) |
||
|inne nazwy = czterotlenek osmu (dawn.) |
|||
|wzór sumaryczny = OsO<sub>4</sub> |
|wzór sumaryczny = OsO<sub>4</sub> |
||
|inne wzory = |
|inne wzory = |
||
|masa molowa = 254 |
|masa molowa = 254,23 |
||
|wygląd = białe |
|wygląd = białe, błyszczące kryształy{{r|Grube2}} o nieprzyjemnym zapachu{{r|MSDS}} |
||
|SMILES = |
|SMILES = |
||
|numer CAS = |
|numer CAS = |
||
|PubChem = |
|PubChem = {{PubChem|30318}} |
||
|DrugBank = |
|DrugBank = |
||
|gęstość = |
|gęstość = 5,1 g/cm<sup>3</sup> |
||
|gęstość źródło = |
|gęstość źródło ={{r|Patnaik2003}} |
||
|stan skupienia w podanej g = |
|stan skupienia w podanej g = ciało stałe{{r|Patnaik2003}} |
||
|g warunki niestandardowe = |
|g warunki niestandardowe = |
||
|rozpuszczalność w wodzie = |
|rozpuszczalność w wodzie = 72,4 g/l |
||
|rww źródło = |
|rww źródło = {{r|Patnaik2003}} |
||
|rww warunki niestandardowe = |
|rww warunki niestandardowe = |
||
|inne rozpuszczalniki = |
|inne rozpuszczalniki = rozpuszczalny w większości rozpuszczalników organicznych{{r|Patnaik2003}} |
||
|temperatura topnienia = |
|temperatura topnienia = 40,6 |
||
|tt źródło = |
|tt źródło = {{r|Patnaik2003}} |
||
|tt warunki niestandardowe = |
|tt warunki niestandardowe = |
||
|temperatura wrzenia = |
|temperatura wrzenia = 129,7 |
||
|tw źródło = |
|tw źródło = {{r|Patnaik2003}} |
||
|tw warunki niestandardowe = |
|tw warunki niestandardowe = |
||
|temperatura krytyczna = |
|temperatura krytyczna = 405 |
||
|tk źródło = |
|tk źródło = {{r|Patnaik2003}} |
||
|ciśnienie krytyczne = |
|ciśnienie krytyczne = 170 |
||
|ck źródło = |
|ck źródło = {{r|Patnaik2003}} |
||
|logP = |
|logP = |
||
|kwasowość = |
|kwasowość = |
||
| Linia 49: | Linia 48: | ||
|moment dipolowy = |
|moment dipolowy = |
||
|moment dipolowy źródło = |
|moment dipolowy źródło = |
||
|karta charakterystyki = |
|karta charakterystyki = {{Sigma-Aldrich|O5500|Sigma|link=tak| data dostępu = 2019-05-28}} |
||
|zagrożenia GHS źródło = |
|zagrożenia GHS źródło = MSDS |
||
|piktogram GHS = |
|piktogram GHS = {{Piktogram GHS|05|06|08}} |
||
|hasło GHS = |
|hasło GHS = Dgr |
||
|zwroty H = |
|zwroty H = {{Zwroty H|300|310|314|330|334}} |
||
|zwroty EUH = |
|zwroty EUH = {{Zwroty EUH|brak}} |
||
|zwroty P = |
|zwroty P = {{Zwroty P|260|264|280|284|301+310|302+350}} |
||
|NFPA 704 = |
|NFPA 704 = |
||
|NFPA 704 źródło = |
|NFPA 704 źródło = |
||
| Linia 64: | Linia 63: | ||
|ts źródło = |
|ts źródło = |
||
|ts warunki niestandardowe = |
|ts warunki niestandardowe = |
||
|numer RTECS = |
|numer RTECS = RN1140000 |
||
|dawka śmiertelna = |
|dawka śmiertelna = LD<sub>50</sub>=162 mg/kg (mysz, doustnie){{r|Patnaik2003}} |
||
|pochodne = |
|pochodne = |
||
|podobne związki = [[tlenek |
|podobne związki = [[tlenek rutenu(VIII)]] |
||
|commons = |
|commons = |
||
}} |
}} |
||
'''Tlenek osmu(VIII)''' {{chem2|OsO4}} – [[związki nieorganiczne|nieorganiczny związek chemiczny]] z grupy [[tlenki|tlenków]], w którym [[osm]] występuje na VIII [[stopień utlenienia|stopniu utlenienia]]. Jest półproduktem w otrzymywaniu osmu z rud, a w chemii organicznej stosowany jest jako utleniacz w [[dihydroksylacja|dihydroksylacji]] [[Olefiny|olefin]]. |
|||
== |
== Otrzymywanie == |
||
Otrzymać go można kilkoma metodami: |
|||
Działa szkodliwie po połknięciu, parzy [[skóra|skórę]], [[drogi oddechowe]] i [[przełyk]]. Zanieczyszczone [[oko|oczy]] należy przemyć natychmiast dużą ilością [[woda|wody]]. W przypadku złego samopoczucia należy zasięgnąć porady [[lekarz|lekarza]] i w miarę możliwości pokazać etykietę opakowania. [[substancja|Substancję]] przechowywać w oryginalnym opakowaniu, dobrze wentylowanym miejscu, najlepiej bez dostępu [[światło|światła]]. Przy pracy z tą substancją należy stosować odpowiednie ubranie ochronne<ref>http://www.merckmillipore.com/PL/pl/product/OsmiumVIII-oxide,MDA_CHEM-124505?RedirectedFrom=http%3A%2F%2Fwww.merckmillipore.com%2Fpoland%2Fchemicals%2Ftlenek-osmuviii%2FMDA_CHEM-124505%2Fp_BIeb.s1Ld8UAAAEWY.EfVhTl&ReferrerURL=https%3A%2F%2Fpl.wikipedia.org%2F</ref>. |
|||
* [[utlenianie]] wodnych roztworów związków osmu, np. [[osmian(VI) sodu|osmianu sodu]], {{chem2|Na2OsO4}}, za pomocą stężonego [[Kwas azotowy|kwasu azotowego]], a następnie wydzielenie lotnego {{chem2|OsO4}} przez destylację (metoda przemysłowa){{r|Patnaik2003}}; |
|||
* utlenianie [[chlorek osmu(IV)|chlorku osmu(IV)]], {{chem2|OsCl4}}, za pomocą roztworu [[Podchloryn sodu|podchlorynu sodu]]{{r|Patnaik2003}}; |
|||
* ogrzewanie rozdrobnionego osmu metalicznego w [[tlen]]ie w temp. {{C|300–400}}{{r|Patnaik2003}}. Metoda te jest najbardziej użyteczna w warunkach laboratoryjnych. Powstający gazowy {{chem2|OsO4}} ulega kondensacji w schłodzonej części aparatury tworząc białe, błyszczące kryształy{{r|Grube2}}. |
|||
== Właściwości == |
|||
Tlenek osmu(VIII) jest białym lub żółtawym krystalicznym ciałem stałym{{r|Grube2}} o niskiej temperaturze topnienia ({{C|40,6}}) i wrzenia ({{C|129,7}}). Rozpuszcza się w wodzie (bez rozkładu{{r|Grube2}}) i w większości rozpuszczalników organicznych{{r|Patnaik2003}}. Można przeprowadzać go w stan gazowy w warunkach [[Destylacja z parą wodną|destylacji z parą wodną]]{{r|Grube2}}. Jest silnie trujący w każdej formie dostania się do organizmu{{r|Patnaik2003}}. Ma nieprzyjemny{{r|MSDS}} zapach przypominający chlor{{r|PubChem}}. Jest odporny na działanie światła i może być przechowywany bez ograniczeń w naczyniach z bezbarwnego szkła{{r|Grube2}}. Jest też stabilny termicznie, dopiero w temperaturze powyżej {{C|800}} ulega rozkładowi do {{chem2|[[tlenek osmu(VI)|OsO3]]}}; natomiast ogrzewany z metalicznym osmem daje {{chem2|[[tlenek osmu(IV)|OsO2]]}}{{r|Patnaik2003}}. |
|||
Ulega redukcji [[Wodór|wodorem]], na zimno do {{chem2|[[Tlenek osmu(IV)|OsO2]]}}, na gorąco do wolnego osmu{{r|Grube1}}. |
|||
Reaguje ze stężonym [[Kwas solny|kwasem solnym]] z wydzieleniem [[chlor]]u{{r|Grube2}}. Z [[Wodorotlenki|wodorotlenkami]] [[Litowce|potasowców]] daje [[sole]] o wzorze {{chem2|''Me''2OsO4(OH)2}} oraz – w przypadku {{chem2|[[wodorotlenek rubidu|RbOH]]}} i {{chem2|[[wodorotlenek cezu|CsOH]]}} – {{chem2|''Me''OsO4(OH)}} i in. Reaguje też [[Fluorki|fluorkami]] tworząc jony {{chem2|[OsO4F2](2-)}}, a z [[amoniak]]iem wobec alkaliów daje anion {{chem2|[N\tOsO3](-)}}. Z licznymi [[Związki organiczne|związkami organicznymi]] tworzy rozmaite [[związki kompleksowe]]{{r|Patnaik2003}}. |
|||
== Zastosowanie == |
|||
;Otrzymywanie osmu |
|||
Tlenek osmu(VIII) jest półproduktem w otrzymywaniu osmu z minerałów zawierających inne [[VIII grupa poboczna|platynowce]], zwłaszcza do oddzielania soli osmu od związków [[ruten]]u. Wykorzystuje się tu fakt, że w wyniku utleniania kwasem azotowym roztworów {{chem2|Os^{VI} }} powstaje lotny {{chem2|OsO4}}, podczas gdy jony {{chem2|Ru^{VI} }} dają kompleksy z kwasem azotowym. Po oddestylowaniu {{chem2|OsO4}} rozpuszcza się go w w wodnym roztworze [[wodorotlenek sodu|NaOH]] z dodatkiem [[etanol]]u i dodaje [[chlorek amonu]]. Prowadzi to wytrącenia się kompleksu {{chem2|OsO2(NH3)4Cl2}}, który redukuje się wodorem do metalicznego osmu{{r|Patnaik2003}}. |
|||
;Dihydroksylacja |
|||
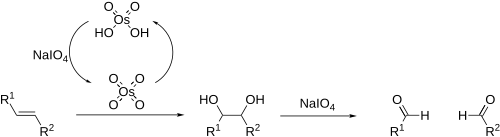
W chemii organicznej stosowany jest do [[dihydroksylacja|dihydroksylacji]] wiązania podwójnego C=C z wytworzeniem [[diole|dioli]] wicynalnych, C(OH)−C(OH){{r|Patnaik2003}}: |
|||
:[[Plik:Dihydroxylation with OsO4.png|lewo|600px|Dihydroksylacja]] |
|||
{{clear|left}} |
|||
Pierwszym etapem reakcji jest [[cykloaddycja]] [3+2] prowadząca do cyklicznego [[estry|diestru]] osmianowego(VI){{refn|grupa=uwaga|Inny możliwy mechanizm powstawania diestru osmianowego to cykloaddycja [2+2], w wyniku której powstaje tylko jedno wiązanie estrowe C−O−Os, natomiast drugi atom węgla łączy się bezpośrednio z atomem osmu wiązaniem C−Os. Czteroczłonowy produkt cykliczny ulega następnie przegrupowaniu do pięcioczłonowego diestru{{r|Bruckner562}}.}}, który ulega następnie hydrolizie, np. za pomocą roztworu {{chem2|[[siarczyn sodu|Na2SO3]]}} do diolu{{r|Hornback}}. Zamiast {{chem2|OsO4}} w reakcji tej można stosować [[nadmanganian potasu]], {{chem2|KMnO4}}, który jest tańszy i bezpieczniejszy, jednak wydajności produktów są niższe. Mechanizm procesu jest analogiczny{{r|Savin}}. |
|||
Reakcję tę prowadzi się zwykle wobec dodatkowych utleniaczy, np. {{chem2|[[Żelazicyjanek potasu|K4Fe(CN)6]]}}, dzięki czemu drogi i trujący {{chem2|OsO4}} jest regenerowany w mieszaninie reakcyjnej i można używać go w ilościach [[katalizator|katalitycznych]]{{r|Minato|OrgSyn}}. W obecności [[chiralność cząsteczek|chiralnych]] [[ligand (chemia)|ligandów]] reakcja ta przebiega [[stereoselektywność|stereoselektywnie]], umożliwiając otrzymywanie dioli chiralnych o określonej [[Konfiguracja absolutna|konfiguracji]]{{r|Kolb}}. Reakcja ta znana jest jako [[asymetryczna dihydroksylacja Sharplessa]]{{r|Mundy}}: |
|||
[[Plik:Sharpless Dihydroxylation Mechanism.png|550px|left|Mechanizm dihydroksylacji Sharplessa]] |
|||
{{clear|left}} |
|||
Jeżeli dihydroksylację prowadzi się w obecności [[Nadjodan sodu|nadjodanu sodu]], pełni on rolę utleniacza odtwarzającego {{chem2|OsO4}}, a jednocześnie powoduje rozerwanie wiązania C(OH)−C(OH). W efekcie olefina przekształcana jest w dwie cząsteczki [[aldehydy|aldehydów]] ([[utlenianie Lemieux–Johnsona]]){{r|L-J|Bruckner566}}: |
|||
:[[Plik:Lemieux–Johnson oxidation.svg|lewo|500px|Utlenianie Lemieux–Johnsona]] |
|||
{{clear|left}} |
|||
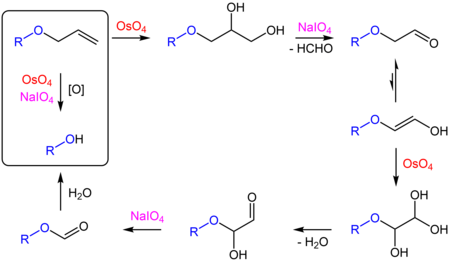
Reakcję tę wykorzystuje się do usuwania [[grupa allilowa|allilowych]] [[grupa ochronna|grup ochronnych]] [[Alkohole|alkoholi]] ({{chem2|RO\sCH2\sCH\dCH2 → ROH}}) i [[Aminy|amin]] ({{chem2|RNH\sCH2\sCH\dCH2 → RNH2}}). Mechanizm reakcji jest następujący{{r|Kitov}}: |
|||
:[[Plik:Allyl Group Oxidative Cleavage.png|lewo|450px|Oksydatywne usuwanie grupy allylowej]] |
|||
{{clear|left}} |
|||
;Mikroskopia |
|||
Tlenek osmu(VIII) jest też stosowany w mikroskopii do utrwalenia i barwienia preparatów biologicznych{{r|Patnaik2003}}. |
|||
== Uwagi == |
|||
{{Uwagi}} |
|||
== Przypisy == |
== Przypisy == |
||
{{Przypisy |
{{Przypisy| |
||
* <ref name="Minato">{{cytuj|autor=Makoto Minato, Keiji Yamamoto, Jiro Tsuji|tytuł=Osmium tetraoxide catalyzed vicinal hydroxylation of higher olefins by using hexacyanoferrate(III) ion as a cooxidant|czasopismo=The Journal of Organic Chemistry|data=1990|wolumin=55|numer=2|s=766–768|doi=10.1021/jo00289a066|język=en|dostęp=z}}</ref> |
|||
* <ref name="OrgSyn">{{cytuj|autor=Javier Gonzalez, Christine Aurigemma, Larry Truesdale|tytuł=Synthesis of (+)-(1S,2R)- and (−)-(1R,2S)-trans-2-phenylcyclohexanol via Sharpless asymmetric dihydroxylation (AD)|czasopismo=Organic Syntheses|data=2002|wolumin=79|s=93|doi=10.15227/orgsyn.079.0093}}</ref> |
|||
* <ref name="Grube1">{{cytuj|tytuł=Handbook of Preparative Inorganic Chemistry|redaktor=Georg Brauer|wydawca=Academic Press|miejsce=New York • London|data=1965|s=1603|rozdział=Osmium (IV) Oxide|autor r=H.L. Grube|wolumin=2}}</ref> |
|||
* <ref name="Grube2">{{cytuj|tytuł=Handbook of Preparative Inorganic Chemistry|redaktor=Georg Brauer|wydawca=Academic Press|miejsce=New York • London|data=1965|s=1603–1604|rozdział=Osmium (VIII) Oxide|autor r=H.L. Grube|wolumin=2}}</ref> |
|||
* <ref name="Kolb">{{cytuj|autor=Hartmuth C. Kolb, Michael S. VanNieuwenhze, K. Barry Sharpless|tytuł=Catalytic Asymmetric Dihydroxylation|czasopismo=Chemical Reviews|data=1994|wolumin=94|numer=8|s=2483–2547|doi=10.1021/cr00032a009|język=en|dostęp=z}}</ref> |
|||
* <ref name="MSDS">{{Sigma-Aldrich|O5500|Sigma|MSDS=tak| data dostępu = 2019-05-28}}</ref> |
|||
* <ref name="Mundy">{{cytuj|autor=Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro|tytuł=Name Reactions and Reagents in Organic Synthesis|data=2005|isbn=9780471739876|miejsce=Hoboken, NJ, USA|wydawca=John Wiley & Sons, Inc.|doi=10.1002/9780471739876|język=en|dostęp=z}}</ref> |
|||
* <ref name="Patnaik2003">{{Patnaik2003|strony= 671–674|rozdział= Osmium tetroxide}}</ref> |
|||
* <ref name="L-J">{{Cytuj |autor = R. Pappo, D. S. Allen, Jr., R. U. Lemieux, W. S. Johnson |tytuł = Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds |czasopismo = The Journal of Organic Chemistry |data = 1956|wolumin = 21 |numer = 4 |s = 478–479 |doi = 10.1021/jo01110a606 |język = en|dostęp=z}}</ref> |
|||
* <ref name="Hornback">{{Cytuj | autor = Joseph M. Hornback | tytuł = Organic Chemistry | wydanie = 2 | wydawca = Thomson Brooks/Cole | data = 2006 | s = 439 | isbn = 0-534-38951-1| język = en}}</ref> |
|||
* <ref name="Bruckner562">{{cytuj |autor= Reinhard Bruckner | tytuł = Organic Mechanisms. Reactions, Stereochemistry and Synthesis | wydawca = Springer | miejsce = Berlin Heidelberg | data = 2010 | s= 562–563 | isbn = 978-3-642-03650-7 | doi = 10.1007/978-3-642-03651-4|rozdział=The cis-vic Dihydroxylation of Alkenes: No Oxidative Cleavage, but an Important Prelude| język = en|dostęp=z}}</ref> |
|||
* <ref name="Bruckner566">{{cytuj |autor= Reinhard Bruckner | tytuł = Organic Mechanisms. Reactions, Stereochemistry and Synthesis | wydawca = Springer | miejsce = Berlin Heidelberg | data = 2010 | s= 566–567 | isbn = 978-3-642-03650-7 | doi = 10.1007/978-3-642-03651-4|rozdział=Oxidative Cleavage of Alkenes| język = en|dostęp=z}}</ref> |
|||
* <ref name="Savin">{{Cytuj | autor = Kenneth A. Savin | tytuł = Writing Reaction Mechanisms in Organic Chemistry | wydawca = Elsevier/Academic Press | data = 2015 | s = 366–367 | isbn = 978-0-12-411475-3 | doi = 10.1016/C2012-0-07415-7 | wydanie=3|język = en|dostęp=z}}</ref> |
|||
* <ref name=Kitov>{{Cytuj |autor = Pavel I. Kitov, David R. Bundle |tytuł = Mild Oxidative One-Pot Allyl Group Cleavage |czasopismo = Organic Letters |data = 2001|wolumin = 3 |numer = 18 |s = 2835–2838 |doi = 10.1021/ol016278t |język = en|dostęp=z}}</ref> |
|||
}} |
|||
Wersja z 15:41, 28 maj 2019
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
OsO4 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
254,23 g/mol | ||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| PubChem |
{{{nazwa}}}, [w:] PubChem, United States National Library of Medicine, CID: (ang.). | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Tlenek osmu(VIII) OsO
4 – nieorganiczny związek chemiczny z grupy tlenków, w którym osm występuje na VIII stopniu utlenienia. Jest półproduktem w otrzymywaniu osmu z rud, a w chemii organicznej stosowany jest jako utleniacz w dihydroksylacji olefin.
Otrzymywanie
Otrzymać go można kilkoma metodami:
- utlenianie wodnych roztworów związków osmu, np. osmianu sodu, Na
2OsO
4, za pomocą stężonego kwasu azotowego, a następnie wydzielenie lotnego OsO
4 przez destylację (metoda przemysłowa)[3]; - utlenianie chlorku osmu(IV), OsCl
4, za pomocą roztworu podchlorynu sodu[3]; - ogrzewanie rozdrobnionego osmu metalicznego w tlenie w temp. 300–400 °C[3]. Metoda te jest najbardziej użyteczna w warunkach laboratoryjnych. Powstający gazowy OsO
4 ulega kondensacji w schłodzonej części aparatury tworząc białe, błyszczące kryształy[1].
Właściwości
Tlenek osmu(VIII) jest białym lub żółtawym krystalicznym ciałem stałym[1] o niskiej temperaturze topnienia (40,6 °C) i wrzenia (129,7 °C). Rozpuszcza się w wodzie (bez rozkładu[1]) i w większości rozpuszczalników organicznych[3]. Można przeprowadzać go w stan gazowy w warunkach destylacji z parą wodną[1]. Jest silnie trujący w każdej formie dostania się do organizmu[3]. Ma nieprzyjemny[2] zapach przypominający chlor[4]. Jest odporny na działanie światła i może być przechowywany bez ograniczeń w naczyniach z bezbarwnego szkła[1]. Jest też stabilny termicznie, dopiero w temperaturze powyżej 800 °C ulega rozkładowi do OsO
3; natomiast ogrzewany z metalicznym osmem daje OsO
2[3].
Ulega redukcji wodorem, na zimno do OsO
2, na gorąco do wolnego osmu[5].
Reaguje ze stężonym kwasem solnym z wydzieleniem chloru[1]. Z wodorotlenkami potasowców daje sole o wzorze Me
2OsO
4(OH)
2 oraz – w przypadku RbOH i CsOH – MeOsO
4(OH) i in. Reaguje też fluorkami tworząc jony [OsO
4F
2]2−
, a z amoniakiem wobec alkaliów daje anion [N≡OsO
3]−
. Z licznymi związkami organicznymi tworzy rozmaite związki kompleksowe[3].
Zastosowanie
- Otrzymywanie osmu
Tlenek osmu(VIII) jest półproduktem w otrzymywaniu osmu z minerałów zawierających inne platynowce, zwłaszcza do oddzielania soli osmu od związków rutenu. Wykorzystuje się tu fakt, że w wyniku utleniania kwasem azotowym roztworów OsVI
powstaje lotny OsO
4, podczas gdy jony RuVI
dają kompleksy z kwasem azotowym. Po oddestylowaniu OsO
4 rozpuszcza się go w w wodnym roztworze NaOH z dodatkiem etanolu i dodaje chlorek amonu. Prowadzi to wytrącenia się kompleksu OsO
2(NH
3)
4Cl
2, który redukuje się wodorem do metalicznego osmu[3].
- Dihydroksylacja
W chemii organicznej stosowany jest do dihydroksylacji wiązania podwójnego C=C z wytworzeniem dioli wicynalnych, C(OH)−C(OH)[3]:
Pierwszym etapem reakcji jest cykloaddycja [3+2] prowadząca do cyklicznego diestru osmianowego(VI)[a], który ulega następnie hydrolizie, np. za pomocą roztworu Na
2SO
3 do diolu[7]. Zamiast OsO
4 w reakcji tej można stosować nadmanganian potasu, KMnO
4, który jest tańszy i bezpieczniejszy, jednak wydajności produktów są niższe. Mechanizm procesu jest analogiczny[8].
Reakcję tę prowadzi się zwykle wobec dodatkowych utleniaczy, np. K
4Fe(CN)
6, dzięki czemu drogi i trujący OsO
4 jest regenerowany w mieszaninie reakcyjnej i można używać go w ilościach katalitycznych[9][10]. W obecności chiralnych ligandów reakcja ta przebiega stereoselektywnie, umożliwiając otrzymywanie dioli chiralnych o określonej konfiguracji[11]. Reakcja ta znana jest jako asymetryczna dihydroksylacja Sharplessa[12]:

Jeżeli dihydroksylację prowadzi się w obecności nadjodanu sodu, pełni on rolę utleniacza odtwarzającego OsO
4, a jednocześnie powoduje rozerwanie wiązania C(OH)−C(OH). W efekcie olefina przekształcana jest w dwie cząsteczki aldehydów (utlenianie Lemieux–Johnsona)[13][14]:
Reakcję tę wykorzystuje się do usuwania allilowych grup ochronnych alkoholi (RO−CH
2−CH=CH
2 → ROH) i amin (RNH−CH
2−CH=CH
2 → RNH
2). Mechanizm reakcji jest następujący[15]:
- Mikroskopia
Tlenek osmu(VIII) jest też stosowany w mikroskopii do utrwalenia i barwienia preparatów biologicznych[3].
Uwagi
- ↑ Inny możliwy mechanizm powstawania diestru osmianowego to cykloaddycja [2+2], w wyniku której powstaje tylko jedno wiązanie estrowe C−O−Os, natomiast drugi atom węgla łączy się bezpośrednio z atomem osmu wiązaniem C−Os. Czteroczłonowy produkt cykliczny ulega następnie przegrupowaniu do pięcioczłonowego diestru[6].
Przypisy
- ↑ a b c d e f g H.L. Grube, Osmium (VIII) Oxide, [w:] Georg Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York • London: Academic Press, 1965, s. 1603–1604.
- ↑ a b Tlenek osmu(VIII) (nr O5500) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2019-05-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b c d e f g h i j k l m n o p q r s Osmium tetroxide, [w:] Pradyot Patnaik, Handbook of Inorganic Chemicals, London: McGraw-Hill, 2003, s. 671–674, ISBN 0-07-049439-8 (ang.).
- ↑ Błąd w przypisach: Błąd w składni elementu
<ref>. Brak tekstu w przypisie o nazwiePubChemBŁĄD PRZYPISÓW - ↑ H.L. Grube, Osmium (IV) Oxide, [w:] Georg Brauer (red.), Handbook of Preparative Inorganic Chemistry, t. 2, New York • London: Academic Press, 1965, s. 1603.
- ↑ The cis-vic Dihydroxylation of Alkenes: No Oxidative Cleavage, but an Important Prelude, [w:] Reinhard Bruckner, Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin Heidelberg: Springer, 2010, s. 562–563, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Joseph M. Hornback, Organic Chemistry, wyd. 2, Thomson Brooks/Cole, 2006, s. 439, ISBN 0-534-38951-1 (ang.).
- ↑ Kenneth A. Savin, Writing Reaction Mechanisms in Organic Chemistry, wyd. 3, Elsevier/Academic Press, 2015, s. 366–367, DOI: 10.1016/C2012-0-07415-7, ISBN 978-0-12-411475-3 (ang.).
- ↑ Makoto Minato, Keiji Yamamoto, Jiro Tsuji, Osmium tetraoxide catalyzed vicinal hydroxylation of higher olefins by using hexacyanoferrate(III) ion as a cooxidant, „Journal of Organic Chemistry”, 55 (2), 1990, s. 766–768, DOI: 10.1021/jo00289a066 (ang.).
- ↑ Javier Gonzalez, Christine Aurigemma, Larry Truesdale, Synthesis of (+)-(1S,2R)- and (−)-(1R,2S)-trans-2-phenylcyclohexanol via Sharpless asymmetric dihydroxylation (AD), „Organic Syntheses”, 79, 2002, s. 93, DOI: 10.15227/orgsyn.079.0093.
- ↑ Hartmuth C. Kolb, Michael S. VanNieuwenhze, K. Barry Sharpless, Catalytic Asymmetric Dihydroxylation, „Chemical Reviews”, 94 (8), 1994, s. 2483–2547, DOI: 10.1021/cr00032a009 (ang.).
- ↑ Bradford P. Mundy, Michael G. Ellerd, Frank G. Favaloro, Name Reactions and Reagents in Organic Synthesis, Hoboken, NJ, USA: John Wiley & Sons, Inc., 2005, DOI: 10.1002/9780471739876, ISBN 978-0-471-73987-6 (ang.).
- ↑ R. Pappo i inni, Osmium Tetroxide-Catalyzed Periodate Oxidation of Olefinic Bonds, „Journal of Organic Chemistry”, 21 (4), 1956, s. 478–479, DOI: 10.1021/jo01110a606 (ang.).
- ↑ Oxidative Cleavage of Alkenes, [w:] Reinhard Bruckner, Organic Mechanisms. Reactions, Stereochemistry and Synthesis, Berlin Heidelberg: Springer, 2010, s. 566–567, DOI: 10.1007/978-3-642-03651-4, ISBN 978-3-642-03650-7 (ang.).
- ↑ Pavel I. Kitov, David R. Bundle, Mild Oxidative One-Pot Allyl Group Cleavage, „Organic Letters”, 3 (18), 2001, s. 2835–2838, DOI: 10.1021/ol016278t (ang.).