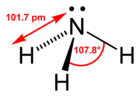Amoniak
| |||||||||||||||||||||||||||||||||||||||||
 butla ze sprężonym amoniakiem | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
NH | ||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
17,03 g/mol | ||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwny gaz o charakterystycznym drażniącym zapachu | ||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||
Amoniak (nazwy systematyczne: azan, trihydrydoazot[1]), NH
3 – nieorganiczny związek chemiczny azotu i wodoru.
Budowa cząsteczki[edytuj | edytuj kod]
Cząsteczka amoniaku ma strukturę tetraedryczną. Kształt cząsteczki amoniaku przypomina piramidę trygonalną, jednak niewiążąca wolna para elektronowa n na atomie azotu znajduje się na czwartym zhybrydyzowanym orbitalu typu sp³. Pozostałe trzy orbitale stanowią wiązania z atomami wodoru[8]. Obecność wolnej pary elektronowej powoduje niewielkie zniekształcenie tetraedrycznej struktury, gdyż odpychanie elektronów pary n jest silniejsze niż tych, tworzących wiązania N−H. Z tego względu kąt między wiązaniami jest nieco mniejszy (106°45′) niż np. między wiązaniami C−H w cząsteczce metanu (109°28′). Z kolei w cząsteczce wody, która zawiera dwie pary niewiążące n kąt między wiązaniami O−H jest jeszcze mniejszy (104°45′) niż w cząsteczce amoniaku[9]. Struktura cząsteczki amoniaku i większość jego pochodnych (amin) nie jest jednak stereochemicznie stabilna to znaczy ulega ona tzw. inwersji parasolowej, w której cząsteczka „przewraca się na drugą stronę” jak parasol na silnym wietrze, a wolna para elektronowa n przeskakuje na drugą stronę płaszczyzny cząsteczki.
Z powodu stosunkowo dużej różnicy elektroujemności między atomem azotu i wodoru (0,84 według skali Paulinga) oraz asymetrycznej budowie, cząsteczka amoniaku ma dość duży moment dipolowy (μ = 1,47 D). Polarność cząsteczek amoniaku jest przyczyną tworzenia się między nimi wiązań wodorowych.
Otrzymywanie[edytuj | edytuj kod]
W naturze amoniak powstaje jako produkt gnicia substancji białkowych. Do celów laboratoryjnych można otrzymać go w wyniku działania mocnych zasad na sole amonowe w podwyższonej temperaturze, np.:
- 2NH
4Cl + Ca(OH)
2 → CaCl
2 + 2NH
3 + 2H
2O
Inną, rzadszą metodą jest hydroliza azotków:
- Mg
3N
2 + 6H
2O → 3Mg(OH)
2 + 2NH
3
W przemyśle amoniak otrzymuje się głównie bezpośrednio z pierwiastków metodą Habera i Boscha (90% produkcji światowej)[10]. Wcześniej do przemysłowego otrzymywania amoniaku stosowano reakcję hydrolizy cyjanamidu wapnia (otrzymywanego z karbidu i azotu), był to jednak proces bardzo energochłonny (190 GJ/t amoniaku)[10][11]:
Amoniak można też otrzymać przez suchą destylację niektórych roślin i produktów zwierzęcych oraz redukcję kwasu azotawego i jego soli wodorem in statu nascendi.
Właściwości[edytuj | edytuj kod]
Palność[edytuj | edytuj kod]
Amoniak jest palny (temperatura samozapłonu: 630 °C). Spala się żółtawym płomieniem na azot i wodę[12]:
- 4NH
3 + 3O
2 → 2N
2 + 6H
2O
Spalanie ustaje po usunięciu płomienia. Mieszaniny z powietrzem (16–27% obj. NH
3) są wybuchowe[12].
Jeśli spalanie prowadzi się w obecności platyny jako katalizatora, produktem nie jest azot, lecz tlenek azotu[12]:
- 4NH
3 + 5O
2 → 4NO + 6H
2O
Proces ten znany jest jako metoda Ostwalda i stosowany jest w produkcji nawozów sztucznych[12].
Aktywność chemiczna gazowego amoniaku[edytuj | edytuj kod]
W stanie gazowym, powyżej 700 °C amoniak ma silne właściwości redukujące, co jest spowodowane jego dysocjacją termiczną z wydzieleniem wodoru. W niższych temperaturach jest stabilny chemicznie. Po dłuższym kontakcie z rtęcią, srebrem i halogenami wilgotny amoniak tworzy związki wybuchowe wrażliwe na uderzenia.
Rozpuszczalność[edytuj | edytuj kod]
Amoniak bardzo dobrze rozpuszcza się w wodzie tworząc wodę amoniakalną – w warunkach normalnych 1 objętość wody może rozpuścić 1176 objętości amoniaku, jednak w temperaturze 20 °C będą to już 702 objętości. W roztworach wodnych amoniak hydrolizuje według równania:
- NH
3 + H
2O → NH+
4 + OH−
Stała Kb tej reakcji wynosi 1,81×10−5.
Ciekły amoniak jako rozpuszczalnik[edytuj | edytuj kod]
Ciekły amoniak wykazuje wiele podobieństw do wody. Analogicznie do niej autodysocjuje według równania:
- 2NH
3 → NH+
4 + NH−
2
Stała Ki tej autodysocjacji w temperaturze −50 °C wynosi 10−30. Kation amonowy (NH+
4) jest słabszym kwasem (według definicji Brønsteda i Lowry’ego) niż kation hydroniowy (H
3O+
), a anion amidkowy (NH−
2) jest silniejszą zasadą niż jon wodorotlenowy OH−
, co powoduje, że nawet słabe kwasy silnie dysocjują w amoniaku, a silne zasady dysocjują słabo.
Ciekły amoniak rozpuszcza metale alkaliczne i metale ziem alkalicznych z wytworzeniem kolorowych, silnie redukujących, przewodzących prąd roztworów. Kolor roztworu zmienia się wraz ze stężeniem jonów metalu. Przy małym stężeniu roztwór jest niebieski, przy zatężeniu zmienia barwę na brązową.
Związki amoniaku[edytuj | edytuj kod]
Ze względu na hydrolizę amoniaku, jego roztwory wodne mają odczyn zasadowy i reagują z kwasami tworząc sole, w których skład wchodzi jon amonowy, np. azotan amonu czy siarczan amonu. W reakcji gazowego amoniaku z gazowym chlorowodorem powstaje chlorek amonu. Reakcja ta zachodzi przy niewielkim udziale wilgoci.
W wyniku wymiany jednego, dwóch lub trzech atomów wodoru przez atomy metali powstają kolejno: analogiczne do zasad amidki (np. amidek sodu, NaNH
2, czy amidek potasu, KNH
2), imidki (np. imidek wapnia, CaNH) i (analogiczne do tlenków) azotki (np. azotek magnezu, Mg
3N
2). Wszystkie te związki łatwo hydrolizują na odpowiednie zasady i amoniak.
Z niektórymi solami amoniak tworzy analogiczne do hydratów amoniakaty. Na przykład z chlorkiem wapnia tworzy amoniakat CaCl
2·8NH
3. Z tego powodu chlorek wapnia nie nadaje się do osuszania amoniaku.
Amoniak znajduje szerokie zastosowanie w syntezie organicznej. W wyniku działania amoniaku na halogenki alkilowe powstają aminy będące homologami amoniaku:
- CH
3Cl + NH
3 → CH
3NH
2 + HCl
w reakcji pochodnych halogenowych kwasów karboksylowych z nadmiarem amoniaku powstają aminokwasy:
- CH
2ClCOOH + NH
3 → NH
2CH
2COOH + HCl
a w reakcji estrów kwasu izocyjanowego z amoniakiem tworzą się alkilowe pochodne mocznika:
- CH
3NCO + NH
3 → CH
3NHCONH
2
Analiza[edytuj | edytuj kod]
Zarówno amoniak, jak i jego związki, można wykryć i oznaczyć metodami chemicznymi przy stężeniach rzędu μg/m³, przede wszystkim za pomocą odczynnika Nesslera lub metodą indofenolową[13].
Zastosowanie[edytuj | edytuj kod]
Największe ilości amoniaku są w przemyśle zużywane do produkcji nawozów sztucznych oraz do otrzymywania metodą Ostwalda tlenku azotu(II), który jest półproduktem do otrzymywania kwasu azotowego. Ponadto amoniaku używa się do produkcji węglanu sodu (sody amoniakalnej) metodą Solvaya, materiałów wybuchowych, cyjanowodoru, tkanin syntetycznych etc.
Ze względu na swoje własności termodynamiczne amoniak jest stosowany jako czynnik chłodniczy (R717), zwłaszcza w dużych urządzeniach chłodniczych.
Woda amoniakalna stosowana jest jako składnik soli trzeźwiących w celu przywrócenia świadomości osób, u których wystąpiło omdlenie.
Amoniak wymieszany z powietrzem jest stosowany na statkach do redukcji cząstek NOx w procesie selektywnej redukcji katalitycznej (SCR).
Zagrożenia[edytuj | edytuj kod]
Oddziaływanie na organizm ludzki[edytuj | edytuj kod]
Ciekły amoniak wylany na skórę wywołuje odmrożenia. Jest przy tym silnie toksyczny (LC50 wynosi 7,5 g/m³ (2 h, szczur, inhalacja), a LD50 350 mg/kg dla szczura przy podaniu doustnym), działa drażniąco na skórę i błony śluzowe.
Wpływ na organizm ludzki w zależności od stężenia:
| Wpływ na organizm ludzki | stężenie [ppm] | Dopuszczalny czas przebywania |
|---|---|---|
| Charakterystyczny zapach wyczuwalny przez większość ludzi | 25[a] (próg wykrywalności) | Nieograniczony |
| Dosyć silny zapach wyczuwalny przez każdego człowieka | 35 | 8 godzin dziennie (maksymalne dopuszczalne stężenie trwałe) |
| Zapach bardzo wyraźnie wyczuwalny | 50 | Według niezbędnych potrzeb. |
| Ostry nieprzyjemny zapach, przy krótkotrwałym wdychaniu bez szkodliwego wpływu na organizm ludzi zdrowych | 100 | Opuścić pomieszczenie niezwłocznie |
| Podrażnienie śluzówki oczu, nosa i dróg oddechowych | 400–700 (próg zagrożenia) |
Godzina przebywania przeważnie nie powoduje poważnych następstw |
| Napad kaszlu, uczucie zatykania oddechu, silne podrażnienie śluzówki nosa, oczu i dróg oddechowych | 1000–1700 | Półgodzinne przebywanie może prowadzić do groźnych następstw |
| Silny kaszel, skurcze gardła, silne uczucie zatykania oddechu wraz ze żrącym podrażnieniem śluzówki nosa, oczu i dróg oddechowych | 2000–5000 | W ciągu 1/2 godziny może nastąpić śmierć przez uduszenie |
| Silne uczucie porażenia nerwowego i duszenia | >5000 | Śmierć następuje w ciągu kilku minut |
Historia[edytuj | edytuj kod]
Pierwszy opisany związek amoniaku – salmiak (chlorek amonu), otrzymany został ok. 332 roku p.n.e. z odchodów wielbłądów w pobliżu świątyni Amona w oazie Siwa na terenie dzisiejszego Egiptu. Stąd pochodzi nazwa „amoniak” używana w różnych formach w większości języków świata[14][15].
Chlorek amonu był też znany przez średniowiecznych alchemików – był wzmiankowany przez Alberta Wielkiego na początku XIII wieku. W XV w. Basilius Valentinus otrzymał amoniak przez działanie na tę sól zasadą. Skład amoniaku został ustalony przez Claude’a Louisa Bertholleta.
Zobacz też[edytuj | edytuj kod]
Uwagi[edytuj | edytuj kod]
- ↑ Próg wykrywalności w niskich temperaturach jest jeszcze niższy i wynosi 2–5 ppm.
Przypisy[edytuj | edytuj kod]
- ↑ a b c d Neil G. Connelly i inni, Nomenclature of Inorganic Chemistry. IUPAC Recommendations 2005 (Red Book), International Union of Pure and Applied Chemistry, RSC Publishing, 2005, s. 314, ISBN 978-0-85404-438-2 (ang.).
- ↑ a b c d e Lide 2009 ↓, s. 4-46.
- ↑ Lide 2009 ↓, s. 8-40.
- ↑ a b Lide 2009 ↓, s. 6-51.
- ↑ Lide 2009 ↓, s. 9-51.
- ↑ a b Amoniak, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-04-10] (ang.).
- ↑ a b Amoniak, bezwodny (nr 294993) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2014-01-28]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Lee 1999 ↓, s. 212–213.
- ↑ Lee 1999 ↓, s. 66–67.
- ↑ a b Max Appl, Ammonia, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 7–8, DOI: 10.1002/14356007.a02_143.pub2 (ang.).
- ↑ Bernhard Langhammer, Calcium Carbide, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, 2005, s. 2–3, DOI: 10.1002/14356007.a04_533 (ang.).
- ↑ a b c d Adam Bielański, Podstawy chemii nieorganicznej, wyd. 5, t. 2, Warszawa: PWN, 2002, s. 651, ISBN 83-01-13654-5.
- ↑ John Wolf i inni, Air, [w:] Ullmann’s Encyclopedia of Industrial Chemistry, Weinheim: Wiley‐VCH, s. 94–95, DOI: 10.1002/14356007.b07_403.pub2 (ang.).
- ↑ Wayne L. Felty, From camel dung, „Journal of Chemical Education”, 59 (2), 1982, s. 170, DOI: 10.1021/ed059p170.3 (ang.).
- ↑ Gregory C. Miller, From camel dung (the author replies), „Journal of Chemical Education”, 59 (2), 1982, s. 170, DOI: 10.1021/ed059p170.4 (ang.).
Bibliografia[edytuj | edytuj kod]
- J.D. Lee: Zwięzła chemia nieorganiczna. Warszawa: Wydawnictwo Naukowe PWN, 1999. ISBN 83-01-12352-4.
- David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).