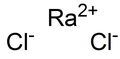Chlorek radu
| |||||||||||||||||||
| |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Wzór sumaryczny |
RaCl2 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
296,09 g/mol | ||||||||||||||||||
| Wygląd |
bezbarwne, krystaliczne ciało stałe[1] | ||||||||||||||||||
| Identyfikacja | |||||||||||||||||||
| Numer CAS | |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| Podobne związki | |||||||||||||||||||
| Inne aniony | |||||||||||||||||||
| Inne kationy | |||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||
Chlorek radu, RaCl2 – nieorganiczny związek chemiczny z grupy chlorków, sól kwasu solnego i radu. Jest pierwszym, otrzymanym w czystej postaci, związkiem radu. Pierwszą próbkę radu otrzymali Maria Skłodowska-Curie i André-Louisem Debierne w wyniku elektrolizy tego chlorku na katodzie rtęciowej[3]. Jest silnie trujący.
Otrzymywanie[edytuj | edytuj kod]
Chlorek radu krystalizuje z roztworu w postaci dihydratu. Może zostać odwodniony poprzez ogrzewanie w temperaturze 100 °C przez godzinę na powietrzu, a potem jeszcze przez pięć i pół godziny w 520 °C w atmosferze argonu[4].
Można go otrzymać przez przepuszczenie suchego chlorowodoru nad podgrzewanym bromkiem radu lub przez przepuszczenie tego samego gazu nad odwodnionym siarczanem radu.
Właściwości[edytuj | edytuj kod]
Chlorek radu jest bezbarwną substancją krystaliczną, która wykazuje niebieskozieloną luminescencję, szczególnie podczas ogrzewania. Przechowywany przez dłuższy czas żółknie, a jeśli jest zanieczyszczony jonami baru przybiera różowy kolor. W porównaniu do innych chlorków metali ziem alkalicznych słabiej rozpuszcza się w wodzie (w temperaturze 20 °C rozpuszcza się 245 g na litr rozpuszczalnika).
Zastosowanie[edytuj | edytuj kod]
Jest używany w początkowych etapach oddzielania radu od baru podczas ekstrakcji z blendy smolistej[5]. W medycynie jest wykorzystywany do produkcji radonu stosowanego do leczenia nowotworów.
Przypisy[edytuj | edytuj kod]
- ↑ a b c Kirby i Salutsky 1964 ↓, s. 5.
- ↑ Kirby i Salutsky 1964 ↓, s. 6.
- ↑ Kirby i Salutsky 1964 ↓, s. 3.
- ↑ F. Weigel, A. Trinkl. Crystal Chemistry of Radium. I. Radium Halides. „Radiochimica Acta”. 9, s. 36–41, 1968.
- ↑ M. Curie, A. Debierne. „C. R. Hebd. Acad. Sci. Paris”. 151, s. 523–525, 1910.
Bibliografia[edytuj | edytuj kod]
- H.W. Kirby, Murrell L. Salutsky: The Radiochemistry of Radium. Subcommittee on Radiochemistry, National Academy of Sciences, 1964.
- Gmelins Handbuch der anorganischen Chemie. Wyd. 8. Berlin: Verlag Chemie, 1928, s. 60–61.
- Gmelin Handbuch der anorganischen Chemie. Wyd. 8. T. 2 Suplement. Berlin: Springer, 1977, s. 362–364.