Amidy
Amidy – organiczne związki chemiczne zawierające grupę amidową R−NR′R″, gdzie R = reszta kwasowa; R′, R″ = wodór lub dowolna grupa organiczna. Amidy szeroko występują w przyrodzie. Są pochodnymi kwasów (zarówno organicznych, jak i nieorganicznych). Amidami są też polimery nazywane poliamidami. Szczególnym przypadkiem poliamidów są peptydy i białka. Są to polimery powstające z α-aminokwasów. W przypadku peptydów i białek stosuje się termin wiązanie peptydowe zamiast terminu wiązanie amidowe. Jest to jednak takie samo wiązanie, a terminy te można uważać za synonimy.
Klasyfikacja[edytuj | edytuj kod]
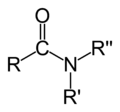
Ze względu na rzędowość, amidy dzielą się na[1]:
- pierwszorzędowe – mające jedną grupę acylową przy atomie azotu,
- drugorzędowe – mające dwie grupy acylowe (są to więc imidy)
- trzeciorzędowe – mające trzy grupy acylowe (triacyloaminy)
Międzynarodowa Unia Chemii Czystej i Stosowanej nie zaleca określać amidów jako pierwszo-, drugo- i trzeciorzędowych ze względu na liczbę podstawionych atomów wodoru w grupie −NH
2[1].
Ze względu na pochodzenie możemy wyróżnić m.in.:
- karboksyamidy – amidy kwasów karboksylowych[2], np. acetamid, acetanilid, asparagina, benzamid, formamid, LSD
- karbamidy – podstawione pochodne mocznika (karbamidu)
- sulfonamidy – pochodne kwasów sulfonowych
- amidy kwasów fosforu, np. cyklofosfoamid i amidofosforyny
Otrzymywanie[edytuj | edytuj kod]
Amidy można otrzymać głównie przez reakcje[3]:
z
- amoniakiem (amidy pierwszorzędowe),
- aminą pierwszorzędową (amidy drugorzędowe),
- aminą drugorzędową (amidy trzeciorzędowe).
Przykładowe metody otrzymywania amidów[4]:
- metoda mieszanych bezwodników
- metoda karbodiimidowa – w reakcji kwasów karboksylowych z aminami pierwszorzędowymi w obecności DCC jako czynnika sprzęgającego
- metoda karbodiimidowa z dodatkami – w reakcji kwasów karboksylowych z pierwszorzędowymi aminami w obecności DCC oraz odpowiednimi „dodatkami” np. N-hydroksysukcynoimidem, 3-hydroksy-4-keto-1,2,3-benzotriazyną lub N-hydroksybenzotriazolem (HOBt)[5][6]
Amidy arylowe otrzymać można z iminoeterów (R1
−O−C(=NR2
)R3
) w wyniku przegrupowania Chapmana[7]. Reakcja przebiega na drodze wewnątrzcząsteczkowej aromatycznej substytucji nukleofilowej (SNAr):

Odmianę przegrupowania Chapmana zaobserwowano podczas benzoilowania reszty pirymidynowej urydyny. Produktem kinetycznym reakcji jest O4–benzoilourydyna, która w ciągu kilku godzin ulega spontanicznemu przegrupowaniu do N3-benzoilourydyny[8]:

Właściwości chemiczne[edytuj | edytuj kod]
Amidy są amfolitami, tzn. reagują zarówno z kwasami, jak i z zasadami, co jest spowodowane występowaniem tautomerii amidowo-imidowej. Wiązanie amidowe jest zazwyczaj trwalsze od innych pochodnych kwasów karboksylowych (estrów, bezwodników kwasowych i halogenków kwasowych).
Najważniejsze reakcje[edytuj | edytuj kod]
- hydroliza w środowisku kwasowym do kwasów i soli
- hydroliza w środowisku zasadowym do soli i amoniaku lub amin
- estryfikacja alkoholami, katalizowana przez kwasy
- redukcja amidów do amin
- dehydratacja pierwszorzędowych amidów do nitryli.
Zastosowanie[edytuj | edytuj kod]
Amidy znalazły zastosowanie między innymi w lecznictwie, w przemyśle tworzyw sztucznych, jako plastyfikator, rozpuszczalnik, środek zwilżający w produkcji lakierów i materiałów wybuchowych, do impregnacji tkanin nieprzemakalnych (amidy kwasu stearynowego). Nukleozydowe amidy kwasu fosfonowego (amidofosforyny nukleozydów) są niezwykle reaktywne[9] i wykorzystywane są jako najczęściej stosowane syntony do chemicznej syntezy oligonukleotydów.
Zobacz też[edytuj | edytuj kod]
- amidki – nieorganiczne związki chemiczne o wzorze ogólnym M−NH
2
Przypisy[edytuj | edytuj kod]
- ↑ a b amides, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.A00266, ISBN 0-9678550-9-8 (ang.).
- ↑ carboxamides, [w:] A.D. McNaught, A. Wilkinson, Compendium of Chemical Terminology (Gold Book), S.J. Chalk (akt.), International Union of Pure and Applied Chemistry, wyd. 2, Oxford: Blackwell Scientific Publications, 1997, DOI: 10.1351/goldbook.C00850, ISBN 0-9678550-9-8 (ang.).
- ↑ C.A.G.N. Montalbetti, V. Falque, Amide bond formation and peptide coupling, „Tetrahedron”, 61, 2005, s. 10827–10852, DOI: 10.1016/j.tet.2005.08.031 (ang.).
- ↑ Synteza amidów metodami mieszanych bezwodników, karbodiimidową i karbodiimidową z dodatkami, [w:] Preparatyka i elementy syntezy organicznej, Jerzy T. Wróbel (red.), Warszawa: Wydawnictwo Naukowe PWN, 1983, s. 842–847, ISBN 83-01-02392-9.
- ↑ D. Łowicki i inni, Syntheses, structural and antimicrobial studies of a new N-allylamide of monensin A and its complexes with monovalent metal cations, „Tetrahedron”, 65, 2009, s. 7730–7740, DOI: 10.1016/j.tet.2009.06.077 (ang.).
- ↑ D. Łowicki, Structural and antimicrobial studies of a new N-phenylamide of monensin A complex with sodium chloride, „Journal of Molecular Structure”, 923, 2009, s. 53–59, DOI: 10.1016/j.molstruc.2009.01.056 (ang.).
- ↑ V.F. Burdukovskiy, D.M. Mognonov, I.A. Farion, Chapman rearrangement in the synthesis of aromatic polyamides, „Journal of Polymer Science Part A: Polymer Chemistry”, 45 (20), 2007, s. 4656–4660, DOI: 10.1002/pola.22212.
- ↑ M. Sekine, General Method for the Preparation of N-3-Substituted and O-4-Substituted Uridine Derivatives by Phase-Transfer Reactions, „Journal of Organic Chemistry”, 54 (10), 1989, s. 2321–2326, DOI: 10.1021/jo00271a015.
- ↑ S.L. Beaucage, M.H. Caruthers, Deoxynucleoside Phosphoramidites – A New Class of Key Intermediates for Deoxypolynucleotide Synthesis, „Tetrahedron Letters”, 22 (20), 1981, s. 1859–1862, DOI: 10.1016/S0040-4039(01)90461-7 (ang.).
