Związki heterocykliczne
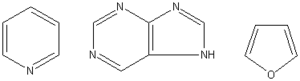
Związki heterocykliczne – szeroka klasa pierścieniowych związków chemicznych, w których co najmniej jeden układ cykliczny zawiera jeden lub więcej atomów pierwiastków innych niż węgiel. Najczęściej spotykanymi pierwiastkami wchodzącymi w skład pierścieni są tlen, azot i siarka[1]. Struktury te mogą obejmować zarówno układy aromatyczne jak i alicykliczne. Prostymi związkami heterocyklicznymi są pirydyna (C5H5N), pirymidyna (C4H4N2) oraz dioksan (C4H8O2).
Zazwyczaj w chemii organicznej za związek hetorocykliczny uważa się każdy związek cykliczny, który zawiera w części cyklicznej inny pierwiastek niż węgiel. Jednakże istnieje kilka wyjątków od tej reguły: niektóre klasy związków organicznych, takie jak węglowodany, zazwyczaj nie są nazywane związkami heterocyklicznymi, mimo że z formalnego punktu widzenia nimi są. Ponadto wiele związków makrocyklicznych zwyczajowo nie jest nazywanych związkami heterocyklicznymi.
W przypadku wielu związków chemicznych, które są "standardowo" zbudowane z regularnie występujących dwóch rodzajów atomów (np. tlenu i węgla (eter koronowy) lub z krzemu i tlenu (cyklosiloksany), lub azotu i fosforu (fosfazen)) terminu "związek heterocykliczny" używa się dopiero wtedy, gdy w cyklu pojawiają się jeszcze jakieś inne atomy, np. azotu lub w przypadku cyklosiloksanów i fosfazenów – paradoksalnie – węgla.
Przegląd wybranych związków heterocyklicznych[edytuj | edytuj kod]
Nazwa w liczbie mnogiej oznacza występowanie izomerów.
Pierścienie trójczłonowe[edytuj | edytuj kod]
Heterocykle zbudowane z trzech atomów węgla są bardzo reaktywne z uwagi na występowanie znacznych naprężeń w obrębie pierścienia. Jeżeli obecny jest tylko jeden heteroatom, to związek taki jest zasadniczo stabilny w warunkach standardowych, jednakże związki zawierające dwa heteroatomy są bardzo nietrwałe, występują raczej jako reaktywne intermediaty. Do pospolitych związków z pierścieniem trójczłonowym należą:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | azyrydyna | azyryna |
| tlen | oksiran (tlenek etylenu) | oksiren |
| siarka | tiiran (siarczek etylenu) | tiiren |
Do związków z dwoma heteroatomami należą:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | diazyrydyna | diazyryna |
| tlen | dioksiran | – |
| azot/tlen | oksazyrydyna | oksazyren |
Pierścienie czteroczłonowe[edytuj | edytuj kod]
Związki z jednym heteroatomem:
| Heteroatom | Nasycony | Nienasycony |
|---|---|---|
| azot | azetydyna | azetyny[b], azet[a] |
| tlen | oksetan | okset[a][b] |
| siarka | tietan | tiet[a][b] |
Związki z dwoma heteroatomami:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | diazetydyny | diazetyny[a] |
| tlen | dioksetany | diokset[a][b] |
| siarka | ditietany | ditiet[a][b] |
Pierścienie pięcioczłonowe[edytuj | edytuj kod]
W przypadku tej grupy heterocykli związki nienasycone są bardziej rozpowszechnione ze względu na dodatkową stabilizację wynikającą z charakteru aromatycznego.
Pierścienie pięcioczłonowe z jednym heteroatomem:
| Heteroatom | Nasycony | Nienasycony |
|---|---|---|
| azot | tetrahydropirol (azolidyna, pirolidyna) | dihydropirole (piroliny)[b], pirol[a] |
| tlen | tetrahydrofuran (oksolan) | dihydrofurany[b], furan[a] |
| siarka | tetrahydrotiofen (tiolan) | dihydrotiofeny[b], tiofen[a] |
| arsen | arsolan | arsol[a] |
Pierścienie pięcioczłonowe zawierające dwa heteroatomy, z których przynajmniej jeden jest azotem, zbiorczo nazywa się azolami. tiazole i izotiazole zawierają w cząsteczce atom azotu i siarki. ditiolany zawierają dwa atomy siarki.
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | imidazolidyna | pirazol, imidazol |
| azot/tlen | oksazolidyna | oksazol, izoksazol |
| azot/siarka | tiazolidyna | tiazol, izotiazol |
| tlen | dioksolany | dioksole |
| siarka | ditiolanyo | ditiole |
| tlen/siarka | oksatiolan | oksatiole |
Ponadto istnieje duża grupa pierścieni pięcioczłonowych z trzema atomami heterocyklicznymi. Przykładem może być ditiazol, zawierający dwa atomy siarki i jeden azotu.
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | triazolidyny | triazole |
| azot/2×siarka | ditiazolidyny | ditiazole |
| 2×azot/tlen | oksadiazolidyny | furazan, oksadiazol |
| 2×azot/siarka | tiadiazolidyny | tiodiazol |
Pierścienie pięcioczłonowe zawierające cztery heteroatomy:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | tetrazolidyna | tetrazole |
Pierścienie sześcioczłonowe[edytuj | edytuj kod]
Związki z jednym heteroatomem:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | piperydyna | pirydyna |
| tlen | tetrahydropiran | piran |
| siarka | tion | tiopiran |
Związki z dwoma heteroatomami:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | piperazyna[c] | diazyny |
| azot/tlen | morfolina[c] | oksazyny |
| azot/siarka | tiomorfolina[c] | tiazyny |
| siarka | ditiany | ditiiny |
| tlen | dioksany | dioksyny |
Związki z trzema heteroatomami:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | triazynany | triazyny |
| tlen | trioksany | trioksyny |
Związki z czterema heteroatomami:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | tetrazynany | tetrazyny |
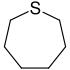
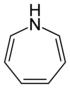
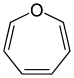
Pierścienie siedmioczłonowe[edytuj | edytuj kod]
Do tych związków zalicza się jedynie układy alicykliczne, pozbawione charakteru aromatycznego:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | azepan | azepina |
| tlen | oksepan | oksepina |
| siarka | tiepan | tiepina |
Związki z dwoma heteroatomami:
| Heteroatom | Nasycony | Nienasycony[a] |
|---|---|---|
| azot | diazepany | diazepiny |
| azot/siarka | diazepany | tiazepiny |
Wzory strukturalne[edytuj | edytuj kod]
| Nasycony | Nienasycony z maksymalną liczbą wiązań podwójnych | ||||||
|---|---|---|---|---|---|---|---|
| Heteroatom | azot | tlen | siarka | azot | tlen | siarka | |
| 3 atomy | |||||||
| Nazwa | azyrydyna | oksiran | tiran | 2H-Azyryna | oksiren | tiren | |
| Struktura | 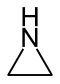 |
 |
 |
 |
 |

| |
| 4 atomy | |||||||
| Nazwa | azetydyna | oksetan | tietan | azet | Kation oksetioniowy | Kation tietioniowy | |
| Struktura |  |
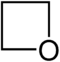 |
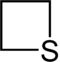 |
 |
 |

| |
| 5 atomów | |||||||
| Nazwa | pirolidyna | tetrahydrofuran | tetrahydrotiofen | pirol | Furan | tiofen | |
| Struktura | 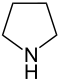 |
 |
 |
 |
 |
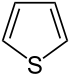
| |
| 6 atomów | |||||||
| Nazwa | piperydyna | tetrahydropiran | tian | pirydyna | Kation piraniowy | Kation tiopiraniowy | |
| Struktura |  |
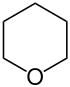 |
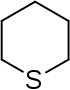 |
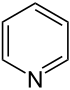 |
 |
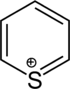
| |
| 7 atomów | |||||||
| Nazwa | azepan | oksepan | tiepan | azepina | oksepina | tiepina | |
| Struktura | 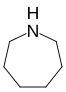 |
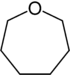 |
 |
 |
 |

| |
Uwagi[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ Eicher, T.; Hauptmann, S.: The Chemistry of Heterocycles: Structure, Reactions, Syntheses, and Applications. Wiley-VCH, 2nd ed. 2003. ISBN 3-527-30720-6.
