Medycyna nuklearna
Medycyna nuklearna – gałąź medycyny zajmująca się zagadnieniami związanymi z diagnozowaniem i leczeniem chorób przy użyciu izotopów promieniotwórczych[1].
W medycynie nuklearnej izotopy promieniotwórcze łączone są z innymi elementami tworząc związki chemiczne lub są parowane z istniejącymi związkami farmaceutycznymi tworząc radiofarmaceutyki. Jest to substancja, która bierze udział w drogach metabolicznych człowieka i jednocześnie zawiera znacznik promieniotwórczy, dzięki czemu można precyzyjnie śledzić jego działanie w organizmie. Odpowiednio dobierając część aktywną biologicznie radiofarmaceutyków można sprawić, aby badały one konkretne procesy życiowe – docierały w badane miejsce. Substancja chemiczna może być zmodyfikowana tak, aby nie ulegała procesom metabolicznym i mogła się gromadzić w tkankach. Medycyna nuklearna wykorzystuje tę właściwość, polegając na mechanizmach przebiegu czynności życiowych organizmów do obrazowania rozmiarów i postępów choroby w ciele pacjenta.
Radiofarmaceutyki podawane są zazwyczaj dożylnie. Należy odczekać pewien czas, zależny od części aktywnej biologicznie radiofarmaceutyku, aby mógł on się włączyć w badany proces. Czas ten zależy od podawanych radiofarmaceutyków, lecz zazwyczaj wynosi kilkadziesiąt minut[2][3].
W niektórych chorobach medycyna nuklearna pozwala wykryć i rozpoznać problem we wcześniejszej fazie niż tradycyjne metody diagnostyczne.
Medycyna nuklearna dzieli się na dwa podstawowe działy:
- diagnostyczna medycyna nuklearna – wykorzystanie substancji radioaktywnych do uzyskania czystego i pełnego obrazu kości, tkanek itp.
- interwencyjna medycyna nuklearna – wystawienie nowotworu na działanie radioaktywnych substancji w celu zniszczenia zarażonej komórki
We współczesnej medycynie w procesie leczenia najczęściej stosuje się obie gałęzie jednocześnie[4].
Metody medycyny nuklearnej wykorzystywane są między innymi w onkologii, w leczeniu niektórych typów nowotworów oraz w ramach zabiegów paliatywnych, mające na celu zmniejszenie dolegliwości bólowych, związanych z występowaniem rozsianego procesu nowotworowego (np. przerzuty do kości). Stosowane są również w celu lokalizacji zmian niewidocznych przy użyciu innych metod. Medycyna nuklearna stosowana jest również jako narzędzie w diagnostyce i leczeniu chorób, np. endokrynologicznych (głównie chorób tarczycy). Zastosowanie tej techniki umożliwia zróżnicowanie między „zimnymi” i „ciepłymi” guzami.
Metodą obrazowania stosowaną w medycynie nuklearnej jest scyntygrafia. Zaletą tej techniki jest, poza uwidacznianiem struktury, również dodatkowa możliwość badania funkcji czynnościowej danego organu. Dodatkowo ta gałąź medycyny zajmuje się diagnostyką in vitro, czyli oznaczaniem poziomu substancji we krwi metodami radioimmunologicznymi, przy pomocy znaczników izotopowych (np. w celu określenia poziomu niektórych hormonów).
Terapeutyczne zastosowanie substancji promieniotwórczych dotyczy głównie chorób nowotworowych tarczycy, gdzie od wielu lat stosuje się jeden z syntetycznych izotopów jodu, 131I, jak również leczenia przerzutów nowotworowych (m.in. raka stercza) do kości przy użyciu fosforu 32P, strontu 89Sr, renu 186Re, 188Re oraz samaru 153Sm.
Szczególna uwaga należy się metodom terapii nowotworowej będącym kombinacją chemoterapii i radioimmunoterapii (z zastosowaniem znakowanych monoklonalnych przeciwciał) m.in. w chorobie Hodgkina (Zevalin), jak również celowanej terapii znakowanymi analogami hormonów w guzach neuroendokrynnych przewodu pokarmowego (znakowany oktreotyd).
Historia[edytuj | edytuj kod]
Trudno jest wskazać dokładną datę powstania medycyny nuklearnej[5], gdyż jest związana z wieloma dziedzinami wiedzy (fizyką, chemią, medycyną).
Jako genezę medycyny nuklearnej datuje się połowę lat dwudziestych ubiegłego wieku, gdy w niemieckim mieście Freiburg György von Hevesy wykonał eksperymenty z wykorzystaniem radionuklidów, które zaaplikował szczurom, dzięki czemu ukazał szlak metaboliczny tych substancji oraz stworzył wskaźniki promieniotwórcze[6][7].
Jednak nie byłoby medycyny nuklearnej bez wcześniejszych odkryć w tej materii. Już pod koniec XIX wieku odkryte zostały promieniowanie rentgenowskie, które później próbowano wykorzystać do celów medycznych. W 1886 roku Henri Becquerel odkrył promieniowanie soli uranu, co było początkiem innego spojrzenia na właściwości znanych pierwiastków. Dalsze badania nad odkryciem Becquerela rozpoczęła Maria Skłodowska-Curie wraz z mężem Pierre'em Curie, którzy nazwali ten proces radioaktywnością.
Od tamtej pory nastąpiła fala odkryć. Wyodrębniono nieznane wcześniej pierwiastki (na przykład rad). Rozróżniono także promieniowanie alfa, promieniowanie beta, promieniowanie gamma.
Odkrycie w 1934 roku sztucznie produkowanych radionuklidów przez Frédérica Joliot-Curie i Irène Joliot-Curie było znaczącym krokiem w medycynie nuklearnej. W lutym 1934 roku, po odkryciu radioaktywności w folii aluminiowej, którą poddali promieniowaniu Polonu, opisali oni produkcję pierwszego sztucznego materiału radioaktywnego.
W latach trzydziestych i czterdziestych XX wieku nastąpiły pierwsze poważne zastosowania kliniczne radionuklidów. W 1937 roku na Uniwersytecie Kalifornijskim w Berkeley posłużono się promieniowaniem fosforu-32 do leczenia białaczki. W 1938 roku John Livingood wraz z Glenem Seaborgiem wynaleźli izotopy jodu 131I oraz kobaltu Co-60[8]. Prowadzili też pierwsze pomiary wychwytu jodu przez tarczycę[6][7].
Otwarcie pierwszego reaktora produkującego radioizotopy tylko do celów medycznych w Oak Ridge National Laboratory w 1946 roku było kolejnym znacznym krokiem w rozwoju nauki. Medycyna nuklearna zyskała większą rozpoznawalność wśród naukowców 7 grudnia 1946 roku, gdy został opublikowany artykuł doktora Sama Seidlina w tygodniku Journal of the American Medical Association opisujący wyleczenie pacjenta z nowotworem tarczycy za pomocą radioaktywnego izotopu jodu 131I. Ten sam izotop był później wykorzystywany jako lek na nadczynność tarczycy.
Sam termin medycyny nuklearnej wprowadzony został w 1952 roku[6][7].
Wykorzystywanie medycyny nuklearnej rozpowszechniono na początku lat pięćdziesiątych XX wieku, gdy wzrastała wiedza o promieniotwóczości, radionuklidach i ich użyciu przy badaniach procesów biochemicznych za pomocą wskaźników promieniotwórczych. Pionierami w tej dziedzinie byli Benedict Cassen, który wynalazł pierwszy scyntygraf w 1951 roku, oraz Hal Anger, który stworzył pierwszą gamma kamerę. Przyczyniło się to do upowszechnienia medycyny nuklearnej.
Rozwój medycyny nuklearnej przez następne lata był bardzo duży. W 1954 roku w powstało Amerykańskie Stowarzyszenie Medycyny Nuklearnej i Obrazowania Nuklearnego, w 1960 roku stowarzyszenie to zaczęło publikować artykuły medyczne. W późniejszych latach powstało także Polskie Towarzystwo Medycyny Nuklearnej.
Odkryto mnóstwo radionuklidów przeznaczonych do medycznych zastosowań, jednak najważniejszym z nich był technet 99mTc. Wynaleziony został w 1937 roku przez Carlo Perriera oraz Emilio Segrè jako sztuczny element o liczbie atomowej 43. Charakteryzuje się krótkim okresem połowicznego rozpadu, co minimalizuje napromieniowanie ciała. Cecha ta sprawia, że jest on podstawowym wskaźnikiem wykorzystywanym w medycynie nuklearnej do celów diagnostycznych.
Do lat siedemdziesiątych XX wieku większość organów człowieka mogła być wizualizowana za pomocą medycyny nuklearnej. W latach osiemdziesiątych opracowane zostały radiofarmaceutyki pomagające w diagnozowaniu chorób serca[6][7].
Dużym osiągnięciem w medycynie nuklearnej okazało się wynalezienie pozytonowej emisyjnej tomografii komputerowej (PET), opierającej się na technice obrazowania rejestrującej promieniowanie powstające podczas anihilacji pozytonów (anty-elektronów). Nieco później wynaleziona została tomografia emisyjna pojedynczych fotonów – metoda badawcza SPECT, która umożliwiła wizualizację przepływu krwi w mózgu.
Diagnostyczne obrazowanie[edytuj | edytuj kod]
W nuklearnym obrazowaniu medycznym, radiofarmaceutyki wprowadzane są do ciała pacjenta dożylnie lub doustnie. Po czasie potrzebnym na włączenie się substancji do procesów życiowych człowieka, promieniowanie mające swoje źródło w radiofarmaceutykach jest wykrywane przez zewnętrzne detektory w postaci kamer gamma. W odróżnieniu od badań za pomocą promieniowania rentgenowskiego, gdzie promieniowanie podawane jest od zewnątrz, w medycynie nuklearnej źródło promieniowania znajduje się w obrębie ciała pacjenta.
Wyróżnia się kilka technik diagnostycznych.
- 2D: Scyntygrafia wprowadzanie radiofarmaceutyków, detekcja rozpadu promieniotwórczego do stworzenie dwuwymiarowego obrazu.
-
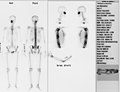
Skan całego ciała człowieka.
-
Scyntygram kośćca młodej kobiety.
-
Rak gruczołu krokowego – wiele przerzutów do kości
Nuklearne obrazowanie medyczne całego szkieletu. Badanie to wykonuje się gdy:
- podejrzenie nowotworu pierwotnego lub przerzutów do kości, a także ocenę skuteczności terapii,
- zapalenie kości i stawów,
- ocena zmian pourazowych,
- choroby metaboliczne kości.
Stosowany znacznik należy do grupy fosfonianów i jest transportowany za pomocą krwi. Wykazuje on naturalne gromadzenie się w strukturze kostnej – najbardziej intensywnie w kościach dobrze ukrwionych. W stanach chorobowych występuje zwiększenie aktywności procesów metabolicznych – gromadzi się więcej krwi niż w typowych warunkach[9][10]. Obrazowanie w takim przypadku ukazywałoby nadmierne nagromadzenie się znacznika badawczego. Stosuje się przede wszystkim znacznik 99mTc-MDP (metylenodifosfonian) o aktywności 550–750 MBq.
Obrazowanie serca za pomocą medycyny nuklearnej[edytuj | edytuj kod]
Do badań izotopowych serca i naczyń zalicza się między innymi:
- scyntygrafię perfuzyjną mięśnia sercowego
- badanie pierwszego przejścia
- scyntygrafię ognisk zawału mięśnia sercowego
- arteriografię izotopową.
-
Prawidłowy przepływ krwi w sercu
-
Prawidłowa praca mięśnia sercowego
-
Niedokrwienie mięśnia sercowego
Podczas badania serca wykorzystuje się technet 99mTc, a także tal 201Tl. Badania służą ocenie czynności układu krwionośnego, od której może zależeć przygotowanie do zabiegu operacyjnego. Prawidłowy przepływ krwi w sercu polega na dostarczeniu krwi do wszystkich jego części. Oznacza to, że podczas badań zostanie nagromadzona duża ilość znacznika badawczego. W niedokrwieniu mięśnia sercowego, które jest spowodowane znacznym zmniejszeniem lub zablokowaniem perfuzji krwi, znacznik będzie się gromadził w mniejszych ilościach. Może to doprowadzić do martwicy słabo ukrwionej części narządu. Scyntygrafia perfuzyjna serca pozwala na nieinwazyjną ocenę ukrwienia mięśnia sercowego w czasie wysiłku i w stanie spoczynku. Badanie informuje o wielkości i lokalizacji niedokrwienia mięśnia lewej komory serca. Jest głównie stosowane w przygotowaniu do zabiegu operacyjnego lub zabiegu naprawczego naczyń wieńcowych.
Obrazowanie przytarczyc[edytuj | edytuj kod]
-
Gruczolak przytarczycy
-
Nadczynność tarczycy wykryta za pomocą jodu 123I
Przedstawia gruczolaka który przylega do lewego fragmentu gruczołu tarczycy. Obrazowanie z wykorzystaniem trzech znaczników badawczych: pierwsza kolumna – MIBI, druga kolumna Jod 123I, trzecia kolumna Cyfrowa angiografia substrakcyjna. Badanie scyntygraficzne trwa około trzech godzin. Najpierw podaje się znacznik 99mTc, który gromadzi się w tarczycy. Po około 25 minutach wykonywane jest obrazowanie tarczycy, po czym podawany jest znacznik 99mTc-MIBI i wykonywane są dwa obrazowania przytarczyc – pierwsze po paru minutach od podania znacznika, drugie po 2 godzinach. Opracowanie wyników polega na odjęciu od siebie obrazów uzyskanych z wykorzystaniem różnych znaczników, co pozwala uwidocznić przytarczyce.
Obrazowanie wątroby i dróg żółciowych[edytuj | edytuj kod]

W medycynie nuklearnej skanowanie wątroby i dróg żółciowych jest używane do wykrywania chorób pęcherzyka żółciowego. Coraz rzadziej używa się jodu 123I. Najczęściej wykorzystuje się znaczniki 99mTc, które podaje się dożylnie i gdy trafiają one do wątroby to gromadzą się w komórkach Kupfera-Browicza. Scyntygrafia wątroby ukazuje także obraz śledziony, dzięki czemu możliwa jest pośrednia ocena ciśnienia w żyle wrotnej i pobudzenia immunologicznego śledziony. Scyntygrafia wątroby trwa około 30 minut.
Scyntygrafia dróg żółciowych pozwala określić szybkość wydzielania żółci przez miąższ wątrobowy i jej odpływ do dwunastnicy, czyli drożność przewodów żółciowych. Scyntygrafia dróg żółciowych trwa około 70 minut. Badanie scyntygraficzne wątroby i dróg żółciowych może być wykonywane u osób w każdym wieku. Może być wielokrotnie powtarzane ze względu na niewielkie dawki promieniowania. Jedynie kobiety w czasie ciąży i podczas laktacji nie mogą przystąpić do badania[4].
Obrazowanie płuc[edytuj | edytuj kod]
Scyntygrafia perfuzyjna płuc polega na ocenie ukrwienia – obserwuje się krążenie krwi w naczyniach zaopatrujących płuca. Stosuje się znacznik 99mTc o aktywności z zakresu 40-150 MBq. Badanie trwa około godziny. Przez około 20 minut po zaaplikowaniu znacznika rejestruje się sygnał z płuca z sześciu stron (przód, tył, skosy). U osób zdrowych obserwuje się równomierne rozmieszczenie znacznika z nieco większym zagęszczeniem w dolnej części płuc. U pacjentów u których występuje niedrożność naczyń krwionośnych w obrębie płuc widoczne są obszary do których znacznik (a więc i krew) nie dociera.
Scyntygrafia wentylacyjna umożliwia ocenę drożności drzewa oskrzelowego i płuc – obserwuje przemieszczanie się powietrza w płucach. Stosuje się rozpylony kwas pentetynowy znakowany 99mTc. Badanie podobnie jak w scyntygrafi perfuzyjnej trwa około godziny. Pacjent wdycha radiofarmaceutyk i przez 20 minut rejestruje się obaz płuc z sześciu stron. U zdrowego pacjenta rejestruje się równomierne rozmieszczenie znacznika w płucach. U chorego widoczne są ogniska z mniejszą ilością nagromadzonego znacznika lub jego brakiem[7].
-
Prawidłowy obraz wentylacji i perfuzji płuc w różnych perspektywach (V/Q)
-
Scyntygrafia wentylacyjno-perfuzyjna u kobiety z zatorowością płucną (A), po podaniu ksenonu 133Xe (znacznika w scyntygrafii)
SPECT – tomografia trójwymiarowa[edytuj | edytuj kod]
Wykorzystywane radiofarmaceutyki podawane są pacjentowi w niskich stężeniach i nakierowane na określone miejsce do badania. Związki aktywne ulegają przemianom nuklearnym, co skutkuje wydzielaniem promieniowania gamma. Jest ono mierzone przez kamery gamma. Na detektor nakłada się kolimator, blokujący wiązki promieniowania docierające pod kątem innym niż prosty. Aby powstał trójwymiarowy obraz, stosuje się mechaniczny wysięgnik, który obraca detektor o parę stopni. Wykonywanych jest wiele ujęć, których złożenie pozwala na stworzenie pełnego trójwymiarowego obrazu. Głównie wykorzystywana do obrazowania mózgu, ale także płuc, gruczołu krokowego, jelita i trzustki.
PET[edytuj | edytuj kod]
Jest to podobna metoda do badań SPECT, która wykorzystuje do obrazowania pary fotonów (SPECT odbiera wszystkie fotony). Pacjentowi podaje się radioizotopy o krótkim czasie połowicznego rozpadu oraz ulegającym rozpadowi beta plus. Powstałe w ten sposób pozytony zderzają się z elektronami pochodzącymi z tkanek i ulegają anihilacji. Dzięki temu powstają dwa fotony o energii 511 keV poruszających się w przeciwnych kierunkach. Są one rejestrowane przez dwa z wielu detektorów umieszczonych w pierścieniu dookoła ciała pacjenta. Pozwala to na dokładne ustalenie miejsca rozpadu, a w dalszym toku na złożenie pełnego obrazu. PET jest badaniem bardziej wrażliwym i precyzyjnym niż SPECT.
-
Obrazowanie mózgu w badaniu SPECT
-
Animacja badania SPECT
-
Maksimum emisji (MIP) dla rozpadu związku 18F-FDG w badaniu PET
-
Obraz mózgowia wykonany metodą PET
-
Urządzenie SPECT
-
Schemat działania metody PET
Techniki hybrydowe[edytuj | edytuj kod]
W niektórych centach medycyny nuklearnej nakłada się skany przy wykorzystaniu oprogramowania lub ulepszonych detektorów. Używa się tomografii komputerowej lub rezonansu magnetycznego, aby uwydatnić część ciała pacjenta, która jest obiektem badania z dziedziny medycyny nuklearnej. Wyłaniają się z tego metody PET-MRI, PET-CT i SPECT-CT, które wykorzystują skanery hybrydowe składające się z połączenia skanerów PET/SPECT z tomografami komputerowymi.
-
Skan całego ciała PET-CT (prawidłowy)
-
Skan całego ciała z wykorzystaniem metody PET-CT
Skan całego ciała metodami PET-CT i SPECT-CT wykorzystuje się zazwyczaj do wykrywania różnych rodzajów raka. Można dzięki temu wykryć przerzuty, powiększanie się ogniska pierwotnego lub też nawrót choroby. Nieprawidłowy skan ciała uwydatnia wiele przerzutów raka, a badanie takie umożliwia podjęcie skutecznych kroków aby przeciwdziałać dalszemu postępowi choroby.
Interwencyjna medycyna nuklearna[edytuj | edytuj kod]
Terapia radionuklidowa może być wykorzystana do zwalczania takich przypadłości jak nadczynność tarczycy, rak tarczycy, zaburzenia krwi, choroby kostne i stawowe.
Tak jak w diagnostyce medycyny nuklearnej, radioizotop aplikuje się pacjentowi doustnie lub dożylnie. Dawki te są jednak większe niż w przypadku diagnostyki. Aby zminimalizować szansę efektów ubocznych czy też zniszczenia zdrowych komórek lub organów znajdujących się w pobliżu obiektu leczenia, dawka podawana pacjentowi zawiera więcej substancji nakierowujących izotop promieniotwórczy na daną tkankę.
Częste zabiegi medycyny nuklearnej
| Podawana substancja | Przypadłość |
|---|---|
| Jod-131 (131I) | Nadczynność tarczycy i rak tarczycy |
| Itr-90 (90Y) i Jod-131 (131I) | Chłoniaki |
| 131-I mIBG | Guzy neuroendokrynne |
| Samar-153 (153Sm) lub Stront-89 (89Sr) | paliatywne leczenie bólów kostnych |
Najczęściej używane radionuklidy w brachyterapii[11]
| Radionuklid | Rodzaj promieniowania | T 1/2 | Energia promieniowania |
|---|---|---|---|
| Cez-131 (137Cs) | promieniowanie gamma | 30,17 lat | 0,662 MeV |
| Kobalt-60 (60Co) | promieniowanie gamma | 5,26 lat | 1,17 – 1,33 MeV |
| Iryd-192 (192Ir) | przemiana β- | 73,8 dni | 0,38 MeV |
| Jod-125 (125I) | promieniowanie gamma | 59,6 dni | 27,4, 31,4 i 35,5 keV |
| Pallad-103 (103Pd) | promieniowanie gamma | 17,0 dni | 21 keV |
| Ruten-106 (106Ru) | przemiana β- | 1,02 lat | 3,54 MeV |
Źródło radionuklidów[edytuj | edytuj kod]
Jedna trzecia radionuklidów produkowana jest w laboratoriach Chalk River w Ontario w Kanadzie. Kolejna jedna trzecia izotopów medycznych produkowana jest w Petten w reaktorze nuklearnym w Holandii
Reaktor w Chalk River służy do naświetlania materiałów neutronami, które są produkowane w dużej ilości w czasie rozszczepiania jąder izotopu U-235. Neutrony te zmieniają jądro napromieniowanego materiału poprzez dodawanie neutronów lub poprzez rozdzielenie go podczas rozszczepienia jądrowego. W reaktorze, jednym z produktów rozszczepienia U-235 jest molibden-99 (Mo-99), który jest ekstrahowany i rozsyłany do tzw. "radiofarmaceutycznych magazynów" w całej Ameryce Północnej. Okres półtrwania Mo-99 wynosi 2,7 dni. Radioaktywny Mo-99 rozpada się w wyniku przemiany beta do technetu-99m, emitując jednocześnie elektron, następnie Tc-99m jest ekstrahowany. Tc-99m rozpada się dalej, a wewnątrz pacjenta, któremu został podany ten izotop uwalnia się foton gamma. Jest on wykrywany za pomocą kamery gamma, ponieważ Tc-99m rozpada się przekształca w stan podstawowy – Tc-99, który jest nieradioaktywny w porównaniu z Tc-99m.
Najpowszechniej stosowanym radioizotopem w pozytonowej emisyjnej tomografii komputerowej jest F-18, który nie jest wytwarzany w reaktorze jądrowym, ale w cyklotronie (akcelerator kołowy). Cyklotron jest używany do przyspieszania protonów bombardujących ciężkie i stabilne jądro izotopu tlenu O-18. F-18 jest często używany do syntezy FDG (fluoro-deoksyglukozy).
Typowe badania w medycynie nuklearnej polegają na podawaniu radionuklidu pacjentowi różnymi sposobami (dożylnie lub w połączeniu z żywnością). Większość z nich emituje promieniowanie gamma, a właściwości uszkadzających komórki cząstek promieniowania beta są wykorzystywane w zastosowaniach terapeutycznych. Udoskonalone radionuklidy stosowane w medycynie nuklearnej pochodzą z procesów rozszczepienia lub fuzji w reaktorach jądrowych, które wytwarzają radionuklidy o dłuższym okresie półtrwania, albo z cyklotronów, które wytwarzają radionuklidy o krótszym okresie półtrwania lub wykorzystywane są naturalne procesy rozpadów niektórych izotopów takich jak: Mo/Tc lub Sr/Rb.
| izotop | symbol | Z | T1/2 | rozpad | Energia gamma (keV) | Energia pozytonowa (keV) |
|---|---|---|---|---|---|---|
| Obrazowanie: | ||||||
| Fluor-18 | 18F | 9 | 109,77 min | β+ | 511 (193%) | 249,8 (97%) |
| Gal-67 | 67Ga | 31 | 3,26 d | ec | 93 (39%), 185 (21%), 300 (17%) |
– |
| Krypton-81m | 81mKr | 36 | 13,1 s | IT | 190 (68%) | – |
| Rubid-82 | 82Rb | 37 | 1,27 min | β+ | 511 (191%) | 3,379 (95%) |
| Azot-13 | 13N | 7 | 9,97 min | β+ | 511 (200%) | 1190 (100%) |
| Technet-99m | 99mTc | 43 | 6,01 h | IT | 140 (89%) | – |
| Ind-111 | 111In | 49 | 2,80 d | ec | 171 (90%), 245 (94%) |
– |
| Jod-123 | 123I | 53 | 13,3 h | ec | 159 (83%) | – |
| Ksenon-133 | 133Xe | 54 | 5,24 d | β- | 81 (31%) | 0,364 (99%) |
| Tal-201 | 201Tl | 81 | 3,04 d | ec | 69–83 (94%), 167 (10%) |
– |
| Terapia: | ||||||
| Itr-90 | 90Y | 39 | 2,67 d | β- | – | 2,280 (100%) |
| Jod-131 | 131I | 53 | 8,02 d | β- | 364 (81%) | 0,807 (100%) |
|
Z = liczba atomowa, liczba protonów; T1/2 = czas połowicznego rozpadu; rozpad – rodzaj | ||||||
Najpowszechniejszymi stosowanymi radionuklidami w medycynie nuklearnej są:
Najczęściej używanymi lotnymi i ciekłymi radionuklidami są:
Dawki promieniowania[edytuj | edytuj kod]
Każdy pacjent poddawany procedurom medycyny nuklearnej odbiera pewną dawkę promieniowania[4][14]. Międzynarodowe wytyczne określają dopuszczalny poziom promieniowania jaki może przyjąć człowiek. Często jest to zależne od rodzaju zawodu i trybu życia. Dawki promieniowania dostarczane pacjentom podczas badań są najczęściej akceptowalne, mimo iż istnieje niewielkie ryzyko karcynogenezy. Ryzyko to jest podobnej skali jak w badaniach z użyciem promieniowania rentgenowskiego. W odróżnieniu od badań rentgenowskich, dawka promieniowania nie jest otrzymywana z zewnętrznego źródła – lampa rentgenowska, lecz jest dostarczana do organizmu przy pomocy radiofarmaceutyków. Zatem promieniowanie dostarczane jest do organizmu z wewnątrz. Dodatkowo dawki promieniowania zazwyczaj są znacznie większe niż te stosowane w promieniowaniu rentgenowskim.
Dawka promieniowania w badaniach medycyny nuklearnej wyrażona jest jako dawka skuteczna promieniowania. Najczęściej określana jest ona w milisiwertach (mSv). Oznacza ona stopień narażenia całego organizmu na promieniowanie. Uzależniona jest od ilości substancji promieniotwórczych dostarczonej pracjentowi wyrażonej w megabekerelach (MBq), czasu połowicznego rozpadu, a także rozpropagowania w ciele.
Skuteczna dawka promieniowania dla 150 Mbq Tal-201 podczas procedury obrazowania niespecyficznego guza. Pospolite skanowanie kości z dawką 600 MBq technetu-99m-MDP skutkuje skuteczną dawką promieniowania równą 3,5 mSv.
| Badanie | Dawka |
|---|---|
| Scyntygrafia perfuzyjna serca (99mTc-MIBI) | 5 mSv |
| scyntygrafia perfuzyjna mózgu (99mTc-HMPAO) | 4 mSv |
| scyntygrafia kośćca (99mTc-MDP) | 3 mSv |
| scyntygrafia perfuzyjna płuc (99mTc-MAA) | 2 mSv |
| scyntygrafia dynamiczna nerek (99mTc-MAG3, 99mTc-DTPA) | 0.5 – 1.5 mSv |
| scyntygrafia tarczycy (99mTc-nadtechnetan) | 0,7 mSv |
| 18FDG-PET | 10 mSv |
| PET z użyciem nuklidów żyjących krócej niż 18F | 0,5 – 5 mSv |
Graniczne dawki promieniowania określa Rozporządzenie Rady Ministrów z dnia 11 sierpnia 2021 r. w sprawie wskaźników pozwalających na wyznaczenie dawek promieniowania jonizującego stosowanych przy ocenie narażenia na promieniowanie jonizujące (Dz.U. z 2021 r. poz. 1657).
Roczna dawka graniczna promieniowania, wyrażona jako dawka skuteczna dla pracowników przemysłu jąrowego wynosi 20 mSv. Może być jednak przekraczana do wartości 50 mSv jednak przez następne 5 lat sumarycznie nie może przekroczyć 100 mSv. Dawka graniczna wyrażona jako dawka równoważna w ciągu roku kalendarzowego wynosi:
- 150 mSv dla soczewek oczu,
- 500 mSv jako wartość średnia dla dowolnego 1 cm² napromieniowanej tkanki,
- 500 mSv dla dłoni, przedramion, stóp.
Dla osób spoza przemysłu jądrowego dawka graniczna wyrażona jako dawka skuteczna wynosi 1 mSv w ciągu roku. Może być ona przekraczana do wartości 5 mSv pod warunkiem, że w ciągu 5 kolejnych lat sumarycznie nie przekroczy 5 mSv. Kobieta w ciąży nie może być zatrudniona w warunkach, które prowadzą do otrzymania dawki skutecznej przekraczającej 1 mSv.
Dawki promieniowania używane w medycynie diagnostycznej są znacznie niższe od tych, które mogą spowodować skutki w postaci choroby popromiennej. Izotopy promieniotwórcze stosowane w medycynie nuklearnej są bezpieczne dla pacjenta. Wbrew powszechnemu przekonaniu narażenie radiologiczne pacjenta podczas badań scyntygraficznych jest mniejsze niż np. w przypadku wykonywania tomografii komputerowej.
Medycyna nuklearna w Polsce[edytuj | edytuj kod]
W Polsce medycyna nuklearna jest jedną ze specjalizacji lekarskich[1], a jej konsultantem krajowym od 7 czerwca 2019 jest prof. dr hab. Leszek Królicki[15]. Lekarzy medycyny nuklearnej zrzesza Polskie Towarzystwo Medycyny Nuklearnej – organizacja której celem jest rozwijanie i propagowanie medycyny nuklearnej w praktyce, a także rozwój personelu medycznego poprzez organizowanie zjazdów naukowych i wykładów, współpracę z krajowymi i zagranicznymi towarzystwami naukowymi, współpracę z organem państwowym odpowiedzialnym za medycynę nuklearną w kraju.
W Polsce istnieje wiele zakładów medycyny nuklearnej:
- Zakład Medycyny Nuklearnej w Centrum Onkologii w Kielcach
- Pracownia Obrazowania Molekularnego - BioSkaner, prowadzona przez Laboratorium Obrazowania Molekularnego i Rozwoju Technologii Uniwersytetu Medycznego w Białymstoku Sp. z o.o., www.bioskaner.eu/
- Zakład Medycyny Nuklearnej i Endokrynologii Onkologicznej w Gliwicach,
- Pracownia PET-CT we Wrocławiu,
- Zakład Medycyny Nuklearnej w Szpitalu Morskim w Gdyni,
- Zakład Medycyny Nuklearnej w Centrum Onkologii w Bydgoszczy
- Zakład Medycyny Nuklearnej w Wielkopolskim Centrum Onkologii w Poznaniu,
- Zakład Medycyny Nuklearnej Centralnego Szpitala Klinicznego w Warszawie.
- Zakład Medycyny Nuklearnej Uniwersytetu Medycznego w Łodzi
- Zakład Medycyny Nuklearnej Clinica Medica Sp. J. w Tychach
- Zakład Medycyny Nuklearnej w 105. Kresowym Szpitalu Wojskowym w Żarach (woj. lubuskie).
- Zakład Medycyny Nuklearnej w Wojewódzkim Zespole Specjalistycznym w Rzeszowie[16]
- Zakład Medycyny Nuklearnej Voxel w Uniwersyteckim Centrum Klinicznym w Katowicach[17]
- Kliniczny Zakład Medycyny Nuklearnej Wielospecjalistycznego Szpitala Wojewódzkiego w Gorzowie Wlkp.
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b Program specjalizacji w dziedzinie MEDYCYNY NUKLEARNEJ (moduł podstawowy i moduł specjalistyczny) dla lekarzy nieposiadających odpowiedniej specjalizacji I lub II stopnia, lub tytułu specjalisty w odpowiedniej dziedzinie medycyny, lub zrealizowanego i zaliczonego odpowiedniego modułu podstawowego. Centrum Medyczne Kształcenia Podyplomowego, 2018-11-13. [dostęp 2021-05-28].
- ↑ What is nuclear medicine?. Society of Nuclear Medicine. [dostęp 2014-09-25]. [zarchiwizowane z tego adresu (2018-01-27)].
- ↑ Stanisław Nowak : Zarys medycyny nuklearnej.
- ↑ a b c Dziennik Urzędowy Ministra Zdrowia [online], mz.gov.pl [dostęp 2024-04-24] (pol.).
- ↑ http://jnm.snmjournals.org/content/40/1/16N.full.pdf
- ↑ a b c d What is Nuclear Medicine?. University of Wisconsin-La Crosse. [dostęp 2014-09-25]. [zarchiwizowane z tego adresu (2015-05-07)].
- ↑ a b c d e John W. Frank : Nuclear Medicine for Medical Students ad Junior Doctors.
- ↑ BNMS – Nuclear Medicine History [online], www.bnms.org.uk [dostęp 2017-11-25] [zarchiwizowane z adresu 2018-01-28] (ang.).
- ↑ Jeffrey A. Siegel: Guide for Diagnostic Nuclear Medicine
- ↑ Christiaan Schiepers, A.L. Baert : Diagnostic Nuclear Medicine 2nd Revised Edition
- ↑ Nuclear Wallet Cards [online], www.nndc.bnl.gov [dostęp 2017-11-25] (ang.).
- ↑ Eckerman KF, Endo A: MIRD: Radionuclide Data and Decay Schemes.
- ↑ Radioisotopes in Medicine. World Nuclear Association. [dostęp 2014-09-25]. [zarchiwizowane z tego adresu (2016-01-17)].
- ↑ Polish Archives of Internal Medicine [online], ojs.kardiologiapolska.pl [dostęp 2019-04-03] [zarchiwizowane z adresu 2015-05-25] (ang.).
- ↑ Konsultanci krajowi. Ministerstwo Zdrowia. [dostęp 2021-05-28].
- ↑ Wojewódzki Zespół Specjalistyczny w Rzeszowie » Zakład Medycyny Nuklearnej [online], www.wzsrzeszow.pl [dostęp 2017-07-16].
- ↑ MEDYCZNE CENTRA DIAGNOSTYCZNE VOXEL W KATOWICACH | Voxel S.A. [online], www.voxel.pl [dostęp 2018-10-11] [zarchiwizowane z adresu 2018-10-11] (pol.).
Bibliografia[edytuj | edytuj kod]
- Stanisław Nowak : Zarys medycyny nuklearnej.
- Bożena Birkenfield, Maria Listewnik : Medycyna nuklearna – obrazowanie molekularne.
- Christiaan Schiepers, A.L. Baert : Diagnostic Nuclear Medicine 2nd Revised Edition.
- Eckerman KF, Endo A: MIRD: Radionuclide Data and Decay Schemes.
- Jeffrey A. Siegel : Guide for Diagnostic Nuclear Medicine.
- John W. Frank : Nuclear Medicine for Medical Students ad Junior Doctors.
- Ajit K. Padhy, K. K. Solanki – International Atomic Energy Agency : Nuclear Medicine Resources Manual.
- Johan Nuyts : Nuclear Medicine Technology and Techniques.
- James A. Sorenson, Michael E. Phelps : Physics In Nuclear Medicine.
Linki zewnętrzne[edytuj | edytuj kod]
- Polskojęzyczne
- Polskie Towarzystwo Medycyny Nuklearnej
- Instytut Problemów Jądrowych im. Andrzeja Sołtana – Spotkanie z promieniotwórczością
 Aleksandra Wrońska, Bliżej Nauki: Akceleratory, detektory i… zdrowie. O mariażu fizyki jądrowej z medycyną, kanał FAIS UJ na YouTube, 25 stycznia 2022 [dostęp 2023-11-30].
Aleksandra Wrońska, Bliżej Nauki: Akceleratory, detektory i… zdrowie. O mariażu fizyki jądrowej z medycyną, kanał FAIS UJ na YouTube, 25 stycznia 2022 [dostęp 2023-11-30].
- Anglojęzyczne