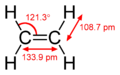Eten
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C2H4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
28,05 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwny gaz o słodkim zapachu[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||

Eten, etylen, C2H4 – organiczny związek chemiczny, najprostszy możliwy alken (węglowodór nienasycony).
Właściwości[edytuj | edytuj kod]
Eten jest gazem bezbarwnym, o słodkawym zapachu. Jest substancją łatwopalną. Rozpuszcza się bardzo dobrze w rozpuszczalnikach niepolarnych np. arenach i alkanach.
Budowa[edytuj | edytuj kod]
Jest to cząsteczka płaska i symetryczna, a kąty pomiędzy wiązaniami (H-C-H) wynoszą 120°. Długości wiązania w tej cząsteczce wynoszą odpowiednio:
- pomiędzy atomem węgla a atomami wodoru 110 pm;
- pomiędzy atomami węgla 134 pm;
W wyniku hybrydyzacji orbitali (sp2) w obu atomach węgla, pomiędzy nimi występuje jedno wiązanie π i jedno wiązanie σ. Ulega reakcjom addycji, utlenienia i polimeryzacji.
W mieszaninie z powietrzem jest wybuchowy w granicach stężeń 2,75–28,6%, oraz podczas ogrzewania pod zwiększonym ciśnieniem.
Występowanie, otrzymywanie i zastosowanie[edytuj | edytuj kod]
W stanie naturalnym występuje w niewielkich (zmiennych) ilościach w gazie ziemnym. Otrzymywany jest na skalę techniczną podczas termicznego rozkładu węglowodorów gazowych i ciekłych (piroliza etenowo-propenowa), z gazowych produktów procesów rafinacji ropy naftowej (kraking termiczny i katalityczny, hydrokraking, reforming) i z gazów koksowniczych.
Niewielkie ilości etenu do celów laboratoryjnych można otrzymać w wyniku odwodnienia etanolu przez wkraplanie go do gorącego kwasu siarkowego lub podczas ogrzewania etanolu z tlenkiem glinu:
- C2H5OH → C2H4↑ + H2O
Można też otrzymać poprzez ogrzewanie folii polietylenowej (reakcja depolimeryzacji):
- -[-CH2-CH2-]-n → n C2H4↑
Eten jest jednym z podstawowych surowców przemysłu petrochemicznego. Stosowany jest do produkcji polietylenu i wielu kopolimerów, etylobenzenu (do produkcji styrenu), tlenku etylenu, chloropochodnych (chlorek winylu, dichloroetan), etanolu i wyższych alkoholi alifatycznych.
Etylen w biochemii[edytuj | edytuj kod]
Etylen jest hormonem roślinnym, stymulującym opadanie liści, dojrzewanie owoców, starzenie się roślin. Wydzielany jest przez praktycznie wszystkie części rośliny[5].
Biosynteza[edytuj | edytuj kod]

Biosynteza etylenu przebiega w kilku etapach. Substratem jest metionina, która jest przekształcana w S-adenozylometioninę (SAM) przez enzym o nazwie syntaza SAM. Następnie SAM jest przekształcana w kwas 1-aminocyklopropano-1-karboksylowy (ACC) przez syntazę ACC (ACS), natomiast metionina jest regenerowana w cyklu Yanga (patrz schemat obok). Ostatnim etapem jest konwersja ACC do etylenu przez oksydazę ACC (ACO), gdzie ACC jest utleniany przy udziale oksydazy ACC do etylenu oraz dwutlenku węgla i cyjanowodoru[6].
Zastosowanie[edytuj | edytuj kod]
W przechowalniach owoców skuteczne usuwanie etylenu wydzielanego przez owoce zapobiega ich przedwczesnemu dojrzewaniu. Natomiast przed sprzedażą owoce poddaje się działaniu etylenu w celu szybkiego doprowadzenia ich do stanu dojrzałości. Takiemu zabiegowi standardowo poddaje się banany, które zbierane są zielone, w stadium dojrzałości zbiorczej i po dotarciu na miejsce przeznaczenia dla uzyskania jednolitych jakościowo owoców poddane są zabiegowi gazowania etylenem przez okres 4-7 dni[7]. Przedwczesnemu dojrzewaniu zapobiega się blokując działanie etylenu za pomocą 1-Metylocyklopropenu.
Potrójna odpowiedź u roślin[edytuj | edytuj kod]
Etylen jest odpowiedzialny za tzw. potrójną odpowiedź u roślin. Gdy nasiono kiełkuje i napotyka przeszkodę, musi wykonać manewr, aby ją ominąć. Etylen stymuluje grubienie łodygi, zmniejszenie elongacji i wykrzywienie się rośliny, tak by ta mogła przedostać się na powierzchnię.
Mutacje[edytuj | edytuj kod]
Występuje kilka rodzajów mutacji roślin związanych z etylenem:
- ein – roślina nie ma receptorów etylenu
- eto – roślina produkuje za dużo etylenu, ale reaguje na podawane przez człowieka inhibitory
- ctr – nie reagują na inhibitory (ponieważ nie występuje u nich kinaza, będąca normalnie negatywnym regulatorem ekspresji) i dlatego przeprowadzają potrójną odpowiedź, nawet w powietrzu.
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e f g h Eten. [martwy link] The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-08-08]. (ang.).[niewiarygodne źródło?]
- ↑ a b c Ethylene, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2012-08-08] (ang.).
- ↑ a b Etylen (nr 00489) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ a b Eten, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2015-04-10] (ang.).
- ↑ S. F. Yang, N. E. Hoffman. Ethylene biosynthesis and its regulation in higher plants. „Ann. Rev. Plant Physiol.”. 35, s. 155–189, 1984. DOI: 10.1146/annurev.pp.35.060184.001103.
- ↑ Fizjologia roślin. Jan Kopcewicz, Stanisław Lewak (red.). Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14549-8.
- ↑ Edward Lange, Waldemar Ostrowski: Przechowalnictwo owoców. Warszawa: PWRiL, 2002, s. 301. ISBN 83-09-01494-5.