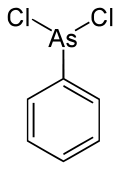
Fenylodichloroarsyna
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||
| Wzór sumaryczny |
C6H5AsCl2 | ||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
222,93 g/mol | ||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||
| Podobne związki |
etylodichloroarsyna, metylodichloroarsyna, difenylochloroarsyna, difenylocyjanoarsyna, luizyt, chlorek benzalu | ||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||
Fenylodichloroarsyna, PD – arsenoorganiczny związek chemiczny, trwały parzący bojowy środek trujący zaliczany również do sternitów[10][11]. Bezbarwna ciecz o drażniącym zapachu, dobrze rozpuszczalna w rozpuszczalnikach organicznych. Stosowana, także w mieszaninach z innymi substancjami, w czasie I wojny światowej.
Otrzymywanie[edytuj | edytuj kod]
Fenylodichloroarsyna może być otrzymywana poprzez reakcję benzenu z trichlorkiem arsenu w temperaturze 0 °C i w obecności bezwodnego chlorku glinu jako katalizatora. Do mieszaniny poreakcyjnej dodaje się wody, aby rozłożyć katalizator oraz rozpuścić powstały chlorowodór. Powstałą w ten sposób mieszaninę dwufazową rozdziela się za pomocą rozdzielacza, a następnie dolną fazę oczyszcza się z użyciem destylacji próżniowej[12].
Innym sposobem otrzymania fenylodichloroarsyny z benzenu i trichlorku arsenu jest ogrzewanie ich mieszaniny w stosunku objętościowym 1:2 przez kilkadziesiąt godzin, a następnie frakcjonowanie. Frakcja pomiędzy 240 a 260 °C jest w miarę czystym produktem, jednak zawiera także difenylochloroarsynę[13].
Fenylodichloroarsynę można wytworzyć także przez ogrzewanie trifenyloarsyny (AsPh
3) z trichlorkiem arsenu do 250 °C w zatopionej rurce lub przy zwykłym ciśnieniu i wysokiej temperaturze[13].
Kolejną metodą syntezy jest szybkie ogrzanie do 254 °C mieszaniny difenylortęci (HgPh2) z trichlorkiem arsenu i pozostawienie jej w tej temperaturze przez ok. 4 godziny:
- (C
6H
5)
2Hg + AsCl
3 → 2C
6H
5AsCl
2 + HgCl
2
Niższe temperatury powodują powstanie chlorku fenylortęci. Może być on jednak wykorzystany do otrzymania fenylodichloroarsyny poprzez ogrzewanie go z trichlorkiem arsenu na łaźni wodnej przez 4–5 godzin, a następnie filtrację otrzymanej mieszaniny. Filtrat poddawany jest następnie destylacji próżniowej[13].
Właściwości[edytuj | edytuj kod]
W stanie czystym jest bezbarwną cieczą, żółciejącą powoli, bardzo mało lotną (404 mg/m³ w 20 °C)[1]. Dobrze rozpuszcza się w wielu rozpuszczalnikach organicznych, także w chlorku arsenu. Jest dobrym rozpuszczalnikiem dla difenylochloroarsyny i difenylocyjanoarsyny. Produkt techniczny jest brązowoczarny[11]. Pary są wyczuwalne od ok. 0,1 ppm[6] i mają ostry zapach[12].
Pod wpływem wody, także wilgoci powietrza, częściowo hydrolizuje tworząc tlenek fenyloarsyny, związek o podobnych właściwościach trujących, niezmniejszający ogólnej toksyczności zastosowanego środka bojowego:
- C
6H
5AsCl
2 + H
2O ⇄ C
6H
5AsO + 2HCl
Hydroliza zachodzi jednak wolniej niż w przypadku analogów alifatycznych, m.in. etylodichloroarsyny i metylodichloroarsyny[3]. Fenylodichloroarsyna jest odporna na działanie tlenu z powietrza. Pod wpływem środków utleniających powstaje z niej kwas fenyloarsonowy (C
6H
5AsO(OH)
2)[11].
W reakcji z etanolanem sodu powstaje fenyloetoksychloroarsyna[13]:
- C
6H
5AsCl
2 + NaOC
2H
5 → NaCl + C
6H
5AsClOC
2H
5
Alkalia powodują powstanie soli kwasu fenyloarsonawego[3], które są jednak niestabilne[13]:
- C
6H
5AsCl
2 + 4NaOH → 2NaCl + C
6H
5As(ONa)
2 + 2H
2O
Pod wpływem bromu fenylodichloroarsyna rozkłada się całkowicie[3]:
- C
6H
5AsCl
2 + 2Br
2 → C
6H
4Br
2 + AsCl
2Br + HBr
Fenylodichloroarsynę, podobnie jak i difenylochloroarsynę, można oznaczyć poprzez utlenienie i hydrolizę w roztworze alkoholowo-wodnym i miareczkowanie mianowanym roztworem jodu[3]:
- C
6H
5AsCl
2 + I
2 + 2H
2O → C
6H
5AsO(OH)
2 + 2HJ + HCl
Zagrożenia[edytuj | edytuj kod]
Fenylodichloroarsyna ma działanie parzące i wymiotne. Działanie parzące jest słabsze niż w przypadku luizytu. Na skórę działa parząco, jednak objawy pojawiają się w ciągu ok. 30–60 minut. W miejscu pęcherzy mogą pozostać trwałe przebarwienia. Rodnik fenylowy, powstały z par fenylodichloroarsyny, wywołuje wymioty objawiające się w ciągu ok. 1–2 minut po ekspozycji[14]. Może wystąpić także biegunka lub żółtaczka[5][15]. Kontakt z oczami powoduje podrażnienie spojówki i rogówki. W przypadku łagodnych i średnich podrażnień, całkowite wyleczenie oczu następuje po ok. 1–6 tygodniach, jednak poważne uszkodzenie rogówki może być nieodwracalne[14].
Dokładny mechanizm biologicznej aktywności i toksyczności tego związku nie jest dokładnie poznany. Możliwymi mechanizmami są arylowanie DNA oraz inhibicja mechanizmu antyoksydacyjnego glutationu[14]. Fenylodichloroarsyna przenika do erytrocytów i łączy się z pewnym składnikiem komórki w jej wnętrzu. Składnikiem tym jest najprawdopodobniej glutation[16].
Stosowanie fenylodichloroarsyny w mieszaninie z iperytami siarkowymi nie wzmacnia działania trującego, jednak może utrudniać diagnozę i opóźniać poddanie właściwemu leczeniu[17].
- LCt50 2600 mg·min/m³ (drogi oddechowe)[5]
- ICt50 (stężenie obezwładniające) 16 mg·min/m³ (przezskórnie jako sternit)[5]
- ICt50 1800 mg·min/m³ (przezskórnie jako środek parzący)[18]
Może być odkażana odkażalnikami utleniającymi i chlorującymi[19] oraz dimerkaprolem i DMSA, w których grupy sulfhydrylowe tworzą z atomem arsenu 5-członowe pierścienie[14][16].
Historia[edytuj | edytuj kod]
Synteza fenylodichloroarsyny została przeprowadzona przez Bayera, Dehna i in. w połowie XIX w. W czasie I wojny światowej w Instytucie Cesarza Wilhelma środek ten był doskonalony przez Fritza Habera[10].
Została po raz pierwszy użyta przez Niemcy we wrześniu 1917 roku[20][21]. Po poznaniu efektów działania tego środka, Wielka Brytania zamierzała zbadać fenylodichloroarsynę i związki jej podobne, w celu użycia ich pod koniec wojny. Francja używała mieszaniny difenylochloroarsyny z fenylodichloroarsyną, która odgrywała rolę ciekłego rozpuszczalnika, w stosunku 4:6 o nazwie Sternite. Był to tzw. przełamywacz maski, którego działanie wykorzystywało niewystarczająco skuteczne filtry masek przeciwgazowych[10][22]. Stosowana także jako rozpuszczalnik w mieszaninie o nazwie błękitny krzyż[20].
Fenylodichloroarsyna, podobnie jak difenylochloroarsyna i difenylocyjanoarsyna, stosowana była w mieszaninach z fosgenem i difosgenem. Działanie polegało na wywołaniu wymiotów u żołnierza, przez co nie mógł on używać maski przeciwgazowej i zdejmując ją narażał się na działanie bardziej toksycznych substancji[10][22].
W czasie II wojny światowej armie niemiecka i włoska posiadały zapasy mieszaniny iperytu i fenylodichloroarsyny[10]. W tym okresie była ona prawdopodobnie stosowana wraz z iperytem i luizytem przez Japonię przeciwko Chinom[23].
Przypisy[edytuj | edytuj kod]
- ↑ a b Phenyl dichloroarsine, [w:] Chemical Warfare Agents. Toxicology and Treatment, Timothy C. Marrs (red.), Robert L. Maynard (red.), Frederick R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, s. 697, ISBN 978-0-470-01359-5 (ang.).
- ↑ a b c d Dichlorophenylarsine, [w:] GESTIS-Stoffdatenbank, Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, ZVG: 570115 [dostęp 2011-03-02] (niem. • ang.).
- ↑ a b c d e f g Związki arsenoorganiczne, [w:] Aleksandra Stachlewska-Wróblowa, Analiza skażeń chemicznych, wyd. 2, Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1985, s. 221.
- ↑ a b c David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, ISBN 978-1-4200-9084-0 (ang.).
- ↑ a b c d e Blister Agents, [w:] Steven L. Hoenig, Compendium of Chemical Warfare Agents, New York: Springer, 2007, s. 35–38, ISBN 978-0-387-34626-7 (ang.).
- ↑ a b Arsenic Agents C04-A, [w:] D. Hank Ellison, Handbook of Chemical and Biological Warfare Agents, wyd. 2, Boca Raton: CRC Press, 2008, s. 202–203, ISBN 978-0-8493-1434-6 (ang.).
- ↑ Związki arsenu z wyjątkiem wymienionych w innym miejscu niniejszego załącznika, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2021-05-28] (ang.).
- ↑ Phenyldichloroarsine, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2011-03-02] (ang.).
- ↑ Phenyldichloroarsine [online], The MSDS Hazard Communication Library [dostęp 2011-03-02] (ang.).
- ↑ a b c d e Fenylodichloroarsyna (PD), [w:] Eric Croddy, Clarisa Perez-Armendariz, John Hart, Broń chemiczna i biologiczna, Warszawa: Wydawnictwa Naukowo-Techniczne, 2003, s. 141, ISBN 83-204-2817-3.
- ↑ a b c Gazy bojowe powodujące kichanie – sternity, [w:] Vademecum obrony przeciwlotniczej i przeciwgazowej ludności cywilnej, wyd. 2, Warszawa: Zakład Ubezpieczeń na Wypadek Choroby, 1936, s. 248, OCLC 14748313.
- ↑ a b Preparations of blister agents, [w:] Jared Ledgard, A Laboratory History of Chemical Agents, 2006, s. 127–128, ISBN 978-0-615-13645-5 (ang.).
- ↑ a b c d e Aromatic halogenated and cyanoarsines, [w:] A Text-Book of Inorganic Chemistry, J. Newton Friend (red.), t. 11, Organometallic Compounds, cz. 2, Derivatives of Arsenic, London: Charles Griffin & Company, 1930, s. 105 (ang.).
- ↑ a b c d Geoffrey M. Fitzgerald, Timothy Vollmer, CBRNE – Vesicants, Organic Arsenicals – L, ED, MD, PD, HL [online], eMedicine, 24 marca 2009 [dostęp 2011-03-19] (ang.).
- ↑ Organic Arsenicals, [w:] Chemical Warfare Agents. Toxicology and Treatment, Timothy C. Marrs (red.), Robert L. Maynard (red.), Frederick R. Sidell (red.), wyd. 2, John Wiley & Sons, 2007, s. 473–474, ISBN 978-0-470-01359-5 (ang.).
- ↑ a b Richard J. O’Connor, Evelyn L. McGown, Kilian Dill, Interaction of Phenyldichloroarsine with Biological Molecules, Institute Report No. 222, Presidio of San Francisco: Letterman Army Institute of Research, sierpień 1986 [dostęp 2021-05-28] (ang.).
- ↑ Daniel J. Dire, CBRNE – Vesicants, Mustard – Hd, Hn1-3, H [online], eMedicine, 7 stycznia 2010 [dostęp 2011-03-18] (ang.).
- ↑ Phenyldichloroarsine, [w:] Hazardous Substances Data Bank [online] [dostęp 2011-03-21] (ang.).
- ↑ Fenylodichloroarsyna, [w:] 1000 słów o chemii i broni chemicznej, Zygfryd Witkiewicz (red.), Warszawa: Wydawnictwo Ministerstwa Obrony Narodowej, 1987, s. 91, ISBN 83-11-07396-1, OCLC 19360683.
- ↑ a b Jules Bebie, Manual of Explosives, Military Pyrotechnics and Chemical Warfare Agents. Composition, Properties, Uses, New York: The Macmillan Company, 1943, s. 121 (ang.).
- ↑ Robert Noyes, Chemical Weapons Destruction and Explosive Waste/Unexploded Ordnance Remediation, Noyes Publication, 1996, s. 5, ISBN 0-8155-1406-9 (ang.).
- ↑ a b Związki arsenoorganiczne, [w:] Leszek Konopski, Historia broni chemicznej, Warszawa: Bellona, 2009, s. 53, ISBN 978-83-11-11643-6.
- ↑ The situation at the end of World War II, [w:] Wil D. Verwey, Riot Control Agents and Herbicides in War. Their Humanitarian, Toxicological, Ecological, Military, Polemological, and Legal Aspects, BRILL, 1977, s. 273, ISBN 978-90-286-0336-3 (ang.).