Żarłacz żółty
| Negaprion brevirostris[1] | |||
| (Poey, 1868)[2] | |||

| |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada | |||
| Podgromada | |||
| Rząd | |||
| Rodzina | |||
| Rodzaj | |||
| Gatunek |
żarłacz żółty | ||
| Synonimy | |||
| |||
| Kategoria zagrożenia (CKGZ)[3] | |||
 | |||
| Zasięg występowania | |||
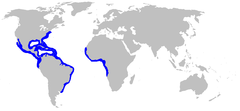 Zasięg występowania żarłacz żółtego | |||
Żarłacz żółty[4][5], żarłacz cytrynowy (Negaprion brevirostris) − gatunek dużego rekina z rodziny żarłaczowatych (Carcharhinidae). Występuje w tropikalnych wodach u wybrzeży wschodniego Oceanu Spokojnego oraz w wodach Oceanu Atlantyckiego u wybrzeży północno-zachodniej Afryki oraz u wybrzeży obu Ameryk, od Nowego Jorku na północy po Montevideo na południu. Zamieszkuje płytkie wody o głębokości nie przekraczającej 90 m, wzdłuż górnych krawędzi szelfów kontynentalnych. Zwykle spotyka się go w pobliżu raf koralowych, lasów namorzynowych, w zatokach, ujściach rzek i lagunach, ale również i w portach. Jest to gatunek amfidromiczny, przystosowany do życia w wodzie słodkiej i słonej, okresowo przemieszczający się między wodami morskimi i słodkimi. Dorosłe osobniki odbywają nieregularne, ciągłe migracje. Posiada masywnie zbudowany korpus z wydłużoną szeroką głową o tępo zakończonym pysku z dużym otworem gębowym oraz dużą, heterocerkiczną płetwę ogonową z trójkątnym fałdem skórnym na końcu górnego łuku. Cechą charakterystyczną tego gatunku są proporcjonalnie duże szerokie płetwy piersiowe. Dorosłe osobniki osiągają 2,4−3,5 m długości. Samice są wyraźnie większe od samców.
Podobnie jak inne żarłaczowate jest żyworodny. Kopulacja odbywa się za pomocą pterygopodium, narządu płciowego samca. Po trwającej około 10−12 miesięcy ciąży samica rodzi 4−17 młodych, mierzących 60−65 cm długości. Dieta tego rekina składa się z ryb kostnoszkieletowych, ryb chrzęstnoszkieletowych, głowonogów i skorupiaków. Jego łupem padają również ptaki i ssaki morskie. Najczęściej pływa samotnie, czasami łączy się w niewielkie grupy. Niekiedy tworzy międzygatunkowe skupiska z innymi dużymi żarłaczowatymi. Wśród znanych pasożytów żarłacza żółtego rozróżnia się liczne gatunki tasiemców, przywr i widłonogów. Międzynarodowa Unia Ochrony Przyrody na podstawie danych z badań i połowów oraz licznych obserwacji w środowisku naturalnym, uznała tego rekina za gatunek bliski zagrożenia (NT).
Taksonomia i filogenetyka
[edytuj | edytuj kod]W 1868 roku gatunek ten po raz pierwszy opisał kubański zoolog Felipe Poey jako Hypoprion brevirostris[2]. W 1940 roku australijski ichtiolog Gilbert Percy Whitley przeniósł go wraz z Carcharias acutidens o nowego rodzaju Negaprion[1]. Epitet gatunkowy pochodzi od łacińskich słów brevis znaczącego "krótki" i rostrum oznaczającego "dziób" lub "pysk". Syntyp to młoda samica mierząca 82,5 cm długości wyłowiona u wybrzeży meksykańskiego Mazatlán, znajdująca się w Muzeum Historii Naturalnej w Waszyngtonie pod numerem katalogowym USNM 28167[2].
W 1988 roku Leonard Compagno opierając się na fenetycznych badaniach uznał, że żarłacz żółty, Negaprion acutidens i Lamiopsis temminckii tworzą wspólny klad[6]. Analiza filogenetyczna na podstawie danych allozymowych, opublikowanych przez Gavina Naylora w 1992 roku, wskazuje, że gatunek ten jest taksonem siostrzanym do kladu, który tworzą Loxodon macrorhinus i Triaenodon obesus[7]. Carrier i inni w 2004 roku potwierdzili to założenie, przedstawiając taksony Loxodon, Negaprion i Triaenodon jako zajmujące pośrednią pozycję na drzewie ewolucyjnym żarłaczowatych, pomiędzy bazalnymi rodzajami Galeocerdo, Rhizoprionodon i Scoliodon oraz bardziej zaawansowanymi Carcharhinus i Sphyrna[8]. Schultz i inni w 2008 roku na podstawie badań markerów mikrosatelitarnych DNA, dowiedli, że N. brevirostis i N. acutidens rozdzieliły się około 10-14 milionów lat temu, z powodu zamknięcia się Tetydy wskutek kolizji Afryki, Arabii i Indii z Eurazją, co odizolowało od siebie oba gatunki[9].
Występowanie i środowisko
[edytuj | edytuj kod]
Żarłacz żółty zamieszkuje ciepłe tropikalne wody u wybrzeży wschodniego Oceanu Spokojnego oraz na zachodzie i wschodzie Oceanu Atlantyckiego. Na wschodzie Atlantyku spotykany jest od południowych krańców Sahary Zachodniej po Namibię, w tym w Zatoce Gwinejskiej oraz w wodach wokół Archipelagu Bijagós, Wyspy Książęcej, Wyspy Świętej Heleny, Wyspy Świętego Tomasza, Wyspy Bioko i Wyspy Annobón. Na zachodzie występuje od Nowego Jorku na północy po Montevideo na południu. Na północnym zachodzie zamieszkuje Zatokę Meksykańską, Zatokę Wenezuelską, Zatokę Moskitów, Kanał Jamajski, Cieśninę Florydzką, Cieśninę Jukatańską, Zatokę Campeche, Zatokę Darién, Zatokę Urabá i Morze Karaibskie oraz wody wokół Bahamów, Kajmanów, Kuby, Jamajki, Haiti, Juventud, Tortugi i Małych Antyli[10]. Na południu spotykany wzdłuż wybrzeży Ameryki Południowej w tym w Zatoce Wszystkich Świętych i Zatoce Guanabara, wokół Wyspy Itaparica, Wyspy Grande i Wyspy Węży oraz lagunach Patos i Mirim[9]. Na wschodzie Pacyfiku odnotowywany od północnych krańców Półwyspu Kalifornijskiego po peruwiańskie Trujillo. Występuje tu w Zatoce Kalifornijskiej, Zatoce Panamskiej, Zatoce Tehuantepec i Zatoce Guayaquil, oraz w wodach Wyspy Cedros, Wysp Marii, Wyspy Malpelo i Wyspy Tiburón[6][11][12].
Rekin ten preferuje płytkie przybrzeżne wody wzdłuż półek szelfów kontynentalnych o głębokości zwykle nie przekraczających 90 m (sporadycznie nurkuje głębiej)[12]. Zwykle spotyka się go w pobliżu raf koralowych, lasów namorzynowych, w zatokach, ujściach rzek i lagunach, ale również i w portach (w tym w pobliżu pirsów), w wodach o piaszczystym, mulistym lub skalistym dnie[3][13]. Młode przebywają w płytkich wodach przybrzeżnych o głębokości czasami jedynie 50–80 cm[14], preferując głównie środowisko namorzynowe z uwagi na dużą dostępność pokarmu i ochronę przed atakami drapieżników, w tym większych rekinów[15]. W wodach Bahamów na jednym kilometrze kwadratowym występować może od 250 do 500 niedojrzałych osobników[16][17]. Jest to gatunek amfidromiczny, przystosowany do życia w wodzie słodkiej i słonej, okresowo przemieszczający się między wodami morskimi i słodkimi[3]. Nie wpływa do rzek daleko w głąb lądu jak żarłacz tępogłowy. Spotykany w ujściu Amazonki do wyspy Grande de Gurupá oraz w ujściu Rio Pará po miasto Abaetetuba[18].
Cechy morfologiczne
[edytuj | edytuj kod]
Rekin ten posiada wrzecionowaty, wydłużony, mocno zbudowany korpus z wydłużoną szeroką głową o tępo zakończonym pysku z dużym U-kształtnym otworem gębowym. W szczękach mieści się kilka rzędów zębów. Pierwszy z nich ułożony jest pionowo, a każdy kolejny coraz bardziej pochylony ku tyłowi. W razie utraty któregoś z zębów na jego miejsce przesuwa się następny z kolejnego rzędu. Trzon górnych zębów jest masywny i trójkątny o piłkowanych krawędziach po obu stronach, podstawa jest szeroka, bocznie spłaszczona. Podobnej wielkości dolne zęby posiadają delikatnie gładkie ostre krawędzie i szerszą podstawę w stosunku do szczytu zęba. W górnej szczęce mieści się 20-24 zębów, w dolnej 22–26. Duże nozdrza osadzone po bokach przedniej spodniej części pyska posiadają małe księżycowate fałdy skórne. Stosunkowo małe, okrągłe oczy o okrągłych źrenicach, wyposażone są w fałdy półksiężycowate spojówek (ochraniające migotkę). Za nimi znajdują się niewielkie owalne tryskawki. Rekin ten posiada pięć niedużych równych szczelin skrzelowych. Na spodzie pyska widoczne są liczne elektroreceptory zwane ampułkami Lorenziniego[12].

Tępo zakończona pierwsza, stosunkowo niska, mała trójkątna płetwa grzbietowa ma długą wolną dalszą ostrą końcówkę. Kształtem przypomina łagodnie wygięty ku tyłowi sierp. Jej proksymalna krawędź leży dokładnie nad tylną krawędzią podstawy płetw piersiowych. Duża druga płetwa grzbietowa ma romboidalny kształt, zaokrągloną górną końcówkę i szeroką podstawę. Umiejscowiona jest nad płetwą odbytową. Pomiędzy płetwami grzbietowymi widoczny wyraźny międzygrzbietowy łuk. Ostro zakończone płetwy piersiowe są długie i szerokie, z mocno zagiętą dystalną krawędzią. Ulokowane są tuż za ostatnią parą szczelin skrzelowych. Małe płetwy brzuszne mają romboidalny kształt i szeroką podstawę. U samca z wewnętrznej tylnej części płetw brzusznych wykształcił się narząd kopulacyjny zwany pterygopodium. Samice posiadają proporcjonalnie większe płetwy brzuszne niż samce. Płetwa odbytowa jest większa od płetw brzusznych, lecz mniejsza niż druga płetwa grzbietowa. Posiada zaostrzoną, mocno wygiętą ku tyłowi dolną i ostrą wolną górną końcówkę. Na końcu ogona mieści się długa, heterocerkiczna, asymetryczna płetwa ogonowa. Na końcu jej górnego łuku, kilkukrotnie dłuższego od dolnego, mieści się szeroki wydłużony wyraźny fałd skórny bez wyraźnego poprzedzającego go wcięcia[12][19].
Skórę pokrywają romboidalne połyskujące łuski plakoidalne. Mają kształt litery W i zachodzą na siebie w 1/3 długości. Grzbiet rekina ma ciemnoszarą, jasnobrunatną lub ciemnobrązową barwę. Spód ciała oraz płetw piersiowych i boki są nieco jaśniejsze, barwy białej, srebrnej lub jasnożółtej. Dorosłe osobniki osiągają zazwyczaj 2,4−3 m (maksymalnie 3,4−3,5 m). Wielkość jest cechą dymorfizmu płciowego, samice są wyraźnie większe od samców[6][19].
Najbliżej spokrewniony z żarłaczem żółtym, Negaprion acutidens, posiada większe płetwy grzbietowe i brzuszne, ostrzej zakończony pysk oraz ciemniejszą barwę grzbietu. Osiąga również większe rozmiary. Gatunki te nie sposób jednak pomylić w środowisku naturalnym z uwagi na odrębne obszary występowania[20].
Ekologia i zachowanie
[edytuj | edytuj kod]
Żarłacz żółty to drapieżnik znajdujący się na szczycie łańcucha pokarmowego, aktywny zarówno za dnia jak i w nocy. Najczęściej pływa samotnie lub w małych grupach liczących 2−4 osobników. Niekiedy wraz z innymi dużymi żarłaczami – takimi jak żarłacz rafowy (Carcharhinus amblyrhynchos) i żarłacz karaibski (Carcharhinus perezi) – tworzy grupy składające się z osobników różnych gatunków[6]. Młode rekiny padają niekiedy ofiarą większych rekinów, w tym osobników własnego gatunku (kanibalizm). Obserwuje się duże grupy głowomłota tropikalnego (Sphyrna lewini) polujące na młode żarłacze żółte w pobliżu przybrzeżnych namorzynowych „szkółek"[19]. Na większości obszarów występowania ryba ta nie ma naturalnych wrogów, z wyjątkiem wód wschodniego Pacyfiku, gdzie polują na nią niekiedy żarłacze białe lub inne gatunki dużych rekinów[6]. Żyje zwykle do 25 lat[21]. Gatunek filopatryczny, osobniki zajmują stale określony areał, nie wykazują jednak terytorializmu (na tym samym obszarze może współwystępować wiele osobników)[22]. Wielkość areału u młodocianych wynosi 0,23-1,26 km², stwierdzono pozytywną zależność między wielkością osobników a wielkością zajmowanych przez nie terytoriów[23]. Osobniki w różnych stadiach ontogenezy różnią się pod względem preferencji siedliskowych i aktywności dobowej. O ile młodociane pozostają w pobliżu przybrzeżnych refugiów całą dobę i są aktywne (żerują) przez całą dobę, to osobniki dorosłe żerują głównie w nocy w środowiskach przybrzeżnych, ze świtem odpływają 7–8 km w kierunku pełnego morza, i spędzają dzień w pelagialu[22]. Prędkość pływania jest niższa niż innych dużych rekinów – wynosi 0,33-0,7 m/s, w krótkotrwałych zrywach dochodzi do 5,6 m/s[a][22].
Pasożytnictwo
[edytuj | edytuj kod]
Wśród pasożytów wewnętrznych tego gatunku wyróżnia się tasiemce z rzędów Tetraphyllidea (Anthobothrium, Paraorygmatobothrium, Phoreiobothrium, Phyllobothrium i Platybothrium) i Trypanorhyncha (Callitetrarhynchus, Dasyrhynchus, Floriceps, Otobothrium, Poecilancistrium, Pseudogrillotia i Tentacularia)[24][25]. Larwy tasiemców bytują się w skorupiakach, rybach kostnoszkieletowych i głowonogach. Po zjedzeniu ich przez rekina tasiemiec rozwija się w formę dorosłą[24]. Tetraphyllidea zagnieżdżają się w zastawce spiralnej serca[26], podczas gdy Trypanorhyncha żyją w górnym fragmencie jelita[24]. Na skórze żarłacz żółtego spotyka się przywry monogeniczne z rodzajów Dermophthirius, Neodermophthirius (wokół płetw i na grzbiecie) i Heteronchocotyle (w okolicy skrzeli)[27] oraz widłonogi (Alebion carchariae, Kroyeria spatulata, Nemesis pilosus, Nesippus orientalis, Paralebion elongatus, Perissopus dentatus[28] i Pandarus sinuatus[29]). W pozbyciu się zewnętrznych parazytów rekinowi pomagają ryby z rodziny wargaczowatych, ostrobokowatych (Carangoides i Caranx) i babkowatych (w tym Gobiosoma grosvenori, Elacatinus evelynae, Elacatinus randalli i Elacatinus tenox)[30][31]. Żarłacz żółty widywany jest często z przyczepionymi do boku podnawkowatymi z rodzajów Echeneis i Remora[11]. Ryby te dzięki przekształconej w owalną przyssawkę płetwie grzbietowej podróżują wraz z rekinem odżywiając się resztkami jego pożywienia[12][11].
Odżywianie
[edytuj | edytuj kod]Żarłacz żółty odżywia się głównie nocą. Zwykle poluje przy dnie lub w pobliżu dna, dużo rzadziej przy tafli wody. Jego głównym pożywieniem są ryby kostnoszkieletowe, rzadziej ryby chrzęstnoszkieletowe oraz bezkręgowce, takie jak głowonogi (mątwy, ośmiornice i kałamarnice[32]), krewetki, równonogi i skorupiaki. Łupem padają również ptaki, ssaki morskie i gady morskie (żółwie i węże morskie)[20][32]. W miejscach gdzie pokarmu jest dużo, rekin ten wybiera wyselekcjonowane ofiary, najczęściej gatunki wolniejsze, wykorzystujące do obrony kamuflaż. W wodach Bahamów poluje na skarusowate, batrachowate i ryby z rodziny Gerreidae[33][34]. U wybrzeży Wyspy Świętej Heleny jego dieta składa się z ostrobokowatych, żaglonowatych, belonowatych, pomakantowatych i bramowatych[35]. Dzięki współpracy kilku osobników gatunek ten z powodzeniem poluje na większe od siebie ofiary[6].
Cykl życiowy
[edytuj | edytuj kod]Podobnie jak inne żarłaczowate, jest żyworodny. Samce dojrzewają płciowo osiągnąwszy długość 224 cm, samice po osiągnięciu 240 cm[19]. Gody mają miejsce w miesiącach wiosennych lub latem, w zależności od szerokości geograficznej[3][19]. W tym okresie pobudzone samce uporczywie próbują doprowadzić do kopulacji, często w sposób agresywny, gryząc samicę w okolicy płetwy grzbietowej i płetw piersiowych. Jest to typowe zachowanie dla żarłaczowatych. Z tego powodu często spotyka się blizny na grzbiecie samic[36]. Kopulacja ma miejsce w płytkich przybrzeżnych wodach i odbywa się za pomocą pterygopodium, narządu wykształconego z dystalnych fragmentów płetw brzusznych samców[19][36]. Embriony w ciele matki zużywają zapasy żółtka z pęcherzyka żółtkowego, który później łączy się ze ścianą macicy, tworząc tzw. łożysko żółciowe, dzięki któremu dostarczane jest pożywianie z organizmu matki[6]. Po trwającej 10-12 miesięcy ciąży samica rodzi od 4 do 17 młodych[19]. Liczba młodych zależy od rozmiarów matki – im większa samica, tym liczniejszy miot[36]. Na różnych obszarach poród ma miejsce od kwietnia do września[19]. Samice w tym czasie wracają na płytkie wody, o głębokości niekiedy jedynie 60 cm[3]. Noworodki mierzą około 60−65 cm i od chwili narodzin potrafią swobodnie pływać i pobierać pokarm[37]. Przez pierwszych kilka lat młodociane osobniki pozostają w płytkich przybrzeżnych wodach, dużo bezpieczniejszych od otwartej toni głębszych wód. Do osiągnięcia dojrzałości przebywają w większych grupach. Dzięki temu chronione są lepiej przed atakami drapieżników[12]. Samice zachodzą w ciążę zwykle co drugi rok[19], i co dwa lata powracają na te same miejsca rozrodu. Gatunek poliandryczny[38].
Relacje z ludźmi
[edytuj | edytuj kod]Żarłacz żółty poławiany jest na wszystkich obszarach występowania w celach komercyjnych, jak i turystyczno-rekreacyjnych. Gatunek ten jest ważny dla przemysłu rybołówstwa morskiego u zachodnich wybrzeży Oceanu Atlantyckiego oraz w wodach wschodniego Pacyfiku. Poławiany za pomocą sieci skrzelowych, takli, sieci przydennych oraz za pomocą hobbystycznego sprzętu wędkarskiego. Czasami znajdowany jako przyłów. Cenione są głównie płetwy, które eksportuje się do południowo-wschodniej Azji, w celu produkcji zupy z płetwy rekina oraz mięso, które spożywa się lokalnie lub wysyła do Japonii. Skóra wykorzystywana jest do produkcji galanterii i ozdób, podobnie jak szczęki i zęby, które z uwagi na wielkość sprzedaje się w formie elementów dekoracyjnych. Pozostałe niewykorzystane fragmenty przetwarza się w celu produkcji mączki rybnej[3][19].
Na podstawie danych z połowów oraz obserwacji stanu populacji w środowisku naturalnym, Międzynarodowa Unia Ochrony Przyrody uznała gatunek ten za bliski zagrożenia i wpisała do Czerwonej księgi gatunków zagrożonych. Rekin ten nie jest objęty ochroną na żadnym z obszarów występowania. W wodach Stanów Zjednoczonych gatunek ten wraz z innymi dużymi gatunkami rekinów został objęty programem The Highly Migratory Species Division of the National Marine Fisheries Service, zarządzanym przez Narodową Administrację ds. Oceanów i Atmosfery (NOAA). Wielkość populacji tego rekina spada. Za główne zagrożenie dla tego gatunku uznaje się przełowienie (w tym nadmierne kłusownictwo na młodych rekinach), choć znaczenie ma również degradacja naturalnych siedlisk oraz zanieczyszczenie wody[3][19].
Żarłacz żółty, pomimo sporych rozmiarów stanowi niewielkie zagrożenie dla ludzi. Według danych The International Shark Attack File rekin ten odpowiedzialny jest za zaledwie 10 niesprowokowanych ataków, z czego żaden z nich nie był śmiertelny. Wszystkie ataki miały miejsce w wodach u wybrzeży Florydy oraz na Karaibach[19]. Rekin ten jest obojętny względem nurków i surferów, choć zachowuje się agresywniej w grupie, zwłaszcza w obecności innych dużych rekinów[3].
Uwagi
[edytuj | edytuj kod]- ↑ Zaobserwowano osobniki Isurus oxyrhynhus i Prionace glauca pływające z prędkością, odpowiednio, do 13,3 i 19,2 m/s (Sundstrom et al. (2001) za Wood (1982)).
Przypisy
[edytuj | edytuj kod]- ↑ a b Negaprion brevirostris, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c d F. Poey. Synopsis piscium cubensium. Catalogo razonado de los peces de la isla de Cuba. „Repertorio Fisico-Natural de la Isla de Cuba”. 2, s. 451, ryc. 4 (rys. 5–6, 20), 1868. (hiszp.).
- ↑ a b c d e f g h L.F. Sundström, Negaprion brevirostris, [w:] The IUCN Red List of Threatened Species 2020, wersja 2020-2 [dostęp 2020-08-31] (ang.).
- ↑ Ciołkowiak, E.: Niebezpieczne zwierzęta morskie. Warszawa: BEL, 2005. ISBN 83-89968-00-2.
- ↑ Kowalska, K., Bembiszewski, J.M., Rolik, H.: Mały słownik zoologiczny, Ryby. Warszawa: Wiedza Powszechna, 1973, s. 295. ISBN 978-83-21-401-34-8.
- ↑ a b c d e f g Compagno, L.J.V.: Sharks of the Order Carcharhiniformes. Princeton University Press, 1988, s. 319-320. ISBN 0-691-08453-X.
- ↑ Naylor, G.J.P.. The phylogenetic relationships among requiem and hammerhead sharks: inferring phylogeny when thousands of equally most parsimonious trees result. „Cladistics”. 8 (4), s. 295-318, 1992. DOI: 10.1111/j.1096-0031.1992.tb00073.x.
- ↑ Carrier, J.C., Musick, J.A. i Heithaus, M.R.: Biology of Sharks and Their Relatives. Warszawa: CRC Press, 2004, s. 52. ISBN 0-8493-1514-X.
- ↑ a b Schultz, J.K., Feldheim, K.A., Gruber, S.H., Ashley, M.V., McGovern, T.M., Bowen, B.W.. Global phylogeography and seascape genetics of the lemon sharks (genus Negaprion). „Molecular Ecology”. 17 (24), s. 5336–5348, 2008. DOI: 10.1111/j.1365-294X.2008.04000.x.
- ↑ Springer, S.. The sex ratio and seasonal distribution of some Florida sharks. „Copeia”. 3, s. 188-194, 1940.
- ↑ a b c Dibattista, J.D., Feldheim, K.A., Garant, D., Gruber, S.H., Hendry, A.P.. Anthropogenic disturbance and evolutionary parameters: a lemon shark population experiencing habitat loss. „Evolutionary Applications”. 4 (1), s. 1-17, 2011. DOI: 10.1111/j.1752-4571.2010.00125.x.
- ↑ a b c d e f Compagno, L.J.V.: Sharks of the World: An Annotated and Illustrated Catalogue of Shark Species Known to Date. Rzym, Włochy: Food and Agricultural Organization, 1984, s. 455–457. ISBN 92-5-101384-5.
- ↑ Springer, S.. History notes on the lemon shark, Negaprion brevirostris. „Texas Journal of Science”. 3, s. 349-359, 1950.
- ↑ Morrissey, J.F., Gruber, S.H.. Habitat selection by the juvenile lemon shark, Negaprion brevirostris. „Environmental Biology of Fishes”. 38, s. 311-319, 1993.
- ↑ B.M. Wetherbee, S.H. Gruber i R.S. Rosa. Movement patterns of juvenile lemon sharks Negaprion brevirostris within Atol das Rocas, Brazil: a nursery characterized by tidal extremes. „Marine Ecology Progress Series”, s. 283–293, 2007. 343. DOI: 10.3354/meps06920.
- ↑ Gruber, S.H., de Marignac, J.R.C., Hoenig, J.M.. Survival of juvenile lemon sharks at Bimini, Bahamas, estimated by mark-depletion experiments. „Transactions of the American Fisheries Society”. 130, s. 376-384, 2001.
- ↑ Jacobsen: An ecosystem-level study of a shallow, subtropical, marine lagoon, North Sound, Bimini, Bahamas. Ph.D. dissertation University of Georgia, 1987, s. 52-53.
- ↑ E. Cortés i S.H. Gruber. Diet, feeding habits, and estimates of daily ration of young lemon sharks, Negaprion brevirostris (Poey). „Copeia”, s. 204–218, 1990.
- ↑ a b c d e f g h i j k l Alexia Morgan: Education Biological Profiles LEMON SHARK (Negaprion brevirostis). FLMNH Ichthyology, 2011. [dostęp 2015-01-08]. (ang.).
- ↑ a b L.J.V. Compagno, D.A. Ebert i M.J. Smale: Guide to the sharks and rays of southern Africa. Londyn: New Holland, 1989, s. 158.
- ↑ S.W Smith, D.W. Au i C. Show. Intrinsic rebound potential of 26 species of Pacific sharks. „Marine and Freshwater Research”, s. 663-678, 1998.
- ↑ a b c Sundström L.F., Gruber S.H., Clermont S.M., Correia J.P.S., de Marignac J.R.C., Morrisey J.F., Lowrance C.R., Thomassen L. & Oliveira M.T.. Review of elasmobranch behavioural studies using ultrasonic telemetry with special reference to the lemon shark, Negaprion brevirostris, around Bimini Islands, Bahamas.. „Environmental Biology of Fishes”. 60, s. 225-250, 2001. (ang.).
- ↑ Morrissey John F. & Gruber Samuel H.. Home range of juvenile lemon sharks, Negaprion brevirostris.. „Copeia”, s. 425-434, 1993.
- ↑ a b c Palm, H.W.: The Trypanorhyncha Diesing. PKSPL-IPB Press, 1863. ISBN 979-9336-39-2.
- ↑ Shuler, R.H.. Some cestodes of fish from Tortugas, Florida. „Journal of Parasitology”. 24 (1), s. 57-63, 1938.
- ↑ Caira, J.N., Richmond, C., Swanson, J.. A revision of Phoreiobhrium (Tetraphyllidea: Onchobothriidae) with descriptions of five new species. „Journal of Parasitology”. 91 (5), s. 1153-1174, 2005. DOI: 10.1645/GE-3459.1.
- ↑ Sproston, N.G.. A synopsis of the monogenetic trematodes. „Transactions of the Zoological Society of London”. 25, s. 185-600, 1946.
- ↑ Cressey, R.F.. Copepods parasites on sharks from the west coast of Florida. „Smithsonian Contributions to Zoology”. 38, s. 1-30, 1970.
- ↑ Cressey, R.F.. Revision of the family Pandaridae (Copepoda: Caligoida). „Proceedings of the United States National Museum”. 121 (3570), s. 133, 1967.
- ↑ Brunnschweiler, J.M., Andrews, P.L.R., Southall, E.J., Pickering, M., Sims, D.W.. Rapid voluntary stomach eversion in a free-living shark. „Journal of Marine Biology, Ass. U.K.”. 85, s. 1141-1144, 2005.
- ↑ Naylor, G.J.P., Caira, J.N., Jensen, K., Rosana, K.A.M., White, W.T., Last, P.R.. A DNA sequence based approach to the identification of shark and ray species and its implications for global elasmobranch diversity and parasitology. „Bulletin of the American Museum of Natural History”. 367, s. 262, 2012.
- ↑ a b Ross Robertson: Negaprion brevirostris (Poey, 1868) LEMON SHARK. 2010. [dostęp 2015-01-12]. (ang.).
- ↑ S.P. Newman, S.H. Gruber i R.D. Handy. The scarecrow toadfish: habitat, abundance and size at maturity at Bimini, Bahamas. „Journal of Fish Biology”, s. 248-252, 2004.
- ↑ Michael Bright: The private life of sharks: the truth behind the myth. Mechanicsburg: Stackpole Books, 2010. ISBN 0-8117-2875-7.
- ↑ A. Edwards: Fish and fisheries of Saint Helena Island. Centre for Tropical Coastal Management Studies. Anglia: University of Newcastle upon Tyne, 1990.
- ↑ a b c C.M. Breder i D.E. Rosen: Modes of reproduction in fishes. New Jersey: T.F.H. Publications, 1966, s. 941.
- ↑ E. Lieske i R. Myers: Collins Pocket Guide. Coral reef fishes. Indo-Pacific & Caribbean including the Red Sea. Haper Collins Publishers, 1994, s. 400. ISBN 978-0002199742.
- ↑ Feldheim Kevin A., Samuel H. Gruber, Mary V. Ashley. Reconstruction of parental microsatellite genotypes reveals female polyandry and philopatry in the lemon sharks, Negaprion brevirostris.. „Evolution”, s. 2332-2342, 2004.
