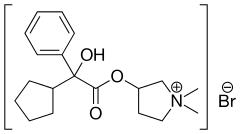
Bromek glikopironiowy
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
C19H28BrNO3 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
398,34 g/mol | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||||||||||||||
| ATC |
A03AB02, R03BB06, A03CA05, D11AA01, R03AL04, R03AL07, R03AL09, R03AL11, R03AL12 | ||||||||||||||||||||||||||
| Stosowanie w ciąży |
kategoria C[3] | ||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
Bromek glikopironiowy (łac. glycopyrronii bromidum) – wielofunkcyjny organiczny związek chemiczny, czwartorzędowa sól amoniowa, z grupy inhibitorów receptorów muskarynowych (M1–M3), długodziałający wziewny lek rozszerzający oskrzela w przewlekłej obturacyjnej chorobie płuc (POChP), stosowany również w chorobie wrzodowej, znieczuleniu ogólnym, ślinotoku, nadmiernym poceniu oraz medycynie paliatywnej.
Mechanizm działania[edytuj | edytuj kod]
Bromek glikopironiowy jest długo działającym antagonistą receptorów muskarynowych (M1–M3) i wykazuje 4–5 razy wyższą selektywnością do receptorów M1 i M3 niż M2 (zgodnie z teoretycznymi przewidywaniami optymalny lek antymuskarynowy stosowany w leczeniu przewlekłej obturacyjnej choroby płuc (POChP) powinien być antagonistą jedynie receptorów M1 i M3[6])[5]. Poprzez wiązanie się z receptorami muskarynowymi hamuje cholinergiczne działanie acetylocholiny wydzielanej na zakończeniach nerwów przywspółczulnych oraz w mięśniach gładkich[5]. Działanie obwodowe bromku glikopironiowego podobne jest to atropiny[7]. Po 7 dniach wziewnego stosowania leku zostaje osiągnięty stan stacjonarny[5].
Zastosowanie[edytuj | edytuj kod]
- podtrzymujące leczenie rozszerzające oskrzela w celu łagodzenia objawów u dorosłych pacjentów z przewlekłą obturacyjną chorobą płuc[4]
- ciężka postać ślinotoku u dzieci i młodzieży w wieku od 3 lat z przewlekłymi zaburzeniami neurologicznymi[7]
- pierwotna nadmierna potliwość (bezpośrednio)[5]
- ogniskowa nadmierna potliwość dłoni i/lub stóp (jontoforeza)[8]
- zahamowanie nadmiernego wydzielania śluzu w oskrzelach oraz zmniejszenia objętości i kwasowości soku żołądkowego w premedykacji[5][9]
- zapobieganie bradykardii wywołanej pobudzeniem nerwu błędnego lub podaniem chlorku suksametoniowego podczas zabiegu operacyjnego[5][9]
- zablokowanie pobudzania odruchów sercowo–naczyniowych z nerwu błędnego podczas indukcji znieczulenia i intubacji[5]
- zapobieganie obwodowych działań muskarynowych po podaniu parasympatykomimetyków (takich jak neostygmina lub pirydostygmina) zastosowanych w celu odwrócenia blokady mięśniowo–nerwowej spowodowanej przez niedepolaryzujące środki zwiotczające[5][9]
- pomocniczo w chorobie wrzodowej żołądka w przypadku kiedy przeciwwskazane jest podanie leków doustnych lub konieczne jest natychmiastowe działanie antycholinergiczne[5]
- w nadmiernym wydzielaniu w drogach oddechowych lub śliny w medycynie paliatywnej (wskazanie pozarejestracyjne)[5][10]
Bromek glikopironiowy jest dopuszczony do obrotu w Polsce (2018), w postaci doustnej i wziewnej, zarówno jako preparat prosty (Seebri, Sialanar, Tovanor, Enurev), jak i w lekach złożonych z indakaterolem (Ultibro, Ulunar, Xoterna) oraz formoterolem i beklometazonem (Trimbow)[11].
Działania uboczne[edytuj | edytuj kod]
Bromek glikopironiowy może powodować następujące działania niepożądane u ponad 10% pacjentów: zatrzymanie moczu, zaparcie, drażliwość, blokada nosa, zmniejszenie ilości wydzieliny w oskrzelach, a u ponad 1% pacjentów: zakażenia górnych dróg oddechowych, zapalenie płuc, zakażenie układu moczowego, pobudzenie, senność, krwawienie z nosa, wysypka, gorączka[7].
Przypisy[edytuj | edytuj kod]
- ↑ Glycopyrrolate (nr SML0029) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2018-07-20]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Glycopyrrolate Material Safety Data Sheet. Spectrum Chemical Manufacturing. [dostęp 2018-07-20]. [zarchiwizowane z tego adresu (2018-07-20)]. (ang.).
- ↑ Drugs and Supplements Glycopyrrolate (Inhalation Route). Mayo Foundation for Medical Education and Research, 2017-03-01. [dostęp 2018-07-20]. (ang.).
- ↑ a b c Seebri Breezhaler 44 mikrogramy proszek do inhalacji w kapsułkach twardych – Charakterystyka Produktu Leczniczego. Centrum Systemów Informacyjnych Ochrony Zdrowia Rejestr Produktów Leczniczych. [dostęp 2018-07-20].
- ↑ a b c d e f g h i j k l m n o p q r s
 Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-07-20].
Jan K. Podlewski, Alicja Chwalibogowska-Podlewska: Leki współczesnej terapii online. Medical Tribune Polska. [dostęp 2018-07-20].
- ↑ Kesavan Suresh Babu, Jaymin Bhagwanji Morjaria, Umeclidinium in chronic obstructive pulmonary disease: latest evidence and place in therapy, „Therapeutic Advances in Chronic Disease”, 8 (4–5), 2017, s. 81–91, DOI: 10.1177/2040622317700822, PMID: 28491268, PMCID: PMC5406010.
- ↑ a b c Proveca Limited: Sialanar 320 mikrogramów/ml roztwór doustny – Charakterystyka Produktu Leczniczego. Europejska Agencja Leków. [dostęp 2018-07-20].
- ↑ Concordia International: Robinul Powder for Solution for Iontophoresis – Charakterystyka Produktu Leczniczego. The electronic Medicines Compendium (eMC). [dostęp 2018-07-20]. (ang.).
- ↑ a b c Concordia International: Glycopyrronium Bromide 200 micrograms/ml Solution for Injection – Charakterystyka Produktu Leczniczego. The electronic Medicines Compendium (eMC). [dostęp 2018-07-20]. (ang.).
- ↑ J.H. Kwon, M.J. Kim, S. Bruera, M. Park i inni. Off-Label Medication Use in the Inpatient Palliative Care Unit. „J Pain Symptom Manage”. 54 (1), s. 46–54, 2017. DOI: 10.1016/j.jpainsymman.2017.03.014. PMID: 28479415.
- ↑ Obwieszczenie Prezesa Urzędu Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych z dnia 16 kwietnia 2018 r. w sprawie ogłoszenia Urzędowego Wykazu Produktów Leczniczych Dopuszczonych do Obrotu na terytorium Rzeczypospolitej Polskiej. Dziennik Urzędowy Ministra Zdrowia, 2018-04-16. [dostęp 2018-07-20].