Histydyna
| |||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
C6H9N3O2 | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
155,15 g/mol | ||||||||||||||||||||||||||||||||||
| Wygląd |
biały lub prawie biały, krystaliczny proszek lub bezbarwne kryształy[1] | ||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||
| Numer CAS |
71-00-1 | ||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||
Histydyna (łac. Histidinum; His, H) – organiczny związek chemiczny, jeden z 20 aminokwasów białkowych[2]. Ze względu na budowę cząsteczki histydyna zaliczana jest zarówno do aminokwasów zasadowych, gdyż jej łańcuch boczny zawiera 2 atomy azotu, jak i aromatycznych, ze względu na obecność aromatycznego pierścienia imidazolowego. Jest kodowana przez kodony CAU i CAC w procesie translacji białka.
Właściwości fizyczne[edytuj | edytuj kod]
Histydyna to białe ciało stałe, które topi się z rozkładem w temperaturze = 273 °C dla mieszaniny racemicznej[6], a znacznie wyższej = 282 °C dla występującego naturalnie izomeru L[7]. Wartość pK dla grupy karboksylowej –COOH wynosi 1,80; łańcucha bocznego (imidazolu) pK = 6,04; a protonowanej grupy α–aminowej (NH3)+ pK = 9,33[8].
Właściwości chemiczne[edytuj | edytuj kod]
Iminowy atom azotu w łańcuchu bocznym tego aminokwasu stosunkowo łatwo tworzy wiązanie koordynacyjne z kationami metali w metaloproteinach. W środowisku wodnym pierścień imidazolowy ulega tautomerii iminowo–enaminowej:
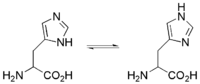
Ponadto w środowisku fizjologicznym pierścień imidazolowy jest częściowo protonowany (pKa ≈ 6) i może służyć zarówno jako katalizator zasadowy (nieprotonowany nukleofilowy atom azotu jest akceptorem jonu wodorowego), jak i katalizator kwasowy (protonowany atom azotu jest donorem H+). W efekcie histydyna jest często obecna jako kluczowy aminokwas w centrach aktywnych wielu enzymów[9].
W reakcji dekarboksylacji w obecności fosforanu pirydoksalu powstaje histamina:

Występowanie w białkach[edytuj | edytuj kod]



- Każdy z czterech kationów żelaza Fe2+ obecnych w cząsteczce hemoglobiny znajduje się wewnątrz niemal całkowicie płaskiej struktury protoporfiryny IX tworząc prostetyczną grupę hemową. Kation Fe2+ jest w grupie hemowej koordynowany przez 4 atomy azotu protoporfiryny. W formie nieutlenowanej piąte wiązanie koordynacyjne jonu żelaza (prostopadle do płaszczyzny grupy hemowej) tworzy tzw. histydyna proksymalna, a szóste miejsce koordynacyjne, po drugiej stronie płaszczyzny jest puste (formie utlenowanej miejsce to zajmuje cząsteczka tlenu O2). Po przeciwnej stronie płaszczyzny niż histydyna proksymalna znajduje się tzw. histydyna dystalna. Nie jest ona związana z grupą prostetyczną jednak odgrywa ważną rolę. Histydyna dystalna zabezpiecza jony żelaza grup hemowych sąsiednich cząsteczek hemoglobiny, aby nie doszło do kontaktu między nimi, chroni jon żelaza przed utlenieniem, gdyż forma utleniona (methemoglobina) nie jest zdolna do skutecznego transportu tlenu. Ponadto histydyna dystalna utrudnia wiązanie się tlenku węgla (CO) do kationu żelaza, co jest szczególnie ważne, gdyż powinowactwo grupy hemowej do czadu jest znacznie wyższe niż do tlenu, a wiązanie CO jest praktycznie nieodwracalne.
- Histydyna wchodzi w skład triady katalitycznej wielu enzymów
- Przykłady:
- karboksypeptydazy II: Asp 338 – His 397 – Ser 146
- subtylizyny: Asp 32 – His 64 – Ser 221
- trypsyny: Asp 102 – His 57 – Ser 195
- chymotrypsyny: Asp 102 – His 57 – Ser 195
- W proteazach cysteinowych cysteina aktywowana jest przez histydynę podobnie jak enzymach z rodziny chymotrypsyny seryna. Np. papaina
- His••••Cys
- Metaloproteina, której miejscem aktywnym jest kation cynku Zn2+ koordynowany przez atomy azotu trzech pierścieni imidazolowych histydyny.
- (His)3••••Zn2+
Przypisy[edytuj | edytuj kod]
- ↑ a b Farmakopea Polska VIII, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2008, s. 3491, ISBN 978-83-88157-53-0.
- ↑ a b Podręczny słownik chemiczny, Romuald Hassa (red.), Janusz Mrzigod (red.), Janusz Nowakowski (red.), Katowice: Videograf II, 2004, s. 163, ISBN 83-7183-240-0.
- ↑ a b c d Histydyna. [martwy link] The Chemical Database. Wydział Chemii Uniwersytetu w Akronie. [dostęp 2012-12-16]. (ang.).[niewiarygodne źródło?]
- ↑ L-Histydyna (nr 53319) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski.
- ↑ a b Histidine, [w:] ChemIDplus, United States National Library of Medicine [dostęp 2012-12-16] (ang.).
- ↑ a b DL–DL-Histydyna (nr H7750) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-06-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b L–Histydyna (nr 151688) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-06-30]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ B.D. Hames, N.M. Hooper: Biochemia Krótkie wykłady. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 32, seria: Wydanie drugie. ISBN 978-83-01-13872-1.
- ↑ Ingle, Robert A. Histidine Biosynthesis. „The Arabidopsis Book”, s. e0141, 2011. DOI: 10.1199/tab.0141.
- ↑ J.M. Berg, J.L. Tymoczko, L. Stryer: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, s. 269–272, seria: Wydanie trzecie zmienione. ISBN 83-01-14379-7.
- ↑ a b c J.M. Berg, J.L. Tymoczko, L. Stryer: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, s. 227–244, seria: Wydanie trzecie zmienione. ISBN 83-01-14379-7.



