Fotosynteza: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
drobne merytoryczne, drobne redakcyjne |
dod |
||
| Linia 4: | Linia 4: | ||
[[Plik:Blatt-wiki.jpg|thumb|right|250px|Źródłem zielonego koloru [[liść|liścia]] jest [[chlorofil]] czyli [[barwniki fotosyntetyczne|barwnik fotosyntetyczny]].]] |
[[Plik:Blatt-wiki.jpg|thumb|right|250px|Źródłem zielonego koloru [[liść|liścia]] jest [[chlorofil]] czyli [[barwniki fotosyntetyczne|barwnik fotosyntetyczny]].]] |
||
'''Fotosynteza''' ({{greka|φώτο}} – światło, σύνθεσις – łączenie) – [[anabolizm|anaboliczny]] proces [[biochemia|biochemiczny]] syntezy [[związki organiczne|związków organicznych]] z prostych [[związki nieorganiczne|nieorganicznych]] substancji chemicznych pod wpływem [[promieniowanie słoneczne|promieniowania słonecznego]]. Jest to jedna z najważniejszych przemian biochemicznych na [[Ziemia|Ziemi]]<ref name=bryantfrigaard>{{Cytuj pismo | autor=Bryant DA., Frigaard NU | tytuł=Prokaryotic photosynthesis and phototrophy illuminated. | rok=2006 | czasopismo=Trends in microbiology | doi=10.1016/j.tim.2006.09.001 | wydanie=14 | numer=11 | miesiąc=listopad | pmid= 16997562 | strony=488–96}}</ref> - [[organizm samożywny|organizmy samożywne]] wykorzystują jej produkty bezpośrednio jako źródło energii, a [[Organizm cudzożywny|organizmy cudzożywne]] - pośrednio, ponadto proces ten utrzymuje wysoki poziom tlenu w atmosferze |
'''Fotosynteza''' ({{greka|φώτο}} – światło, σύνθεσις – łączenie) – [[anabolizm|anaboliczny]] proces [[biochemia|biochemiczny]] syntezy [[związki organiczne|związków organicznych]] z prostych [[związki nieorganiczne|nieorganicznych]] substancji chemicznych pod wpływem [[promieniowanie słoneczne|promieniowania słonecznego]]. Jest to jedna z najważniejszych przemian biochemicznych na [[Ziemia|Ziemi]]<ref name=bryantfrigaard>{{Cytuj pismo | autor=Bryant DA., Frigaard NU | tytuł=Prokaryotic photosynthesis and phototrophy illuminated. | rok=2006 | czasopismo=Trends in microbiology | doi=10.1016/j.tim.2006.09.001 | wydanie=14 | numer=11 | miesiąc=listopad | pmid= 16997562 | strony=488–96}}</ref> - [[organizm samożywny|organizmy samożywne]] wykorzystują jej produkty bezpośrednio jako źródło energii, a [[Organizm cudzożywny|organizmy cudzożywne]] - pośrednio, ponadto proces ten utrzymuje wysoki poziom tlenu w atmosferze. |
||
Fotosynteza zasadniczo składa się z dwóch etapów – fazy jasnej, w której absorbowana jest energia promieniowania słonecznego, a jako produkt uboczny wydzielany jest tlen, oraz fazy ciemnej, podczas której energia słoneczna jest wykorzystywana do syntezy związków organicznych. W uproszczonej formie, sumaryczny przebieg fotosyntezy z glukozą jako syntezowanym węglowodanem podstawowym, zapisuje się<ref>{{Cytuj książkę | nazwisko=Brown | imię=Theodore | nazwisko2=Nelson | imię2=John D. | nazwisko3=Kemp | imię3=Kenneth W. | autor link= | inni= | tytuł=Chemistry: the central science | data=2003 | wydawca=Prentice Hall | miejsce=Upper Saddle River, NJ | isbn=0-13-048450-4 | strony=958}}</ref>: |
Fotosynteza zasadniczo składa się z dwóch etapów – fazy jasnej, w której absorbowana jest energia promieniowania słonecznego, a jako produkt uboczny wydzielany jest tlen, oraz fazy ciemnej, podczas której energia słoneczna jest wykorzystywana do syntezy związków organicznych. W uproszczonej formie, sumaryczny przebieg fotosyntezy z glukozą jako syntezowanym węglowodanem podstawowym, zapisuje się<ref>{{Cytuj książkę | nazwisko=Brown | imię=Theodore | nazwisko2=Nelson | imię2=John D. | nazwisko3=Kemp | imię3=Kenneth W. | autor link= | inni= | tytuł=Chemistry: the central science | data=2003 | wydawca=Prentice Hall | miejsce=Upper Saddle River, NJ | isbn=0-13-048450-4 | strony=958}}</ref>: |
||
| Linia 12: | Linia 12: | ||
Najczęściej [[substrat (chemia)|substratami]] fotosyntezy są [[dwutlenek węgla]] i [[woda]], [[produkt reakcji|produktem]] – węglowodan, a [[Źródła światła|źródłem światła]] – Słońce. Zarówno bezpośrednie produkty fotosyntezy, jak i niektóre ich pochodne (np. [[skrobia]] i [[sacharoza]]) określane są jako [[asymilaty]]. |
Najczęściej [[substrat (chemia)|substratami]] fotosyntezy są [[dwutlenek węgla]] i [[woda]], [[produkt reakcji|produktem]] – węglowodan, a [[Źródła światła|źródłem światła]] – Słońce. Zarówno bezpośrednie produkty fotosyntezy, jak i niektóre ich pochodne (np. [[skrobia]] i [[sacharoza]]) określane są jako [[asymilaty]]. |
||
W komórkach eukariotycznych proces fotosyntezy zachodzi w wyspecjalizowanych organellach – [[chloroplast]]ach, zawierających barwniki fotosyntetyczne. U roślin organami zawierającymi komórki z chloroplastami są głównie [[liść|liście]], będące podstawowymi organami [[Asymilacja (biologia)|asymilacyjnymi]]. Pewne ilości chloroplastów zawierają także komórki niezdrewniałych [[łodyga|łodyg]] oraz kwiatów i owoców. Ze względu na rozkład wody i wydzielanie tlenu, sinice i fotosyntetyzujące [[jądrowce|eukarionty]] zalicza się do organizmów o oksygenicznym typie fotosyntezy, z wydzieleniem tlenu. |
W komórkach eukariotycznych proces fotosyntezy zachodzi w wyspecjalizowanych organellach – [[chloroplast]]ach, zawierających barwniki fotosyntetyczne. U roślin organami zawierającymi komórki z chloroplastami są głównie [[liść|liście]], będące podstawowymi organami [[Asymilacja (biologia)|asymilacyjnymi]]. Pewne ilości chloroplastów zawierają także komórki niezdrewniałych [[łodyga|łodyg]] oraz kwiatów i owoców. Ze względu na rozkład wody i wydzielanie tlenu, sinice i fotosyntetyzujące [[jądrowce|eukarionty]] zalicza się do organizmów o oksygenicznym typie fotosyntezy, z wydzieleniem tlenu. Wśród bakterii jedynie sinice przeprowadzają fotosyntezę w sposób opisany powyżej. Jako [[donor]]ów elektronów używają one związków siarki lub prostych związków organicznych. Tlen w tym procesie nie jest wydzielany, a ten rodzaj fotosyntezy określa się jako anoksygeniczny typ fotosyntezy, bez wydzielenia tlenu. |
||
Fotosynteza rozwinęła się wśród [[mikroorganizm]]ów, we wczesnej [[historia życia na Ziemi|historii życia na Ziemi]]. Pierwsze organizmy fotosyntetyczne, około 3,5 mld lat temu, używały [[wodór|wodoru]] lub [[siarkowodór|siarkowodoru]] zamiast wody<ref>{{cytuj pismo |
|||
Wśród bakterii jedynie sinice przeprowadzają fotosyntezę w sposób opisany powyżej. Jako [[donor]]ów elektronów używają one związków siarki lub prostych związków organicznych. Tlen w tym procesie nie jest wydzielany, a ten rodzaj fotosyntezy określa się jako anoksygeniczny typ fotosyntezy, bez wydzielenia tlenu. |
|||
| autor = Olson JM |
|||
| tytuł = Photosynthesis in the Archean era |
|||
| czasopismo = Photosyn. Res. |
|||
| numer = 2 |
|||
| wydanie = 88 |
|||
| strony = 109–17 |
|||
| rok = 2006 |
|||
| miesiąc = maj |
|||
| doi = 10.1007/s11120-006-9040-5 |
|||
| pmid = 16453059 |
|||
}}</ref>. Co najmniej 2,7 mld lat temu pojawiły się [[sinice]] posiadające zdolność fotosyntezy tlenowej, które zmieniły skład chemiczny atmosfery (tzw. [[katastrofa tlenowa]]) i doprowadziły do powstania [[warstwa ozonowa|powłoki ozonowej]]<ref>{{cytuj pismo |
|||
| autor = Buick R |
|||
| tytuł = When did oxygenic photosynthesis evolve? |
|||
| czasopismo = Philos. Trans. R. Soc. Lond., B, Biol. Sci. |
|||
| numer = 1504 |
|||
| wydanie = 363 |
|||
| strony = 2731–43 |
|||
| rok = 2008 |
|||
| miesiąc = sierpień |
|||
| doi = 10.1098/rstb.2008.0041 |
|||
| pmid = 18468984 |
|||
}}</ref>. |
|||
== Organizmy wykorzystujące fotosyntezę == |
== Organizmy wykorzystujące fotosyntezę == |
||
Wersja z 09:25, 31 sty 2009
Szablon:Propozycja Dobrego Artykułu


Fotosynteza (stgr. φώτο – światło, σύνθεσις – łączenie) – anaboliczny proces biochemiczny syntezy związków organicznych z prostych nieorganicznych substancji chemicznych pod wpływem promieniowania słonecznego. Jest to jedna z najważniejszych przemian biochemicznych na Ziemi[1] - organizmy samożywne wykorzystują jej produkty bezpośrednio jako źródło energii, a organizmy cudzożywne - pośrednio, ponadto proces ten utrzymuje wysoki poziom tlenu w atmosferze.
Fotosynteza zasadniczo składa się z dwóch etapów – fazy jasnej, w której absorbowana jest energia promieniowania słonecznego, a jako produkt uboczny wydzielany jest tlen, oraz fazy ciemnej, podczas której energia słoneczna jest wykorzystywana do syntezy związków organicznych. W uproszczonej formie, sumaryczny przebieg fotosyntezy z glukozą jako syntezowanym węglowodanem podstawowym, zapisuje się[2]:
6H2O + 6CO2 + (energia świetlna) → C6H12O6 + 6O2
Najczęściej substratami fotosyntezy są dwutlenek węgla i woda, produktem – węglowodan, a źródłem światła – Słońce. Zarówno bezpośrednie produkty fotosyntezy, jak i niektóre ich pochodne (np. skrobia i sacharoza) określane są jako asymilaty.
W komórkach eukariotycznych proces fotosyntezy zachodzi w wyspecjalizowanych organellach – chloroplastach, zawierających barwniki fotosyntetyczne. U roślin organami zawierającymi komórki z chloroplastami są głównie liście, będące podstawowymi organami asymilacyjnymi. Pewne ilości chloroplastów zawierają także komórki niezdrewniałych łodyg oraz kwiatów i owoców. Ze względu na rozkład wody i wydzielanie tlenu, sinice i fotosyntetyzujące eukarionty zalicza się do organizmów o oksygenicznym typie fotosyntezy, z wydzieleniem tlenu. Wśród bakterii jedynie sinice przeprowadzają fotosyntezę w sposób opisany powyżej. Jako donorów elektronów używają one związków siarki lub prostych związków organicznych. Tlen w tym procesie nie jest wydzielany, a ten rodzaj fotosyntezy określa się jako anoksygeniczny typ fotosyntezy, bez wydzielenia tlenu.
Fotosynteza rozwinęła się wśród mikroorganizmów, we wczesnej historii życia na Ziemi. Pierwsze organizmy fotosyntetyczne, około 3,5 mld lat temu, używały wodoru lub siarkowodoru zamiast wody[3]. Co najmniej 2,7 mld lat temu pojawiły się sinice posiadające zdolność fotosyntezy tlenowej, które zmieniły skład chemiczny atmosfery (tzw. katastrofa tlenowa) i doprowadziły do powstania powłoki ozonowej[4].
Organizmy wykorzystujące fotosyntezę
Dawniej wszystkie organizmy wyposażone w chlorofil zaliczano do jednego królestwa – roślin. Badania ewolucjonistów wykazały, że zdolność do fotosyntezy nie jest dobrym kryterium oceny związków filogenetycznych. Fotosynteza tlenowa (z uwolnieniem tlenu) wykształciła się pierwotnie jedynie u sinic, natomiast aparat fotosyntetyczny organizmów eukariotycznych (chloroplast) jest wynikiem endosymbiozy[5][6][7]. Omówiony poniżej przebieg fotosyntezy dotyczy roślin, u pozostałych organizmów zdolnych do przeprowadzania procesu fotosyntezy istnieją różnice w poszczególnych reakcjach składających się na cały proces.
Organizmy uzyskujące energię metaboliczną na drodze fotosyntezy to:
- wszystkie rośliny (nieliczne wyjątki to rośliny cudzożywne: saprofityczne i pasożytnicze);
- niektóre protisty, takie jak eugleniny, bruzdnice, złotowiciowce, różnowiciowce, okrzemki, brunatnice;
- część bakterii i archeanów: sinice, bakterie zielone, bakterie purpurowe, heliobakterie oraz halobakterie (uzyskujące energię w procesie fotochemicznym odmiennym od klasycznej fotosyntezy).
W przypadku protistów i bakterii zdolnych do przeprowadzania fotosyntezy część gatunków może korzystać zarówno z energii światła, gdy jest dostępne, lub wykorzystywać związki organiczne jako źródło energii, gdy światło nie jest dostępne. Organizmy takie określa się jako miksotrofy.

Ze względu na istnienie ścisłych powiązań symbiotycznych, z efektów fotosyntezy niemal bezpośrednio mogą korzystać porosty, a także organizmy zasadniczo cudzożywne posiadające zoochlorelle, zooksantelle i cyjanelle.
Niektóre ślimaki morskie, np. Elysia chlorotica przyswajają chloroplasty z przyjmowanego pokarmu i przechowują w swoich ciele, gdzie nadal zachodzi fotosynteza[8]. Niektóre geny jądrowe komórek roślinnych zostały na drodze poziomego przepływu genów przeniesione do genomu ślimaków, dzięki czemu chloroplasty są zaopatrywane w białka, które pozwalają im przetrwać[9].
U większości zwierząt i protistów będących gospodarzami dla tzw. kleptochloroplastów, symbioza ta nie jest aż tak zaawansowana, gdyż chloroplasty pozbawione produktów genomu jądrowego skonsumowanych glonów są w stanie przeżyć w ciele nowego gospodarza najwyżej 2–3 miesiące[10].
Stosunkowo często zwierzęta i protisty są gospodarzami dla fotosyntetyzujących jednokomórkowych glonów, a nie tylko chloroplastów. Glony takie nazywa się endofitami, a w zależności od barwy i przynależnośi taksonomicznej wyróżnia się wśród nich zoochlorelle, zooksantelle i cyjanelle[11]. Stopień współzależności bywa różny – niektóre endosymbiotyczne glony są silnie uwstecznione, zachowując pewną autonomię tak, że istnieje niemal płynna granica między uznawaniem za endosymbionty a za autonomiczne chloroplasty (np. prochlorofity oraz zawierające nukleomorf chloroplasty kryptomonad i chlorarachniofitów).
Fotosynteza eukariotów

Na proces fotosyntezy składają się dwa etapy:
- faza jasna, nazywana także fazą świetlną, polega na przekształceniu energii zawartej w świetle do energii wiązań chemicznych dwóch wysokoenergetycznych związków chemicznych: ATP i NADPH. Oba związki wysokoenergetyczne wytwarzane są dzięki przenoszeniu elektronów poprzez kolejne przenośniki. Kwanty światła pochłonięte przez cząsteczki barwników asymilacyjnych służą do oderwania elektronów od cząsteczek chlorofilu a przyłączonych do kompleksów białkowych znajdujących się w błonach białkowo-lipidowych. Energia światła wykorzystywana jest do oderwania elektronu od cząsteczki wody i przeniesienia go przez system przekaźników elektronów na utlenioną formę NADP+. W transporcie elektronów biorą udział kompleksy białkowe: fotoukład I (PS I), fotoukład II (PS II), kompleks cytochromowy b6f trwale związane z błonami, oraz ruchliwe przekaźniki elektronów w postaci plastochinonu i plastocyjaniny. Transport elektronów przez wymienione przenośniki prowadzi także do wytworzenia różnicy stężeń jonów wodorowych w poprzek błon. Energia zmagazynowana w postaci różnicy stężeń jest wykorzystywana przez enzym, syntazę ATP, do wytworzenia ATP. Uproszczony zapis reakcji zachodzących w fazie jasnej przedstawia równanie (nie przedstawia ono jednak ściśle proporcji NADPH do ATP):
- 2 H2O + 2 NADP+ + 2 ADP + 2 Pi → 2 NADPH + 2 H+ + 2 ATP + O2
- faza ciemna nazywana także cyklem Calvina-Bensona. Energia zgromadzona w ATP i NADPH wykorzystywana jest do przekształcenia dwutlenku węgla do prostych związków organicznych cukrów. Następuje to poprzez przyłączenie CO2 do pięciowęglowego związku – 1,5-bisfosforybulozy. Powstały związek sześciowęglowy rozpada się na dwie cząsteczki zawierające po trzy atomy węgla, które po zredukowania przy użyciu NADPH stanowią pierwszy trwały produkt fotosyntezy – triozy. W wyniku ich przekształcania powstaje glukoza oraz odtwarzana jest 1,5-bisfosforybuloza konieczna do związania kolejnych cząsteczek dwutlenku węgla.
- Uproszczony zapis reakcji zachodzących w fazie ciemnej przedstawia równanie:
- 3 CO2 + 9 ATP + 6 NADPH + 6 H+ → C3H6O3 + 9 ADP + 8 Pi + 6 NADP+ + 3 H2O
Faza jasna
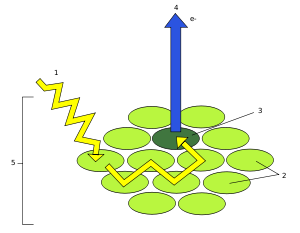

Zamiana energii światła słonecznego na energię wiązań chemicznych jest możliwa dzięki absorpcji kwantów światła (fotonów) przez chlorofil. Cząsteczka tego barwnika może absorbować zarówno kwant światła czerwonego, przechodząc ze stanu podstawowego (trypletowego) do pierwszego stanu wzbudzonego (pierwszego stanu singletowego), jak i kwant światła niebieskiego przechodząc ze stanu podstawowego do drugiego stanu wzbudzonego (drugiego stanu singletowego). Drugi stan wzbudzenia jest wyjątkowo nietrwały, cząsteczka chlorofilu szybko przechodzi do pierwszego stanu wzbudzenia, emitując kwant energii w zakresie podczerwieni. Energia pierwszego stanu wzbudzenia może być przekazana poprzez kolejne cząsteczki chlorofilu do centrum reakcji fotoukładu I lub II wybijając z niego elektron. W sytuacji, kiedy porcja energii nie może być przyjęta przez centrum reakcji, wzbudzony chlorofil emituje kwant światła czerwonego, co można zaobserwować jako czerwone promieniowanie fluorescencyjne[12].
Niezależnie od tego czy zostanie pochłonięty kwant światła niebieskiego, czy kwant światła czerwonego do wybicia elektronu z centrum reakcji potrzebna jest jedynie energia pierwszego stanu wzbudzonego. W absorpcji światła biorą także udział barwniki należące do karotenoidów. Ich maksima absorpcji (400–500 nm) przypadają na cześć widma w niewielkim stopniu absorbowaną przez chlorofil. Cząsteczki karotenoidów obecne w antenach fotosyntetycznych przekazują energię wzbudzenia do centrum reakcji za pośrednictwem chlorofilu. Udział karotenoidów w absorpcji światła zwiększa możliwości wykorzystania pasma światła widzialnego nie absorbowanego przez chlorofile. Barwniki pomocnicze znajdują się w kompleksach zbierających światło (LHC, ang. light-harvesting complex) nazywanych także antenami pomocniczymi. Anteny pomocnicze to kompleksy barwnikowo-białkowe otaczające centrum reakcji, do którego przekazują energię wzbudzenia barwników w nich występujących[13]. LHC II towarzyszący fotoukładowi II składa się z białka o masie 26 kDa, siedmiu cząsteczek chlorofilu a, sześciu cząsteczek chlorofilu b i dwóch cząsteczek karotenoidów[14]. Poza pełnieniem funkcji barwników pomocniczych karotenoidy chronią aparat fotosyntetyczny przed uszkodzeniem w przypadku nadmiaru światła[15].
Zakres światła wychwytywany przez chlorofil, tj. 380–710 nm określany jest jako promieniowanie czynne fotosyntetycznie (ang. skrót – PAR). Jest to pewne uproszczenie, gdyż co prawda większość fotoautotrofów wykorzystuje właśnie światło o tej długości fali, mimo to istnieją organizmy, których zakres światła używanego do fotosyntezy wykracza poza te wartości. Światło słoneczne niesie promieniowanie o różnych długościach fali, a PAR na poziomie morza stanowi ok. 44% jego całej energii[16]. Również PAR jest nierównomiernie wykorzystywane przez różne grupy organizmów, zwłaszcza wodnych. Czerwona i niebieska cześć widma absorbowana przez chlorofile jest w dużym stopniu pochłaniana przez wodę. Sinice i krasnorosty absorbują kwanty światła z udziałem kompleksów barwnikowo-białkowych o nazwie fikobilisomy, w których oprócz białek występują barwniki należące do grupy fikobilin. Fikobilisomy podobnie jak układy antenowe LHC przekazują energię wzbudzenia do centrum reakcji zawierającego chlorofil. Pojedynczy fikobilisom zawiera setki setki fikobilin i wykazuje maksimum absorpcji w zakresie 470–650 nm[17]. Badania in vitro na glonach wykazały, że β-karoten przekazuje chlorofilowi 10% energii świetlnej, luteina – 60%, a fukoksantyna – 100%. Badania in vivo wykazały, że u zielenic na chlorofil przekazywane jest około połowy energii pochłanianej przez karotenoidy, u sinic – 10–15%, natomiast u glonów zawierające fukoksantynę (stramenopile takie jak okrzemki i brunatnice) – 70–80%. Taką samą wydajność uzyskują glony, u których energia słoneczna wychwytywana jest przez fikobiliny, tj. sinice i krasnorosty[18]. W doświadczeniach na glonach Chlorella wykazano, że na 2500 wzbudzonych cząsteczek chlorofilu powstawała jedna cząsteczka O2[19].
Fosforylacja niecykliczna

Energia kwantów światła przekazana do centrum reakcji fotoukładu II powoduje wybicie elektronu[20]. Elektron jest przekazywany przez cząsteczkę feofityny, a następnie poprzez cząsteczki plastochinonu połączone z białkami na wolny plastochinon. Powstały wskutek redukcji plastochinonu, plastochinol przemieszcza się w błonie tylakoidu, na drodze dyfuzji, do kompleksu cytochromowego b6f. W obrębie kompleksu cytochromowego b6f zachodzi cykl Q, w wyniku którego dodatkowe protony H+ przemieszczane są ze stromy chloroplastów do wnętrza tylakoidów. Kompleks cytochromowy b6f przekazuje elektron na niewielkie białko zwierające miedź – plastocyjaninę. Odbiorcą elektronów od plastocyjaniny jest fotoukład I[21], po uprzednim wybiciu elektronów z centrum reakcji. Wybicie elektronu z centrum reakcji fotoukładu I odbywa się poprzez wzbudzenie cząsteczki chlorofilu. Elektron wybity z centrum reakcji fotoukładu I przekazywany jest na cząsteczkę NADP+, która staje się formą zredukowaną NADPH. W przekazaniu elektronu na cząsteczkę NADP+ bierze udział kilka przekaźników, między innymi cząsteczka witaminy K (filochinon) oraz ferredoksyna. Miejsce po elektronie oderwanym z centrum reakcji fotoukładu II zapełniane jest przez elektron oderwany z wody. Reakcja ta jest przeprowadzana przez kompleks rozkładający wodę[22][23]. Po oderwaniu 4 elektronów następuje rozszczepienie 2 cząsteczek wody na 4 protony i cząsteczkę tlenu[24]. W wyniku uwalniania protonów, z rozkładu wody, wewnątrz tylakoidu – lumen, pobierania protonów podczas redukcji NADP+ w stromie chloroplastu oraz transportu protonów w cyklu Q, ze stromy do wnętrza tylakoidu, powstaje gradient protonowy – różnica stężeń protonów na zewnątrz i wewnątrz tylakoidu. Gradient protonowy jest wykorzystywany przez kompleks syntazy ATP do wytwarzania drugiego produktu fazy jasnej – ATP[25]. Opisany szlak wędrówki elektronów z cząsteczki wody na cząsteczkę NADP+ określa się jako fosforylację niecykliczną[26][27].

Fosforylacja cykliczna
W okresie zwiększonego zapotrzebowania na ATP elektron z ferredoksyny może zostać przeniesiony nie na NADP+, lecz na kompleks cytochromowy b6f i następnie poprzez plastocyjaninę powrócić do centrum reakcji fotoukładu II. Takiemu cyklicznemu transportowi elektronów towarzyszy przenoszenie protonów przez błonę tylakoidu, wytwarzanie gradientu stężeń protonów i synteza ATP, nie powstaje jednak NADPH. Opisany szlak wędrówki elektronu nosi nazwę fosforylacji cyklicznej[28][29].
Faza ciemna
Związki będące produktami fazy ciemnej fotosyntezy zostały szczegółowo poznane dzięki badaniom Melvina Calvina i Andrew Bensona, za co w 1961 roku Melvin Calvin otrzymał nagrodę Nobla. Badania te wykazały, że izotop węgla 14C podawany organizmom fotosytetyzującym pojawia się najpierw w związku trójwęglowym – kwasie 3-fosfoglicerynowym. Z tego powodu rośliny, u którym pierwszym produktem asymilacji CO2 jest związek trójwęglowy, określa się jako rośliny typu C3[30].

Faza karboksylacji
Dwutlenek węgla przyłączany jest do 1,5-bisfosforybulozy. Enzymem katalizującym przyłączenie cząsteczki CO2 jest karboksylaza 1,5-bisfosforybulozy określana też jako karboksydysmutaza lub RuBisCO (ang. ribulose bisphosphate carboxylase-oxygenase). Enzym ten jest jednym z najbardziej rozpowszechnionych białek w przyrodzie. W wyniku przyłączenia cząsteczki CO2 do 1,5-bisfosforybulozy powstaje nietrwały związek sześciowęglowy – 1,5-bisfosfo-2-karboksy-3-ketoarabitol, który niemal natychmiast rozpada się na dwie cząsteczki kwasu 3-fosfoglicerynowego[31].
Faza redukcji
Kwas 3-fosfoglicerynowy jest fosforylowany ze zużyciem ATP powstającego w fazie jasnej do kwasu 1,3-bisfosfoglicerynowego. Drugi wysokoenergetyczny produkt fazy jasnej jest z kolei zużywany w reakcji redukcji kwasu 1,3-bisfosfoglicerynowego do aldehydu 3-fosfoglicerynowego[32].
Faza regeneracji
Z aldehydu 3-fosfoglicerynowego oraz pozostającego w stanie równowagi izomeru – fosfodihydroksyacetonu w cyklu reakcji (patrz schemat) z udziałem enzymów przenoszących części łańcuchów węglowych odtwarzany jest akceptor CO2 1,5-bisfosforybuloza. Po związaniu 6 cząsteczek CO2 z cyklu może zostać wyprowadzona 1 cząsteczka heksozy[32].
Reakcje te zachodzą w stromie chloroplastów i są określane jako cykl Calvina-Bensona. Jest to tzw. faza bezpośrednio niezależna od światła fotosyntezy. Należy jednak podkreślić, że światło stymuluje również niektóre enzymy cyklu Calvina-Bensona poprzez utrzymywanie w stanie zredukowanym ich grup sulfhydrylowych[33].
Modyfikacje fotosyntezy
Fotosynteza C4 (cykl Hatcha-Slacka)

Fotosynteza C4 to proces wiązania dwutlenku węgla u roślin określanych nazwą rośliny C4. Rośliny te wykształciły mechanizmy anatomiczne i fizjologiczne pozwalające na zwiększenie stężenia CO2 w komórkach, w których zachodzi cykl Calvina-Bensona[34].
Przystosowania anatomiczne polegają na zróżnicowaniu komórek zaangażowanych w wiązanie CO2 na komórki mezofilowe oraz komórki pochew okołowiązkowych. Komórki pochew okołowiązkowych posiadają grubą ścianę komórkową, zwykle wysyconą suberyną, dzięki czemu ściana komórkowa jest w bardzo małym stopniu przepuszczalna dla gazów. Proces wiązania CO2 przebiega w komórkach mezofilu, gdzie dwutlenek węgla przyłączany jest do fosfoenolopirogronianu. W reakcji tej powstaje związek czterowęglowy – kwas szczawiooctowy. Jest on w zależności od gatunku rośliny przekształcany do asparaginianu lub jabłczanu i w tej postaci przenoszony do komórek pochew okołowiązkowych. Tam zachodzi reakcja dekarboksylacji i wydzielenie CO2, która jest włączany do cyklu Calvina-Bensona. Cykl ten zachodzi tylko w komórkach pochew okołowiązkowych, gdzie stężenie CO2 przekracza 10–20 razy stężenie CO2 w komórkach mezofilu. Fotosynteza C4 jest zatem sposobem zagęszczania CO2 w tych komórkach, gdzie zachodzi cykl Calvina-Bensona (w komórkach pochew okołowiązkowych). Przy zwiększonym stężeniu CO2 druga reakcja katalizowana przez enzym RuBisCO – przyłączanie do 1,5-bisfosforybulozy tlenu – rozpoczynająca szlak metaboliczny o nazwie fotooddychanie praktycznie nie zachodzi. Proces fotosyntezy u roślin C4 przebiega wydajniej. CO2 nie jest tracony w procesie fotooddychania, jednak nakład energetyczny na związanie jednej cząsteczki CO2 jest większy niż u roślin C3[35].
Rośliny C4 podzielono na trzy podtypy:
- Podtyp NADP-ME
- Podtyp NAD-ME
- Podtyp PEP-CK[36].
Kryterium podziału jest rodzaj enzymu odpowiedzialnego za przeprowadzenie reakcji dekarboksylacji w komórkach pochew okołowiązkowych. Jest to odpowiednio: enzym jabłczanowy (ME) zależny od NADP, enzym jabłczanowy zależny od NAD i karboksykinaza fosfoenolopirogronianu (PEP-CK). Do roślin C4 należą gatunki z wielu rodzin np.: kukurydza, trzcina cukrowa, proso zwyczajne, sorgo występujących w klimacie zwrotnikowym. Wiele z nich występuje jednak w warunkach klimatu umiarkowanego; w Europie ponad 100 gatunków w stanie naturalnym[37].
Fotosynteza C3-C4
Fotosynteza C3-C4 zachodzi u roślin, u których pierwszym produktem asymilacji CO2 jest związek czterowęglowy, lecz reakcje cyklu Calvina-Bensona zachodzą zarówno w komórkach mezofilu, jak i komórkach pochew okołowiązkowych. Rośliny o fotosyntezie pośredniej między C3 a C4 posiadają anatomiczne zróżnicowanie komórek na komórki mezofilowe i komórki pochew okołowiązkowych[38].
Wśród glonów występują gatunki zdolne zarówno do asymilacji dwutlenku węgla przez RuDP, jak i PEP, a więc przechodzące w zależności od warunków z jednego typu do drugiego, takie jak Chlorella vulgaris (zielenica) lub Porphyridium cruentum (krasnorost)[18].
Fotosynteza CAM

U roślin z rodziny Crassulaceae (gruboszowate), wykryto po raz pierwszy specyficzny przebieg fotosyntezy, nazwany fotosyntezą CAM (ang. Crassulacean Acid Metabolism) – kwasowy metabolizm węgla gruboszowatych. Proces ten zachodzi także np. u ananasów i licznych sukulentów z różnych rodzin botanicznych, a także roślin zasiedlających kwaśne wody, np. jeziora lobeliowe. Rośliny te zamykają aparaty szparkowe w dzień, przez co wymiana gazowa jest ograniczona, a woda zatrzymywana w tkankach. Szparki otwierają się nocą, a pochłonięty CO2 jest przyłączany do fosfoenolopirogronianu (podobnie jak u roślin C4), w wyniku czego tworzy się jabłczan, który magazynowany jest w wakuoli. W ciągu dnia, gdy rośliny mogą wykorzystywać energię światła słonecznego w fazie jasnej fotosyntezy, pochodzący z rozkładu jabłczanu CO2 zasila cykl Calvina. Przez to roślina może prowadzić fotosyntezę przy zamkniętych aparatach szparkowych[39].
Pseudocykliczny transport elektronów
Przy znacznym natężeniu światła w chloroplastach zużywany jest nie tylko CO2, ale także O2. Tlen może być redukowany do nadtlenku wodoru H2O2 z udziałem fotoukładu I[40]. Przeniesienie elektronów na O2 zamiast na NADP+ nosi nazwę reakcji Mehlera[41]. Tworzenie reaktywnych form tlenu O2- oraz H2O2 ma miejsce przede wszystkim w chloroplastach ze zbyt mała ilością NADP+. Zbyt mała ilość NADP+ występuje głównie podczas oświetlania roślin wysokim natężeniem światła, kiedy fotosyntetyczny transport elektronów przebiega bardzo wydajnie, niemal cała pula NADP+ obecna w chloroplastach pozostaje w stanie zredukowanym. W takiej sytuacji elektrony mogą być przekazywane na tlen, co prowadzi do powstawania gradientu protonów i syntezy ATP, zapobiegając jednocześnie uszkodzeniu fotoukładów. Ze względu na syntezę ATP przy braku syntezy NADPH taki transport elektronów jest określany jako pseudocykliczny transport elektronów[42]. Badania wykazały, że poza ochroną fotoukładów transport elektronów na O2 reguluje interakcje pomiędzy cyklicznym a niecyklicznym transportem elektronów[43]. Chociaż stężenia tlenu nie wymienia się zwykle jako czynnika wpływającego na natężenie fotosyntezy to w sytuacji intensywnego oświetlenia w wyniku fotolizy wody stężenie tlenu w komórkach jest na tyle duże, że reakcja Mehlera ma znaczący udział w wydajności całego procesu fotosyntezy.
Wydajność energetyczna fotosyntezy
Całkowite utlenienie mola glukozy do CO2 i H2O (w warunkach normalnych) prowadzi do uwolnienia energii równej 2796 kJ. Wytworzenie jednego mola glukozy w reakcjach cyklu Calvina zgodnie z danymi przedstawionymi na schemacie wymaga 12 moli NADPH i 18 moli ATP. Utlenienie 1 mola NADPH do NADP+ prowadzi do wydzielenia 220 kJ energii. Zużycie 1 mola ATP dostarcza 31 kJ energii. Zatem 12 moli NADPH stanowi (12 x 220 kJ) 2640 kJ, a 18 moli ATP (18 x 31 kJ) 558 kJ. W sumie do wytworzenia cząsteczki glukozy zostaje zużyte 3198 kJ. Wydajność energetyczna cyklu Calvina-Bensona wynosi więc 87%. Doświadczalnie wyznaczona ilość kwantów światła niezbędna to syntezy jednej cząsteczki glukozy wynosi 48. 1 mol kwantów światła czerwonego to 176 kJ. Na wytworzenie jednej mola glukozy potrzebne jest więc (48 x 176 kJ x mol-1) 8448 kJ. Wydajność energetyczna całego procesu fotosyntezy dla światła czerwonego wyniesie więc 33%. Chlorofil może absorbować zarówno kwanty światła czerwonego, jak i niebieskiego, którego mol kwantów niesie energię 268 kJ. W tym przypadku na wytworzenie glukozy potrzebne byłoby (48 x 268 kJ x mol-1) 12864 kJ energii, a wydajność procesy wyniosłaby 22%. W liściu jednak w absorpcji światła biorą udział chlorofile oraz inne barwniki asymilacyjne i dokładne określenie wydajności całego procesu nie jest możliwe. Gdy wydajność fotosyntezy obliczy się jako energię zgromadzoną w biomasie w stosunku do energii słonecznej docierającej do powierzchni Ziemi wyniesie ona maksymalnie 4–6%, w zależności od typu fotosyntezy[44][45].
Fotosynteza u prokariontów
Do organizmów prokariotycznych zdolnych do korzystania ze światła jako źródła energii należą: sinice, bakterie zielone, bakterie purpurowe, heliobakterie oraz należące do odrębnej domeny wykorzystujące światło znacznie inaczej niż pozostałe organizmy fotosyntetyzujące halobakterie[46].
Oksygeniczny (tlenorodny) typ fotosyntezy, z wydzieleniem tlenu, występuje jedynie u sinic. Przebieg fotosyntezy u tych bakterii nie różni się znacząco od przebiegu fotosyntezy u roślin. Charakterystyczną cechą sinic są układy antenowe zawierające jako barwnik pomocniczy fikobiliny i związane z nimi fikobiliproteiny takie jak fikocyjanina lub fikoerytryna. Układy antenowe sinic określane są jako fikobilisomy. Niektóre z sinic w określonych warunkach mogą także przeprowadzać anoksygeniczą fotosyntezę z wykorzystaniem jako donora elektronów H2S [47]. Pozostałe bakterie wykazują wyłącznie anoksygeniczny typ fotosyntezy, bez wydzielania tlenu. Łańcuch transportu elektronów może przypominać albo fotoukład I – tak jest w przypadku bakterii zielonych siarkowych i heliobakterii, lub fotoukład II – tak jest w przypadku bakterii purpurowych i bakterii zielonych nitkowatych[48].
Bakterie zielone i heliobakterie

Bakterie zielone siarkowe mogą wykorzystywać jako źródło elektronów wodór, siarkowodór, tiosiarczan, a nawet pierwiastkową siarkę[49]. Kompleksy antenowe tych bakterii zawierają bakteriochlorofile a, c, d i e. W skład centrum jedynego fotoukładu wchodzi bakteriochlorofil a. Elektron wybity przez światło z fotoukładu przenoszony jest kolejno na bakteriochlorofil 663, centrum żelazo-siarkowe, ferredoksynę, mononukleotyd flawinowy i ostatecznie redukuje nukleotyd nikotynoadeninowy (NAD+). Transport elektronów w tym procesie ma charakter linearny, a układ przenośników obecnych w fotoukładzie jest zbliżony do fotoukładu I obecnego u roślin[48].
Istnieje także możliwość powrotu elektronu do centrum reakcji poprzez menachinon (witamina K2), kompleks cytochromowy bc i cytochrom c. Podczas takiego cyklicznego transportu elektronów następuje przenoszenie protonów w poprzek błony plazmatycznej i wytworzenie siły protonomotorycznej, koniecznej do syntezy ATP. Taka droga odpowiadałby cyklicznemu transportowi elektronów w fosforylacji cyklicznej roślin[50].
Podobny łańcuch transportu elektronów posiadają heliobakterie. Są one jedynymi bakteriami posiadającymi bakteriochlorofil g[51]. Nie posiadają struktur porządkujących kompleksy biorące udział w fotosyntezie, a barwniki asymilacyjne znajdują się wprost w błonie komórkowej. Centrum reakcji z bakteriochlorofilem g wykazuje maksimum absorpcji przy 798 nm. Heliobakterie są względnymi autotrofami. W środowisku bez dostępu do światła przechodzą na metabolizm heterotroficzny, wykorzystują do wzrostu mleczan i pirogronian[48].
Strategia metaboliczna niektórych przedstawicieli heliobakterii, bakterii purpurowych i bakterii zielonych polegająca na wykorzystywaniu energii świetlnej określana jest jako fototrofia z różnymi odmianami – fotoorganoheterotrofia, gdy źródłem elektronów (reduktorem) są związki organiczne, fotolitoheterotrofia, gdy są to substancje nieorganiczne (związki siarki, wodór), a w obu przypadkach źródłem węgla są związki organiczne, natomiast gdy źródłem węgla jest dwutlenek węgla – fotoorganoautotrofia, gdy źródłem elektronów są związki organiczne i fotolitoautotrofia, gdy są to substancje nieorganiczne[16]. Zatem tylko te dwa ostatnie przypadki fotoredukcji są właściwą fotosyntezą.
Bakterie purpurowe

Bakterie purpurowe jako źródło elektronów mogą wykorzystywać związki siarki, siarkę pierwiastkową, wodór oraz proste związki organiczne (np. jabłczan, bursztynian). Kompleksy antenowe tych bakterii zawierają bakteriochlorofile a lub b. Fotoukład bakterii purpurowych przypomina fotoukład II występujący u roślin[48]. Zawiera trzy polipeptydy o masie 21, 24, 32 kDa, 4 cząsteczki bakteriochlorofilu, 2 cząsteczki bakteriofeofityny, i cząsteczką karotenoidu, dwa chinony i atom żelaza[52]. Maksimum absorpcji przypada na długość fali 870 nm, stąd określenie fotoukładu P-870[53].
Elektron wybity przez światło z fotoukładu przenoszony jest kolejno na bakteriofeofitynę (bakteriochlorofil pozbawiony magnezu), następnie poprzez chinon A przenoszony jest na cząsteczkę chinonu swobodnie przemieszczającą się w błonie. Ze zredukowanego chinonu elektron trafia na kompleks cytochromowy bc1, a z niego na cytochrom c2, który przenosi elektron do centrum reakcji fotoukładu. W przedstawionym, cyklicznym, transporcie elektronów wytwarzane jest jedynie ATP. NADH2 lub NADPH2 wytwarzany jest prawdopodobnie bez udziału światła w odwrotnym łańcuchu transportu elektronów. Elektrony odrywane od związku będącego donorem (H2S, H2, S2O32-, związki organiczne) przenoszone są na cytochrom c2. Następnie trafiają na cytochrom b, co wymaga nakładu energii w postaci ATP. Z cytochromu b elektrony przenoszone są na chinon, a z niego na cząsteczkę NAD+ lub NADP+. Transport elektronów z chinonu na NAD+ także odbywa się wbrew potencjałowi i wymaga zużycia ATP. W efekcie zachodzenia odwrotnego łańcucha transportu elektronów wytwarzana jest siła redukcyjna w postaci NADH2 (NADPH2) niezbędna do redukcji CO2. Związki, które posłużyły jako donory elektronów, przekształcane są w siarkę, wodę lub kwasy organiczne[54][55][53].
NADH oraz ATP wytworzone przy okazji transportu elektronów zużywane są w cyklu Calvina-Bensona, odwrotnym cyklu Krebsa[56]. W redukcji CO2, poza NADH, może także uczestniczyć zredukowana ferredoksyna. Związkiem, z którym łączy się CO2 może być acetylo-CoA lub bursztynylo-CoA, co prowadzi do powstania odpowiednio pirogronianu lub 2-oksoglutaranu[53].
Halobakterie
W odmienny sposób energię świetlną wykorzystują halobakterie, w których błonie komórkowej znajduje się specyficzne białko połączone z barwnikiem – bakteriorodopsyna. Kompleks ten może pochłaniać kwanty światła, przechodząc w stan wzbudzenia. Powrót do stanu podstawowego umożliwia przeniesienie przez błonę protonu. Przeniesienie protonów na zewnątrz komórki prowadzi do powstania gradientu elektrochemicznego wykorzystywanego następnie przez syntazę ATP zlokalizowaną w błonie komórkowej do syntezy ATP[57][48].
Ewolucja fotosyntezy

Fotosynteza jest ewolucyjnie bardzo starym procesem. Dowody chemiczne oraz znalezione skamieniałości wskazują, że fotosyntezujące sinice istniały 2,5-2,6 miliarda lat temu[58]. Poprzedzały je z pewnością różne formy fotosyntetyzujących bakterii anoksygenicznych. Dane uzyskane przez badanie izotopów węgla sugerują, że asymilacja węgla przez organizmy autotroficzne zachodziła co najmniej miliard lat wcześniej[59][60]. Natura najwcześniejszych organizmów fotosyntetyzujących nie jest dobrze znana. Główne elementy aparatu fotosyntetycznego to centra reakcji, kompleksy antenowe, kompleksy transferu elektronów i asymilacji węgla. Elementy te nie mają wspólnej historii ewolucji we wszystkich organizmach, dlatego na aparat fotosyntetyczny najlepiej patrzeć jako na mozaikę elementów, z których każdy ma swoją własną historię ewolucji. Istnieją dwie szkoły badania pochodzenia centrów reakcji i fotosyntezy. Pierwsza z nich widzi początek rozwoju centrów reakcji jeszcze w fazie prebiotycznej[61], druga szkoła widzi centra reakcji rozwijające się od cytochromu b w bakteriach[62].
Przedstawiane są dwa modele kolejnego etapu rozwoju centrów reakcji w bakteriach purpurowych, bakteriach zielonych i sinicach.
W modelu selektywnej utraty wspólny przodek zawierał zarówno centrum reakcji PS I, jak centrum reakcji PS II. Ewolucja centrów reakcji w bakteriach purpurowych i bakteriach zielonych nitkowatych doprowadziła do utraty centrum reakcji PS I. Z kolei rozwój bakterii zielonych siarkowych oraz heliobakterii doprowadził do utraty centrum reakcji PS II. Oba centra reakcji PS I i PS II pozostały u sinic[63].
W modelu połączenia wspólny przodek występował w dwóch liniach, jeden zawierał centrum reakcji PS I, a inny zawierał centrum reakcji PS II. Linia pierwsza dała początek zielonym bakteriom siarkowym oraz heliobakterii, a linia druga zapoczątkowała bakterie purpurowe i zielone bakterie nitkowate. Dwa centra reakcji sinic byłyby skutkiem połączenia organizmu zawierającego centrum reakcji PS I i organizmu zawierającego centrum reakcji PS II [64]. Historia ewolucji różnych kompleksów antenowych – LHC wydaje się całkiem niezależna. Przejście z anoksygenicznej do tlenowej fotosyntezy miało miejsce, kiedy sinice nauczyły się używać wody jako dawcy elektronów do wytwarzania siły redukcyjnej używanej do redukcji CO2. Przed tym przejściowym dawcą elektronów mógł być nadtlenek wodoru, a jeszcze wcześniej źródłem siły redukcyjnej mogłyby być jony żelaza.
Komórki eukariotyczne zdolność do fotosyntezy posiadły około 1,6 mld lat temu poprzez wchłonięcie na drodze endocytozy bakterii fotosyntetyzujących o typie fotosyntezy występującej u sinic[65]. Dowodem takiego pochodzenia chloroplastów jest posiadanie własnego materiału genetycznego przez chloroplasty oraz całkowitego aparatu transkrypcji i translacji potrzebnego do wytworzenia białek zapisanych w genach chloroplastowych. Geny chloroplastu wykazują znaczne podobieństwo do genów sinic, niemniej jednak znaczna część białek chloroplastowych jest obecnie kodowana przez geny jądrowe i muszą być importowane do chloroplastów z cytoplazmy.
Jednorazowa endosymbioza[66] nie wyjaśnia pochodzenia wszystkich organizmów eukariotycznych posiadających chloroplasty. Dlatego przyjmuje się, że doszło do przynajmniej dwóch, a prawdopodobnie do wielu endosymbioz, w wyniku których powstały współczesne komórki fotosyntetyzujących protistów. Wtórna endosymbioza umożliwia fotosyntezę u organizmów takich jak: kryptomonady, chlorarachniofity, eugleniny, okrzemki, brunatnice, złotowiciowce i innych. W przypadku dwóch pierwszych grup chloroplasty zawierają nukleomorfy, tj. resztki jądra komórkowego endosymbionta, w przypadku kryptomonad – pierwotnego krasnorostu, w przypadku chlorarachniofitów – pierwotnej zielenicy[67].
Przyjmuje się, że fotosynteza typu C4 istnieje od 12 do 13 milionów lat. Z tego okresu pochodzi najstarsza skamieniała trawa Tomlinsonia o anatomii liścia typowej dla roślin C4. Jednak prawdziwy rozkwit roślin C4 nastąpił około 6–7 milionów lat temu, kiedy stężenie CO2 w atmosferze spadło do poziomu 20 Pa, a stężenie tlenu wynosiło 20 kPa[68].
Czynniki wpływające na natężenie fotosyntezy
Natężenie światła

Do powierzchni ziemi dociera średnio ok. 1,3 kJ m-2 s-1 energii. W sprzyjających warunkach rośliny mogą zużytkować w procesie fotosyntezy około 5%. Zależność fotosyntezy od natężenia światła obrazuje tak zwana krzywa świetlna. W przypadku braku oświetlania rośliny wydzielają CO2 produkowany podczas oddychania komórkowego. Przy natężeniach światła bardzo niskich proces wydzielanie CO2 w oddychaniu komórkowym przeważą nad fotosyntetycznym wiązaniem CO2 i roślina nadal wydziela dwutlenek węgla. Przy pewnym natężeniu światła specyficznym dla gatunku rośliny i panujących warunków (np. temperatury) dochodzi do zrównania pobierania CO2 w procesie fotosyntezy i wydzielania CO2 w procesie oddychania komórkowego, punkt ten nazywany jest świetlnym punktem kompensacyjnym. Rośliny wykorzystujące fotosyntezę C3 mają wartość tego punktu niższą niż rośliny o fotosyntezie C4. Szczególnie niska wartość świetlnego punktu kompensacyjnego mają rośliny określane nazwą cieniolubne lub cienioznośne. Przy natężeniu światła powyżej świetlnego punktu kompensacyjnego następuje dalszy wzrost natężenia fotosyntezy. Przy pewnym natężeniu światła, charakterystycznym dla każdej z roślin, dochodzi do wysycenia procesu fotosyntezy. Punkt ten nazywa się świetlnym punktem wysycenia. Jest on wyższy dla roślin o fotosyntezie C4 niż dla roślin o fotosyntezie C3. Również u roślin określanych jako światłolubne (heliofity) świetlny punkt wysycenia jest wyższy niż dla roślin określane jako cieniolubne (skiofity). Długie działanie wysokiego natężenie światła prowadzi do uszkodzenia aparatu fotosyntetycznego i obniżenia wiązania CO2 przez roślinę. Zjawisko hamowania fotosyntezy przez wysokie natężenie światła nosi nazwę fotoinhibicji i jest głównie efektem uszkodzenia fotoukładu II[69][70].
W wodzie światło ulega pochłanianiu, dlatego jego dostępność jest znacznie bardziej ograniczona niż na lądzie. Organizmy przeprowadzające fotosyntezę pod wodą muszą wykorzystywać dostępne siatło bardziej efektywnie. W czasie maksymalnego rozwoju w jeziorach, fitoplankton może pochłaniać 70% docierającego światła[71]. Im głębiej, tym więcej światła ulega rozproszeniu i pochłonięciu. Ilość światła, przy której następuje kompensacja świetlna, dla różnych gatunków ma specyficzną wartość i występuje na różnych głębokościach. Głębokość, na której oddychanie (rozkład materii organicznej) równoważy fotosyntezę (tworzenie materii organicznej) w ekosystemie jako całości nazywa się poziomem kompensacyjnym. Umownie, jest to głębokość, do której dociera 1% światła fotosyntetycznie czynnego padającego na powierzchnię. W wodach mętnych jest to kilka metrów, w wodach przejrzystych do 150 m[18]. Naświetloną strefę przypowierzchniową, w której fotosynteza przeważa nad oddychaniem, nazywa się strefą eufotyczną lub trofogeniczną, a strefę poniżej poziomu kompensacyjnego – afotyczną lub trofolityczną. Makrofity są w stanie rozwijać się przy natężeniu co najmniej 2% światła padającego na powierzchnię. Rekordowe głębokości zasięgu makrofitów odnotowano w jeziorze Titicaca – rośliny naczyniowe (Potamogeton strictus) do 11 m, ramienice do 14 m, mchy do 29 m i jeziorze Tahoe – rośliny naczyniowe do 6,5 m, a ramienice i mchy do 75 m[71]. W tym jeziorze produkcja pierwotna glonów osiąga mierzalne wartości na głębokości 105 m, a rozwój zielenicy Gongrosira zaobserwowano na głębokości 160 m[11]. Z kolei przy samej powierzchni natężenie światła wywołuje fotoinhibicję. Występuje ona, gdy promieniowanie przekracza 200–800 μE · m -2 · s -1, a całkowicie wyklucza fotosyntezę przy wartościach powyżej 1 400 μE · m -2 · s -1. Fotoinhibicja może zachodzić na głębokości 0–0,5 m w wodach humusowych, a w jeziorach przezroczystych w słoneczne dni nawet do 30 m[11]. Optymalne natężenie światła dla glonów zwykle jest rzędu tysięcy lub dziesiątek tysięcy luksów. Zależne jest od różnych czynników, takich jak temperatura czy stężenie dwutlenku węgla, a także jest różne u różnych organizmów. Przykładowo, u okrzemki z rodzaju Asterionella w warunkach naturalnych optymalne stężenie wynosiło 5 000 lx w temperaturze 5°C, a 12 500 lx w temperaturze 17°C. W innych badaniach algologicznych fotoinhibicja dała się zauważyć przy natężeniu 10 000 lx, a fotosynteza ustawała całkowicie przy 100 000 lx[18]. Rośliny i glony przystosowują się do niskich stężeń światła zwiększaniem ilości chlorofilu (np. zielenica Chlorella) albo reorganizując aparat fotosyntetyczny, co przyspiesza tempo fotosyntezy (np. okrzemka Cyclotella)[71]. Czas potrzebny na adaptację do zmiany oświetlenia może wynosić od kilkunastu minut do kilkunastu dni[11].
U glonów stosunek białek do węglowodanów wśród ostatecznych produktów fotosyntezy jest odwrotnie proporcjonalny do natężenia światła. Przy silnym natężeniu światła biosynteza białek jest ograniczona, m.in. przez brak przyswajalnego azotu[18].
Barwa światła

U roślin lądowych w największym stopniu wykorzystywana jest energia światła pochłanianego przez chlorofil (głównie niebieskie, w mniejszym, stopniu fioletowe, czerwone, pomarańczowe i żółte), a w mniejszym przez karotenoidy. U fotoautotrofów wodnych bywa odmiennie. U zielenic jest podobnie jak u roślin lądowych. U sinic najefektywniej wykorzystywane jest światło żółte pochłaniane przez niebieską fikocyjaninę, u wielu krasnorostów – światło żółte i zielone (pochłaniane przez czerwoną fikoerytrynę), okrzemek i brunatnic (glonów z grupy stramenopili) – światło niebieskie i zielone pochłaniane przez karotenoidy[18]. Optymalna barwa światła (długość fali świetlnej) dla organizmów zajmujących różne siedliska wodne związana jest z różnicami w rozpraszaniu poszczególnych długości fal przez wodę. Barwa organizmu fotosyntetyzującego odpowiada pasmu widma, które jest w najmniejszym stopniu pochłaniane przez barwniki fotosyntetyczne. Glony występujące głęboko (np. w metalimnionie) muszą zarówno mieć odpowiednią barwę (czerwoną), jak i wykazywać właściwości skiofityczne. Przykładem są czerwone sinice z gatunków Planktothrix rubescens i Planktothrix aghardii var. isothrix lub kryptomonady Rhodomonas minuta osiagająca optimum na głębokości, do której dociera 50% światła padającego na powierzchnię i Rhodomonas lens, dla której jest to głębokość otrzymująca 10%[71]. Niektóre glony zmieniają barwę w zależności od zasiedlanej głębokości, np. sinice Chamaesiphon subglobosus i Lingbya purpurescens przechodzą od barwy zielonej do krwistoczerwonej. Zmienność wykazują też inne sinice, krasnorosty i liczne glony morskie[11].
Dwutlenek węgla

Stężenie dwutlenku węgla w powietrzu wynoszące około 0,036% jest znacznie niższe niż optymalne dla procesu fotosyntezy przy sprzyjających warunkach świetlnych i odpowiedniej temperaturze. W optymalnych warunkach natężenie fotosyntezy wzrasta aż do stężenia CO2 około 0,1%. Przy wyjątkowo niskich stężeniach CO2 procesy oddychania i fotooddychania wytwarzają więcej CO2 niż jest asymilowane w fotosyntezie. Stężenie CO2, przy którym jego wydzielanie równoważy się z fotosyntetycznym pobieraniem, nosi nazwę punkt kompensacyjny stężenia dwutlenku węgla. Dla roślin o fotosyntezie C4 jest on bliski zeru, a dla roślin o fotosyntezie C3 zależnie od gatunku i temperatury leży on w przedziale 0,009–0,018% CO2. Natężenie fotosyntezy dla roślin C4 jest przy niskich stężeniach dwutlenku węgla wyższe niż dla roślin C3. Przy wartościach bliskich stężeniu optymalnemu rośliny C3 uzyskują niewielką przewagę w intensywności wiązania CO2, co wykorzystuje się to w uprawach szklarniowych poprzez "nawożenie" roślin CO2 w sprzyjających warunkach temperaturowych i świetlnych. Stężenia CO2 powyżej 1% są dla roślin toksyczne i powodują zahamowanie procesy fotosyntezy[72][73]. Badania na zielenicy Chlorella vulgaris nie wykazały, aby stężenie do 4% wpływało na aktywność RuBisCO, choć wpływało na niektóre inne enzymy biorące udział w metabolizmie węgla (jak anhydraza węglanowa czy karboksylaza PEP)[18].
Bardziej skomplikowane są stosunki między stężeniem CO2, a fotosyntezą w wodzie (fototrofy wodne). Dwutlenek węgla rozpuszczony w wodzie może występować w fazie cząsteczkowej lub jako jony HCO3- i CO32-. Proporcje występowania tych form zależą od odczynu wody i zawartości substancji buforujących, np. jonów wapnia tworzących bufor wodorowęglanowy. Przy wysokim pH przeważającą formą jest HCO3- i CO32-, przy niskim pH wzrasta zawartość CO2 w postaci rozpuszczonego gazu. Postacie rozpuszczonego węgla nieorganicznego (ang. DIC, dissolved inorganic carbon) są w różnym stopniu dostępne dla organizmów fotosyntetyzujących. Większość wykorzystuje niemal wyłącznie cząsteczkowy dwutlenek węgla; z kolei do przyswajania jonów wodorowęglanowych przystosowane jest mniej gatunków (np. zielenica Hydrodictyon africanum[74], niektóre okrzemki[75], niektóre rośliny naczyniowe). Zdolność do wiązania węgla w postaci jonów wodorowęglanowych daje organizmom przewagę konkurencyjną, gdyż zwiększa wydajność pozyskiwania węgla. W niektórych badaniach organizmy zdolne do asymilacji HCO3- wykorzystywały większość całego dostępnego węgla (glony z rodzajów Anabaena, Microcystis i Scenedesmus do 90%, makrofity takie jak wywłócznik kłosowy i rdestnica przeszyta do 70%), podczas gdy organizmy do tego niezdolne – zaledwie 5%[76]. Poza tym, organizmy zdolne do asymilacji jonów wodorowęglanowych mogą żyć w wodach o odczynie pH = 11, w których rozpuszczony dwutlenek węgla już nie występuje[71]. Często glony najpierw zużywają jony wodorowęglanowe, a po ich wyczerpaniu natężenie fotosyntezy spada. Ten efekt jest szczególnie silny w wodach zasadowych, gdzie wodorowęglany i węglany to główna postać węgla nieorganicznego[11]. Z drugiej strony, zanurzone rośliny wodne niepotrafiące wykorzystywać HCO3- i dla których niedostępny jest atmosferyczny dwutlenek węgla, mają punkt kompensacyjny pozwalający na wykorzystywanie mniejszych stężeń rozpuszczonego CO2 (2–12μM), niż rośliny zdolne do zdobywania nieorganicznego węgla z innych źródeł (60–110 μM)[71]. Jony wodorowęglanowe nie są bezpośrednio włączane do cyklu Calvina, lecz po ich uprzedniej dehydratacji przy użyciu powszechnie występującego u różnych organizmów enzymu anhydrazy węglanowej, a więc jako dwutlenek węgla. W tej postaci są wiązane przez RuBisCO[18]. Aktywność anhydrazy węglanowej jest uzależniona m.in. od stężenia dwutlenku węgla – u Chlorella vulgaris przy jego zwiększonej koncentracji spada i spowalnia fotosyntezę. Przy normalnych lub niskich stężeniach CO2 – wzrasta i wzmaga natężenie fotosyntezy[18]. Jest to wynik wpływu odczynu (zależnego od stężenia dwutlenku węgla) na właściwości tego enzymu.
Temperatura
Jak dla wszystkich procesów przeprowadzanych z użyciem enzymów tak i dla fotosyntezy temperatura jest czynnikiem ograniczającym. Rośliny są w stanie przeprowadzać fotosyntezę w temperaturach niewiele poniżej zera (rośliny górskie) aż do temperatur zbliżających się do 50°C (rośliny pustyń). Nieco szerszy zakres tolerancji wykazują glony, zwłaszcza sinice. Eukariotyczne glony są w stanie żyć i fotosyntetyzować do temperatury 55–60°C, choć dla większości gatunków granica ta sięga zaledwie do 40°C. Termofilne gatunki sinic przeprowadzają fotosyntezę do ok. 75°C w wodach obojętnych lub zasadowych i ok. 56°C w wodach kwaśnych[11]. Przy optymalnych warunkach świetlnych optimum temperaturowe wynosi około 30°C[77] i jest niższe dla roślin C3 niż dla roślin C4[78]. Przy wyższych temperaturach natężenie fotosyntezy spada, co jest związane przede wszystkim ze wzrastającą intensywnością reakcji oddychania i fotooddychania w temperaturach powyżej 40°C. W temperaturze powyżej 40°C spada powinowactwo enzymu RuBisCO do CO2, przez co większego znaczenia nabiera druga funkcja tego enzymy – oksydacja 1,5-bisfosforybulozy. W temperaturze 60–70°C dochodzi do denaturacji kompleksów chlorofilowo-białkowych, co prowadzi do całkowitego zaniku aktywności fotosyntetycznej rośliny. Zmiana właściwości enzymów biorących udział w reakcjach fotosyntezy to niejedyna przyczyna zmian w natężeniu fotosyntezy. Wraz ze wzrostem temperatury zwiększa się płynność błon komórkowych, co prowadzi do wycieku jonów, między innymi protonów, z wnętrza tylakoidów. W efekcie pomimo transportu elektronów przez przenośniki nie jest wytwarzany gradient protonowy niezbędny do syntezy ATP. W niskich temperaturach płynność błon komórkowych ulega zmniejszeniu, co ogranicza tempo dyfuzji ruchliwych przenośników elektronów, głównie plastochinonu i plastocyjaniny, a w konsekwencji obniża wydajność fazy jasnej fotosyntezy[79]. Wrażliwość na fotooksydację wzrasta wraz z temperaturą, przez co postuluje się, że duże natlenienie wód po letnich zakwitach jest wraz z wysoką temperaturą przyczyną śmierci skądinąd ciepłolubnych gatunków sinic[18]. Dla niektórych termofilnych sinic optymalna temperatura fotosyntezy wynosi 68–72°C, podczas gdy dla gatunków umiarkowanie termofilnych – 45–50°C. Z kolei niektóre kriofilne szczepy zielenicy Chlamydomonas nivalis optymalnie fotosyntetyzują przy temperaturze 3°C (choć dla innych szczepów tego gatunku to może być nawet 20°C)[11]. U niektórych organizmów temperatura może modyfikować dominujący typ fotosyntezy. Chlorella vulgaris w temperaturze ok. 25°C przeprowadza cykl Hatcha-Slacka, natomiast w temperaturze niższej lub wyższej – typ C3[18].
Woda
Woda zwykle nie stanowi czynnika bezpośrednio wpływającego na wydajność fotosyntezy, jednak gospodarka wodna rośliny ma dla tego procesu pewne znaczenie. Zamknięcie aparatów szparkowych w sytuacji niedoboru wody w roślinie prowadzi do ograniczenia wnikania CO2 do wnętrza liścia, a to z kolei powoduje zahamowanie fotosyntezy. Powstanie mechanizmów zapobiegających ograniczaniu fotosyntezy w warunkach niedoboru wody, spowodowało wykształcenie roślin CAM i C4 prowadzących dużo bardziej oszczędną gospodarkę wodą niż rośliny C3[80].
Tlen
Stężenie tlenu w atmosferze jest stosunkowo stałe, jednak w komórce, do której tlen dociera przez aparaty szparkowe oraz jest wytwarzany w fazie jasnej fotosyntezy, lokalne stężenie tlenu może ulegać znaczącym wahaniom. Stężenie tlenu w cytoplazmie wzrasta przy intensywnym zachodzeniu fazy jasnej fotosyntezy. Jeśli aparaty szparkowe pozostają otwarte O2 zostaje usunięty z organów asymilacyjnych, jeśli jednak aparaty szparkowe pozostają zamknięte lub przymknięte stężenie tlenu jest znacznie wyższe niż w roztworze, w którym rozpuszczone są składniki powietrza atmosferycznego. Tlen wpływa przede wszystkim na zachodzenie procesu utleniania 1,5-bisfosforybulozy, katalizowanego przez enzym RuBisCO. Zjawisko zwiększonego wydzielania CO2 podczas oświetlania roślin oraz przez krótki okres po oświetlaniu nazywane jest fotooddychaniem, a jego bezpośrednią przyczyną jest dwufunkcyjność enzymu RuBisCO. Ze względu na konkurowanie o miejsce katalityczne karboksylazy 1,5-bisfosforybulozy przez CO2 i O2 wzrost stężenia tlenu, następujący podczas intensywnego zachodzenia fazy jasnej, prowadzi do zahamowania natężenia fotosyntezy. Jednocześnie intensywne zachodzenie fotosyntezy prowadzi do obniżenia stężenia CO2 w komórce, co zwiększa udział reakcji rozpoczynającej fotooddychanie. Do zwiększenia stężenie tlenu dochodzi szczególnie podczas stresu, gdy w wyniku suszy, zasolenia lub wysokiej temperatury dochodzi do zamknięcia aparatów szparkowych, tlen nie może zostać usunięty z liści, a CO2 dostarczany jest w niewystarczających ilościach. W tej sytuacji dochodzi do zwiększenia udziału fotooddychania. Prawdopodobnie fotooddychanie chroni rośliny rosnące w zmieniających się warunkach przed uszkodzeniem aparatu fotosyntetycznego poprzez wytwarzanie CO2 i podtrzymywanie reakcji fazy ciemnej w warunkach niewystarczającego dostarczania CO2 z atmosfery[81]. Rośliny przeprowadzające fotosyntezę C4 nie wykazują fotooddychania i nie obserwuje się u nich wpływu stężenia tlenu na natężenie fotosyntezy, w stężeniach zbliżonych do stężenia tlenu w powietrzu atmosferycznym. Wykazują jednak większą wrażliwość na niskie temperatury[82].
W stężeniach tlenu znacząco wyższych od stężenia atmosferycznego także u roślin C4 obserwuje się spadek natężenia fotosyntezy, co prawdopodobnie związane jest ze wzrostem natężenia reakcji Mehlera[83].
Wysokie stężenie tlenu powstającego przy intensywnej fotosyntezie może być przyczyną powstawania reaktywnych form tlenu i prowadzić do fotooksydacji chlorofilu i degradacji fotoukładów[84].
Bakterie fotosyntetyzujące mogą być fakultatywnymi lub obligatoryjnymi anaerobami. Zielone bakterie z rodziny Chlorobiaceae giną w obecności tlenu. Cześć bakterii purpurowych na świetle jest anaerobami, a w ciemności stają się heterotroficznymi aerobami.
Wysokie stężenie tlenu jest toksyczne zwłaszcza dla sinic. Fotooksydacja zachodzi zwykle przy dłuższym działaniu światła i zwiększana jest przez wysoką temperaturę i niskie stężenie CO2 i mineralnych substancji pokarmowych. Prawdopodobnie łagodzona jest przez karotenoidy[18].
Kalendarium badań nad fotosyntezą
- 1648 Van Helmont stwierdził, że gaz z węgla (dwutlenek węgla) jako "innego rodzaju powietrze" [85] jest tożsamy z gazem z młodego wina. Stwierdził, że masa wierzby pochodzi bardziej z wody niż z ziemi. Jego eksperymenty powstały z dążenia do poznania związku życia, słońca, powietrza, wody i ziemi.
- 1727 Stefan Hales wykazał, że cześć masy roślin pochodzi z powietrza.
- 1771 Joseph Priestley w prostym eksperymencie udowodnił wydzielenie tlenu przez rośliny. Joseph Priestley umieścił gałązkę mięty w naczyniu z wodą pod szklanym kloszem. Powietrze pod kloszem nie powodowało gaśnięcia świecy.
- 1778 Jan van Ingenhousz wykazał, że wydzielanie tlenu przez rośliny zależy od oświetlania.
- 1796 Jean Senebier wykazał, że oświetlane rośliny pochłaniają dwutlenek węgla a wydzielają tlen.
- 1804 Nicolas-Théodore de Saussure powtórzył doświadczenie Jeana Senebiera.
- 1842 Julius Robert von Mayer wykazał, że rośliny wykorzystują energię światła do syntezy związków organicznych.
- 1883 niemiecki botanik Theodor Wilhelm Engelmann zademonstrował, że efektywność fotosyntezy zależy od długości fali świetlnej, jaka pada na organizm[86].
- 1893 Charles Reid Barnes zaproponował nazwę fotosynteza dla procesu syntezy związków organicznych w obecności chlorofilu i światła. Wcześniej proces redukcji CO2 w obecności światła nazywany był asymilacją[87].
- 1931 Cornelis Bernardus van Niel na podstawie badań fotosyntezy u bakterii siarkowych wysunął hipotezę, że tak jak siarka u bakterii siarkowych pochodzi z H2S, tak tlen u roślin pochodzi z H2O.
- 1937 Robert Hill wykazał, że izolowane chloroplasty w środowisku wodnym wydzielają tlen bez obecności CO2, potwierdzając doświadczalnie hipotezę van Niela.
- 1941 Samuel Ruben i Martin David Kamen ostatecznie udowodnili pochodzenie tlenu wydzielanego w fotosyntezie z wody. W doświadczeniu zastosowali wodę znakowaną izotopem tlenu 18O. Pomiary spektrometrem masowym potwierdziły obecność izotopu 18O, w wydzielanym podczas fotosyntezy O2.
- 1954 Daniel Arnon wykazał, że izolowane chloroplasty są zdolne do wytwarzania ATP.
- 1957 Robert Emerson przeprowadził doświadczenie polegające na pomiarze natężenia fotosyntezy w świetle bliskiej (671 nm) i dalekiej czerwieni (700 nm). Przy jednoczesnym oświetlaniu oboma długościami fal natężenie fotosyntezy było wyższe niż suma natężeń fotosyntezy przy długości 671 nm i 700 nm. Stało się to podstawą do stwierdzenia, że fotosyntezie biorą udział dwa współdziałające układy barwników. Obecność takich układów potwierdziło wykrycie fotoukładu I (PS I, P-700) o maksimum absorpcji przy 700 nm i fotoukładu II (PS II, P-680) o maksimum absorpcji przy 680 nm. Opisane przez Emersona zjawisko znane jest jako efekt Emersona.
- 1946–1953 Melvin Calvin, Andrew Benson i James Bassham badając jednokomórkowe glony – Chlorella i Scenedesmus ustalili związki powstające w fazie ciemnej fotosyntezy i kolejność ich powstawania. Nagroda Nobla w dziedzinie chemii w roku 1961 za odkrycie tzw. cyklu Calvina.
- 1961 Peter Dennis Mitchell wyjaśnił mechanizm syntezy ATP dzięki gradientowi elektrochemicznemu w mitochondriach i chloroplastach. Nagroda Nobla w dziedzinie chemii w roku 1978 za stworzenie chemiosmotycznej teorii Mitchella[88].
- 1966 Marshall Davidson Hatch i Charles Roger Slack w Australii[89] i Hugo P. Kortschak na Hawajach[90] opisują rośliny, u których tylko 20% znakowanego węgla znajduje się w związkach trójwęglowych, 80% znakowanego izotopu węgla znajduje się w związkach czterowęglowych. Odkrycie prowadziło do opisania szczególnego typu fotosyntezy C4.
- 1988 Hartmut Michel otrzymał, wraz z Robertem Huberem i Johannem Deisenhoferem, nagrodę Nobla w dziedzinie chemii za wyznaczenie trójwymiarowej struktury centrum reakcji fotosyntezy u bakterii[91].
- 1992 Rudolph Arthur Marcus otrzymał Nagrodę Nobla w dziedzinie chemii za opis działania łańcucha transportu elektronów[92].
Znaczenie

Fotosynteza jest jednym z podstawowych procesów biologicznych. Warunkuje ona istnienie absolutnej większości organizmów żywych na Ziemi. Dzięki reakcjom fotosyntezy możliwa jest przemiana materii nieorganicznej (CO2) w organiczną stanowiącą źródło energii dla organizmów heterotroficznych.
Jedynym alternatywnym źródłem związków organicznych jest proces chemosyntezy przeprowadzany przez niektóre bakterie. Ilość materii organicznej powstałej w wyniku chemosyntezy jest znikoma. Istnieją jednakże całe ekosystemy wokół hydrotermalnych kominów oceanicznych, w których produkcją związków organicznych zajmują się bakterie chemosyntetyzujące. Jednakże nawet w ekosystemach położonych na dnie oceanów fotosynteza prawdopodobnie zachodzi[93][94]. Niewielkie ilości światła geotermalnego mogą być wykorzystane w procesie fotosyntezy u bakterii żyjących w otoczeniu kominów hydrotermalnych, przeprowadzających chemosyntezę, jako dodatkowe źródło energii[95][96]. Pomimo produkcji substancji organicznych głównie na drodze chemosyntezy nawet te odległe od światła słonecznego ekosystemy pozostają zależne od procesu fotosyntezy zachodzącej na powierzchni kontynentów i oceanów. Organizmy tworzące wyższe poziomy troficzne w kominach oceanicznych posiadają hemoglobinę i korzystają z tlenu będącego ubocznym produktem fotosyntezy[97].
To właśnie uboczny produkt fotosyntezy, tlen, jest niezbędny do życia wszystkich organizmów heterotroficznych z wyjątkiem bakterii beztlenowych. Z drugiej strony, tlen jako pierwiastek reaktywny może prowadzić do niszczenia związków organicznych i być toksyczny dla organizmów, nie tylko bezwzględnych anaerobów, dlatego niemal wszystkie obecnie żyjące na Ziemi organizmy wykształciły mniej lub bardziej skuteczne mechanizmy ochrony przed toksycznym działaniem tlenu. Paradoksalnie istnieją organizmy, które są jednocześnie zdolne do tlenorodnej fotosyntezy i ściśle beztlenowych innych procesów metabolicznych. Tak jest w przypadku niektórych sinic, które mogą anaerobowo wiązać wolny azot wyłącznie w oddzielonych od reszty kolonii heterocystach. Prawdopodobnie jednak we wczesnej historii życia tlen uwalniany przez pierwotne organizmy fotosyntetyzujące oksygenicznie był przyczyną swoistej klęski ekologicznej i wymarcia znacznej części ówczesnych gatunków[16]. Cały obecny w atmosferze Ziemi tlen jest skutkiem fotosyntezy. Proces fotosyntezy wyznacza także poziom CO2 w atmosferze ziemskiej. Jego obecna zawartość – 0,0333% jest czynnikiem ograniczającym natężenie fotosyntezy wszystkich roślin z wyjątkiem roślin o fotosyntezie typu C4. Dlatego przy wzrastającej ilości CO2 w atmosferze ziemskiej należy spodziewać się także wzrostu wydajności procesu fotosyntezy. W wyniku zachodzenia fotosyntezy w okresie roku na Ziemi gromadzone jest 1010 ton węgla w postaci związków organicznych, co odpowiada energii około 4,2 x 1017 kJ[98].
Cała energia zawarta w paliwach kopalnych (np. węgiel, torf, ropa, gaz ziemny) pochodzi z procesu fotosyntezy, który zachodził w roślinach przez miliony lat. Wtórne produkty fotosyntezy jako różnego rodzaju produkty roślinne stanowią źródło pokarmu, drewna, surowców dla przemysłu chemicznego, farmaceutyki i przetwórstwa[99].
Zobacz też
- ↑ Bryant DA., Frigaard NU. Prokaryotic photosynthesis and phototrophy illuminated.. „Trends in microbiology”, s. 488–96, listopad 2006. DOI: 10.1016/j.tim.2006.09.001. PMID: 16997562.
- ↑ Theodore Brown, John D. Nelson, Kenneth W. Kemp: Chemistry: the central science. Upper Saddle River, NJ: Prentice Hall, 2003, s. 958. ISBN 0-13-048450-4.
- ↑ Olson JM. Photosynthesis in the Archean era. „Photosyn. Res.”, s. 109–17, maj 2006. DOI: 10.1007/s11120-006-9040-5. PMID: 16453059.
- ↑ Buick R. When did oxygenic photosynthesis evolve?. „Philos. Trans. R. Soc. Lond., B, Biol. Sci.”, s. 2731–43, sierpień 2008. DOI: 10.1098/rstb.2008.0041. PMID: 18468984.
- ↑ Whatley J. M.. The endosymbiotic origin of chloroplasts. „Int. Rev. Cytol.”, s. 259–299, 1993. ISSN 0074-7696. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Douglas SE. Plastid evolution: origins, diversity, trends.. „Current opinion in genetics development”, s. 655–61, grudzień 1998. PMID: 9914199.
- ↑ Reyes-Prieto A., Weber AP., Bhattacharya D. The origin and establishment of the plastid in algae and plants.. „Annual review of genetics”, s. 147–68, grudzień 2007. DOI: 10.1146/annurev.genet.41.110306.130134. PMID: 17600460.
- ↑ Muscatine L., Greene RW. Chloroplasts and algae as symbionts in molluscs.. „International review of cytology”, s. 137–69, 1973. PMID: 4587388.
- ↑ Rumpho ME., Worful JM., Lee J., Kannan K., Tyler MS., Bhattacharya D., Moustafa A., Manhart JR. Horizontal gene transfer of the algal nuclear gene psbO to the photosynthetic sea slug Elysia chlorotica.. „Proceedings of the National Academy of Sciences of the United States of America”, s. 17867–71, listopad 2008. DOI: 10.1073/pnas.0804968105. PMID: 19004808.
- ↑ G. I. McFadden, i in. Evidence that an amoeba acquired a chloroplast by retaining part of an engulfed eukaryotic alga. „Proceedings of the National Academy of Sciences of the United States of America”, s. 3690–3694, 1996.07.23. (ang.).
- ↑ a b c d e f g h Barbara Kawecka, Pertti Vesa Eloranta: Zarys ekologii glonów wód słodkich i środowisk lądowych. Warszawa: Wydawnictwo Naukowe PWN, 1994. ISBN 83-01-11320-0.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 93. ISBN 83-01-14549-8.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 278-285. ISBN 83-01-14549-8.
- ↑ Kühlbrandt W., Wang DN., Fujiyoshi Y. Atomic model of plant light-harvesting complex by electron crystallography.. „Nature”, s. 614–21, luty 1994. DOI: 10.1038/367614a0. PMID: 8107845.
- ↑ Frank HA., Cogdell RJ. Carotenoids in photosynthesis.. „Photochemistry and photobiology”, s. 257–264, marzec 1996. PMID: 8881328.
- ↑ a b c January Weiner: Życie i ewolucja biosfery. Podręcznik ekologii ogólnej. Warszawa: Wydawnictwo Naukowe PWN, 1999. ISBN 83-01-12668-X.
- ↑ Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 544. ISBN 978-83-01-14379-4.
- ↑ a b c d e f g h i j k l Stefan Gumiński: Fizjologia glonów i sinic. Wrocław: Wydawnictwo Uniwersytetu Wrocławskiego, 1990. ISBN 83-229-0372-3.
- ↑ Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 543. ISBN 978-83-01-14379-4.
- ↑ Rutherford A. W.. Photosystem II, the water-splitting enzyme. „Trends in biochemical sciences”, s. 227–32, czerwiec 1989. PMID: 2669240. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Chitnis PR. Photosystem I. „Plant physiology”, s. 661–9, lipiec 1996. PMID: 8754676. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Duysens L., Amesz J., Kamp B. M.. Two photochemical systems in photosynthesis.. „Nature”. May 6;190, s. 510–1, 1961. PMID: 13725322. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 285-289. ISBN 83-01-14549-8.
- ↑ Dau H., Haumann M. Eight steps preceding O-O bond formation in oxygenic photosynthesis--a basic reaction cycle of the Photosystem II manganese complex.. „Biochimica et biophysica acta”, s. 472–83, czerwiec 2007. DOI: 10.1016/j.bbabio.2007.02.022. PMID: 17442260.
- ↑ Boyer P. D.. The ATP synthase--a splendid molecular machine. „Annual review of biochemistry”, s. 717–49, 1997. DOI: 10.1146/annurev.biochem.66.1.717. PMID: 9242922. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Yachandra V. K., DeRose V. J., Latimer M. J., Mukerji I., Sauer K., Klein M. P.. Where plants make oxygen: a structural model for the photosynthetic oxygen-evolving manganese cluster. „Science (New York, N.Y.)”, s. 675–9, kwiecień 1993. PMID: 8480177. (Błąd! Nieznany kod języka: Enhlish. Sprawdź listę kodów.).
- ↑ Nugent JH. Oxygenic photosynthesis. Electron transfer in photosystem I and photosystem II.. „European journal of biochemistry / FEBS”, s. 519–31, maj 1996. PMID: 8647094.
- ↑ Arnon D. I.. The discovery of photosynthetic phosphorylation.. „Trends Biochem. Sci.”, s. 258–262, 1984.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 289-291. ISBN 83-01-14549-8.
- ↑ Calvin M. Photosynthesis as a resource for energy and materials.. „Photochemistry and photobiology”, s. 425–44, czerwiec 1976. PMID: 781695.
- ↑ G. H. Lorimer. The carboxylation and oxygenation of ribulose-1,5-bisphosphate: The primary events in photosynthesis and photorespiration.. „Annu Rev. Plant Physiol.”, s. 349–383, 1981.
- ↑ a b Buchanan B. B.. Carbon dioxide assimilation in oxygenic and anoxygenic photosynthesis. „Photosynth. Res.”, s. 147–162, 1992.
- ↑ Scheibe R.. Light/dark modulation: Regulation of chloroplast metabolism in a new light. „Bot. Acta”, s. 327–334, 1990.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 296-298. ISBN 83-01-14549-8.
- ↑ Hatch M.D.. C4 photosynthesis: unique blend of modified biochemistry, anatomy and ultrastructure.. „Biochim. Biophys. Acta”, s. 81-106, 1987.
- ↑ Gutierrez, M., Gracen, V. E., Edwards, G. E.. Biochemical and cytological relationships in C4 plants. „Planta”, s. 279–300, 1974.
- ↑ Kortschak HP., Hartt CE., Burr GO. Carbon Dioxide Fixation in Sugarcane Leaves.. „Plant physiology”, s. 209–13, marzec 1965. PMID: 16656075.
- ↑ Rawsthorne S. Towards an understanding of C3-C4 photosynthesis.. „Essays in biochemistry”, s. 135–46, 1992. PMID: 1425599.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 298-301. ISBN 83-01-14549-8.
- ↑ Steiger H. M., Beck E.. Formation of hydrogen peroxide and oxygen dependence of photosynthetic CO2 assimilation by intact chloroplasts.. „Plant Cell Physiol”, s. 561–576, 1981.
- ↑ Mehler A.H.. Studies on reaction of illuminated chloroplasts. I. Mechanism of the reduction of oxygen and other Hill reagents.. „Arch Biochem Biophys”, s. 65–77, 1951.
- ↑ Allen J. F.. Oxygen reduction and the optimum production of ATP in photosynthesis.. „Nature”, s. 599–500, 1975.
- ↑ Heber U., Egneus E., Hanck U., Jensen M., Koster S.. Regulation of photosynthetic electron transport and photophosphorylation in intact chloroplasts and leaves of Spinacia oleracea L.. „Planta”, s. 4149, 1978.
- ↑ Zhu XG, Long SP, Ort DR. What is the maximum efficiency with which photosynthesis can convert solar energy into biomass?. „Current Opinion in Biotechnology”, s. 153-159, 2008. DOI: 10.1016/j.copbio.2008.02.004. PMID: 18374559.
- ↑ Organizacja Narodów Zjednoczonych do spraw Wyżywienia i Rolnictwa: Chapter 1 - Biological energy production. [dostęp 22 grudnia 2008]. (ang.).
- ↑ Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydaw. Naukowe PWN, 2005, s. 201. ISBN 83-01-14378-9.
- ↑ Cohen Y., Jørgensen BB., Revsbech NP., Poplawski R. Adaptation to Hydrogen Sulfide of Oxygenic and Anoxygenic Photosynthesis among Cyanobacteria.. „Applied and environmental microbiology”, s. 398–407, luty 1986. PMID: 16346996.
- ↑ a b c d e Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 315-319. ISBN 83-01-14549-8.
- ↑ Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydaw. Naukowe PWN, 2005, s. 203. ISBN 83-01-14378-9.
- ↑ Kazimierz Strzałka: Fotosynteza bakteryjna. Warszawa: W: Encyklopedia Biologiczna. Agencja Publicystyczno-Wydawnicza Opres, 1998. ISBN 83-85909-35-4.
- ↑ Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydaw. Naukowe PWN, 2005, s. 204. ISBN 83-01-14378-9.
- ↑ Deisenhofer J., Michel H. The Photosynthetic Reaction Center from the Purple Bacterium Rhodopseudomonas viridis.. „Science (New York, N.Y.)”, s. 1463–1473, wrzesień 1989. DOI: 10.1126/science.245.4925.1463. PMID: 17776797.
- ↑ a b c Hans G. Schlegel: Mikrobiologia ogólna. Warszawa: Wydaw. Naukowe PWN, 2004, s. 479-481. ISBN 83-01-13999-4.
- ↑ Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydaw. Naukowe PWN, 2005, s. 192–193. ISBN 83-01-14378-9.
- ↑ Władysław Kunicki-Goldfinger: Życie bakterii. Warszawa: Wydaw. Naukowe PWN, 2005, s. 204. ISBN 83-01-14378-9.
- ↑ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S. Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria. „J Bacteriol”. 187, s. 3020–7, 2005. PMID: 15838028.
- ↑ Hans G. Schlegel: Mikrobiologia ogólna. Warszawa: Wydaw. Naukowe PWN, 2004, s. 487. ISBN 83-01-13999-4.
- ↑ Kazmierczak J. and Altermann W.. Neoarchean biomineralization by benthic cyanobacteria.. „Science”, s. 2351, 2002. DOI: 10.1126/science.1075933.
- ↑ Kutschera U., Niklas KJ., Darwin C., Wallace AR. The modern theory of biological evolution: an expanded synthesis.. „Naturwissenschaften”. Jun;91, s. 255–76, 2004. DOI: 10.1007/s00114-004-0515-y. PMID: 15241603.
- ↑ Walter M.R. (1983) Archean stromatolites: evidence of the Earth’s earliest benthos. In: Schopf JW (ed) Earth’s Earliest Biosphere, pp 187–213. Princeton University Press, Princeton, New Jersey
- ↑ Mauzerall D.. Light, iron, Sam Granick and the origin of life. „Photosynthesis Research”, s. 163–170, 1992. DOI: 10.1007/BF00039178.
- ↑ Meyer TE. Evolution of photosynthetic reaction centers and light harvesting chlorophyll proteins.. „Bio Systems”, s. 167–75, 1994. PMID: 7888608.
- ↑ Vermaas WF., Blankenship RE. Evolution of heliobacteria: implications for photosynthetic reaction center complexes.. „Photosynthesis research”, s. 285–94, 1994. PMID: 11539188.
- ↑ Xiong J., Bauer CE. A cytochrome b origin of photosynthetic reaction centers: an evolutionary link between respiration and photosynthesis.. „Journal of molecular biology”, s. 1025–37, październik 2002. PMID: 12367526.
- ↑ Lynn Margulis: Origin of Eukaryotic Cells; evidence and research implications for a theory of the origin and evolution of microbial, plant, and animal cells on the Precambrian earth. New Haven, Connecticut: Yale University Press, 1970. ISBN 0-300-01353-1. (Błąd! Nieznany kod języka: English. Sprawdź listę kodów.).
- ↑ Whatley JM., John P., Whatley FR. From extracellular to intracellular: the establishment of mitochondria and chloroplasts.. „Proceedings of the Royal Society of London. Series B, Containing papers of a Biological character. Royal Society (Great Britain)”, s. 165–87, kwiecień 1979. PMID: 36620.
- ↑ Palmer JD., Delwiche CF. Second-hand chloroplasts and the case of the disappearing nucleus.. „Proceedings of the National Academy of Sciences of the United States of America”, s. 7432–5, lipiec 1996. PMID: 8755491.
- ↑ Edwards GE., Furbank RT., Hatch MD., Osmond CB. What does it take to be C4? Lessons from the evolution of C4 photosynthesis.. „Plant physiology”, s. 46–9, styczeń 2001. PMID: 11154293.
- ↑ Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998, s. 120-122. ISBN 83-232-0815-8.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 307-310. ISBN 83-01-14549-8.
- ↑ a b c d e f Winfried Lampert, Ulrich Sommer: Ekologia wód śródlądowych. tłum. Joanna Pijanowska. Warszawa: Wydawnictwo Naukowe PWN, 2001. ISBN 83-01-13387-2.
- ↑ Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998, s. 122-124. ISBN 83-232-0815-8.
- ↑ 310-311
- ↑ J.A. Raven. The Mechanism of Photosynthetic Use of Bicarbonate by Hydrodictyon africanum. „Journal of Experimental Botany”, luty 1968. (ang.).
- ↑ Roberts K., Granum E., Leegood RC., Raven JA. Carbon acquisition by diatoms.. „Photosynthesis research”, s. 79–88, lip-wrz 2007. DOI: 10.1007/s11120-007-9172-2. PMID: 17497225. (ang.).)
- ↑ S.C. Maberly, D.H.N. Spence. Photosynthetic Inorganic Carbon Use by Freshwater Plants. „Journal of Ecology”, s. 705–724, listopad 1983. (ang.).
- ↑ Hew CS., Krotkov G., Canvin DT. Effects of Temperature on Photosynthesis and CO(2) Evolution in Light and Darkness by Green Leaves.. „Plant physiology”, s. 671–677, maj 1969. PMID: 16657119.
- ↑ Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998, s. 124-125. ISBN 83-232-0815-8.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 312-313. ISBN 83-01-14549-8.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 313-314. ISBN 83-01-14549-8.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 301-304. ISBN 83-01-14549-8.
- ↑ Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998, s. 109-114. ISBN 83-232-0815-8.
- ↑ Volk RJ., Jackson WA. Photorespiratory Phenomena in Maize: Oxygen Uptake, Isotope Discrimination, and Carbon Dioxide Efflux.. „Plant physiology”, s. 218–223, luty 1972. PMID: 16657928.
- ↑ Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005, s. 621-626. ISBN 83-01-14549-8.
- ↑ The Annual Register, Or, A View of the History, Politics, and Literature for the year of 1768 (Johann Baptista van Helmont)
- ↑ Neil Campbell, Jane Reece: Biology. San Francisco: Pearson, Benjamin Cummings, 2005, s. 187-188. ISBN 0-8053-7146-X.
- ↑ Howard Gest. Definition of photosynthesis. History of the word photosynthesis and evolution of its definition. „Photosynthesis Research”, s. 7–10, 2002.
- ↑ historia badań na podstawie Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998, s. 96-97. ISBN 83-232-0815-8.
- ↑ Hatch MD., Slack CR., Johnson HS. Further studies on a new pathway of photosynthetic carbon dioxide fixation in sugar-cane and its occurrence in other plant species.. „The Biochemical journal”, s. 417–22, luty 1967. PMID: 6029601.
- ↑ Kortschak HP., Hartt CE., Burr GO. Carbon Dioxide Fixation in Sugarcane Leaves.. „Plant physiology”, s. 209–13, marzec 1965. PMID: 16656075.
- ↑ Nota biograficzna. [dostęp 2008-12-21].
- ↑ Nota biograficzna. [dostęp 2008-12-21].
- ↑ Van Dover, C. L., J. R. Cann, C. Cavanaugh, S. Chamberlain, J. R. Delaney, D. Janecky, J. Imhoff, J. A. Tyson, and the LITE Workshop Participants. Light at deep sea hydrothermal vents. „EOS Trans. Am. Geophys. Union”, s. 44-45, 1994.
- ↑ Van Dover, C. L., G. T. Reynolds, A. D. Chave, J. A. Tyson.. Light at deep sea hydrothermal vents. „Geophys. Res. Lett.”, s. 2049-2052, 1996.
- ↑ Beatty JT., Overmann J., Lince MT., Manske AK., Lang AS., Blankenship RE., Van Dover CL., Martinson TA., Plumley FG. An obligately photosynthetic bacterial anaerobe from a deep-sea hydrothermal vent.. „Proceedings of the National Academy of Sciences of the United States of America”, s. 9306–10, czerwiec 2005. DOI: 10.1073/pnas.0503674102. PMID: 15967984.
- ↑ Yurkov VV., Krieger S., Stackebrandt E., Beatty JT. Citromicrobium bathyomarinum, a novel aerobic bacterium isolated from deep-sea hydrothermal vent plume waters that contains photosynthetic pigment-protein complexes.. „Journal of bacteriology”, s. 4517–25, sierpień 1999. PMID: 10419948.
- ↑ Weber RE., Hourdez S., Knowles F., Lallier F. Hemoglobin function in deep-sea and hydrothermal-vent endemic fish: Symenchelis parasitica (Anguillidae) and Thermarces cerberus (Zoarcidae).. „The Journal of experimental biology”, s. 2693–702, sierpień 2003. PMID: 12819275.
- ↑ Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007, s. 327. ISBN 978-83-01-14379-4.
- ↑ Stanisław Więckowski: Fotosynteza. Warszawa: W: Encyklopedia Biologiczna. Agencja Publicystyczno-Wydawnicza Opres, 1998. ISBN 83-85909-35-4.
Bibliografia
- Jan Kopcewicz, Stanisław Lewak, Halina Gabryś: Fizjologia roślin. Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14549-8.
- Alicja Szweykowska: Fizjologia roślin. Poznań: Wydaw. Naukowe UAM, 1998. ISBN 83-232-0815-8.
- Bruce Alberts, Przemysław Wojtaszek, Hanna Kmita: Podstawy biologii komórki. Cz. 1. Warszawa: Wydawnictwo Naukowe PWN, 2005. ISBN 83-01-14468-8 (cz. 1).
- Jeremy Mark Berg, John L Tymoczko, Lubert Stryer, Neil D Clarke, Zofia Szweykowska-Kulińska, Artur Jarmołowski, Halina Augustyniak: Biochemia. Warszawa: Wydawnictwo Naukowe PWN, 2007. ISBN 978-83-01-14379-4.
- D Hall, K Rao, Maciej Garstka: Fotosynteza. Warszawa: Wydawnictwa Naukowo-Techniczne, 1999. ISBN 83-204-2405-4.




