Chlorek tionylu
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny |
SOCl2 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
118,97 g/mol | ||||||||||||||||||||||||||
| Wygląd |
bezbarwna bądź żółta ciecz o duszącym zapachu[1] | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki |
fluorek tionylu (SOF | ||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Chlorek tionylu, SOCl
2 – nieorganiczny związek chemiczny z grupy chlorków kwasowych, pochodna kwasu siarkawego. W temperaturze pokojowej jest bezbarwną cieczą, dymiąca na powietrzu. Wykorzystywany w reakcjach chlorowania związków organicznych, m.in. podczas produkcji gazów bojowych.
Budowa i właściwości[edytuj | edytuj kod]
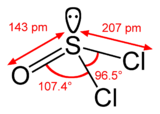
Cząsteczka chlorku tionylu ma budowę piramidalną, wskazującą na obecność wolnej pary elektronowej (w przeciwieństwie do fosgenu o budowie płaskiej). Chlorek tionylu reaguje z wodą tworząc chlorowodór i dwutlenek siarki:
- H
2O + SOCl
2 → 2HCl + SO
2
Jest bardzo reaktywny. W temperaturze około 140 °C ulega rozkładowi.
Otrzymywanie[edytuj | edytuj kod]
Podstawową metodą przemysłowej syntezy chlorku tionylu jest reakcja trójtlenku siarki z dwuchlorkiem siarki[4]:
- SO
3 + SCl
2 → SOCl
2 + SO
2
Inne metody otrzymywania:
Zastosowania[edytuj | edytuj kod]
Chemia organiczna[edytuj | edytuj kod]
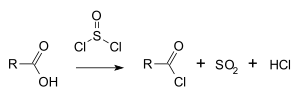
Chlorek tionylu jest szeroko stosowany w reakcjach chlorowania, np. do przekształcania kwasów karboksylowych w chlorki acylowe[5]:
Reaguje z alkoholami dając odpowiednie chlorki alkilowe[6][7]:
W reakcji tej w pierwszym etapie powstaje ester chlorosulfinylowy R−O−SOCl, który rozpada się do chlorku i SO
2[8]:
- R−OH + SOCl
2 → R−O−SOCl + HCl → R−Cl + SO
2
Ze względu na to, że produktami ubocznymi chlorowania za pomocą chlorku tionylu są gazy (HCl i SO
2), a nadmiar SOCl
2 można usunąć przez destylację, procedura oczyszczania właściwego produktu jest zwykle prostsza niż w przypadku chlorowania za pomocą pięciochlorku fosforu.
Z 1,2-aminoalkoholami reaguje z wytworzeniem cyklicznych sulfamidów, natomiast gdy grupy −OH i −NH
2 są bardziej oddalone, grupa hydroksylowa ulega substytucji atomem chloru, a z aminowej powstaje amid, jak np. w pierwszym etapie otrzymywania bicifadyny (leku przeciwbólowego)[8]:
Chemia nieorganiczna[edytuj | edytuj kod]
Chlorek tionylu stosuje się do otrzymywania bezwodnych chlorków metali z soli uwodnionych[9]:
- MCl
n·mH
2O + mSOCl
2 → MCl
n + mSO
2 + 2mHCl
Baterie litowe[edytuj | edytuj kod]
Chlorek tionylu wykorzystuje się także w ogniwach o zastosowaniach specjalnych. Chlorek tionylu jest składnikiem ogniw litowo-chlorkowo tionylowych jako elektroda dodatnia (katoda), z metalicznym litem jako elektrodą ujemną (anodą). Reakcja zachodząca w czasie rozładowywania ogniwa to[10]:
- 4Li + 2SOCl
2 → 4LiCl + S + SO
2
Ogniwa te mają wiele zalet nad innymi rodzajami litowych ogniw pierwotnych, między innymi wysoką gęstość energii, szeroki zakres temperatur pracy i dużą trwałość, jednakże ich wysoka cena i kwestie bezpieczeństwa ograniczają ich zastosowanie. Zawartość tych ogniw jest wysoce toksyczna i wymaga specjalnych procedur utylizacji, dodatkowo istnieje ryzyko eksplozji ogniwa w wyniku zwarcia[10].
Przypisy[edytuj | edytuj kod]
- ↑ Thionyl chloride, [w:] PubChem, United States National Library of Medicine, CID: 24386 [dostęp 2023-08-22] (ang.).
- ↑ a b c d e f g CRC Handbook of Chemistry and Physics, William M. Haynes (red.), wyd. 97, Boca Raton: CRC Press, 2016, s. 4-90, 4-132, 9-66, ISBN 978-1-4987-5429-3 (ang.).
- ↑ Chlorek tionylu, karta charakterystyki produktu Sigma-Aldrich, Merck, 1 września 2023, numer katalogowy: 230464 [dostęp 2023-11-05]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ N.N. Greenwood, A. Earnshaw, Chemistry of the Elements, Pergamon Press, 1984.
- ↑ M.W. Rutenberg, E.C. Horning, 1-Methyl-3-ethyloxindole, „Organic Syntheses”, 30, 1950, s. 62, DOI: 10.15227/orgsyn.030.0062 (ang.).
- ↑ Kathleen R. Mondanaro, William P. Dailey, 3-Chloro-2-(chloromethyl)-1-propene, „Organic Syntheses”, 75, 1998, s. 89, DOI: 10.15227/orgsyn.075.0089 (ang.).
- ↑ Krzysztof E. Krakowiak, Jerald S. Bradshaw, 4-Benzyl-10,19-diethyl-4,10,19-triaza-1,7,13,16-tetraoxacycloheneicosane, „Organic Syntheses”, 70, 1992, s. 129, DOI: 10.15227/orgsyn.070.0129 (ang.).
- ↑ a b Feng Xu i inni, Chlorination/cyclodehydration of amino alcohols with SOCl2: An old reaction revisited, „Journal of Organic Chemistry”, 73 (1), 2008, s. 312–315, DOI: 10.1021/jo701877h (ang.).
- ↑ Alfred R. Pray i inni, Anhydrous Metal Chlorides, „Inorganic Syntheses”, 28, 1990, s. 321–323, DOI: 10.1002/9780470132593.ch80 (ang.).
- ↑ a b Lithium Thionyl Chloride Battery [online], Maxell [zarchiwizowane z adresu 2021-06-23] (ang.).