Randomizowane kontrolowane badania kliniczne

Faza 1: Rejestracja do badań (Enrollment), połączona z oceną kwalifikowalności i randomizacją
Faza 2: Przydział do grup uczestników RCT (Allocation)
Faza 3: Interwencja medyczna (Intervention)
Faza 4: Obserwacja i analiza danych (Follows-Up)
Szczegółowe raporty z badań są opracowywane zgodnie z instrukcją CONSORT 2010[1]. Obejmują m.in. informacje o przyczynach każdego z wyłączeń z badań (excluded).
Randomizowane kontrolowane badania kliniczne (ang. randomized controlled trial, RCT[a]) – „złoty standard” eksperymentów klinicznych, rodzaj badań eksperymentalnych z udziałem ludzi, wykonywanych zgodnie z zasadami dobrej praktyki klinicznej, których celem jest porównanie bezpieczeństwa i skuteczności leków, wyrobów i technik medycznych lub innych rodzajów terapeutycznej lub zapobiegawczej interwencji medycznej.
W czasie badań duża grupa ich uczestników jest losowo (randomizacja) przydzielana do dwóch lub więcej podgrup, np. do podgrupy poddawanej ocenianej nowej procedurze (grupa eksperymentalna) i podgrupy porównawczej (grupa kontrolna), poddawanej interwencji alternatywnej (np. standardowej) lub pozorowanej (np. podawanie placebo lub brak działania). Różnice między wynikami uzyskiwanymi w podgrupach są oceniane metodami statystycznymi[2][3][4][5].
Randomizowane kontrolowane badania kliniczne są jedną z podstaw medycyny opartej na faktach (EBM)[6][7], obok badań obserwacyjnych[8][9][10]. Analogiczne metody są również stosowane poza medycyną, w różnych obszarach badań naukowych, w psychologii, pedagogice i innych naukach społecznych.
Historia
[edytuj | edytuj kod]
Do narodzin medycyny doszło prawdopodobnie kilka tysięcy lat temu w starożytnym Egipcie (papirus Edwina Smitha pochodzi z ok. 1550 roku p.n.e.[11]) i niewiele później w Mezopotamii, Grecji i w Rzymie. Ówczesna medycyna miała częściowo charakter magiczno-religijny, a częściowo empiryczno-racjonalny. Pierwsze procedury medyczne i leki opracowano na podstawie wyników obserwacji i eksperymentów, przypominających późniejsze badania obserwacyjne i eksperymentalne badania naukowe.
Za pioniera eksperymentów klinicznych naszej ery jest uważany James Lind (1716–1794)[b], szkocki lekarz, służący m.in. na okręcie Royal Navy HMS „Salisbury”[12]. W 1747 roku, poszukując sposobu przeciwdziałania powszechnemu wśród marynarzy szkorbutowi, Lind podzielił dwunastu chorych członków załogi na sześć par i każdej z nich dodawał inne składniki do podstawowej diety. Dwie z tych par, które otrzymywały pomarańcze i cytryny, odzyskały zdrowie, co było bezpośrednim i jednoznacznym potwierdzeniem opinii o skuteczności owoców cytrusowych[13][14][15] (cytrusy bywały stosowane już na statkach da Gamy w XV wieku i Cabrala na początku XVI wieku[16][17]). Dalszy rozwój medycyny był związany z kolejnymi „rewolucjami przemysłowymi” (pierwszą, drugą i trzecią). Wzrosły możliwości identyfikacji chorób lub zespołów chorobowych na podstawie oceny objawów subiektywnych (stwierdzonych w badaniu podmiotowym i przedmiotowym) oraz wyników diagnostycznych badań laboratoryjnych i obrazowych (zob. historia i kliniczne znaczenie obrazowania medycznego). Towarzyszył temu postęp farmacji i dyscyplin z nią związanych, a równocześnie wzrost świadomości błędów pomiarów, np. wykonywanych w czasie ocen skuteczności licznych nowych leków. Za przełomowe bywają uznawane badania Selmana Waksmana, laureata Nagrody Nobla (1952) za izolację streptomycyny, pierwszego antybiotyku skutecznego w leczeniu gruźlicy płuc[18][19][20]. Statystyczną analizę skuteczności terapii prowadzili zasłużeni dla tej dyscypliny[21][22][21]:
- Ronald Fisher (1890–1962)[23], autor m.in. Statistical Methods for Research Workers[24] (w tym History of Statistics[25])
- Austin Bradford Hill (1897–1991), epidemiolog i statystyk, najlepiej znany jako autor zestawu 9 kryteriów, wskazujących na występowanie zależności przyczynowej między zjawiskami medycznymi (The Environment and Disease: Association or Causation? 1965[26]); „kryteria Hilla” są wciąż przedmiotem dyskusji naukowych[27][28][29][30].
Statystyczne podstawy RCT budowali również Charles Sanders Peirce, Joseph Jastrow, Jerzy Spława-Neyman i in. (wprowadzenie pojęć przedział ufności, odchylenie standardowe i in.; zob. przegląd zagadnień z zakresu statystycznej analizy wyników pomiarów)[31].
Liderami międzynarodowych starań o zwiększenie wiarygodności wyników eksperymentów klinicznych byli:
- Archibald Cochrane, student Austina Bradforda Hilla, autor książki pt. Effectiveness and Efficiency: Random Reflections on Health Services[32] nazywany „ojcem medycyny opartej na dowodach (EBM)”
- Douglas Altman, autor opublikowanego w 1994 roku alarmującego artykułu pt. The scandal of poor medical research[33], współtwórca Cochrane Collaboration
W końcu XX wieku i w pierwszych dziesięcioleciach kolejnego tysiąclecia metodyka RCT była intensywnie rozwijana jako „złoty standard” eksperymentów klinicznych, stosowany powszechnie[34][35], lecz nie bez ograniczeń[36][37][38].
Etyczne i prawne aspekty współczesnych eksperymentów klinicznych
[edytuj | edytuj kod]Doświadczenia XX wieku
[edytuj | edytuj kod]
Na kierunki rozwoju współczesnej medycyny znacząco wpłynęły wydarzenia historyczne XX wieku, takie jak wojny światowe (w czasie pierwszej poległo 8,5 mln żołnierzy, w czasie drugiej 60 mln ludzi) oraz groźne dla ludzkości epidemie i pandemie (dżuma, gruźlica, grypa, choroba Heinego-Medina, ospa, odra i inne[c]). Do historii medycyny weszły nie tylko działania oddziałów wojskowej służby zdrowia na polach bitew (np. pod Monte Cassino) lub jednostek Czerwonego Krzyża walczących z epidemiami. Ciemna część historii medycyny zawiera wiedzę o zbrodniczych eksperymentach na ludziach w Auschwitz, w japońskiej Jednostce 731 i innych. Rodzajem badań na ludziach jest określanie wartości dopuszczalnej dawki promieniowania (jej przekroczenie było np. przyczyną śmierci Luisa Slotina w czasie realizacji Projektu Manhattan), wartości najwyższych dopuszczalnych stężeń i natężeń w warunkach pracy, wielkości dawek leczniczych itp.
Rezolucje międzynarodowe 1945–1964
[edytuj | edytuj kod]Wkrótce po kapitulacji III Rzeszy utworzono Organizację Narodów Zjednoczonych (Nowy Jork 1945), za której cele uznano zapewnienie pokoju i bezpieczeństwa międzynarodowego, rozwój współpracy między narodami oraz popieranie przestrzegania praw człowieka, w tym prawa do opieki zdrowotnej. Już w 1946 roku na zwołanej przez ONZ Międzynarodowej Konferencji Zdrowia ratyfikowano konstytucję Światowej Organizacji Zdrowia (ang. World Health Organization, WHO, Genewa), a w 1947 roku utworzono współpracujące z WHO Światowe Towarzystwo Medyczne (ang. World Medical Association, WMA)[d][39].
Działania WHO i WMA zmierzają konsekwentnie do jednoznacznego sprecyzowania warunków prowadzenia badań klinicznych. W 1964 roku przyjęto dotyczącą tych zagadnień deklarację helsińską. W następnych latach wchodziły w życie jej kolejne wersje[40].
Jawność badań klinicznych jako powinność naukowa i etyczna
[edytuj | edytuj kod]Na ministerialnym spotkaniu, zorganizowanym w Meksyku w 2004 roku przedstawiciele 58 krajów przyjęli rezolucję określającą obowiązki państw w zakresie organizacji badań medycznych o wysokiej jakości. Stwierdzono, że naukową, etyczną i moralną powinnością prowadzących testy kliniczne jest jawność planów badań i osiągniętych wyników[41].
Opracowano zasady dokumentowania projektów w powszechnie dostępnych na poziomie międzynarodowym rejestrach i archiwach czasopism, co miało na celu nie tylko usprawnienie wymiany wiedzy między naukowcami, ale również zwiększenie zaufania opinii publicznej do nauki (np. chorych do lekarzy) oraz ułatwienie podejmowania decyzji administracyjnych w sprawach dotyczących finansowania nowych badań itp.[42] Międzynarodowy Komitet Redaktorów Czasopism Medycznych[43][44] (ang. International Committee of Medical Journal Editors) wydał oświadczenie, że warunkiem publikacji prac dot. zakresu i wyników badań klinicznych w rekomendowanych czasopismach medycznych będzie wcześniejsza, zgodna z wytycznymi rejestracja ich zgłoszenia w jednym z ogólnodostępnych rejestrów, zarządzanych przez organizację non-profit[45][46] (zob. prerejestracja badania). WHO stworzyła platformę internetową, umożliwiającą przeglądy różnych rejestrów[47][48].
W 2015 roku uzgodniono, że rejestry badań klinicznych będą obejmowały również opisy wcześniejszych, dotychczas nieopublikowanych wyników badań na ludziach (w tym pozytywnych, negatywnych i niejednoznacznych). W tymże roku ponowiono stwierdzenie, że rejestracja wszystkich badań, dotyczących interwencji medycznych jest naukowym, etycznym i moralnym obowiązkiem[49]
The registration of all interventional trials is a scientific, ethical and moral responsibility.
Raporty z badań powinny być opracowywane zgodnie ze stale aktualizowanymi wytycznymi CONSORT[1][50][51].
Statystyczny charakter badań medycznych
[edytuj | edytuj kod]James Lind opierał wnioski dotyczące możliwości przeciwdziałania szkorbutowi na obserwacji 12 chorych członków załogi HMS „Salisbury”, podzielonych na 6 par, które korzystały z różnej diety[12]. Od czasu tego eksperymentu (1747 rok) liczba ludności Ziemi wzrosła ok. dziesięciokrotnie. W przybliżeniu wykładniczy, terytorialnie zróżnicowany dalszy wzrost tej liczby (zob. przeludnienie) oraz rozwój gospodarczy i demograficzny zmieniły charakter wyzwań, które stoją przed medycyną.
Za współczesną analogię badań Linda uważa się eksperymentalne badania kliniczne. W czasie eksperymentów jest wykorzystywana gromadzona przez tysiąclecia doświadczeń medyczna wiedza o zdrowiu i chorobach człowieka i zdrowiu populacji, sposobach diagnostyki, profilaktyki i leczenia. Stan zdrowia pacjentów i skuteczność terapii ocenia się stosując liczne metody diagnostyki laboratoryjnej i obrazowej, analizy czasu przeżycia np. do nawrotu choroby lub do śmierci, wywiady dot. odczuwania bólu, wyniki ankiet dot. subiektywnie odczuwanej jakości życia[e]i wiele innych technik.
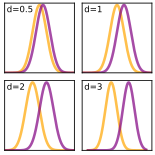
Postęp wiedzy umożliwił wykazanie wielkiego zróżnicowania ludzkich reakcji na patogeny, będącego skutkiem wpływu czynników genetycznych, immunologicznych (np. przebyte infekcje i szczepienia) lub ekonomicznych i organizacyjnych (np. zróżnicowanie sprawności systemów opieki zdrowotnej i innych wskaźników jakości życia). Podejmowane są próby określenia rozmiarów utraty zdrowia z różnych powodów według wieku, płci, rozmieszczenia w przestrzeni i w czasie (zob. np. globalne obciążenie chorobami). Istotnym czynnikiem zróżnicowania reakcji ludzi na oddziaływania chorobotwórcze lub na stosowane terapie jest częste występowanie w populacji chorób przewlekłych i wielochorobowości[52][53]. W warunkach bardzo wysokiego zróżnicowania indywidualnych reakcji na interwencje medyczne uzyskanie wiarygodnych wyników porównań skuteczności dotychczasowych i nowych terapii wymaga zaangażowania licznych uczestników – próby reprezentatywnej dla populacji – i stosowania technik wnioskowania statystycznego (np. wnioskowanie częstościowe lub bayesowskie). W czasie obliczeń efektu często stosuje się wartości d Cohena (różnica między średnimi podzielona przez odchylenie standardowe w próbie)[54]. Im mniejsza jest wielkość efektu, tym liczniejsza próba jest potrzebna do osiągnięcia oczekiwanej mocy testu statystycznego. W czasie standardowej procedury weryfikacji hipotez statystycznych porównuje się statystyki testowe w hipotezie zerowej i alternatywnej, określając prawdopodobieństwo popełnienia błędu I rodzaju (zob. próba statystyczna, poziom istotności α, wartość p)[55].
A. Wykresy Gaussa ilustrujące różne wartości d Cohena
B. Statystyki testowe w hipotezie zerowej i alternatywnej w teście t dla dwóch grup niezależnych (N=100, d=0,5, moc testu ok. 70%)
Eksperymenty kliniczne
[edytuj | edytuj kod]Fazy eksperymentów (0, 1, 2, 3, 4)
[edytuj | edytuj kod]Fazy 0, 1 i 2
[edytuj | edytuj kod]W początkowym okresie eksperymentów klinicznych badania zmierzają do wstępnego potwierdzenie celowości ich rozpoczęcia oraz opracowania racjonalnego, bezpiecznego dla pacjentów programu badań fazy trzeciej, początkowo przewidywanej głównie na podstawie przeglądów pierwotnych i wtórnych źródeł wiedzy – publikacji (zob. PRISMA) zgromadzonych w bogatych medycznych bibliotekach, takich jak baza NLM[potrzebny przypis] (zob. też PubMed) lub biblioteki Cochrane Collaboration[f][58]. Publikacje dotyczą często prac wykonywanych bez udziału ludzi, np. mikrobiologicznych badań posiewów lub testowania leków na zwierzętach. Eksperymenty wykonywane z udziałem ludzi nie wymagają rekrutacji licznych grup uczestników (populacja statystyczna). W fazach 1 i 2 w skład tych grup wchodzi zwykle od kilkunastu do trzystu osób[57][59].
Faza 3 i kontynuacja badań (faza 4)
[edytuj | edytuj kod]W wyniku fazy 3 spodziewane jest ostateczne potwierdzenie skuteczności i bezpieczeństwa nowej terapii, które jest uznawane za podstawę urzędowych decyzji (np. rejestracja leku[60]).
Po wprowadzeniu nowych leków lub technik do praktyki badania bywają kontynuowane (faza 4), m.in. w celu sprawdzenia ewentualnych interakcji z innymi lekami, skutków terapii długotrwałych itp.[57] W fazie 4 są też prowadzone obserwacje dotyczące zdrowia publicznego, np. porównania okresów przed i po wprowadzeniu szczepień lub badania możliwości zapobiegania chorobom zakaźnym i niepożądanym odczynom poszczepiennym[59].
Otrzymanie wiarygodnych wyników trzeciej fazy eksperymentu wymaga rekrutacji licznych grup uczestników (często wielu setek lub tysięcy) oraz przestrzegania procedur badawczych i jawności raportów, publikowanych w dostępnych czasopismach naukowych o potwierdzonej wiarygodności (zob. NLM, PubMed[61], WHO ICTRP[47][62]).
Stosowane są m.in. eksperymentalne badania porównawcze (zob. rodzaje badań epidemiologicznych)[57]:
- – równoległe
- – podział uczestników badania na grupy podobne w chwili rozpoczęcia eksperymentu; w grupach są równolegle stosowane porównywane interwencje medyczne (np. badany produkt leczniczy w grupie badanej i lek standardowy w grupie kontrolnej lub badana interwencja w grupie badanej, chemioterapia w grupie badanej i radioterapia w grupie kontrolnej)
- – naprzemienne (krzyżowe)
- – stosowanie w obu grupach obu porównywanych terapii, wymienianych zgodnie z harmonogramem opisanym w protokole eksperymentu; procedura umożliwiająca skontrolowanie skuteczności obu metod w indywidualnych przypadkach, nie stosowana, gdy mierzalne parametry skuteczności są zmienne oraz gdy pojawiają się i zanikają ze znacznym opóźnieniem, a preparaty mają długi czas półtrwania (między oboma seriami stosuje się „fazę wypłukania”),
- – z zastosowaniem klasteryzacji (ang. data clustering, cluster randomised controlled trial)
- – losowe przydzielanie różnych interwencji nie poszczególnym osobom, lecz niezależnie utworzonym grupom ludzi, np. mieszkańcy wsi lub lokatorzy budynku, uczniowie szkoły, pacjenci kliniki[63][64][65] (zob. też analiza skupień z użyciem centroidów i metody k-średnich[66], Stepped wedge cluster randomized controlled trial designs[67]); zmienność wielkości klastrów wymaga stosowania specjalnych metod obliczeń wyników[68]
- – z zastosowaniem analizy czynnikowej (ang. factorial experiment)
- – korzystanie ze schematów eksperymentalnych nazywanych ang. factorial design[69], tworzonych w celu jednoczesnego badania wpływu więcej niż jednej interwencji. W najprostszym przypadku 2×2 uczestnicy, tworzący cztery grupy, mogą otrzymywać np.[57]:
- – aktywny lek A + aktywny lek B
- – aktywny lek A + placebo B
- – placebo A + aktywny lek B
- – placebo A + placebo B
- Złożone metody analizy wieloczynnikowej pozwalają porównać skuteczności stosowania różnych sposobów terapii, charakterystyczne dla grupy uczestników, a dodatkowo wykryć interakcje między równocześnie stosowanymi interwencjami[57], problemy wynikające z występowania w grupie przypadków wielochorobowości itp.[52][53]
Spośród stosowanych metod wyróżniane są procedury RCT (ang. Randomized controlled trial, „złoty standard”[g][70] badań klinicznych), najczęściej realizowane metodą dwóch grup równoległych. Stwierdzono, że w 2000 roku (przed aktualizacją wytycznych CONSORT) w ten sposób wykonywano badania w 383-ciu na 519 publikacji indeksowanych w PubMed (74%), a w 2006 roku (po aktualizacji) w 477-miu na 616 publikacji (78%)[71].
W czasie badań dotyczących zwalczania ostrych chorób epidemicznych są stosowane adaptacyjne badania kliniczne (ang. outcome-adaptive trials)[72], charakteryzujące się częstymi analizami okresowymi i dostosowywaniem przebiegu badania do ich wyników (przyspieszenie badań leku). Były stosowane m.in. w czasie realizacji projektu An Adaptive Randomized Trial Comparing Multiple Treatments for Ebola Virus (EBOV) Infected Children and Adults (wirus Ebola)[73]. W styczniu 2020 rozpoczęto badania dotyczące leczenia COVID-19: A Multicenter, Adaptive, Randomized Blinded Controlled Trial of the Safety and Efficacy of Investigational Therapeutics for the Treatment of COVID-19 in Hospitalized Adults[74].
Badania wykonywane w fazie 3 eksperymentu są rozpoczynane po jednoznacznym sformułowaniu hipotezy badawczej, opracowaniu programu badań, określeniu niezbędnej liczebności właściwej grupy badawczej oraz obowiązkowej rejestracji przedsięwzięcia. Jednym z kluczowych wstępnych zadań wykonawców jest ustalenie zależności między danymi, określanymi jako wynik ocenianej terapii, a wybranymi kryteriami oceny zmian stanu zdrowia pod wpływem tej terapii[h].
Poprawność RCT jest oceniana na podstawie opisu celu i metodyki, przedstawianego w czasie rejestracji wstępnej, oraz tekstu raportu z wykonania badań. Opisy powinny być przygotowane zgodnie z wytycznymi CONSORT i zawierać szczegółowe informacje o zastosowanych procedurach randomizacji, „zaślepiania” i in., umożliwiające zastosowanie skali Jadada („oksfordzkiego systemu oceny jakości” klinicznych badań eksperymentalnych)[57][56][71][51].
Rekrutacja uczestników badań i zmiany w grupach
[edytuj | edytuj kod]Istotnym warunkiem poprawności wyników badania efektów zmiany sposobu terapii jest prawidłowy dobór próby statystycznej – grupy ludzi nazywanej uczestnikami. Osiągnięcie celu wymaga:
- zapewnienia udziału odpowiednio licznej grupy osób[75][76][77][78], tym liczniejszej im mniejsza jest wielkość spodziewanego efektu[55][79][80]
- spełnienia kryteriów włączenia/wyłączenia – zmian składu grup uczestników, zachodzących często (z różnych powodów) przed, w czasie i po zakończeniu badań[57].
Zgodnie z zasadami lekarskiej etyki zawodowej (Kodeks Etyki Lekarskiej) każdy kandydat do grupy musi wyrażać świadomą zgodę na udział w realizacji programu. Zgłoszenia bywają odrzucane, co sprawia, że cechy grupy często nie odpowiadają populacji generalnej[81].
Kryteria włączania/wyłączania są zależne od bardzo zróżnicowanych celów i technik badań[82][83][84]. W licznych rodzajach badań ze względów etycznych nie jest akceptowany udział dzieci, seniorów, kobiet w okresie ciąży lub laktacji, osób z niepełnosprawnościami i innych, które mogą nie być w pełni zdolne do wyrażenia świadomej zgody. Kryteria wykluczeń chronią też uczestników, którzy mogliby być szczególnie podatni na ewentualne zagrożenia, związane z udziałem w eksperymencie (wszystkie uzasadnienia powinny być opisane w raporcie; zob. schemat blokowy RCT według CONSORT 2010[1])[85].
Randomizacja
[edytuj | edytuj kod]Randomizacja jest metodą losowego przydzielania uczestników badania (pacjentów) do grupy eksperymentalnej i grupy kontrolnej lub większej liczby podgrup. Idealna metoda powinna gwarantować, że losowy charakter doboru nie będzie źródłem wstępnego zróżnicowania podgrup w zakresie wszystkich (znanych i nieznanych) cech uczestników, które mogą wpływać na wynik badania[57][86].
Wśród metod losowych wyróżnia się m.in.[57][86]:
- randomizację prostą („czystą”) – metody w pełni losowe, w których każde włączenie chorego jest dziełem przypadku, jest niezależne od cech klinicznych, demograficznych itd. Przykładem takich metod jest rzut monetą (np. awers – grupa A, rewers – grupa B) lub stosowanie list, uszeregowanych według liczb losowych (zob. generator liczb losowych)
- randomizację blokową (ang. random permuted blocks) – przydzielanie do grup nie jako wynik losowania osób, lecz losowania bloków, czyli równolicznych grup (bloków) o określonej sekwencji przydziału kolejnych chorych do każdej z badanych grup (np. bloki czterocyfrowe: AABB, ABBA, BBAA, ABAB, BAAB, BABA, w których A – grupa eksperymentalna, B – grupa kontrolna)
- randomizację parami – po podziale kandydatów na pary, na podstawie podobieństwa określonych cech, jedna z osób każdej z par jest czysto losowo przydzielana do grupy A lub B, a druga – bez losowania – do grupy drugiej
- randomizację typu biased-coin (B. Efron)[87]
Dążenie do przyspieszenia weryfikacji skuteczności nowych terapii prowadzi do wzrostu popularności badań wieloośrodkowych z udziałem tysięcy uczestników. W tych przypadkach niezbędna jest dobra koordynacja wszystkich działań, w tym bieżące monitorowania przebiegu naboru pacjentów i randomizacji. Stosowane są centralne systemy rejestracji, randomizacji i zarządzania danymi, które sprzyjają wiarygodności wyników badań – korzystają z zaawansowanych metod regresji, umożliwiających m.in. porównanie i minimalizację początkowych różnic między podgrupami i korektę wyników końcowych o wpływ tych różnic. Systemy ułatwiają też pracę naukowców pracujących w poszczególnych ośrodkach (np. w klinikach), nie opracowujących końcowych raportów, przekazujących do systemu wypełnione formularze kart obserwacji klinicznej. Zapobiegają występowaniu pomyłek lub celowych zafałszowań[57][86].
Zaślepianie (utajnianie)
[edytuj | edytuj kod]Uczestniczący w badaniach pacjenci nie są informowani, do której z wymienionych grup zostali zakwalifikowani (utajnienie alokacji, ang. allocation concealment), co zapobiega błędom wynikającym z subiektywizmu. Na istnienie takich błędów może np. wskazywać obserwacja, że korzystniejsze subiektywne miary skuteczności terapii są zamieszczane w tych publikowanych raportach, które nie zawierają opisów sposobu utajniania przydziałów do grup lub nie są one poprawne[57].
Bywa też stosowane:
- – „zaślepienie podwójne” – nie mają dostępu do informacji o alokacji również lekarze uczestniczący w badaniach, co gwarantuje ich obiektywizm, lecz w niektórych przypadkach utrudnia podejmowanie decyzji zgodnych z zasadami etyki lekarskiej (np. wykluczenie z grupy eksperymentalnej pacjenta, u którego wystąpiły niepokojące objawy); niekiedy dokonywane są etapowe oceny postępów leczenia w obu odkodowanych grupach po ich odkodowaniu przez grono niezależnych ekspertów, którzy mogą rekomendować przerwania realizacji programu, jeżeli w jednej z grup uzyskano zdecydowanie lepsze wyniki (za nieetyczne uważa się narażanie drugiej grupy na niepotrzebne ryzyko)[57]
- – „zaślepienie potrójne” – utajnienie informacji przed ośrodkiem kierującym badaniem[88][89].
Całkowite utajnienie umożliwiają systemy centralnej randomizacji, niezależne od ośrodków wykonujących badania, wykorzystujące np. numery opakowań leków, na których nie znajdują się żadne informacje o zawartości.
Efektywne utajnienie wylosowanej terapii bywa niemożliwe, np. z powodu występowania zauważalnych i rozpoznawalnych przez pacjenta oddziaływań specyficznych dla leku[57].
Ostatnio zwiększa się popularność badań typu PROBE (ang. Prospective Randomized Open Blinded End-point), w których zaślepieniu poddaje się wyłącznie specjalistów, uczestniczących w badaniu tylko w ramach ocen punktów końcowych (oceniają wyniki bez wiedzy o alokacji)[57][90].
Raporty z badań
[edytuj | edytuj kod]| Stopień skali | A (N) | A % | B (N) | B (%) |
| 1 | 21 | 7,6 | 44 | 26,7 |
| 2 | 32 | 26,9 | 63 | 38,2 |
| 3 | 40 | 33,6 | 37 | 2,4 |
| 4 | 15 | 12,6 | 16 | 9,7 |
| 5 | 11 | 9,2 | 5 | 3,0 |
Programy badań są realizowane zgodnie z wcześniej zatwierdzonym protokółem. Są nadzorowane przez monitora badań klinicznych CRA (ang. clinical research associate)[j]. Dane dotyczące każdego z uczestników (dane pochodzące z historii choroby i innych dokumentów medycznych, np. wyniki badań laboratoryjnych, diagnostyki obrazowej i in.) są wprowadzane do kart obserwacji klinicznej CRF (ang. c::ase report form) i przekazywane do analizy w formie papierowej lub elektronicznej (zob. schemat elektronicznego obiegu danych).
Wyniki wykonywanych na całym świecie badań są podstawą artykułów naukowych, publikowanych w wielu czasopismach medycznych (poświęconych medycynie ogólnej i zagadnieniom specjalistycznym). Stwierdzono, że w latach 1995–2010 nawet w czasopismach najwyższej rangi (najwyższe IF), zwłaszcza należących do specjalistycznych, są zamieszczane niepełne lub niejednoznaczne opisy zastosowanych procedur badawczych. W takich sytuacjach publikowane wyniki są mało wiarygodne (mogą też sugerować czytelnikowi mylne wnioski)[91][51]. Spostrzeżenie stało się bodźcem do nieustających starań o udoskonalenie dokumentu CONSORT (Consolidated Standards of Reporting Trials). Wytyczne są poprawiane i uzgadniane na szczeblu międzynarodowym. Mimo ich ogólnej dostępności liczne spośród publikowanych opisów badań wciąż budzą zastrzeżenia (są przedmiotem naukowych debat i polemik)[1][71][92][93].
Liczba i tematyka randomizowanych kontrolowanych badań klinicznych
[edytuj | edytuj kod]| Rok | Liczba rejestracji |
| 2000 | 2190 |
| 2002 | 1960 |
| 2004 | 4010 |
| 2006 | 19170 |
| 2008 | 27320 |
| 2010 | 32460 |
| 2012 | 37040 |
| 2014 | 42260 |
| 2016 | 51210 |
| 2018 | 60690 |
Oszacowanie liczby wszystkich badań klinicznych, wykonywanych na świecie od końca XX wieku, umożliwiają biblioteki publikacji naukowych, np. NLM z wyszukiwarką PubMed, Biblioteki Cochrane lub, od 2005 roku, International Clinical Trials Registry Platform. ITCRP gromadzi informacje o eksperymentach klinicznych od chwili ich zgłoszenia do rejestru do zakończenia. Pierwsza rejestracja (przesłanie „raportu próbnego”) oznacza wstępną deklarację jakości zgodnej z CONSORT oraz jawności[94].

– AFRO (Brazzaville): 8807
– AMRO (Waszyngton): 157700
– EMRO (Kair): 30099
– EURO (Kopenhaga): 154558
– SEARO (New Delhi): 31219
– WPRO (Manila): 125935
Od czasu podjęcia prac, zmierzających do opracowania wytycznych CONSORT (Douglas Altman i wsp., przełom XX/XXI w.) liczba rejestracji badań klinicznych wzrosła od ok. 2 tys. rocznie do ponad 60 tys. Nie wszystkie badania zrealizowane spełniają wymagania dla „złotego standardu” (zob. tabela w poprzedniej sekcji), a duża ich część nie jest rejestrowana (sugeruje się, że rejestracja powinna być obowiązkowa[97]).
Wśród ponad 660 tysięcy odpowiedzi PubMed na zapytanie „randomized controlled trial” znajdują się tytuły licznych artykułów (w latach 2013–2018 ponad 38 tys. rocznie), dotyczących procedur różnych badań klinicznych oraz wyników realizacji poszczególnych programów[34]. Według Eun-Kyoung Choi i wsp. (2016) do najczęściej badanych kategorii chorób (ICD-10) należą: choroby układu trawiennego (13,1%), układu nerwowego (9,4%) i układu kostno-mięśniowego (9,1%)[97].
EORTC (European Organisation for Research and Treatment of Cancer) zajmuje się od wielu lat problemami nowotworów, należących do najczęstszych przyczyn zgonów. Badania kliniczne dotyczą m.in. jakości życia pacjentów onkologicznych (HRQoL, dobrostan subiektywny) ocenianej z użyciem kwestionariusza QLQ-C30 (Quality of Life Questionnaire Core 30)[98][99].
Od czasu wybuchu epidemii COVID-19 prowadzone są międzynarodowe adaptacyjne badania kliniczne zmierzające do opracowania leku (zob. leczenie eksperymentalne COVID-19): temat Muticenter, Adaptive, Randomized Blinded Controlled Trial of the Safety and Efficacy of Investigational Therapeutics for the Treatment of COVID-19 in Hospitalized Adults, data rozpoczęcia: 21 stycznia 2020, przewidywana data zakończenia: 1 kwietnia 2023[74].
Randomizowane kontrolowane badania są wykonywane poza medycyną w wielu dziedzinach nauki, np. w edukacji[100], kryminologii[101] i innych.
Programy RCT realizują liczni specjaliści polscy, m.in. uczestniczący w międzynarodowych badaniach wieloośrodkowych (np. prace zespołów Uniwersyteckiego Centrum Klinicznego im. prof. K. Gibińskiego w Katowicach[102], Uniwersytetu Medycznego w Łodzi[103], Wojskowego Instytutu Medycznego w Warszawie[104]).
Popularyzacja RCT
[edytuj | edytuj kod]Prawidłowe wykonywanie eksperymentów klinicznych (m.in. RCT[34]) oraz poprawne wykorzystanie ich wyników wymaga opanowania wiedzy wykraczającej poza ramy specjalności medycznych. Przygotowanie kadry wykonawców projektów badawczych odbywa się m.in. w ramach podyplomowych studiów o charakterze interdyscyplinarnym (medycyna, mikrobiologia, farmakologia, statystyka, socjologia, etyka, systemy opieki zdrowotnej, zarządzanie projektami i in.). Są powadzone przez specjalistów[k] z wykorzystaniem bogatego piśmiennictwa[l][5][105][55]. Wysoko ocenianą pozycją jest książka A.R. Jadada pt. Randomised Controlled Trials: A User’s Guide (wyd. 2. Randomised Controlled Trials: Questions, Answers and Musings, A.R. Jadad i M.W. Enkin)[106][107].
Przebieg badań i ich wyniki żywo interesują wielu ludzi spoza środowiska medycznego: pacjentów-uczestników badań i ich rodziny, innych chorych, oczekujących na skuteczniejsze kuracje, przedstawicieli firm farmaceutycznych, osoby zarządzające systemami ochrony zdrowia i innych, którym brakuje fachowej wiedzy. Powszechny brak zrozumienia istoty statystyki sprawia, że informacje o jednostkowych przypadkach szkodliwości testowanej terapii wywołują niewspółmierne reakcje, np. wycofywanie się z udziału w badaniach lub kwestionowanie ich wyników. Bywa to źródłem takich zjawisk, jak „kontrowersja szczepionkowa” (zob. też „antyszczepionkowcy”). Metodą przeciwdziałania podobnym zjawiskom jest powszechna edukacja, m.in. pogłębianie świadomości, że testy nie zawsze dostarczają zupełnie jednoznacznych dowodów skuteczności i bezpieczeństwa nowej terapii dla poszczególnych osób tworzących grupę uczestników[9], np. z powodu występowania obok głównej choroby trudnych do rozpoznania chorób współistniejących[108] i innych nieprzewidywalnych czynników.
Starania o szeroką popularyzację podstawowej wiedzy nt. badań klinicznych prowadzi w Polsce Stowarzyszenie na Rzecz Dobrej Praktyki Badań Klinicznych[109] (zob. GCP, ang. Good clinical practice). Europejskie Centrum Informacji ds. Konieczności Rozwoju Świadomości Badań (European Communication on Research Awareness Needs) zabiega o wprowadzenie tematyki badań klinicznych do programów edukacji w szkołach państw Unii Europejskiej[110]. W trzech krajach przeprowadzono m.in. próbne szkolenia, polegające na udziale w fikcyjnym teście RCT (sprawdzeniu hipotezy, że czerwone cukierki (grupa eksperymentalna) dają więcej szczęścia niż żółte (grupa porównawcza) i na opracowaniu zgromadzonych danych[111]. Na internetowej platformie ECRAN-u są dostępne materiały, opracowane w różnych językach europejskich i w formie przystępnej dla dzieci i młodzieży, m.in. materiały audio, wideo, kreskówki i in.)[112] oraz książka Testing Treatments (wyd. 2006 i 2011, opracowanie James Lind Initiative, nadzór Iain Chalmers), udostępniana na Testing Treatments interactive[113].
Zobacz też
[edytuj | edytuj kod]Uwagi
[edytuj | edytuj kod]- ↑ Skrót RCT bywa stosowany w piśmiennictwie medycznym w znaczeniu „randomized clinical trial” lub „randomized comparative trial” (zob. hasło ang. „Randomized controlled trial”). Oba pojęcia nie odpowiadają sobie, ponieważ nie wszystkie badania kliniczne, w których istotna jest randomizacja („randomized trial”), są wykonywane z udziałem grupy kontrolnej jako badania porównawcze (controlled trials).
- ↑ Część historyków medycyny wskazuje wcześniejsze początki porównawczych badań klinicznych, co ilustrują poniższe przykłady.
- Opis eksperymentu z VI wieku p.n.e., przypominającego współczesne eksperymenty kliniczne, znalazł się m.in. w biblijnej Księdze Daniela[125][126]. W czasie eksperymentu, trwającego 10 dni, dwie grupy uczestników otrzymywały różne posiłki: grupa 1 – posiłek królewski: mięso i wino; grupa 2 (Daniel i trzech jego przyjaciół) – warzywa i wodę. Eksperyment przeprowadzono w czasie zbliżonym do okresu życia i działalności Hipokratesa, któremu nadano miano ojca medycyny[127].
- Z punktu widzenia współczesnych medycznych badań statystycznych szczególnie dużą rolę odegrał Roger Bacon (ok. 1214–1292), empirysta, pionier stosowania metody naukowej w Europie[128], opisujący kontrolowany eksperyment jako sposób zdobywania wiedzy[125].
- ↑ Długa historia nękających ludzkość epidemii wiąże się z historią medycyny (zob. np. medycyna starożytnego Egiptu i plagi egipskie, Hipokrates – ojciec medycyny). Za ojca bakteriologii i wirusologii jest uważany Louis Pasteur (1822–1895), twórca pierwszej szczepionki ochronnej dla ludzi (ochrona przed wściekliną). Historia walki z wielkimi epidemiami XX wieku jest związana z historią szczepień i poszukiwań nowych szczepionek i leków, wymagających udoskonalania metod badań klinicznych[59].
- ↑ Sekretariat WMA działał do 1974 roku w Nowym Jorku (przy ONZ), a w następnych latach w Ferney-Voltaire (Francja)[39] w pobliżu Genewy (przy WHO).
- ↑ Stosowane są np. kwestionariusze health-related quality of life (HRQoL). Zmiany HRQoL (kwestionariusz EORTC QLQ-C30) określano np. w czasie międzynarodowych randomizowanych badań skuteczności leków w onkologii[122], np. pazopanibu (celowany lek przeciwnowotworowy), porównywanej z placebo. W badaniach uczestniczyło 369 pacjentów z mięsakiem w stadium zaawansowanym. Potwierdzono, że stosowanie leku wyraźnie zwiększa czas przeżycia bez progresji (PFS, ang. progression-free survival), nie powodując istotnej zmiany HRQoL[123]. Jednym z ośrodków, w których prowadzono badania, było Centrum Onkologii – Instytut im. Marii Skłodowskiej-Curie[123]
- ↑ Archibald Cochrane – „the father of evidence-based medicine”[124]
- ↑ Jakość badań jest określana często z użyciem skali Jadada (tzw. „oksfordzki system oceny jakości”[121]).
- ↑ Jeden z przykładów, ilustrujących znaczenie problemu wyboru właściwych miar "skuteczności terapii" przedstawił Krzysztof Lewandowski w artykule pt. Zależność między wynikami terapii a przyjętymi kryteriami oceny czasu przeżycia wolnego od progresji choroby i czasu wolnego od zdarzeń – analiza na podstawie wyników stosowania inhibitorów kinazy tyrozynowej u chorych na przewlekłą białaczkę szpikową. W pracy przeanalizowano 71 aplikacji z lat 1990–2002, dotyczących wprowadzania nowych leków przeciwnowotworowych (Hematologia 2011)[119]. Analogiczne wymagania, dotyczące metodyki RCT, są stawiane wszystkim legalizowanym interwencjom medycznym, w tym np. takim, których głównym efektem jest poprawa dobrostanu subiektywnego. Przykładem takich badań są m.in. analizy skuteczności terapii „kąpielami leśnymi” (jap. shinrin-yoku)[120].
- ↑ Analizowano opisy RCT opublikowane w latach 1995, 2000, 2005 i 2010 (pierwszy kwartał) w pięciu medycznych czasopismach ogólnych o najwyższym IF (BMJ, CMAJ, JAMA, Lancet i NEJM) oraz pięciu czasopismach specjalistycznych (American Journal of Respiratory and Critical Care Medicine, JAMA Psychiatry, Circulation, Diabetes i Journal of Clinical Oncology).
- ↑ zob. też contract research organization
- ↑ Autorami pracy Elementy oceny organizacji i wyników badań klinicznych (Centrum Medyczne Kształcenia Podyplomowego, Warszawa 2011) są m.in.: Maciej Chwaliński – onkolog[114], Janusz Kabata – specjalista w dziedzinie diagnostyki laboratoryjnej[115][116], Michał Dąbrowski – lekarz działający w Centrum Medycznym międzynarodowej sieci Synexus, Wojciech Masełbas – neurolog[117], prezes Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce[118].
- ↑ Kursy są prowadzone np. w Centrum Medycznym Kształcenia Podyplomowego w Warszawie. Wydano ogólnodostępne materiały pt. „Elementy oceny organizacji i wyników badań klinicznych” (Warszawa 2011)[57]; Spis treści: I. Michał Jakubczyk, Maciej Niewada, Wprowadzenie ; II. Wojciech Masełbas, Eksperymentalne i nieeksperymentalne metody oceny interwencji medycznych ; III. Wojciech Masełbas, Metodyka prowadzenia badania klinicznego ; IV. Wojciech Masełbas, Wpływ założeń statystycznych na plan badania klinicznego ; V. Maciej Niewada, Ocena metodologicznej jakości badania klinicznego wybrane aspekty; VI. Michał Jakubczyk, Statystyka opisowa i wnioskowanie statystyczne; podstawy; VII. Michał Jakubczyk, Tabele 2×2 i miary EBM; VIII. Łukasz Borowiec, Najczęściej wykorzystywane testy statystyczne; IX. Łukasz Borowiec, Analizy korelacji i analizy wieloczynnikowe; X. Michał Jakubczyk, Analiza przeżycia.
Przypisy
[edytuj | edytuj kod]- ↑ a b c d Kenneth F. Schulz, Douglas G. Altman, David Moher for the CONSORT Group. CONSORT 2010 Statement: updated guidelines for reporting parallel group randomised trials. „The BMJ (Research Methods & Reporting)”. 340 (7748), 24 March 2010. BMJ Group. DOI: 10.1136/bmj.c332. ISSN 0959-8138. (ang.).; w języku polskim: Instrukcja (deklaracja) CONSORT 2010: zaktualizowane wytyczne dla raportów opisujących randomizowane badania kliniczne z grupą kontrolną
- ↑ Randomised controlled trial. [w:] NICE glossary [on-line]. National Institute for Health and Care Excellence (NICE). [dostęp 2019-11-24]. (ang.).
- ↑ William C. Shiel Jr., MD, FACP, FACR: Medical Definition of Randomized controlled trial. [w:] MedicineNet > MedTerms Medical Dictionary [on-line]. MedicineNet, Inc.. [dostęp 2019-11-24]. (ang.).
- ↑ Randomized controlled trial (RCT). [w:] Strona internetowa UNICEF Office of Research - Innocenti; For every child [on-line]. unicef.org. [dostęp 2019-11-24]. (ang.).
- ↑ a b Christopher Bulpitt: Randomised Controlled Clinical Trials. Martinus Nijhoff Publishers, 1983, s. 262 ss. ISBN 90-247-2749-9.; osiem wydań w 1983–2012 (wersje uzupełnione)
- ↑ Analizy badań klinicznych. [w:] Polski Instytut Evidence Based Medicine (PI-EBM) [on-line]. PI-EBM. [dostęp 2020-01-18].
- ↑ R. Jaeschke, D.J. Cook, G.H. Guyatt: EBM - język i koncepcje. [w:] Polski Instytut Evidence Based Medicine (Medycyna Praktyczna 1998-2000) [on-line]. PI-EBM. [dostęp 2020-01-18].
- ↑ A. Anglemyer, H.T. Horvath, L. Bero. Healthcare outcomes assessed with observational study designs compared with those assessed in randomized trials. „Cochrane Database Syst Rev”, 2014 Apr 29. DOI: 10.1002/14651858.MR000034.pub2. PMID: 24782322. (ang.).; zob. Cochrane Collaboration
- ↑ a b Stephen G. West i inni, Alternatives to the Randomized Controlled Trial, „Am J Public Health”, 8, 98, American Public Health Association, 2008, s. 1359–1366, DOI: 10.2105/AJPH.2007.124446, ISSN 0090-0036, PMID: 18556609, PMCID: PMC2446460 (ang.).
- ↑ Andrew Anglemyer, Hacsi T Horvath, Lisa Bero: Healthcare outcomes assessed with observational study designs compared with those assessed in randomized trials. [w:] Cochrane Systematic Review - Methodology [on-line]. 29 April 2014. [dostęp 2020-04-07]. (ang.).
- ↑ Fair tests of treatments. What are fair tests? Why do we need fair tests of treatments?. [w:] James Lind Library; Illustrating the development of fair tests of treatments in health care [on-line]. James Lind Initiative, the Royal College of Physicians of Edinburgh and Minervation Ltd. [dostęp 2019-11-29]. (ang.).
- ↑ a b Sutton G: James Lind aboard Salisbury (JLL Bulletin: Commentaries on the history of treatment evaluation). 2004. [dostęp 2019-11-27]. (ang.).
- ↑ James Lind (1716–1794). [w:] BBC History [on-line]. [dostęp 2019-11-25]. (ang.).
- ↑ Żegluj z Jamesem Lindem!. [w:] ECRAN Project [on-line]. Europejskie Centrum Informacji ds. Konieczności Rozwoju Świadomości Badań (European Communication on Research Awareness Needs). [dostęp 2019-11-25].
- ↑ James Lind Library. James Lind Initiative, the Royal College of Physicians of Edinburgh and Minervation Ltd. [dostęp 2019-11-25].
- ↑ Kenneth J. Carpenter: The History of Scurvy and Vitamin C. Cambridge University Press, 29 kwi 1988, s. 300. ISBN 0-521-34773-4.
- ↑ Eric Martini. How Did Vasco Da Gama Sail for 16 Weeks Without Developing Scurvy?. „Lancet”. 361 (9367), s. 1480, 2003 Apr 26. DOI: 10.1016/S0140-6736(03)13131-5. ISSN 1605-1676. (ang.).
- ↑ Iain Chalmers. Why the 1948 MRC trial of streptomycin used treatment allocation based on random numbers. „Journal of the Royal Society of Medicine”. 104 (9), s. 383–386, 2011 Sep. Sage Publications (United Kingdom). DOI: 10.1258/jrsm.2011.11k023. (ang.).
- ↑ Maciej Chwaliński. Kontrolowane badania kliniczne, możliwości i potencjalne błędy. „Nowa Medycyna”, s. 59–62, 1999. Wydawnictwo Medyczne Borgis. ISSN 1233-5991.
- ↑ Selman A. Waksman; Facts. [w:] nobelprize.org [on-line]. [dostęp 2019-11-26]. (ang.).
- ↑ a b Peter Armitage. Fisher, Bradford Hill, and randomization. „International Journal of Epidemiology”. 82 (6), s. 925–928, 1 December 2003. Oxford University Press. DOI: 10.1093/ije/dyg286. ISSN 0300-5771. (ang.).
- ↑ Sir Austin Bradford Hill. Memories of the British streptomycin trial in tuberculosis: The first randomized clinical trial. „Controlled Clinical Trials”. 11 (2), s. 77–79, April 1990. Elsevier. DOI: 10.1016/0197-2456(90)90001-I. ISSN 0197-2456. (ang.).
- ↑ J. J. O'Connor, E. F. Robertson: Sir Ronald Aylmer Fisher. [w:] MacTutor History of Mathematics archive > Biographies [on-line]. School of Mathematics and Statistics University of St Andrews, Scotland JOC/EFR. [dostęp 2019-12-21]. (ang.).
- ↑ Introduction. W: R A Fisher: Statistical Methods for Research Workers. Edinburgh: Oliver and Boyd, 1925, seria: Biological Monographs and Manuals Series.
- ↑ History of Statistics. W: R A Fisher: Statistical Methods for Research Workers. Edinburgh: Oliver and Boyd, 1925, seria: Biological Monographs and Manuals Series.
- ↑ Austin Bradford Hill, The Environment and Disease: Association or Causation?, „Proc R Soc Med”, 58 (5), 1965, s. 295–300, PMID: 14283879, PMCID: PMC1898525.
- ↑ Carl V. Phillips, Karel J. Goodman (University of Texas School of Public Health), The missed lessons of Sir Austin Bradford Hill, „Epidemiologic perspectives & innovations”, 1:3, BioMed Central, 2004, DOI: 10.1186/1742-5573-1-3, ISSN 1742-5573, PMID: 15507128, PMCID: PMC524370 (ang.).
- ↑ Jeremy Howick, Paul Glasziou, Jeffrey K Aronson, The evolution of evidence hierarchies: what can Bradford Hill's ‘guidelines for causation’ contribute?, „Journal of the Royal Society of Medicine (J R Soc Med)”, 102 (5), Sage Publications (United Kingdom), 2009, s. 186–194, DOI: 10.1258/jrsm.2009.090020, PMID: 19417051, PMCID: PMC2677430 (ang.).
- ↑ D.L. Weed, Analogy in causal inference: rethinking Austin Bradford Hill's neglected consideration, „Annals of Epidemiology”, 5, 28, Elsevier, 2018, s. 343-346, DOI: 10.1016/j.annepidem.2018.03.004, ISSN 1047-2797, PMID: 29609873 (ang.).
- ↑ Jeremy Howick, Paul Kelly, Mike Kelly, Establishing a causal link between social relationships and health using the Bradford Hill Guidelines, „SSM - Population Health”, 8: 100402, 2019, DOI: 10.1016/j.ssmph.2019.100402, ISSN 2352-8273, PMID: 31193417, PMCID: PMC6527915 (ang.).
- ↑ Charles Sanders Peirce & Joseph Jastrow (Memoirs of the National Academy of Sciences, 3, 73-83): On Small Differences in Sensation. [w:] Classics in the History of Psychology [on-line]. York University, Toronto, Ontario, 1885. [dostęp 2019-12-04]. ISSN 1492-3713. (ang.).
- ↑ Archie L. Cochrane: Effectiveness & Efficiency: Random Reflections on Health Services. The Nuffield Provintial Hospitals Trust, 1972, s. 92.
- ↑ Twenty top papers to mark The BMJ’s two digital decades. [w:] The BMJ; "The scandal of poor medical research" comes first in top papers poll [on-line]. BMJ Publishing Group Ltd. [dostęp 2020-02-29]. (ang.).
- ↑ a b c 'Randomized controlled trial' Sorted by: Best match, 659,378 results. [w:] PubMed [on-line]. National Center for Biotechnology Information. [dostęp 2020-04-08]. (ponad 18600 prac z 2019 roku)
- ↑ a b Number of registered clinical trials per year. [w:] International Clinical Trials Registry Platform; ICTRP Search Portal Statistics [on-line]. World Health Organization (WHO). [dostęp 2020-03-23]. (ang.).
- ↑ Laura E. Bothwell, Jeremy A Green, Scott H. Podolsky, David S. Jones. Assessing the Gold Standard — Lessons from the History of RCTs. „New England Journal of Medicine”. 374 (22), s. 2175–2181, June 2016. Massachusetts Medical Society. ISSN 0028-4793. (ang.).
- ↑ Laura E. Bothwell, Scott H. Podolsky. The Emergence of the Randomized, Controlled Trial. „New England Journal of Medicine”. 375 (6), s. 501–504, August 2016. Massachusetts Medical Society. DOI: 10.1056/NEJMp1604635. ISSN 0028-4793. (ang.).
- ↑ Robert William Sanson-Fisher, Billie Bonevski, Lawrence W. Green, Cate D’Este. Limitations of the Randomized Controlled Trial in Evaluating Population-Based Health Interventions. „American Journal of Preventive Medicine (AJPM)”. 33 (2), s. 155-161, August 01, 2007. Elsevier. DOI: 10.1016/j.amepre.2007.04.007. ISSN 0749-3797. (ang.).
- ↑ a b The World Medical Association (13, ch. du Levant CIB – Bâtiment A 01210 Ferney-Voltaire France). [w:] WMA > sitemap [on-line]. The World Medical Association, Inc.. [dostęp 2020-01-17].
- ↑ World Medical Association. World Medical Association Declaration of Helsinki Ethical Principles for Medical Research Involving Human Subjects. „Journal of the American Medical Association (JAMA)”. 310 (20), s. 2191–2194, November 27, 2013. DOI: 10.1001/jama.2013.281053. (ang.).
- ↑ International Standards for Clinical Trial Registries; 1.Clinical trials as topic - standards. 2.Registries – standards. World Health Organization WHO Press, 2012, s. 1–48. ISBN 978-92-4-150429-4.
- ↑ Ministerial Summit on Health Research, Mexico City, 16-20 November 2004; Report by the Secretariat. [w:] The Fifty-eighth World Health Assembly; Provisional agenda item 13.18; A58/22 [on-line]. World Health Organization, Geneva, 18 April 2005. [dostęp 2020-01-06]. (ang.).
- ↑ About ICMJE. [w:] Strona internetowa International Committee of Medical Journal Editors [on-line]. ICMJE. [dostęp 2020-03-18]. (ang.).
- ↑ Journals stating that they follow the ICMJE Recommendations. [w:] Strona internetowa ICMJE (International Committee of Medical Journal Editor) [on-line]. ICMJE. [dostęp 2019-12-31]. (ang.).
- ↑ Catherine De Angelis, Jeffrey M. Drazen, Frank A. Frizelle, Charlotte Haug, John Hoey, Richard Horton, Sheldon Kotzin i in.. Clinical Trial Registration: A Statement from the International Committee of Medical Journal Editors. „The New England Journal of Medicine (N Engl J Med)”, s. 1250–1251, September 16, 2004. DOI: 10.1056/NEJMe048225. ISSN 0028-4793. (ang.).
- ↑ Clinical Trials. [w:] Home > Recommendations > Browse > Publishing & Editorial Issues > Clinical Trials [on-line]. International Committee of Medical Journal Editors. [dostęp 2020-01-06]. (ang.).
- ↑ a b Welcome to the WHO ICTRP. [w:] International Clinical Trials Registry Platform (ICTRP) [on-line]. World Health Organization. [dostęp 2019-12-29].
- ↑ Davina Ghersi (IER/RPC) and Lisa Askie (Australian and New Zealand Clinical Trial Registry): International Standards for Clinical Trial Registries (WHO International Clinical Trials Registry Platform). Geneva: World Health Organization, 2012, s. 1–48. ISBN 978-92-4-150-429-4.
- ↑ Vasee S. Moorthy, Ghassan Karam, Kirsten S. Vannice, Marie-Paule Kieny. Rationale for WHO's New Position Calling for Prompt Reporting and Public Disclosure of Interventional Clinical Trial Results. „PLOS Medicine”, April 14, 2015. DOI: 10.1371/journal.pmed.1001819. (ang.).
- ↑ Larissa Shamseer, Douglas G. Altman, Laura Weeks, Jodi Peters, Thilo Kober, Sofia Dias, Kenneth F. Schulz, Amy C. Plint, David Moher: Consolidated standards of reporting trials (CONSORT) and the completeness of reporting of randomised controlled trials (RCTs) published in medical journals. [w:] Cochrane Database of Systematic Reviews [on-line]. The Cochrane Collaboration, John Wiley & Sons, Ltd., 14 November 2012. [dostęp 2020-01-11]. (ang.).
- ↑ a b c d M. To i inni, Are reports of randomized controlled trials improving over time?' A systematic review of 284 articles published in high-impact general and specialized medical journals, „PLoS One”, 8 (12), 2013, e84779, DOI: 10.1371/journal.pone.0084779, PMID: 24391973, PMCID: PMC3877340.
- ↑ a b Alejandro R. Jadad, Matthew J. To, Mohamed Emara, Jennifer Jones. Consideration of Multiple Chronic Diseases in Randomized Controlled Trials. „JAMA”. 24 (306), s. 2670–2672, December 28, 2011. jamanetwork.com. DOI: 10.1001/jama.2011.1886. (ang.).
- ↑ a b Jadad A.R., Cabrera A., Martos F., Smith R., Lyons R.F.: When people live with multiple chronic diseases: a collaborative approach to an emerging global challenge (es: Cuando las personas viven con múltiples enfermedades crónicas: aproximación colaborativa hacia un reto global emergente). [w:] Strona internetowa OPIMEC [on-line]. Granada: Andalusian School of Public Health, 2011. [dostęp 2020-02-12]. (ang.).
- ↑ Stephanie Glen: Cohen’s D: Definition, Examples, Formulas. [w:] Statistics How To [on-line]. Statistics How To, October 15, 2016. [dostęp 2019-12-18]. (ang.).
- ↑ a b c Łukasz Budzicz: Krótki przewodnik po tym jak interpretować dane statystyczne w artykułach empirycznych. [w:] Skrypt AMU [on-line]. lbudzicz.home.amu.du.pl. [dostęp 2019-12-15].
- ↑ a b Amar Bhide, Prakesh S. Shah, Ganesh Acharya. A simplified guide to randomized controlled trials. „Acta Obstetricia et Gynecologica Scandinavica”, s. 380–386, 27 stycznia 2018. Nordic Federation of Societies of Obstetrics and Gynecology. DOI: 10.1111/aogs.13309. (ang.).
- ↑ a b c d e f g h i j k l m n o p Michał Jakubczyk, Maciej Niewada, Wojciech Masełbas, Łukasz Borowiec: Elementy oceny organizacji i wyników badań klinicznych. Warszawa: Centrum Medyczne Kształcenia Podyplomowego, 2011, s. 127 ss. ISBN 978-83-62110-29-2.
- ↑ Biblioteka Cochrane (The Cochrane Library). [w:] Cochran Polska; Wiarygodne dane naukowe. Świadome decyzje. Lepsze zdrowie. [on-line]. [dostęp 2020-03-30].
- ↑ a b c Ernest Kuchar: Jak się bada skuteczność szczepionek?. [w:] Szczepienia.pzh.gov.pl [on-line]. PZH, 2020. [dostęp 2020-04-16].
- ↑ Rejestracja nowego badania klinicznego produktu leczniczego. Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 31 marca 2016. [dostęp 2019-12-10].
- ↑ Wynik dla 'Randomized controlled trial '. [w:] Wyszukiwarka PubMed [on-line]. NLM. [dostęp 2019-12-03]. (ang.).
- ↑ WHO Trial Registration Data Set (Version 1.3.1). [w:] International Clinical Trials Registry Platform (ICTRP) > WHO Data Set [on-line]. WHO. [dostęp 2020-04-11]. (ang.).
- ↑ J. Martin Bland, Cluster randomised trials in the medical literature: two bibliometric surveys, „BMC Med Res Methodol”, 21, 4, Springer Nature, 2004, DOI: 10.1186/1471-2288-4-21, PMID: 15310402, PMCID: PMC515302 (ang.).
- ↑ Marion K. Campbell, Diana R. Elbourne, Douglas G. Altman, CONSORT statement: extension to cluster randomised trials, „The BMJ”, 328 (7441), 2004, s. 702-8, DOI: 10.1136/bmj.328.7441.702, PMID: 15031246, PMCID: PMC381234 (ang.).
- ↑ George C. Patton i inni, Promoting Social Inclusion in Schools: A Group-Randomized Trial of Effects on Student Health Risk Behavior and Well-Being, „Am J Public Health”, 96 (9), 2006, s. 1582–1587, DOI: 10.2105/AJPH.2004.047399, PMID: 16873760, PMCID: PMC1551970 (ang.).
- ↑ Marian Płaszczyca: Metoda k-średnich. [w:] Statystyka od A do Z – internetowa baza wiedzy z zakresu statystyki, ekonometrii i data mining [on-line]. BioStat sp. z o.o.. [dostęp 2019-12-21].
- ↑ Grayling M.J., Wason J.M., Mander A.P., Stepped wedge cluster randomized controlled trial designs: a review of reporting quality and design features, „Trials”, 1:33, 18, BioMed Central, 2017, DOI: 10.1186/s13063-017-1783-0, ISSN 1745-6215, PMID: 28109321, PMCID: PMC5251280 (ang.).
- ↑ Jijia Wang, Song Zhang, Chul Ahn, Sample Size Calculation for Count Outcomes in Cluster Randomization Trials with Varying Cluster Sizes, „Commun Stat Theory Methods”, 1, 49, Taylor & Fracis, 2020, s. 116–124, DOI: 10.1080/03610926.2018.1532004, ISSN 0361-0926, PMID: 31768088, PMCID: PMC6876624 (ang.).
- ↑ Alan A Montgomery, Tim J Peters, Paul Little, 14633287 Design, analysis and presentation of factorial randomised controlled trials, „BMC Med Res Methodol”, 3, 2003, s. 26, DOI: 10.1186/1471-2288-3-26, PMID: 14633287, PMCID: PMC305359.
- ↑ Eduardo Hariton, Joseph J. Locascio, Randomised controlled trials—the gold standard for effectiveness research, „BJOG: An International Journal of Obstetrics and Gynaecology”, Royal College of Obstetricians and Gynaecologists, 125 (13), 2018, s. 1776, DOI: 10.1111/1471-0528.15199, ISSN 1471-0528, PMID: 29916205, PMCID: PMC6235704 (ang.).
- ↑ a b c Sally Hopewell, Susan Dutton, Ly-Mee Yu, An-Wen Chan, Douglas G Altman. The quality of reports of randomised trials in 2000 and 2006: comparative study of articles indexed in PubMed. „The BMJ”, 24 March 2010. BMJ Group. DOI: 10.1136/bmj.c723. ISSN 0959-8138. (ang.).
- ↑ William F.Rosenberger, John M.Lachin. The use of response-adaptive designs in clinical trials. „Controlled Clinical Trials”. 14 (6), s. 471-484, December 1993. DOI: 10.1016/0197-2456(93)90028-C. ISSN 1551-7144. (ang.).
- ↑ Marcin Dudek: Randomizowane badania kliniczne (Randomized Clinical Trials). [w:] XI Polski Zjazd Filozoficzny [on-line]. Wydział Filozofii KUL, wrzesień 2019. [dostęp 2020-04-21].
- ↑ a b Adaptive COVID-19 Treatment Trial (ACTT). [dostęp 2020-04-19]. (ang.).
- ↑ wynik wyszukiwania "Sample size calculations for randomized clinical trials". [w:] PubMed [on-line]. US National Library of Medicine, National Institutes of Health. [dostęp 2019-12-17]. (ang.).
- ↑ Chow J.T.Y. i inni, Sample size calculations for randomized clinical trials published in anesthesiology journals: a comparison of 2010 versus 2016, „Canadian Journal of Anesthesia/Journal canadien d'anesthésie (Can J Anaesth)”, 6, 65, Canadian Anesthesiologists' Society, 2018, s. 611–618, DOI: 10.1007/s12630-018-1109-z, ISSN 0832-610X, PMID: 29569142 (ang.).
- ↑ Song Zhang, Jing Cao, Chul Ahn, Calculating sample size in trials using historical controls, „Clinical Trials (journal); Clin Trial”, 4, 7, SAGE Publications, 2010, s. 343–353, DOI: 10.1177/1740774510373629, ISSN 1740-7745, PMID: 20573638, PMCID: PMC3085081 (ang.).
- ↑ Copsey B. i inni, Sample size calculations are poorly conducted and reported in many randomized trials of hip and knee osteoarthritis: results of a systematic review, „Journal of Clinical Epidemiology (J Clin Epidemiol.)”, 104, Elsevier, 2018, s. 52–61, DOI: 10.1016/j.jclinepi.2018.08.013, ISSN 0895-4356, PMID: 30145325 (ang.).
- ↑ Judyta Borchet: Dobór próby badawczej i problemy z tym związane; Dobór próby badawczej. Metodolog.pl sp. z o.o.. [dostęp 2019-12-15]. (wielkość i siła efektu – podstawowe miary szacujące siłę związków i wpływów)
- ↑ 7.2.4.2. Sample sizes required. [w:] NIST/SEMATECH e-Handbook of Statistical Methods [on-line]. 2012. [dostęp 2019-12-15]. (ang.).
- ↑ Kryteria włączenia-wyłączenia pacjentów w badaniach klinicznych wymagają szczegółowej analizy - twierdza eksperci. [w:] Portal informacyjny e-badaniakliniczne.pl [on-line]. 2018-05-03. [dostęp 2020-04-05].
- ↑ Marissa J Carter i inni, Estimating the Applicability of Wound Care Randomized Controlled Trials to General Wound-Care Populations by Estimating the Percentage of Individuals Excluded From a Typical Wound-Care Population in Such Trials, „Adv Skin Wound Care”, 7, 22, 2009, s. 316–324, DOI: 10.1097/01.ASW.0000305486.06358.e0, PMID: 20375969 (ang.).
- ↑ Mark Zetin, Cara T. Hoepner, Relevance of Exclusion Criteria in Antidepressant Clinical Trials: A Replication Study, „Journal of Clinical Psychopharmacology”, 3, 27, 2007, s. 295-301, DOI: 10.1097/JCP.0b013e318058263f, ISSN 0271-0749, PMID: 17502778 (ang.).
- ↑ Hendrikje Huls i inni, Inclusion and Exclusion Criteria of Clinical Trials for Insomnia, „J Clin Med”, 8, 7, 2018, DOI: 10.3390/jcm7080206, PMID: 30096830, PMCID: PMC6111373 (ang.).
- ↑ Kryteria wykluczenia. [w:] EUPATI, Europejska Akademia Pacjentów [on-line]. [dostęp 2020-04-10].
- ↑ a b c Agnieszka Kukowska, Rafał Dziadziuszko, Jacek Jassem. Metody losowego przydziału leczenia w badaniach klinicznych; Methods of random treatment allocation in clinical trials. „Onkologia w Praktyce Klinicznej”. 1 (3), s. 151–156, 2005. Via Medica. ISSN 1734-3542.
- ↑ Bradley Efron. Forcing a Sequential Experiment to be Balanced. „Biometrika”. 58 (3), s. 403–417, Dec. 1971. Oxford University Press. (ang.).
- ↑ a b Jadad A.R. i inni, Assessing the quality of reports of randomized clinical trials: is blinding necessary?, „Contemporary Clinical Trials (Control Clin Trials)”, 1, 17, Elsevier, 1996, s. 1–12, ISSN 1551-7144, PMID: 8721797 (ang.).
- ↑ Saltaji H., Armijo-Olivo S., Cummings G.G., Amin M., da Costa B.R., Flores-Mir C.. Influence of blinding on treatment effect size estimate in randomized controlled trials of oral health interventions. „BMC Med Res Methodol”. 18 (1), s. 42, 2018 May 18. DOI: 10.1186/s12874-018-0491-0. PMID: 29776394. (ang.).
- ↑ Lennart Hansson, Thomas Hedner, BjÖRn Dahlöf. Prospective Randomized Open Blinded End-point (PROBE) study. „Blood Pressure”. 1 (2), s. 113-119, July 2009. DOI: 10.3109/08037059209077502. (ang.).
- ↑ David Moher, Sally Hopewell, Kenneth F. Schulz, Victor Montori, Peter C. Gøtzsche, P.J. Devereaux, Diana Elbourne, Matthias Egger, Douglas G. Altman, CONSORT Collaborators. CONSORT 2010 Explanation and Elaboration: Updated Guidelines for Reporting Parallel Group Randomised Trials. „International Journal of Surgery”. 10 (1), s. 28–55, 2012. Elsevier. ISSN 1743-9191. (ang.).
- ↑ Dr. Patrick Unterlerchner (Department of Research Policy & Cooperation WHO): Symposium on Translational Research for Innovative Infecti ous Disease Control: From the Laboratory to the Field. World Health Organization Geneva, Switzerland, May 30, 2005. [dostęp 2020-04-13]. (ang.).
- ↑ D Ghersi, M Clarke,b J Berlin,c AM Gülmezoglu,a R Kush,d P Lumbiganon,e D Moher, F Rockhold, I Simh, E Wageri. Reporting the findings of clinical trials: a discussion paper. „Bulletin of the World Health Organization > Perspectives”. 86 (6), s. 492–493, June 2008. (ang.).
- ↑ WHO Registry Criteria. [w:] International Clinical Trials Registry Platform (ICTRP) [on-line]. WHO. [dostęp 2020-04-17]. (ang.).
- ↑ Regional offices. [w:] WHO > About WHO > Who we are [on-line]. WHO. [dostęp 2020-04-17]. (ang.).
- ↑ WHO | ICTRP Search Portal Statistics [online], www.who.int [dostęp 2020-07-09] (ang.).
- ↑ a b Eun-Kyoung Choi, Mi-Jung Kim, Nam-Kyoo Lim, Hyun-Young Park. Review of the Registration in the Clinical Research Information Service. „J Korean Med Sci (JKMS)”. 31 (1), s. 1-8, 2016 Jan. The Korean Academy of Medical Sciences. DOI: 10.3346/jkms.2016.31.1.1. ISSN 1011-8934. PMID: 26770030. PMCID: PMCPMC4712566. (ang.).
- ↑ Neil K. Aaronson i inni, The European Organization for Research and Treatment of Cancer QLQ-C30: a quality-of-life instrument for use in international clinical trials in oncology, „Journal of the National Cancer Institute (J Natl Cancer Inst)”, 85 (5), Oxford University Press, 1993, s. 365–376, DOI: 10.1093/jnci/85.5.365, ISSN 0027-8874, PMID: 8433390 (ang.).
- ↑ Adele Krusche, Katherine Bradbury i in.. Renewed: Protocol for a randomised controlled trial of a digital intervention to support quality of life in cancer survivors. „BMJ Open”, 2019. DOI: 10.1136/bmjopen-2018-024862. ISSN 2044-6055. (ang.).
- ↑ Paul Connolly, Ciara Keenan, Karolina Urbanska: The Trials of Evidence-Based Practice in Education: A Systematic Review of Randomised Controlled Trials in Education Research 1980-2016. [w:] Research Portal Educational Research [on-line]. Queen's University Belfast, 09 Jul 2018. s. 16. [dostęp 2020-04-18]. (ang.).
- ↑ David P. Farrington, Brandon C. Welsh, Randomized experiments in criminology: What have we learned in the last two decades?, „Journal of Experimental Criminology”, 1, 2005, s. 9–38, DOI: 10.1007/s11292-004-6460-0 (ang.).
- ↑ Zespół ds. Badań Klinicznych: Badania Kliniczne > Lista realizowanych badań klinicznych. [w:] Strona internetowa Uniwersyteckiego Centrum Klinicznego im. prof. Kornela Gibińskiego SUM w Katowicach Badania kliniczne [on-line]. UCK. [dostęp 2020-04-18].
- ↑ Marcin Barylski, Małgorzata Górska-Ciebiada, Maciej Ciebiada. Przegląd randomizowanych, kontrolowanych badań klinicznych w grupie osób w wieku podeszłym. „Geriatria”, s. 182-186, 2013.
- ↑ Wykaz badań klinicznych produktów leczniczych/wyrobów medycznych prowadzonych w Wojskowym Instytucie Medycznym. [w:] Strona internetowa Wojskowego Instytutu Medycznego w Warszawie [on-line]. WIM, 2015. s. 1-6. [dostęp 2020-04-18].
- ↑ Tom Brody: Clinical Trials: Study Design, Endpoints and Biomarkers, Drug Safety, and FDA and ICH Guidelines. Academic Press, 2012, 2016. ISBN 978-0-12-804258-8.
- ↑ Alejandro R. Jadad: Randomised Controlled Trials: A User's Guide. BMJ Books, 1998, s. 123. ISBN 0-7279-1208-9.
- ↑ Alehandro R. Jadad, Murray W. Enkin: Randomized Controlled Trials: Questions, Answers and Musings. BMJ Books (2 edition), September 28, 2009, s. 160 ss. ISBN 978-1-4051-3266-4.
- ↑ Ruth O'Hara, Sherry A. Beaudreau, Christine E .Gould, Wendy Froehlich, Helena C. Kraemer. Handling clinical comorbidity in randomized clinical trials in psychiatry. „Journal of Psychiatric Research”. 86, s. 26–33, March 2017. Elsevier. ISSN 0022-3956. (ang.).
- ↑ Baza wiedzy > Akty prawne polskie. [w:] Strona internetowa Stowarzyszenia na Rzecz Dobrej Praktyki Badań Klinicznych w Polsce (Good Clinical Practice, GCP) [on-line]. [dostęp 2019-12-15].
- ↑ ECRAN Project. ECRAN Project. [dostęp 2020-01-01].
- ↑ Philip Baker, Daniel Francist, Abby Cathcar. A mock randomized controlled trial with audience response technology for teaching and learning epidemiology. „Asia-Pacific Journal of Public Health”. 29 (3), s. 229–240, 2017. Sage Publications. ISSN 1010-5395.
- ↑ Gra? Poważnie..?. [w:] ECRAN Project; This project has received funding from the European Union’s Seventh Framework [on-line]. EU Pub. [dostęp 2020-04-19].
- ↑ ' TTi ', ' T 'esting ' T 'reatments ' i 'nteractive; Promoting critical thinking about treatment claims. [dostęp 2020-04-19]. (ang.).
- ↑ Dr Maciej Chwaliński, [w:] baza „Ludzie nauki” portalu Nauka Polska (OPI PIB) [dostęp 2019-11-26].
- ↑ Dr Janusz Kabata, [w:] baza „Ludzie nauki” portalu Nauka Polska (OPI PIB) [dostęp 2019-12-15].
- ↑ Janusz Kabata: Pragmatyczne badania kliniczne. [w:] RD Badania Kliniczne [on-line]. [dostęp 2020-04-15].
- ↑ Dr Wojciech Masełbas, [w:] baza „Ludzie nauki” portalu Nauka Polska (OPI PIB) [dostęp 2019-12-15].
- ↑ Wojciech Masełbas: Randomizowane i podwójnie zaślepione… o co chodzi?. [w:] Serwis Zdrowie [on-line]. 17.07.2017. [dostęp 2019-12-15].
- ↑ Krzysztof Lewandowski. Zależność między wynikami terapii a przyjętymi kryteriami oceny czasu przeżycia wolnego od progresji choroby i czasu wolnego od zdarzeń — analiza na podstawie wyników stosowania inhibitorów kinazy tyrozynowej u chorych na przewlekłą białaczkę szpikową. „Hematologia”. 2 (2), s. 99104, 2011. ISSN 2081-0768.
- ↑ Byeongsang Oh, Kyung Ju Lee , Chris Zaslawski, Albert Yeung 5 , David Rosenthal , Linda Larkey, Michael Back. Health and Well-Being Benefits of Spending Time in Forests: Systematic Review. „Environ Health Prev Med”. 22 (1), s. 71, 2017 Oct 18. DOI: 10.1186/s12199-017-0677-9. (ang.).
- ↑ Olivo S.A. i inni, Scales to assess the quality of randomized controlled trials: a systematic review., „Physical Therapy (Phys Ther.)”, 2, 88, American Physical Therapy Asociation (United States), 2008, s. 156–175, DOI: 10.2522/ptj.20070147, ISSN 0031-9023, PMID: 18073267 (ang.).
- ↑ J.E. Dancey , L.E. Doddb, R. Fordc, R. Kapland, M. Mooneyb, L. Rubinsteinb, L.H. Schwartze, L. Shankarb, P. Therasse. Recommendations for the assessment of progression in randomised cancer treatment trials. „EJC European Journal of Cancer”. 45 (2), s. 281–289, January 2009. Elsevier Ltd.. DOI: 10.1016/j.ejca.2008.10.042. ISSN 0959-8049. (ang.).
- ↑ a b Coens C. i inni, Health-related quality-of-life results from PALETTE: A randomized, double-blind, phase 3 trial of pazopanib versus placebo in patients with soft tissue sarcoma whose disease has progressed during or after prior chemotherapy-a European Organization for research and treatment of cancer soft tissue and bone sarcoma group global network study (EORTC 62072), „Cancer”, 17, 121, Wiley-Blackwell for the American Cancer Society (United States), 2015, s. 2933–2941, DOI: 10.1002/cncr.29426, ISSN 0008-543X, PMID: 26033286 (ang.).
- ↑ Antonio Stavrou, Dimitrios Challoumas, Georgios Dimitrakakis, Archibald Cochrane (1909–1988): the father of evidence-based medicine, „Interact Cardiovasc Thorac Surg”, 1, 18, 2014, s. 121–124, DOI: 10.1093/icvts/ivt451, PMID: 24140816, PMCID: PMC3867052 (ang.).
- ↑ a b James William Treece, Jr: Daniel and the Classic Experimental Design. [w:] Strona internetowa Institute for Creation Research [on-line]. Inst. Creation Res., March 01, 1990. [dostęp 2019-11-28]. (ang.). (autor)
- ↑ 6th Century BC: Biblical Daniel’s Scientific Experiment. [w:] Strona internetowa Alliance for Human Research Protection (AHRP) [on-line]. AHRP. [dostęp 2019-11-28]. (ang.). (about AHRP)
- ↑ Hippocrates (5th century BCE). [w:] James Lind Library; Illustrating the development of fair tests of treatments in health care [on-line]. James Lind Initiative, the Royal College of Physicians of Edinburgh and Minervation Ltd. [dostęp 2019-11-29]. (ang.).
- ↑ Randall Noon: Introduction to Forensic Engineering. CRC Press, 1992. ISBN 0-8493-8102-9.