Borelioza
| borreliosis | |
 Rumień wędrujący | |
| Klasyfikacje | |
| ICD-10 |
A69 |
|---|---|
Borelioza, krętkowica kleszczowa, choroba z Lyme (łac. borreliosis, morbus Lyme) – wieloukładowa choroba zakaźna wywoływana przez bakterie należące do krętków. Najczęściej genogatunkami będącymi czynnikiem etiologicznym są: Borrelia burgdorferi sensu stricto, Borrelia garinii i Borrelia afzelii, przenoszona na człowieka i niektóre zwierzęta przez kleszcze z rodzaju Ixodes. Zakażenie człowieka następuje po ukłuciu i żerowaniu kleszcza w skórze. Rezerwuarem krętka są liczne gatunki zwierząt, głównie gryzonie.
Wczesne objawy choroby obejmują powstanie charakterystycznego rumienia cechującego się obwodowym szerzeniem się i centralnym ustępowaniem. Rumień wędrujący jest najczęstszym objawem wczesnej postaci boreliozy. Inne wczesne zmiany to rzadko występujący naciek limfocytarny skóry oraz objawy grypopodobne obejmujące gorączkę, ból głowy, osłabienie. Wczesne objawy ustępują w ciągu 3 miesięcy i u części chorych rozwija się postać wczesna rozsiana, która może przebiegać pod postacią zapalenia stawów lub neuroboreliozy albo (rzadziej) zapalenia mięśnia sercowego. Po wielu latach od zakażenia u części chorych dochodzi do zanikowego zapalenia skóry, przewlekłego zapalenia stawów, powikłań neurologicznych. Borelioza jest rozpoznawana na podstawie dodatnich testów serologicznych oraz występowaniem typowych objawów klinicznych. Zakażenie jest skutecznie leczone za pomocą antybiotyków z grupy penicylin, cefalosporyn oraz tetracyklin.
Etiologia[edytuj | edytuj kod]
Czynnik chorobotwórczy[edytuj | edytuj kod]
Borelioza w Europie jest wywoływana przez krętki (Spirochaeta) 3 gatunków z kompleksu gatunków (zawierającego co najmniej 18 blisko spokrewnionych gatunków[1]) Borrelia burgdorferi sensu lato (s.l.): Borrelia garinii, Borrelia afzelii, rzadziej przez Borrelia burgdorferi (Borrelia burgdorferi sensu stricto (s.s.)), która dominuje w Ameryce Północnej[2][3]. Istnieje prawdopodobieństwo, że więcej gatunków kompleksu gatunków Borrelia burgdorferi s.l. może wywoływać chorobę z Lyme[1].
Borrelia burgdorferi jest jednym z największych krętków – osiąga długość 10-30 µm i szerokość 1 µm[4]. Cechuje się znaczną ruchliwością dzięki obecności wici na całej długości komórki[5]. Jest bakterią Gram-ujemną, jednakowoż różni się od innych gram-ujemnych bakterii brakiem lipopolisacharydów na zewnętrznej błonie komórkowej[6]. Bakteria ta pokryta jest za to lipoproteinami Osp[6]. B. burgdorferi jest mikroaerofilem, a także pasożytem bezwzględnym, co oznacza że nie może przetrwać poza ciałem kleszcza lub gospodarza[5]. B. burgdorferi może również wytwarzać cysty w niesprzyjających warunkach środowiskowych[5].
Przenoszenie[edytuj | edytuj kod]

Rezerwuarem bakterii jest około 300[3] różnych gatunków ssaków (głównie gryzonie z rodziny nornikowatych i myszowatych; a także wolno żyjące jelenie, sarny i wilki) oraz niektóre gatunki ptaków[3][7] i jaszczurek[8]. Tylko niektóre zwierzęta pełnią równocześnie rolę żywicieli kleszcza i rezerwuaru krętków[3]. Bakterie są przenoszone głównie ze śliną kleszczy z rodzaju Ixodes (w Polsce głównie I. ricinus[3], ale także sporadycznie I.persulcatus czy I. trianguliceps[9]). B. burgdorferi s.l. była również wykrywana u licznych gatunków owadów jak np. pcheł, jednak nie ma dowodów, że te mogą być wektorami krętków[10]. Kleszcz zakaża się krętkiem poprzez żywienie się krwią zakażonych zwierząt. Kolejne stadia rozwojowe kleszcza zakażają swoich kolejnych żywicieli, powodując utrzymywanie się rezerwuaru zarazków w środowisku. 90% udokumentowanych przypadków boreliozy u ludzi nastąpiło w wyniku kontaktu z nimfami kleszczy[2]. Jest to spowodowane małym nosicielstwem krętków Borrelia przez larwy kleszcza, oraz większymi rozmiarami dorosłych osobników kleszczy, dzięki czemu mogą zostać łatwiej zauważone i usunięte zapobiegając tym samym przeniesieniu bakterii z kleszcza na człowieka[11]. Krętki Borrelii mogą być przenoszone trojako[5]:
- Poprzez żywienie się niezarażonego kleszcza na zarażonym kręgowcu. W tym przypadku krętki są pobierane przez kleszcza wraz z krwią ssaka i migrują do jelita pajęczaka, gdzie zwiększają ekspresję bakteryjnego białka OspA wiążacego się z nabłonkiem jelita poprzez receptor TROSPA (ang. tick receptor for OspA)
- Poprzez żywienie się zainfekowanego kleszcza na niezarażonym kręgowcu. Krew pobrana od kręgowca zmienia warunki środowiskowe panujące w jelicie kleszcza takie jak temperatura, pH czy poziom składników odżywczych. Zmiany te zwiększają ekspresję bakteryjnego białka OspC zarazem zmniejszając ekspresję OspA. Krętki migrują do gruczołów ślinowych kleszcza, gdzie OspC wiąże kleszczowe białko Salp15, wywołując immunosupresję. Z gruczołów ślinowych krętki przemieszczają się bezpośrednio do ciała kręgowca. W zależności m.in. od gatunku kleszcza cały proces trwa 18–48 godzin[12].
- Krętki Borrelia mogą również być przenoszone bezpośrednio między kleszczami. Krętki pozostają w miejscu wkłucia przez co najmniej kilka dni przed wniknięciem w głębsze tkanki kręgowca. W związku z tym kleszcze żywiące się w pobliżu miejsca wkłucia zarażonego kleszcza mogą pobrać krętka bezpośrednio z miejsca wkłucia. Opisywane były również tzw. transmisje transowarialne, kiedy to krętki były przenoszone z zainfekowanej samicy bezpośrednio na jej potomstwo.
Częstość występowania zakażonych kleszczy w różnych częściach Europy waha się od 3 do 34%[3]; w niektórych lesistych obszarach północno-wschodniej Polski sięga 25%[3]. Wyniki metaanalizy I. ricinus zebranych z 24 krajów europejskich wykazały, że B. burgdorferi s.l. jest przenoszona przez średnio 14% kleszczy (13% osobników zarażonych jest więcej niż jednym gatunkiem B. burgdorferi s. l.) Największy procent zakażonych kleszczy zaobserwowany został w Europie środkowej i północnej. Wykazano również regionalna zmienność w nosicielstwie poszczególnych gatunków B. burdgorferi s.l: w Europie północnej (m.in. w Norwegii) i środkowej (np. Niemcy) większy procent kleszczy zainfekowany był przez B. afzelii niż przez B. garinii. Odwrotny trend zaobserwowany został m.in. w Wielkiej Brytanii. Ponadto, nosicielstwo poszczególnych gatunków B. burgdorferi s. l: różniło się także pomiędzy stadiami rozwojowymi kleszcza – B. afzelii było bardziej rozpowszechnione u nimf, a B. garinii u osobników dorosłych[13].
| Gatunek B. burgdorferi sensu lato | Gatunki kleszcza będące wektorem | Rezerwuar zwierzęcy | Obszar występowania | Uwagi |
|---|---|---|---|---|
| Borrelia burgdorferi s.s. | Ixodes pacificus; I. ricinus; I. scapularis | ptaki, gryzonie | Europa, Ameryka Północna | |
| B. afzelii | I. persulcatus; I. ricinus | gryzonie, inne małe ssaki | Europa, Azja | |
| B. garinii | I. persulcatus; I. ricinus | ptaki, gryzonie | Europa, Azja | |
| B. lusitaniae | I. ricinus | gryzonie | Europa, Ameryka Północna, Północna Afryka | Niepotwierdzona chorobotwórczość |
| B. spielmanii | I. ricinus | gryzonie | Europa | Niepotwierdzona chorobotwórczość |
| B. valaisiana | I. ricinus, I. columnae | ptaki | Europa, Azja | Niepotwierdzona chorobotwórczość |
| B. bavariensis | I. ricinus | gryzonie | Europa | Niepotwierdzona chorobotwórczość |
| B. bissettii | I. ricinus, I. scapularis, I. pacificus | ptaki, gryzonie | Europa, Azja, Ameryka Północna | Niepotwierdzona chorobotwórczość |
| B. lusitaniae | I. ricinus | jaszczurki | Europa, Afryka Północna | Niepotwierdzona chorobotwórczość |
Wpływ czynników ekologicznych na rozprzestrzenianie się boreliozy[edytuj | edytuj kod]
Na przenoszenie krętków Borrelia wpływ ma aktywność oraz rozmiar populacji kleszczy Ixodes determinowane przez następujące czynniki ekologiczne:
- Mikroklimat – kleszcze Ixodes aktywne są przy temperaturze wyższej niż 4 °C oraz przy wilgotności względnej powyżej 80%[16][17]. Mikroklimat wpływa na populacje Ixodes bezpośrednio poprzez zwiększanie śmiertelności kleszczy oraz pośrednio wpływając na aktywność żywicieli. Zarówno niska, jak i wysoka temperatura negatywnie wpływają na przeżywalność kleszczy[12]. Zachodzące zmiany klimatu mogą znacząco wpłynąć na sezonową aktywność kleszczy przedłużając okres, w którym są one aktywne[12]
- Roślinność i gleba – na populacje kleszczy wpływ ma również roślinność, która przyciąga kręgowce będące źródłem pożywienia, oraz zapewnia schronienie i odpowiedni mikroklimat dla rozwoju kleszcza[5]. Rozmiar populacji Ixodes koreluje również z jakością gleby – ściółka zapewnia kleszczom kryjówkę, a także chroni je przed wysuszeniem[5]. W związku z powyższymi obszar występowania kleszczy może być zmieniany przez działalność ludzką taką jak fragmentacja ekosystemów leśnych, tworzenie parków miejskich, rozwój turystyki oraz tworzenie agrocenoz[12]. Dowiedziono, że w Polsce I. ricinus występuje nie tylko w lasach, ale także w miejskich parkach, skwerach oraz na szlakach turystycznych[15].
- Populacja żywicieli – na wielkość populacji kleszczy wpływ ma również liczba żywicieli kleszczy żyjących w danym ekosystemie. Dowiedziono, że siedliska z małą liczbą jeleniowatych mają mniejsze zagęszczenie kleszczy Ixodes oraz mniejsze ryzyko infekcji boreliozą niż te z proporcjonalnie większą populacją jeleniowatych[12]. Z drugiej strony natomiast usunięcie 70% jeleni z ekosystemu z dużą ilością tych zwierząt nie miało żadnego wpływu na populacje kleszczy, co sugeruje, że korelacja w wielkościach populacji kleszczy oraz żywicieli jest słabsza przy odpowiednio dużym zagęszczeniu konkretnych kręgowców[12]
Epidemiologia[edytuj | edytuj kod]
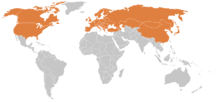
Borelioza jest najczęstszą chorobą odkleszczową[18][19][20]. Co roku co najmniej 86 000 osób jest diagnozowanych na boreliozę, z czego ok. 77% w Europie, 19% w Ameryce Północnej, 4% w Azji i <1% w Afryce[21]. Statystyki te są natomiast obarczone dość dużą niepewnością, gdyż nie we wszystkich krajach lekarze mają obowiązek zgłaszać do placówek zdrowia publicznego[5]. Rozkład zapadalności na boreliozę u różnych grup wiekowych jest dwumodalny – najwięcej przypadków odnotowanych jest w grupach wiekowych 5–9 lat, oraz 50-64[21]. Do ogólnych czynników ryzyka należą[22]:
- Spędzanie dużej ilości czasu w lasach i terenach trawiastych, w tym wykonywanie zawodu zmuszającego do częstego przebywania na zewnątrz; nosicielstwo wśród strażników leśnych może miejscami dochodzić do 71%[23].
- Nienależyte zasłanianie odsłoniętej skóry
- Zbyt późne wyciąganie kleszcza – wyciągnięcie kleszcza w ciągu dwóch dni od wkłucia znacznie zmniejsza ryzyko zachorowania na boreliozę
Borelioza ma status endemii w co najmniej 65 krajach[23]. Najwięcej zachorowań na boreliozę notuje się w północno-wschodnich stanach USA, w Europie Środkowej, Skandynawii i Rosji[3]. Są to obszary endemicznego występowania choroby związane z obszarem bytowania kleszczy Ixodes. Nie ma pewnych dowodów na występowanie w Australii B. burgdorferi ani jakichkolwiek innych krętków przenoszonych przez kleszcze, które mogłyby wywoływać lokalne postacie boreliozy[24].
Polska[edytuj | edytuj kod]
Pierwszy przypadek w Polsce został opisany w 1987 roku[23]. Większość nowych przypadków boreliozy jest notowana między 1 maja a 30 listopada[25], a 80% przypadków występuje w czerwcu i lipcu[25] w okresie żerowania mikroskopijnych, trudnych do zauważenia nimf kleszczy. W Polsce rejonem endemicznym jest północna część kraju (szczególnie województwo podlaskie, warmińsko-mazurskie, zachodniopomorskie)[3][26], choć w ostatnich latach szczególny wzrost zachorowań odnotowano w województwie śląskim i małopolskim[26]. Duża zapadalność na boreliozę w wymienionych województwach spowodowana jest faktem, że posiadają one proporcjonalnie większą niż w innych województwach ilość siedlisk zasiedlanych przez kleszcze[27]. W badaniu epidemiologicznym z 2004 roku, krętki borrelia wykryto u 60% leśników z okolic Lublina i Starachowic[28]. Populacje kleszczy z największym procentowym nosicielstwem krętków Borrelia odnotowane są w pobliżu Katowic (37%)[23][29], a z najmniejszym w okolicach Białegostoku (4,1%)[23]. W 2017 roku w Polsce roczna liczba zachorowań wynosiła 21 516, zapadalność 56 na 100 000. Największa zapadalność wystąpiła w województwie podlaskim 130,1 na 100 000 oraz małopolskim 98,1 na 100 000[30]. Dla porównania, 10 lat wcześniej (2007 rok) liczba zachorowań wyniosła 7735, a zapadalność 20 na 100 000[31]. Warto zauważyć, że zapadalność na boreliozę w Polsce może być zawyżona w związku z fałszywymi dodatnimi rozpoznaniami[32].
Europa[edytuj | edytuj kod]
Borelioza w Europie jest wywoływana przez krętki Borrelia garinii, Borrelia afzelii rzadziej przez Borrelia burgdorferi, która dominuje w Ameryce Północnej[2][3] i jest przenoszona przez kleszcze Ixodes ricinus[33]. Borelioza występuje w prawie każdym kraju Europy[34]. Najwięcej przypadków zachorowań występuje w Europie Środkowej, a znacznie mniej w Europie Południowej[35]. Zapadalność na boreliozę w Europie Zachodniej została oszacowana na 22,05 na 100 000 na rok.[23] Całkowita liczba przypadków (zgłaszanych i niezgłaszanych) może wynosić ponad 200 000 rocznie[36].
Ameryka Północna[edytuj | edytuj kod]
W USA najwięcej zachorowań występuje w 14 stanach centralnych i północno-wschodnich[37]. W całym kraju liczba potwierdzonych przypadków wzrosła o 300% między 1992 a 2015 rokiem[38]. Obecność kleszczy Ixodes została potwierdzona w 49% wszystkich hrabstw[38]. Obserwuje się około 7,9 zachorowań na 100 000 osób[39], jednak w stanach o największym rozpowszechnieniu choroby wynosi aż 31,6 przypadków na 100 000 osób[40]. W Kanadzie występuje w prowincjach: Ontario, Quebec, Manitoba, w północnej Nowej Szkocji i ograniczonych części Saskatchewanu i Albercie, a także Kolumbii Brytyjskiej[41][42].
Ameryka Południowa[edytuj | edytuj kod]
W Ameryce Południowej borelioza nie jest wykrywana[43]. Może to być spowodowane występowaniem endemicznych szczepów B. burgdorferi s. l., niewykrywanych przez tradycyjne testy serologiczne[43].
Azja[edytuj | edytuj kod]
Borelioza jest rozpoznawana w Japonii, północno-zachodnich Chinach oraz wschodnim obszarze Rosji[44][45].
Afryka[edytuj | edytuj kod]
W Afryce rozpoznano pojedyncze przypadki boreliozy w Maroku, Tunezji, Egipcie[23][46][47]. Borelioza może być również obecna w Republice Południowej Afryki[48].
Patomechanizm[edytuj | edytuj kod]

Borrelia dostaje się do organizmu w wyniku ukłucia kleszcza. Proces migracji z kleszcza do gospodarza w niektórych przypadkach trwa 17 godzin od wkłucia kleszcza[49], jednakowoż zazwyczaj najbardziej efektywna transmisja dokonuje się po 72 godzinach od wkłucia[50]. Ślina kleszcza zawiera składniki, które zakłócają reakcję odpornościową w miejscu ukłucia[51], co znacznie ułatwia infekcję. Białka immunosupresyjne w ślinie kleszcza zakłócają zarówno działanie odpowiedzi odpornościowej swoistej, jak i nieswoistej poprzez m.in.[52]:
- Blokowanie działania układu dopełniacza
- Wiązanie histaminy
- Osłabienie działania Komórek NK, komórek dendrytycznych, neutrofili
- Hamowanie produkcji cytokin takich jak IL-10, a także proliferacji Limfocytów T
Ponadto, ślina kleszcza zawiera również enzymy, substancje rozszerzające naczynia krwionośne i antykoagulanty, które spowalniają gojenie się rany powstałej po ukłuciu kleszcza[53]. W początkowych stadiach infekcji, krętki bytują głównie w skórze, gdzie dochodzi do lokalnego wzrostu populacji borrelii poprzedzającej rozprzestrzenianie się bakterii do bardziej odległych tkanek[54].
Odpowiedź zapalna na bakterie powoduje powstanie wczesnej zmiany skórnej (rumień wędrujący)[55]. Borrelia żyje wewnątrzkomórkowo oraz przekracza barierę krew-mózg, co stwarza pewne problemy w czasie leczenia (tylko niektóre antybiotyki penetrują barierę krew-mózg i tylko niektóre działają wewnątrzkomórkowo). W ciągu kilku tygodni po ukłuciu kleszcza krętki rozprzestrzeniają się za pośrednictwem krwi do odległych miejsc – stawów, serca, układu nerwowego. Nieleczona infekcja może być obecna przez wiele miesięcy lub nawet lat, mimo wytwarzania przeciwciał przeciw borrelii[56]. Krętki unikają odpowiedzi immunologicznej poprzez zmniejszanie ekspresji białek powierzchniowych (które są celem układu odpornościowego), zmienność antygenową powierzchniowego białka VlsE oraz inaktywację dopełniacza[57][58] – krętki borrelia są w stanie wiązać czynnik H (poprzez interakcję z bakteryjnym białkiem OspE)[59]. Dzięki obecności czynnika H, czynnik I rozcina dopełniacze C3b i C4b, tym samym dezaktywując działanie dopełniacza[59].
Borrelia zwykle usadawia się w tkance łącznej (skóra, ścięgna, ściany naczyń krwionośnych, w tym w naczyniach mózgowych), w mięśniach i w tkance nerwowej (w komórkach glejowych i nerwowych). Borrelia jest znajdowana w większych ilościach we wzgórzu, korzeniach grzbietowych rdzenia kręgowego[60]. Do rozprzestrzeniania się w tkankach gospodarza, krętki Borrelii wiążą i aktywują plazminogen, przekształcając go w plazminę, co prowadzi do reakcji enzymatycznych rozpuszczających błony komórkowe, tkanki łączne czy ścięgna i ułatwia penetrację tkanek przez bakterię[5].
Uszkodzenie ośrodkowego układu nerwowego prawdopodobnie jest wynikiem przylegania krętków do komórek glejowych[3]. Bakterie mogą indukować proliferację, a następnie apoptozę astrocytów[61], a także wydzielanie do komórek nerwowych cytokin IL-6 i TNF-α i kwasu chinolinowego[62][63] oraz innych substancji, które w nadmiarze stają się szkodliwe dla neuronów. Zmiany w układzie nerwowym powodowane przez boreliozę są na tyle charakterystyczne, że przez wiele lat występowały jako samodzielna jednostka chorobowa zwana zespołem Bannwartha. Istnieje hipoteza, że bakteria wytwarza toksynę bakteryjną odpowiedzialną za co najmniej część objawów choroby, takich jak zaburzenia pamięci, bezsenność oraz drętwienia kończyn i języka, oraz zaobserwowaną w tej chorobie reakcję Jarischa-Herxheimera[64]. Wprawdzie nie istnieje test wykrywający toksyny bakterii, ale pomimo to odkryto hemolityczną aktywność Borrelia burgdorferi[65], a w DNA borrelii odkryto fragment kodujący odmianę jadu kiełbasianego[66]. Wiadomo również, że ściana komórkowa bakterii zawiera toksyczny lipopolisacharyd oraz peptydoglikan, mający własności prozapalne[67].
W patogenezie postaci stawowej największą rolę odgrywa proces rozpoznawania białka OspA (białko powierzchniowe A, wiąże krętka z białkami obecnymi w jelicie kleszcza[2]) przez makrofagi[3]. Dochodzi do syntezy cytokin prozapalnych i tworzenia nacieków zapalnych, zawierających pobudzone komórki jednojądrzaste i fibroblasty. Odczyn zapalny powoduje proliferację błony maziowej, odkładanie się tkanki łącznej i w konsekwencji uszkodzenie stawu[3]. Zmiany histologiczne oraz obserwowane zaburzenia immunologiczne przypominają reumatoidalne zapalenie stawów. Dochodzi do nacieków złożonych z limfocytów T i plazmocytów, przerostu kosmków, a także tworzenia nowych naczyń krwionośnych[68].
Objawy kliniczne i przebieg[edytuj | edytuj kod]

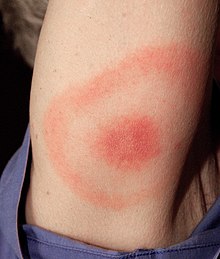

W ciągu od 1 do 3 tygodni od ukłucia pojawia się pojedynczy rumień wędrujący, który jest pierwszym objawem choroby. Charakterystyczne jest jego obwodowe szerzenie się i centralne ustępowanie. Niekiedy rumieniowi mogą towarzyszyć objawy grypopodobne. Rzadkim objawem jest ciemnoczerwony naciek limfocytarny, najczęściej na małżowinie usznej. Zarówno rumień, jak i objawy ogólnoustrojowe ustępują w ciągu 4–12 tygodni[20]. U części chorych objawy zakażenia ograniczonego mogą nie występować[3] lub pozostać niezauważone przez chorego. Wówczas w ciągu od kilku tygodni do kilku miesięcy choroba ujawnia się w postaci zakażenia uogólnionego (stadium wczesne rozsiane). Może przebiegać pod postacią zapalenia stawów lub neuroboreliozy albo (rzadziej) zapalenia mięśnia sercowego. Zapalenie stawów rozwija się u około 60% nieleczonych pacjentów[2][69]. Znacznie rzadziej rozwija się neuroborelioza, występuje u około 15% nieleczonych[2][70]. Najczęstszym powikłaniem neurologicznym jest porażenie nerwu twarzowego. Powikłania kardiologiczne są jeszcze rzadsze, dotyczą około 5% nieleczonych osób[2]. Rzadkie jest występowanie różnych postaci klinicznych u tego samego chorego[3]. Po wielu latach od zakażenia u pacjentów nieleczonych mogą rozwinąć się późne objawy boreliozy, które mogą doprowadzić do trwałego uszkodzenia układu nerwowego lub układu ruchu[3].
Nieleczona borelioza przebiega u człowieka w trzech etapach[20]:
- Etap infekcji zlokalizowanej:
- Rumień wędrujący (rumień pełzający, erythema migrans)[20][3] – jest najczęstszym i patognomonicznym objawem boreliozy[71][72]. W ciągu 1–3 tygodni od ukłucia kleszcza w miejscu ukąszenia pojawia się pojedyncza rumieniowa, okrągła lub owalna plama lub grudka na skórze, która powoli ulega powiększeniu, często z centralnym przejaśnieniem w środku (lub mająca kształt „tarczy strzelniczej”; miejsce wkłucia kleszcza jest jej środkiem[73][74]. Nie występuje we wszystkich przypadkach choroby[3][72][69][75] (jest nieobecny do 20% zakażeń[76]). Rumień najczęściej jest zlokalizowany na skórze kończyn dolnych i tułowia, co jest związane z lokalizacją ukłucia. Zmiany pojawiające się w ciągu 3 dni od ukłucia należy traktować jako odczyn hiperergiczny (odczyn zwykle <5 cm, bez przejaśnienia w centralnej części). Mogą występować wtórne zmiany satelitarne lub pęcherze[74][69]. W nietypowym przebiegu zmianie może towarzyszyć powiększenie lokalnych węzłów chłonnych.
- Naciek limfocytarny (chłoniak limfocytowy skóry, limfocytoma[77], borrelia lymphocytoma)[20][3] – przebiega jako niebolesny czerwony guzek, najczęściej na małżowinie usznej, mosznie, brodawkach sutkowych)[78][79]. Zmiana nieleczona może się utrzymywać nawet kilka lat. Występuje u mniej niż 1% chorych[79].
- Objawy grypopodobne[2][20][80].
- Rumień wędrujący, naciek limfocytarny oraz zanikowe zapalenie skóry (acrodermatitis chronica atrophicans) są patognomoniczne, to znaczy wystarczające do rozpoznania choroby.
- Etap infekcji rozproszonej:
- Nawracające zapalenie stawów – ujawnia się od 2 tygodni do 2 lat od wystąpienia pierwszych objawów boreliozy[3]. Przebiega pod postacią nawracających kilkutygodniowych epizodów bólu i obrzęku stawów. Zapalenie zwykle dotyczy jednego lub rzadziej dwóch stawów i obejmuje duże stawy: kolanowe (najczęściej[81]), łokciowe, skokowe, rzadziej inne[79]. Przebieg asymetryczny[79]. Każde kolejne zaostrzenie jest coraz łagodniejsze[3] aż do ustąpienia dolegliwości. U niektórych pacjentów przechodzi w stan przewlekły.
- Objawy podrażnienia lub limfocytarnego zapalenia opon mózgowo-rdzeniowych[70] i nerwów obwodowych. Zapalenie opon mózgowo-rdzeniowych ma przebieg łagodny, jedynym objawem choroby może być ból głowy.
- Zapalenie nerwów czaszkowych – w stadium wczesnym najczęściej porażenie nerwu twarzowego[3][70], czasem dwustronne, może mieć nawracający przebieg[82][3].
- Zapalenie mięśnia sercowego, serca, wsierdzia lub zapalenie mięśnia sercowego i osierdzia[79][83][84]. Stosunkowo rzadkie (występuje u ok. 5% chorych)[83][84]. Najczęściej ujawnia się w postaci zaburzeń przewodnictwa jako blok przedsionkowo-komorowy o różnym stopniu[3][85]. Może przebiegać bezobjawowo lub dawać objawy duszności i kołatania serca[84].
- Etap infekcji przewlekłej:
- Zanikowe zapalenie skóry – ujawnia się wiele lat po zakażeniu[3], najczęściej występuje na kończynach dolnych u osób w podeszłym wieku. Jest najczęstszym powikłaniem późnym boreliozy[2]. Zmiany początkowo mają charakter zapalny o zabarwieniu sinoczerwonym, niesymetrycznie rozmieszczone. Mogą występować ogniska wzmożonej pigmentacji oraz teleangiektazje. Z czasem dochodzi do zmian zanikowych ze ścieńczeniem skóry z widocznym poszerzeniem żył. Zmianom często towarzyszą parestezje i ból stawów[3].
- Neuroborelioza[3][20] – występuje u 10–15% nieleczonych pacjentów[70]:
- Przewlekłe zapalenie stawów[20], rzadko trwałe uszkodzenie.
- Łagodne zapalenie mięśni, ścięgien, kaletek maziowych[20].
Rozpoznanie[edytuj | edytuj kod]
Podstawową rolę w diagnostyce boreliozy odgrywa diagnostyka serologiczna. Obecnie zalecana jest diagnostyka dwustopniowa. Pierwszy etap obejmuje badania z zastosowaniem testu serologicznego o wysokiej (nawet do 100%[86][87]) czułości: ELISA, test immunofluorescencyjny (IIFT), technika jakościowa ELFA. W przypadku wyniku dodatniego lub wątpliwego konieczne jest zastosowanie testu potwierdzenia – western blot, który charakteryzuje się wysoką (do 100%[88][89]) swoistością.
Należy podkreślić, że dodatni wynik badania serologicznego bez objawów klinicznych typowych dla boreliozy nie ma znaczenia diagnostycznego[20].
Za pomocą testów ELISA wykrywa się przeciwciała w klasie IgM i IgG. Swoiste IgM pojawiają się we krwi po 3–4 tygodniach od zakażenia (mogą być wykrywane w drugim tygodniu choroby, ale u większości pacjentów pojawiają się później)[79] i zanikają w ciągu 4–6 miesięcy. Swoiste IgG są wykrywalne po 6–8 tygodniach od zakażenia i utrzymują się wiele lat nawet u pacjentów skutecznie leczonych antybiotykami, dlatego nie nadają się do określania skuteczności leczenia antybiotykowego[20]. U pacjentów z obecnym rumieniem wędrującym rozpoznanie kliniczne jest wystarczające i należy rozpocząć leczenie bez potwierdzenia badaniami serologicznymi, których wyniki w tej fazie choroby często są negatywne[3].
Możliwe są reakcje krzyżowe na antygeny innych patogenów: wirusa Epsteina-Barr[79][90], cytomegalowirusa[90] czy wirusa opryszczki pospolitej[91].
W neuroboreliozie OUN konieczne jest badanie płynu mózgowo-rdzeniowego[79], gdzie wykrywa się przeciwciała w klasach IgM i IgG. Dla wykazania neuroboreliozy OUN istotne jest wykazanie wysokiego wskaźnika przeciwciał (stosunek zawartości swoistych przeciwciał w płynie mózgowo-rdzeniowym do zawartości w surowicy), zwykle >2[3].
Potwierdzenie rozpoznania zapalenia mięśnia sercowego o tej etiologii wymaga wykazania obecności przeciwciał IgM w surowicy oraz zaburzeń czynności serca potwierdzonych w EKG[79].
PCR jest metodą diagnostyczną pozwalającą wykryć DNA bakterii. Metoda wykazuje największą przydatność we wczesnym zakażeniu, kiedy jeszcze nie zostały wytworzone przeciwciała przeciwko krętkom Borrelia. W późniejszym etapie po wytworzeniu przeciwciał PCR jest metodą uzupełniającą, w sytuacjach gdy diagnostyka oparta o przeciwciała jest utrudniona z powodu defektów immunologicznych lub poważnych schorzeń współistniejących[92]. PCR nie jest szeroko stosowany ze względów ekonomicznych oraz częstych wyników fałszywie dodatnich[93] i fałszywie ujemnych[94]. Wykrycie DNA krętka nie jest jednoznaczne z aktywnym zakażeniem[92]. Ponadto dodatni wynik nie pozwala stwierdzić, czy DNA krętkowe pochodzi z żywych czy martwych organizmów[79]. Negatywny wynik nie pozwala ostatecznie wykluczyć infekcji[92].
W Polsce zgodnie z Rozporządzeniem Ministra Zdrowia z dnia 10 grudnia 2019 r. w sprawie zgłaszania podejrzeń i rozpoznań zakażeń, chorób zakaźnych oraz zgonów z ich powodu (Dz.U. z 2023 r. poz. 1045) borelioza (w tym rumień wędrujący) podlega obowiązkowi zgłaszania do Państwowego Inspektora Sanitarnego, niezwłocznie, nie później jednak niż w ciągu 24 godzin od chwili powzięcia podejrzenia lub rozpoznania zakażenia.
Leczenie[edytuj | edytuj kod]
Boreliozę leczy się za pomocą antybiotyków[95]. Wybór leku zależy od postaci (etapu) choroby.
Nie należy rozpoczynać leczenia antybiotykami przy dodatnich wynikach badań serologicznych bez objawów klinicznych. Podobnie zarówno brak spadku, jak i wzrost miana przeciwciał, po leczeniu nie świadczy o nieskuteczności leczenia[96].
Według zaleceń Polskiego Towarzystwa Epidemiologów i Lekarzy Chorób Zakaźnych skuteczne w leczeniu boreliozy są[97]:
- amoksycylina 3 razy 500 mg (dzieci 50mg/kg/dobę) przez 14–21 dni
- doksycyklina 2 razy 100 mg lub 1 raz 200 mg przez 14–21 dni (nie podawać dzieciom i ciężarnym)
- aksetyl cefuroksymu 2 razy 500 mg (dzieci 30 mg/kg/dobę) przez 14–21 dni
alternatywnie np. przy uczuleniu na w/w leki lub ich nietolerancji można zastosować
- azytromycyna 1 raz 500 mg (dzieci 10 mg/kg/dobę) przez 7–10 dni
- klarytromycyna 2 razy 500 mg (dzieci 15 mg/kg/dobę) przez 14–21 dni
Niekiedy występują nawroty choroby, które wymagają powtórnej antybiotykoterapii. Należy je odróżnić od słabnących dolegliwości, które wymagają jedynie leczenia objawowego. Właściwa antybiotykoteriapia zapewnia wyleczenie w >90% przypadków[20]. Nie ma podstaw naukowych do wielokrotnego powtarzania kuracji lub wielomiesięcznego stosowania antybiotyków[79]. Istotnym zagadnieniem jest też rozpoznanie i leczenie koinfekcji odkleszczowych wymagających osobnego leczenia.
W 2021 roku pojawiły sie naukowe doniesienia sugerujące, iż higromycyna A - związek znany już od dziesięcioleci i produkowany przez Streptomyces hygroscopicus - może być potancjalnie skuteczny w leczeniu boreliozy. W badaniach prowadzonych na szczurach wykazywał wysoką aktywność przeciw krętkom Borrelia burgdorferi, a jednoczesnie był znacznie bezpieczniejszy dla mikroflory jelitowej niż inne antybiotyki[98][99].
Zespół poboreliozowy[edytuj | edytuj kod]
Mianem tym określa się szereg objawów utrzymujących się u pacjentów z boreliozą po leczeniu. Główne objawy to zmęczenie oraz bóle stawów i mięśni[100]. W niektórych przypadkach może trwać do 6 miesięcy. Dokładna przyczyna występowania tego zespołu nie została jeszcze poznana. Większość ekspertów uważa, że jest on efektem uszkodzenia tkanek i układu immunologicznego, powstałego w trakcie infekcji. Podobne objawy występują w następstwie innych infekcji, takich jak: Campylobacter (zespół Guillaina-Barrégo), Chlamydie (zespół Reitera) czy paciorkowce (gorączka reumatyczna). Badania nie wykazały, że stan pacjentów otrzymujących przedłużoną terapię antybiotykową poprawia się szybciej od tych, którzy otrzymują placebo[100][101]. Dodatkowo długotrwała terapia antybiotykowa niesie ze sobą ryzyko poważnych powikłań[70][100][102].
Zapobieganie[edytuj | edytuj kod]
Zapobieganie boreliozie polega przede wszystkim na unikaniu ukąszenia kleszczy poprzez[25][3][20]:
- noszenie ubioru okrywającego możliwie szczelnie ciało (koszula z długimi rękawami, długie spodnie, zakryte buty),
- unikanie wypraw w rejony, w których jest dużo kleszczy,
- unikanie chodzenia poza drogami po lesie, w zaroślach i łąkach,
- niesiadanie na zwalonych pniach drzew (miejsce przebywania młodocianych form kleszczy – nimf),
- stosowanie środków odstraszających kleszcze (repelenty), zwłaszcza tych zawierających DEET[103],
- stosowanie środków do impregnacji odzieży i obuwia zawierających permetrynę i jej pochodne,
- sprawdzanie ciała po pobycie w lesie.
Usuwanie kleszcza[edytuj | edytuj kod]
W przypadku znalezienia kleszcza na ciele należy go niezwłocznie usunąć pęsetą lub przyrządem do usuwania kleszczy. Kleszcza trzeba chwycić tuż przy skórze i pociągnąć wzdłuż osi wkłucia, a miejsce po ukąszeniu dokładnie przemyć spirytusem lub innym odpowiednim środkiem dezynfekującym. Jeśli w skórze pozostanie część głowowa, należy stosować tylko dezynfekcję (część głowowa nie zwiększa ryzyka zakażenia[20]). Jeżeli kleszcz tkwi głęboko, należy udać się do lekarza. Nie wolno kleszcza wykręcać, wyciskać go, smarować benzyną, tłuszczem lub innymi środkami (prowokują wymioty i zwiększają ilość śliny kleszcza wydalanej do krwi, co zwiększa ryzyko zakażenia). Usunięcie kleszcza w ciągu pierwszej doby po ukąszeniu wielokrotnie zmniejsza prawdopodobieństwo zarażenia, choć stwierdzono rozwinięcie się choroby nawet po kilkuminutowym kontakcie z kleszczem[25].
Profilaktyka poekspozycyjna[edytuj | edytuj kod]
Uzasadniona wyłącznie u osób dorosłych w przypadku mnogich ukłuć w regionie endemicznym boreliozy i pochodzących spoza takiego terenu[3][20].
Szczepionka[edytuj | edytuj kod]
W grudniu 1998 amerykańska Agencja Żywności i Leków dopuściła szczepionkę przeciwko boreliozie (LYMErix) produkcji GlaxoSmithKline, opartą na białku powierzchniowym A (OspA) z B. burgdorferi. Kilkudziesięciu zaszczepionych zgłosiło autoimmunologiczne skutki uboczne i został wniesiony pozew zbiorowy przeciw GlaxoSmithKline. Agencja Żywności i Leków oraz Centrum Kontroli i Prewencji Chorób nie stwierdziły związku między szczepionką a skargami. Obawy spowodowały jednak spadek sprzedaży i w 2002 GlaxoSmithKline wycofało LYMErix ze sprzedaży w Stanach Zjednoczonych. Po wycofaniu szczepionki ugodą zakończył się też proces. GlaxoSmithKline pokryło jedynie koszty prawników i sądowe[104][105].
Historia[edytuj | edytuj kod]
Borelioza najprawdopodobniej trapi ludzkość od tysiącleci[106]. Autopsja Ötziego – szczątek neolitycznego mężczyzny zmarłego 5300 lat temu – wykazała obecność DNA Borrelia, co czyni go najwcześniejszym potwierdzonym przypadkiem infekcji Borrelia u ludzi[107]. Pierwszy opis symptomów boreliozy w literaturze medycznej miał miejsce w 1883 roku kiedy to niemiecki lekarz Alfred Buchwald zrelacjonował przypadek obrzęku skóry oraz czerwonych przebarwień na lewej nodze polskiego pacjenta[106]. Buchwald nie był w stanie znaleźć przyczyny dolegliwości, którą nazwał idiopatycznym zanikiem skóry[106][108]. W 1902 roku Karl Herxheimer i Kuno Hartmann wprowadzili nazwę zanikowe zapalenie skóry, która używana była w kontekście choroby opisanej wcześniej przez Buchwalda[106][109].
W 1909 roku szwedzki dermatolog Arvid Afzelius jako pierwszy powiązał rumień wędrujący z ukąszeniem przez kleszcza[110]. W 1922 neuroboreliozę opisało niezależnie dwóch francuskich neurologów – Charles Garin i Antoine Bujadoux[111], a ukąszenia kleszczy z objawami neurologicznymi połączył Alfred Bannwarth w latach 40. Bannwarth, niemiecki neurolog, opisał zespół zaczynający się pojawieniem rumienia skórnego, określanego jako ECM – erythema chronicum migrans, do którego sukcesywnie dołączały objawy limfocytarnego zapalenia opon mózgowych, bóle korzonkowe i objawy zapalenia nerwów czaszkowych i obwodowych. Zespół Bannwartha obecnie jest klasyfikowany jako neuroborelioza[82]. Pod koniec lat 40 szwedzki dermatolog Lenhoff przy użyciu mikroskopu zaobserwował elementy przypominające krętki (które najprawdopodobniej były krętkami Borrelia[106]) w próbkach skóry pobranych z rumienia skórnego[112]. W latach 50 inny szwedzki dermatolog – Hollström dowiódł, że użycie penicyliny prowadzi do szybszego zaniku rumienia skórnego[113]. Pierwszy opis rumienia skórnego w Stanach Zjednoczonych pochodzi z 1970 roku kiedy to w Wisconsin dermatolog Scrimenti wyleczył pacjenta z ECM przy użyciu penicyliny[114]. W 1977 roku opublikowano opis 12 przypadków zapalenia stawów u dzieci z okolic miasteczek Lyme oraz Old Lyme w stanie Connecticut i zasugerowano ich związek ze zmianami skórnymi po ukąszeniach kleszczy[2][115]. Od tej miejscowości wzięła się angielska nazwa choroby, Lyme disease, która jest po angielsku również znana jako borreliosis, po polsku borelioza, od nazwiska francuskiego biologa Amédée Borrela, na którego cześć nazwano również rodzaj bakterii Borrelia. Amerykański entomolog kliniczny i mikrobiolog Willy Burgdorfer w 1981 roku wyizolował z kleszcza Ixodes dammini krętki, które później w uznaniu zasług Burgdorfera nazwano Borrelia burgdorferi[116]. W 1982 wyniki badań z tego odkrycia zostało opublikowane w czasopiśmie naukowym „Science”[117]. Rok później wykryto swoiste przeciwciała w klasie IgM i IgG przeciwko Borrelia burgdorferi[potrzebny przypis].
W latach 90 amerykańska agencja Centers for Disease Control and Prevention (CDC) wprowadziła zbiór kryteriów używanych do diagnozy boreliozy w Stanach Zjednoczonych, a także nakazała lekarzom zgłaszanie nowych przypadków choroby do agencji zdrowia publicznego[38]. Doprowadziło to do znacznego wzrostu w liczbie opisanych przypadków boreliozy[38]. W 2013 roku CDC wydało oświadczenie prasowe, w którym przyznało, że faktyczna liczba rocznych przypadków boreliozy może być nawet 10 razy wyższa niż liczba oficjalnie potwierdzonych przypadków[38][118]. Raport potwierdził, że borelioza stanowi bardzo poważny problem dla amerykańskiego zdrowia publicznego i wzbudził zainteresowanie międzynarodowych mediów[38][118].
Klasyfikacja ICD10[edytuj | edytuj kod]
| kod ICD10 | nazwa choroby |
|---|---|
| ICD-10: A69 | Zakażenia wywołane przez inne krętki |
| ICD-10: A69.2 | Borelioza |
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b G. Stanek, M. Reiter, The expanding Lyme Borrelia complex--clinical significance of genomic species?, „Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases”, 17 (4), 2011, s. 487–493, DOI: 10.1111/j.1469-0691.2011.03492.x, ISSN 1469-0691, PMID: 21414082 [dostęp 2020-07-13].
- ↑ a b c d e f g h i j Patric R. Murray, Ken S. Rosenthal, Michale A. Pfaller: Mikrobiologia. Wrocław: Elsevier Urban & Partner, 2011. ISBN 978-0-323-05470-6.
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag Choroby zakaźne i pasożytnicze. Junusz Cianciara, Jacek Juszczyk (red.). Lublin: CZELEJ, 2007. ISBN 978-83-60608-34-0.
- ↑ A G Barbour, S F Hayes, Biology of Borrelia species., „Microbiological Reviews”, 50 (4), 1986, s. 381–400, ISSN 0146-0749, PMID: 3540570, PMCID: PMC373079 [dostęp 2020-07-24].
- ↑ a b c d e f g h i Peter Wilhelmsson, A STING from a Tick: Epidemiology, Ecology and Clinical Aspects of Lyme Borreliosis [online], 2014 [dostęp 2020-07-13].
- ↑ a b Melisha R. Kenedy, Tiffany R. Lenhart, Darrin R. Akins, The role of Borrelia burgdorferi outer surface proteins, „FEMS Immunology & Medical Microbiology”, 66 (1), 2012, s. 1–19, DOI: 10.1111/j.1574-695X.2012.00980.x, ISSN 0928-8244, PMCID: PMC3424381 [dostęp 2020-07-24] (ang.).
- ↑ Jan Flieger. Borelioza z Lyme (krętkowica kleszczowa). „Przewodnik Lekarza”, 2001.
- ↑ KATHERINE I. SWANSON, DOUGLAS E. NORRIS, Detection of Borrelia burgdorferi DNA in Lizards from Southern Maryland, „Vector borne and zoonotic diseases (Larchmont, N.Y.)”, 7 (1), 2007, s. 42–49, DOI: 10.1089/vbz.2006.0548, ISSN 1530-3667, PMID: 17417956, PMCID: PMC4128253 [dostęp 2020-07-13].
- ↑ Magdalena Nowak-Chmura, Krzysztof Siuda, Ticks of Poland. Review of contemporary issues and latest research, „Annals of Parasitology”, 58 (3), 2012, s. 125–155, ISSN 2299-0631, PMID: 23444797 [dostęp 2020-07-13].
- ↑ L.A. Magnarelli, J.F. Anderson, Ticks and biting insects infected with the etiologic agent of Lyme disease, Borrelia burgdorferi, „Journal of Clinical Microbiology”, 26 (8), 1988, s. 1482–1486, ISSN 0095-1137, PMID: 3170711 [dostęp 2020-07-13].
- ↑ Dania Richter i inni, Absence of Lyme disease spirochetes in larval Ixodes ricinus ticks, „Vector Borne and Zoonotic Diseases (Larchmont, N.Y.)”, 12 (1), 2012, s. 21–27, DOI: 10.1089/vbz.2011.0668, ISSN 1557-7759, PMID: 21923267 [dostęp 2020-07-13].
- ↑ a b c d e f A. Marm Kilpatrick i inni, Lyme disease ecology in a changing world: consensus, uncertainty and critical gaps for improving control, „Philosophical Transactions of the Royal Society B: Biological Sciences”, 372 (1722), 2017, s. 20160117, DOI: 10.1098/rstb.2016.0117, PMID: 28438910, PMCID: PMC5413869 [dostęp 2020-07-20].
- ↑ Carolin Rauter, Thomas Hartung, Prevalence of Borrelia burgdorferi sensu lato genospecies in Ixodes ricinus ticks in Europe: a metaanalysis, „Applied and Environmental Microbiology”, 71 (11), 2005, s. 7203–7216, DOI: 10.1128/AEM.71.11.7203-7216.2005, ISSN 0099-2240, PMID: 16269760, PMCID: PMC1287732 [dostęp 2020-07-13].
- ↑ Lyme Disease: Vectors and Reservoirs.
- ↑ a b E. Sinski, R. Welc-Faleciak, Ryzyko zakażeń przenoszonych przez kleszcze w ekosystemach leśnych Polski, „Zarządzanie Ochroną Przyrody w Lasach”, 06, 2012, ISSN 2081-1438 [dostęp 2020-07-20] (pol.).
- ↑ David Cameron Duffy, Scott R. Campbell, Ambient Air Temperature as a Predictor of Activity of Adult Ixodes scapularis (Acari: Ixodidae), „Journal of Medical Entomology”, 31 (1), 1994, s. 178–180, DOI: 10.1093/jmedent/31.1.178, ISSN 0022-2585 [dostęp 2020-07-13] (ang.).
- ↑ J.S. Gray, Review The ecology of ticks transmitting Lyme borreliosis, „Experimental & Applied Acarology”, 22 (5), 1998, s. 249–258, DOI: 10.1023/A:1006070416135, ISSN 1572-9702 [dostęp 2020-07-13] (ang.).
- ↑ Fell E. An update on Lyme disease and other tick-borne illnesses. „Nurse Pract”. 25 (10), s. 38–40, 43–44, 47–48 passim; quiz 56–57, October 2000. DOI: 10.1097/00006205-200025100-00003. PMID: 11068777.
- ↑ Robert Flisiak: Zapytaj eksperta. Choroby odkleszczowe.
- ↑ a b c d e f g h i j k l m n o Choroby wewnętrzne. Andrzej Szczeklik (red.). Kraków: Wydawnictwo Medycyna Praktyczna, 2010. ISBN 978-83-7430-216-6.
- ↑ a b Zdenek Hubálek, Epidemiology of lyme borreliosis, „Current Problems in Dermatology”, 37, 2009, s. 31–50, DOI: 10.1159/000213069, ISSN 1421-5721, PMID: 19367096 [dostęp 2020-08-07].
- ↑ Lyme disease – Symptoms and causes [online], Mayo Clinic [dostęp 2020-08-07] (ang.).
- ↑ a b c d e f g Lyme disease: Global Status [online], GIDEON – Global Infectious Diseases and Epidemiology Online Network [dostęp 2020-08-07] (ang.).
- ↑ Piesman J., Stone BF. Vector competence of the Australian paralysis tick, Ixodes holocyclus, for the Lyme disease spirochete Borrelia burgdorferi. „International journal for parasitology”. 1 (21), s. 109–111, luty 1991. DOI: 10.1016/0020-7519(91)90127-S. PMID: 2040556.
- ↑ a b c d Uwaga borelioza coraz groźniejsza!. [dostęp 2014-03-13]. [zarchiwizowane z tego adresu (2014-03-13)].
- ↑ a b Uwaga kleszcze!. [dostęp 2014-03-13]. [zarchiwizowane z tego adresu (2014-03-13)].
- ↑ Zachorowania na boreliozę w 2019 [online], medonet.pl [dostęp 2020-08-07] (pol.).
- ↑ Krzysztof Tomasiewicz i inni, The risk of exposure to Anaplasma phagocytophilum infection in Mid-EasternPoland., „Annals of Agricultural and Environmental Medicine”, 11 (2), 31 grudnia 2004, s. 261–264, ISSN 1232-1966 [dostęp 2020-08-07] (ang.).
- ↑ Poland: Lyme Disease | IAMAT [online], www.iamat.org [dostęp 2020-08-07].
- ↑ PZH: Choroby zakaźne i zatrucia w Polsce w 2017. [dostęp 2018-07-19]. [zarchiwizowane z tego adresu].
- ↑ Choroby zakaźne i zatrucia w Polsce – 2007 r. [online], wwwold.pzh.gov.pl [dostęp 2020-08-07].
- ↑ Piotr Czupryna i inni, Lyme disease in Poland – A serious problem?, „Advances in Medical Sciences”, 61 (1), 2016, s. 96–100, DOI: 10.1016/j.advms.2015.10.007, ISSN 1896-1126 [dostęp 2020-08-07] (ang.).
- ↑ Rizzoli A., Hauffe H., Carpi G., Vourc H. G., Neteler M., Rosa R. Lyme borreliosis in Europe. „Euro Surveill.”. PMID: 21794218.
- ↑ Smith R., Takkinen J. Lyme borreliosis: Europe-wide coordinated surveillance and action needed?. „Euro Surveill.”. PMID: 16819127.
- ↑ Lopes de Carvalho I., Núncio MS. Laboratory diagnosis of Lyme borreliosis at the Portuguese National Institute of Health (1990-2004). „Euro Surveill.”. PMID: 17130658.
- ↑ Yijun Lou, Jianhong Wu, Modeling Lyme disease transmission, „Infectious Disease Modelling”, 2 (2), 2017, s. 229–243, DOI: 10.1016/j.idm.2017.05.002, ISSN 2468-2152, PMID: 29928739, PMCID: PMC6001969 [dostęp 2020-08-07].
- ↑ Paul S. Mead, Epidemiology of Lyme Disease, „Infectious Disease Clinics of North America”, 29 (2), Lyme Disease and Other Infections Transmitted by Ixodes scapularis, 2015, s. 187–210, DOI: 10.1016/j.idc.2015.02.010, ISSN 0891-5520 [dostęp 2020-08-07] (ang.).
- ↑ a b c d e f Brian A. Fallon i inni, Conquering Lyme Disease: Science Bridges the Great Divide, Columbia University Press, 2018, DOI: 10.7312/fall18384, ISBN 978-0-231-18384-0, JSTOR: 10.7312/fall18384 [dostęp 2020-07-12].
- ↑ Centers for Disease Control and Prevention (CDC). Lyme disease--United States, 2003-2005. „MMWR Morb Mortal Wkly Rep.”. PMID: 17568368.
- ↑ Centers for Disease Control and Prevention (CDC): Reported cases of Lyme disease by state or locality, 2003-2012. [dostęp 2014-03-23].
- ↑ Nicholas H. Ogden i inni, The emergence of Lyme disease in Canada, „Canadian Medical Association Journal”, 180 (12), 2009, DOI: 10.1503/cmaj.080148, ISSN 1221-1224, PMID: 19506281, PMCID: PMC2691438 [dostęp 2014-03-23].
- ↑ Public Health Agency of Canada: Lyme Disease Frequently Asked Questions. [dostęp 2014-03-23].
- ↑ a b Alejandro Robles, James Fong, Jorge Cervantes, [Borrelia Infection in Latin America], „Revista De Investigacion Clinica; Organo Del Hospital De Enfermedades De La Nutricion”, 70 (4), 2018, s. 158–163, DOI: 10.24875/RIC.18002509, ISSN 0034-8376, PMID: 30067716 [dostęp 2020-08-07].
- ↑ Li M., Masuzawa T., Takada N., Ishiguro F., Fujita H., Iwaki A., Wang H., Wang J., Kawabata M., Yanagihara Y. Lyme disease Borrelia species in northeastern China resemble those isolated from far eastern Russia and Japan. „Appl Environ Microbiol.”. PMID: 9647853.
- ↑ Masuzawa T. Terrestrial distribution of the Lyme borreliosis agent Borrelia burgdorferi sensu lato in East Asia. „Jpn J Infect Dis.”. PMID: 15623946.
- ↑ Dsouli N., Younsi-Kabachii H., Postic D., Nouira S., Gern L., Bouattour A. Reservoir role of lizard Psammodromus algirus in transmission cycle of Borrelia burgdorferi sensu lato (Spirochaetaceae) in Tunisia. „J Med Entomol.”. PMID: 16892633.
- ↑ Bouattour A., Ghorbel A., Chabchoub A., Postic D. [Lyme borreliosis situation in North Africa]. „Arch Inst Pasteur Tunis.”. PMID: 16929760.
- ↑ B.H. Fivaz, T.N. Petney, Lyme disease--a new disease in southern Africa?, „Journal of the South African Veterinary Association”, 60 (3), 1989, s. 155–158, ISSN 1019-9128, PMID: 2699499 [dostęp 2020-08-07].
- ↑ O. Kahl i inni, Risk of infection with Borrelia burgdorferi sensu lato for a host in relation to the duration of nymphal Ixodes ricinus feeding and the method of tick removal, „Zentralblatt Fur Bakteriologie: International Journal of Medical Microbiology”, 287 (1–2), 1998, s. 41–52, DOI: 10.1016/s0934-8840(98)80142-4, ISSN 0934-8840, PMID: 9532263 [dostęp 2020-08-11].
- ↑ J. Piesman i inni, Duration of tick attachment and Borrelia burgdorferi transmission, „Journal of Clinical Microbiology”, 25 (3), 1987, s. 557–558, DOI: 10.1128/JCM.25.3.557-558.1987, ISSN 0095-1137, PMID: 3571459 [dostęp 2020-08-11].
- ↑ Fikrig E., Narasimhan S. Borrelia burgdorferi--traveling incognito?. „Microbes Infect.”, 2006. PMID: 16698304.
- ↑ Joppe W.R. Hovius, Spitting Image: Tick Saliva Assists the Causative Agent of Lyme Disease in Evading Host Skin’s Innate Immune Response, „Journal of Investigative Dermatology”, 129 (10), 2009, s. 2337–2339, DOI: 10.1038/jid.2009.202, ISSN 0022-202X [dostęp 2020-08-11] (ang.).
- ↑ P.A. Nuttall, M. Labuda, Tick–host interactions: saliva-activated transmission, „Parasitology”, 129 (S1), 2004, S177–S189, DOI: 10.1017/S0031182004005633, ISSN 1469-8161 [dostęp 2020-08-12] (ang.).
- ↑ C.M. Shih i inni, Delayed dissemination of Lyme disease spirochetes from the site of deposition in the skin of mice, „The Journal of Infectious Diseases”, 166 (4), 1992, s. 827–831, DOI: 10.1093/infdis/166.4.827, ISSN 0022-1899, PMID: 1527418 [dostęp 2020-08-12].
- ↑ Steere AC., Coburn J., Glickstein L. he emergence of Lyme disease. „J Clin Invest.”, 2004. PMID: 15085185.
- ↑ Steere AC. Lyme disease. „N Engl J Med.”. PMID: 11450660.
- ↑ Rupprecht TA., Koedel U., Fingerle V., Pfister HW. The pathogenesis of lyme neuroborreliosis: from infection to inflammation. „Mol Med.”. PMID: 18097481.
- ↑ Cabello FC., Godfrey HP., Newman SA. „Trends Microbiol.”. PMID: 17600717.
- ↑ a b Sean E. Connolly, Jorge L. Benach, The versatile roles of antibodies in Borrelia infections, „Nature Reviews Microbiology”, 3 (5), 2005, s. 411–420, DOI: 10.1038/nrmicro1149, ISSN 1740-1534 [dostęp 2020-08-12] (ang.).
- ↑ Y. Bai, K. Narayan, D. Dail, M. Sondey i inni. Spinal cord involvement in the nonhuman primate model of Lyme disease. „Lab Invest”. 84 (2), s. 160–172, 2004. DOI: 10.1038/labinvest.3700024. PMID: 14688796.
- ↑ Ramesh G., Alvarez AL., Roberts ED., Dennis VA. i inni. Pathogenesis of Lyme neuroborreliosis: Borrelia burgdorferi lipoproteins induce both proliferation and apoptosis in rhesus monkey astrocytes. „Eur J Immunol.”. 33 (9), s. 2539–2550, 2003 listopad. DOI: 10.1002/eji.200323872. PMID: 12938230.
- ↑ Halperin JJ., Heyes MP. Neuroactive kynurenines in Lyme borreliosis. „Neurology.”, 1992. DOI: 10.1212/wnl.42.1.43. PMID: 1531156.
- ↑ Parthasarathy G., Fevrier HB., Philipp MT. Non-viable Borrelia burgdorferi induce inflammatory mediators and apoptosis in human oligodendrocytes. „Neurosci Lett.”, 2013. PMID: 24157855.
- ↑ J.A. Moore. Jarisch-Herxheimer reaction in Lyme disease. „Cutis”. 39 (5), s. 397–398, 1987. PMID: 3581911.
- ↑ L.R. Williams, F.E. Austin. Hemolytic activity of Borrelia burgdorferi. „Infect Immun”. 60 (8), s. 3224–3230, 1992. PMID: 1639493. PMCID: PMC257305.
- ↑ Mark J. Cartwright, Suzanne E. Martin, Sam T. Donta: A Novel Toxin (Bb Tox 1) of Borrelia burgdorferi. W: 1999 LDF Conference Abstracts. Nowy Jork: 1999.
- ↑ Mikrobiologia i choroby zakaźne, 3 edycja, Gabriel Virella, polskie wydanie 2000.
- ↑ Jolanta Parada-Turska. Stawowa postać boreliozy – obraz kliniczny i leczenie. „Reumatologia”, 2013.
- ↑ a b c Gabriel Virella: Mikrobiologia i choroby zakaźne. Elsevier Urban & Partner Wydawnictwo. ISBN 978-83-85842-59-0.
- ↑ a b c d e f g Halperin JJ. Nervous system Lyme disease. „Infect Dis Clin North Am.”, 2008. PMID: 18452800.
- ↑ Zajkowska i Grzeszczuk 2018 ↓, s. 32.
- ↑ a b Dandache P., Nadelman RB. Erythema migrans. „Infect Dis Clin North Am.”, 2008. PMID: 18452799.
- ↑ Lyme disease. Recognising and treating erythema migrans, „Prescrire International”, 24 (164), 2015, s. 247–249, ISSN 1167-7422, PMID: 26594731 [dostęp 2017-11-28].
- ↑ a b Anna Moniuszko i inni, [Erythema migrans as a patognomic symptom of lyme disease], „Polski Merkuriusz Lekarski: Organ Polskiego Towarzystwa Lekarskiego”, 35 (208), 2013, s. 230–232, ISSN 1426-9686, PMID: 24340896 [dostęp 2017-11-28].
- ↑ Aucott JN., Crowder LA., Yedlin V., Kortte KB. Bull’s-Eye and Nontarget Skin Lesions of Lyme Disease: An Internet Survey of Identification of Erythema Migrans. „Dermatol Res Pract.”. DOI: 10.1155/2012/451727. PMID: 23133445. PMCID: PMC3485866.
- ↑ Signs and Symptoms of Lyme Disease.
- ↑ Stefania Jabłońska: Choroby skóry. Wydawnictwo Lekarskie PZWL, 2008. ISBN 83-200-2430-7.
- ↑ Zalecenia Deutsche Borreliose Gesellschaft https://web.archive.org/web/20100602041154/http://www.borreliose-gesellschaft.de/Texte_und_Empfehlungen/Empfehlungen.pdf.
- ↑ a b c d e f g h i j k Diagnostyka i leczenie boreliozy z Lyme. mp.pl, 2010-04-15. [dostęp 2014-03-13].
- ↑ Paul G. Auwaerter, John Aucott, J. Stephen Dumler, Lyme borreliosis (Lyme disease): molecular and cellular pathobiology and prospects for prevention, diagnosis and treatment, „Expert Reviews in Molecular Medicine”, 6 (2), 2004, s. 1–22, DOI: 10.1017/S1462399404007276, PMID: 14987414 [dostęp 2014-03-14].
- ↑ Puius YA., Kalish RA. Lyme arthritis: pathogenesis, clinical presentation, and management. „Infect Dis Clin North Am.”. 22 (2), s. 289–300, 2008 Jun. DOI: 10.1016/j.idc.2007.12.014. PMID: 18452802.
- ↑ a b Ryszard Podemski: Kompendium neurologii. Gdańsk: Via Medica, 2008, s. 281–282. ISBN 978-83-7555-054-2.
- ↑ a b Matthew L. Robinson i inni, Lyme carditis, „Infectious Disease Clinics of North America”, 29 (2), 2015, s. 255–268, DOI: 10.1016/j.idc.2015.02.003, ISSN 1557-9824, PMID: 25999222 [dostęp 2017-08-31].
- ↑ a b c Ujjwal Rastogi, Nidhi Kumars, Lyme Arrhythmia in an Avid Golfer: A Diagnostic Challenge and a Therapeutic Dilemma, „Journal of Atrial Fibrillation”, 8 (5), 2016, DOI: 10.4022/jafib.1378, ISSN 1941-6911, PMID: 27909484, PMCID: PMC5089497 [dostęp 2017-08-31].
- ↑ Basia Michalski, Adrian Umpierrez De Reguero, Lyme Carditis Buried Beneath ST-Segment Elevations, „Case Reports in Cardiology”, 2017, 2017, DOI: 10.1155/2017/9157625, ISSN 2090-6404, PMID: 28713599, PMCID: PMC5497674 [dostęp 2018-09-29].
- ↑ Allen C. Steere, Gail McHugh, Nitin Damle, and Vijay K. Sikand. Prospective study of serologic tests for lyme disease. „Clin Infect Dis.”. 47 (2), s. 188–195, 2008. DOI: 10.1086/589242. PMID: 18532885. PMCID: PMC5538270.
- ↑ VIDAS® Lyme IgM and VIDAS®: Lyme IgG Clear-cut immune status and rapid, differential diagnosis. bioMérieux Clinical Diagnostics. [dostęp 2012-07-27]. [zarchiwizowane z tego adresu (2013-11-14)].
- ↑ Engstrom SM, Shoop E, Johnson RC. Immunoblot interpretation criteria for serodiagnosis of early Lyme disease. „J Clin Microbiol”. 33 (2), s. 419–427, 1995. PMID: 7714202. PMCID: PMC227960.
- ↑ Sivak SL, Aguero-Rosenfeld ME, Nowakowski J, Nadelman RB, Wormser GP. Accuracy of IgM immunoblotting to confirm the clinical diagnosis of early Lyme disease. „Arch Intern Med”. 156 (18), s. 2105–2109, 1996. DOI: 10.1001/archinte.156.18.2105. PMID: 8862103.
- ↑ a b H.A. Goossens, M.K. Nohlmans, A.E. van den Bogaard. Epstein-Barr virus and cytomegalovirus infections cause false-positive results in IgM two-test protocol for early Lyme borreliosis. „Infection”. 27 (3). s. 231. DOI: 10.1007/BF02561539. PMID: 10378140.
- ↑ L. Strasfeld, L. Romanzi, R.H. Seder, V.P. Berardi. False-positive serological test results for Lyme disease in a patient with acute herpes simplex virus type 2 infection. „Clin Infect Dis”. 41 (12), s. 1826–1827, 2005. DOI: 10.1086/498319. PMID: 16288417.
- ↑ a b c J. Dunaj, A. Moniuszko, J. Zajkowska, S. Pancewicz. The role of PCR in diagnostics of Lyme borreliosis. „Przegl Epidemiol”. 67 (1), s. 35–39, 119–23, 2013. PMID: 23745373.
- ↑ P.J. Molloy, D.H. Persing, V.P. Berardi. False-positive results of PCR testing for Lyme disease. „Clin Infect Dis”. 33 (3), s. 412–413, 2001. DOI: 10.1086/321911. PMID: 11438915.
- ↑ M.E. Aguero-Rosenfeld, G. Wang, I. Schwartz, G.P. Wormser. Diagnosis of lyme borreliosis. „Clin Microbiol Rev”. 18 (3), s. 484–509, 2005. DOI: 10.1128/CMR.18.3.484-509.2005. PMID: 16020686. PMCID: PMC1195970.
- ↑ Boreliozę potrafimy skutecznie leczyć, ale dawki antybiotyków muszą być duże [online], www.termedia.pl [dostęp 2022-04-12] (pol.).
- ↑ Zajkowska i Grzeszczuk 2018 ↓, s. 78.
- ↑ Zajkowska i Grzeszczuk 2018 ↓, s. 76.
- ↑ Nadja Leimer i inni, A selective antibiotic for Lyme disease, „Cell”, 184 (21), 2021, 5405–5418.e16, DOI: 10.1016/j.cell.2021.09.011, PMID: 34619078, PMCID: PMC8526400 [dostęp 2023-11-13] (ang.).
- ↑ Jaki jest skuteczny lek na borelioze nowej generacji? [online], Leki.pl [dostęp 2023-11-13] (pol.).
- ↑ a b c Adriana Marques. Chronic Lyme Disease: An appraisal. „Infect Dis Clin North Am.”, 2008. DOI: 10.1016/j.idc.2007.12.011. PMID: 18452806. PMCID: PMC2430045.
- ↑ Anneleen Berende, Hadewych J.M. ter Hofstede, Fidel J. Vos et al. Randomized Trial of Longer-Term Therapy for Symptoms Attributed to Lyme Disease. „N Engl J Med”. 374, s. 1209–1220, March 31, 2016. DOI: 10.1056/NEJMoa1505425.
- ↑ CDC: Post-Treatment Lyme Disease Syndrome. 2013-02-07. [dostęp 2014-01-08]. (ang.).
- ↑ Daniel Staub i inni, Effectiveness of a repellent containing DEET and EBAAP for preventing tick bites, „Wilderness Environ Med.”, 2002, DOI: 10.1580/1080-6032(2002)013[0012:eoarcd]2.0.co;2, PMID: 11929056 [dostęp 2013-03-13].
- ↑ L.E. Nigrovic, K.M. Thompson. The Lyme vaccine: a cautionary tale. „Epidemiol Infect”. 135 (1), s. 1–8, 2007. DOI: 10.1017/S0950268806007096. PMID: 16893489. PMCID: PMC2870557.
- ↑ A. Abbott. Lyme disease: uphill struggle. „Nature”. 439 (7076), s. 524–525, 2006. DOI: 10.1038/439524a. PMID: 16452949.
- ↑ a b c d e Peter Wilhelmsson, A STING from a Tick: Epidemiology, Ecology and Clinical Aspects of Lyme Borreliosis [online], 2014 [dostęp 2020-07-11].
- ↑ Andreas Keller i inni, New insights into the Tyrolean Iceman’s origin and phenotype as inferred by whole-genome sequencing, „Nature Communications”, 3 (1), 2012, s. 1–9, DOI: 10.1038/ncomms1701, ISSN 2041-1723 [dostęp 2020-07-11] (ang.).
- ↑ Buchwald, A. (1883). Ein Fall von diffuser idiopathischer HautAtrophie. Archiv für Dermatologie und Syphilis, 553-556.
- ↑ Karl Herxheimer, Kuno Hartmann, Ueber Acrodermatitis chronica atrophicans, „Archiv für Dermatologie und Syphilis”, 61 (1), 1902, s. 57–76, DOI: 10.1007/BF01933570, ISSN 1432-069X [dostęp 2020-07-11] (niem.).
- ↑ Karl Marcus. Verhandlungen der dermatologischen Gesellschaft zu Stockholm. „Archiv für Dermatologie und Syphilis”. 107, s. 467–470, 1911. DOI: 10.1007/BF01832773.
- ↑ C. Garin, A. Bujadoux. Paralysis by ticks. 1922. „Clin Infect Dis.”. PMID: 8448296.
- ↑ C. Lennhoff, Spirochaetes in aetiologically obscure diseases, „Acta Dermato-Venereologica”, 28 (3), 1948, s. 295–324, ISSN 0001-5555, PMID: 18891989 [dostęp 2020-07-12].
- ↑ Hollström, E. (1951). Successful treatment of erythema migrans Afzelius. Acta Derm Venereol 31, 235-243.
- ↑ Rudolph J. Scrimenti, Erythema Chronicum Migrans, „Archives of Dermatology”, 102 (1), 1970, s. 104–105, DOI: 10.1001/archderm.1970.04000070106017, ISSN 0003-987X [dostęp 2020-07-12] (ang.).
- ↑ A.C. Steere. Lyme borreliosis in 2005, 30 years after initial observations in Lyme Connecticut. „Wien Klin Wochenschr.”. 118 (21–22), s. 625–633, 2008 Nov. DOI: 10.1007/s00508-006-0687-x. PMID: 17160599.
- ↑ W. Burgdorfer, How the discovery of Borrelia burgdorferi came about, „Clinics in Dermatology”, 11 (3), 1993, s. 335–338, DOI: 10.1016/0738-081x(93)90087-s, ISSN 0738-081X, PMID: 8221514 [dostęp 2020-07-29].
- ↑ W. Burgdorfer i inni, Lyme disease-a tick-borne spirochetosis?, „Science”, 216 (4552), 1982, s. 1317–1319, DOI: 10.1126/science.7043737, ISSN 0036-8075, PMID: 7043737 [dostęp 2020-07-29].
- ↑ a b CDC Online Newsroom | Press Release | CDC provides estimate of Americans diagnosed with Lyme disease each year [online], www.cdc.gov [dostęp 2020-07-12].
Bibliografia[edytuj | edytuj kod]
- Choroby wewnętrzne. Andrzej Szczeklik (red.). T. II. Kraków: Medycyna Praktyczna, 2005, s. 2142–2147. ISBN 83-7430-069-8.
- Krętkowice. W: Zdzisław Dziubek: Choroby zakaźne i pasożytnicze. Zdzisław Dziubek (red.). Wyd. III uaktualnione. Warszawa: Wydawnictwo Lekarskie PZWL, 2003, s. 182–186. ISBN 83-200-2748-9.
- Choroby zakaźne i pasożytnicze. Janusz Cianciara, Jacek Juszczyk (red.). Lublin: CZELEJ, 2007. ISBN 978-83-60608-34-0.
- Stefania Jabłońska: Choroby skóry. Wydawnictwo Lekarskie PZWL, 2008. ISBN 83-200-2430-7.
- Joanna M. Zajkowska, Anna Grzeszczuk, Borelioza, wyd. 2 uaktualnione, Warszawa: PZWL Wydawnictwo Lekarskie, 2018, ISBN 978-83-200-5515-3, OCLC 1034588293 [dostęp 2020-07-30].
Linki zewnętrzne[edytuj | edytuj kod]
- Borelioza w zasobach CDC (ang.)
- Medline Plus (ang.)
