Tetrachlorometan
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Wzór sumaryczny |
CCl4 | ||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
153,82 g/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd |
bezbarwna, przezroczysta ciecz[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||||||||||||||||||||||
| Podobne związki |
chlorometan, dichlorometan, trichlorometan, tetrafluorometan, tetrabromometan, tetrajodometan, tetrachloroeten | ||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||
Tetrachlorometan, czterochlorek węgla – organiczny związek chemiczny z grupy halogenoalkanów, w pełni chlorowana pochodna metanu. Dawniej powszechnie stosowany jako tani rozpuszczalnik, szczególnie często używany przy ekstrakcji tłuszczów i innych związków organicznych z roślin, a także jako dodatek do środków czystości, rozpuszczalnik do farb i klejów (m.in. butaprenu). Do lat 80. XX wieku był stosowany jako środek gaśniczy w gaśnicach tetrowych. Stosowany także jako rozpuszczalnik w niektórych syntezach chemicznych.
Odkrycie[edytuj | edytuj kod]
Został odkryty w 1840 roku przez francuskiego chemika Henriego Victora Regnault.
Zastosowanie[edytuj | edytuj kod]
Obecnie użycie tetrachlorometanu jest zredukowane do minimum, a jego obrót w handlu jest ściśle reglamentowany. Wynika to z faktu, że uważa się go za niebezpieczny dla środowiska naturalnego. Opary działają toksycznie przez drogi oddechowe, w cieczy drażniąco działa na oczy, w kontakcie ze skórą i po połknięciu. Jest związkiem hepatotoksycznym – powoduje uszkodzenie komórek wątroby i w konsekwencji doprowadza do ostrego uszkodzenia wątroby. Stwarza poważne zagrożenie dla zdrowia w następstwie długotrwałego narażenia. Istnieją ograniczone dowody działania rakotwórczego. Działa szkodliwie na organizmy wodne. Może powodować długo utrzymujące się niekorzystne zmiany w środowisku wodnym. Podejrzewa się, że stwarza zagrożenie dla warstwy ozonowej (tzw. dziura ozonowa).
Stosowany jest nadal jako rozpuszczalnik w analizie chemicznej i w syntezie w skali laboratoryjnej. Ze względu na swoje właściwości, tetrachlorometan wraz z heksanem jest używany do wyznaczania gęstości kryształów nierozpuszczalnych w silnie niepolarnych rozpuszczalnikach.
Właściwości[edytuj | edytuj kod]
Właściwości fizyczne[edytuj | edytuj kod]
W temperaturze pokojowej jest to bezbarwna ciecz o słodkawym zapachu. Niepalny, słabo rozpuszczalny w wodzie, mieszalny z rozpuszczalnikami organicznymi (etanolem, benzenem, benzyną). Rozpuszcza oleje, tłuszcze, żywice i inne substancje lipofilowe. Jest to rozpuszczalnik wysoce niepolarny o dużej gęstości (1,59 g/cm³). Pod wpływem wyładowań elektrycznych lub wysokiej temperatury, w obecności tlenu powstaje z niego fosgen. Opary są kilkakrotnie cięższe od powietrza, co wykorzystywano w gaśnicach do dezaktywacji wolnych rodników w płomieniu i izolacji źródła ognia od dostępu powietrza.
Właściwości chemiczne[edytuj | edytuj kod]
Czterochlorek węgla wykazuje lekkie własności utleniające. Np. w reakcji z diestrami H-fosfonianowymi przekształca je w chlorofosforany:
- (RO)
2P(H)O + CCl
4 → (RO)
2P(Cl)O + CHCl
3
Powyższy proces stanowi podstawę metody Athertona-Todda otrzymywania amidofosforanów i triestrów fosforanowych[5]:
- (RO)
2P(H)O + CCl
4 + RNH
2 → [(RO)
2P(Cl)O] → (RO)
2P(NHR)O - (RO)
2P(H)O + CCl
4 + R
3N + R1
OH → [(RO)
2P(Cl)O] → (R1
O)(RO)
2PO
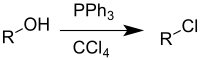
Czterochlorek węgla jest stosowany do syntezy chlorków alkilowych z alkoholi w tzw. reakcji Appela zachodzącej w obecności trifenylofosfiny. W przypadku chiralnych alkoholi drugorzędowych powstający chlorek ma przeciwną konfigurację absolutną asymetrycznego atomu węgla.
Chiralne alkohole trzeciorzędowe ulegają reakcji z CCl
4 zgodnie z mechanizmem substytucji SN1, dlatego otrzymuje się produkt jako mieszaninę racemiczną.
Otrzymywanie[edytuj | edytuj kod]
Produkcja czterochlorku węgla polega na fotochemicznym, wyczerpującym chlorowaniu metanu w fazie gazowej w wysokiej temperaturze (ok. 400 °C):
- CH
4 + 4Cl
2 → CCl
4 + 4HCl
Można go też otrzymać przez działanie chlorem na disiarczek węgla w obecności katalizatorów.
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ a b c d e Farmakopea Polska X, Polskie Towarzystwo Farmaceutyczne, Warszawa: Urząd Rejestracji Produktów Leczniczych, Wyrobów Medycznych i Produktów Biobójczych, 2014, s. 4276, ISBN 978-83-63724-47-4.
- ↑ a b c d e Carbon tetrachloride (nr 289116) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2017-01-07]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b Tetrachlorometan, [w:] Classification and Labelling Inventory, Europejska Agencja Chemikaliów [dostęp 2017-01-07] (ang.).
- ↑ Tetrachlorometan (nr 289116) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2017-01-07]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ F.R. Atherton. Some Aspects of the Organic Chemistry of Derivatives of Phosphorus Oxyacids. „Quarterly Review of the Chemical Society”. 3 (2), s. 146–159, 1949. DOI: 10.1039/QR9490300146.