Oganeson: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
plus istotna informacja (żeby nie było, że GW tylko „oganessjan” wymyśliła) |
m drobne redakcyjne |
||
| Linia 160: | Linia 160: | ||
| 250px | right |
| 250px | right |
||
}} |
}} |
||
Zgodnie z zasadą okresowości oganeson powinien być nieco bardziej reaktywny od radonu, jednak obliczenia teoretyczne wykazały, że może on być nawet znacznie bardziej reaktywny{{r|Kaldor}}. Poza znacznie większą do radonu reaktywnością oganeson może być nawet bardziej reaktywny od flerowu czy koperniku{{r|Nash2005}}. Przyczyną znacznie zwiększonej reaktywności tego pierwiastka względem radonu jest destabilizacja energetyczna i zwiększenie rozmiarów ostatniej zapełnionej [[podpowłoka|podpowłoki]] 7p. Precyzyjniej, poprzez |
Zgodnie z zasadą okresowości oganeson powinien być nieco bardziej reaktywny od radonu, jednak obliczenia teoretyczne wykazały, że może on być nawet znacznie bardziej reaktywny{{r|Kaldor}}. Poza znacznie większą do radonu reaktywnością oganeson może być nawet bardziej reaktywny od flerowu czy koperniku{{r|Nash2005}}. Przyczyną znacznie zwiększonej reaktywności tego pierwiastka względem radonu jest destabilizacja energetyczna i zwiększenie rozmiarów ostatniej zapełnionej [[podpowłoka|podpowłoki]] 7p. Precyzyjniej, poprzez między innymi [[sprzężenie spinowo-orbitalne]] między elektronami 7p a biernymi elektronami 7s<sup>2</sup>, dochodzi do zjawiska, w którym konfiguracja 7s<sup>2</sup>7p<sup>2</sup> flerowu jest na tyle stabilizowana, że można uważać ją za powłokę zapełnioną; tym samym zwiększenie liczby elektronów w atomie oganesonu będzie prowadziło do zmniejszenia jego stabilności{{r|Nash2005}}. Obliczono również, że oganeson, w przeciwieństwie do innych gazów szlachetnych, będzie wiązał elektron z uwolnieniem energii (będzie miał dodatnie [[powinowactwo elektronowe]]){{r|Pyykko|Eliav1996}}, choć wprowadzenie poprawek [[elektrodynamika kwantowa|kwantowo-elektrodynamicznych]] zmniejsza to powinowactwo dla jonu {{chem2|Og-}} o 9% (co wskazuje, że uwzględnienie tego rodzaju poprawek w przypadku superciężkich pierwiastków jest istotne). Przyczyną wysokiego powinowactwa jest stabilizacja poziomu energetycznego 8s wynikająca z efektów relatywistycznych{{r|Landau}}. |
||
Dotychczas nie udało się zsyntetyzować żadnych związków oganesonu, jednak obliczenia teoretyczne ich dotyczące prowadzi się od 1964{{r|60s}}. |
Dotychczas nie udało się zsyntetyzować żadnych związków oganesonu, jednak obliczenia teoretyczne ich dotyczące prowadzi się od 1964{{r|60s}}. |
||
Obliczenia dotyczące cząsteczki dwuatomowej {{chem2|Og2}} wskazały wiązanie przypominające z grubsza {{chem2|Hg2}}, z [[energia dysocjacji wiązania|energią dysocjacji]] wynoszącą 6 kJ/mol (mniej więcej czterokrotnie większą od {{chem2|Rn2}})<!--{{r|Nash2005}} -->. Ponadto wyliczona [[długość wiązania]] była mniejsza od długości wiązania w cząsteczce {{chem2|Rn2}} o 0,16 Å, co wskazuje na silne oddziaływanie tworzące wiązanie<!--{{r|Nash2005}} -->. Z drugiej strony {{chem2|OgH+}} wykazuje energię dysocjacji (innymi słowy powinowactwo oganesonu do [[proton]]u) mniejsze niż {{chem2|RnH+}}{{r|Nash2005}}. Przewidywane wiązanie między |
Obliczenia dotyczące cząsteczki dwuatomowej {{chem2|Og2}} wskazały wiązanie przypominające z grubsza {{chem2|Hg2}}, z [[energia dysocjacji wiązania|energią dysocjacji]] wynoszącą 6 kJ/mol (mniej więcej czterokrotnie większą od {{chem2|Rn2}})<!--{{r|Nash2005}} -->. Ponadto wyliczona [[długość wiązania]] była mniejsza od długości wiązania w cząsteczce {{chem2|Rn2}} o 0,16 Å, co wskazuje na silne oddziaływanie tworzące wiązanie<!--{{r|Nash2005}} -->. Z drugiej strony {{chem2|OgH+}} wykazuje energię dysocjacji (innymi słowy powinowactwo oganesonu do [[proton]]u) mniejsze niż {{chem2|RnH+}}{{r|Nash2005}}. Przewidywane wiązanie między oganesonem a wodorem w OgH byłoby bardzo słabe i należałoby je nawet rozpatrywać raczej jako czyste [[oddziaływania międzycząsteczkowe|oddziaływanie van der Waalsa]] niż jako rzeczywiste wiązanie chemiczne{{r|hydride}}. |
||
Obliczenia wskazują, że oganeson jest najbardziej elektroujemny z grupy gazów szlachetnych{{r|Kaldor}} i powinien być zdolny do wiązania się stabilniej z pierwiastkami wysoce [[elektroujemność|elektroujemnymi]], niż przykładowo [[kopernik (pierwiastek)|kopernik]] lub [[flerow]]{{r|hydride}}. Przewiduje się stabilne stopnie utlenienia II i IV we [[fluorki|fluorkach]] {{chem2|OgF2}} i {{chem2|OgF4}}{{r|Kaldor|fluoride}}, które powinny być trwalsze niż analogiczne związki [[ksenon]]u i [[radon]]u dzięki opisanemu wyżej silnemu efektowi |
Obliczenia wskazują, że oganeson jest najbardziej elektroujemny z grupy gazów szlachetnych{{r|Kaldor}} i powinien być zdolny do wiązania się stabilniej z pierwiastkami wysoce [[elektroujemność|elektroujemnymi]], niż przykładowo [[kopernik (pierwiastek)|kopernik]] lub [[flerow]]{{r|hydride}}. Przewiduje się stabilne stopnie utlenienia II i IV we [[fluorki|fluorkach]] {{chem2|OgF2}} i {{chem2|OgF4}}{{r|Kaldor|fluoride}}, które powinny być trwalsze niż analogiczne związki [[ksenon]]u i [[radon]]u dzięki opisanemu wyżej silnemu efektowi spinowo-orbitalnemu{{r|Kaldor}}. Stopień utlenienia VI byłby z kolei mniej stabilny z powodu tego samego silnego związania podpowłoki 7p<sub>1/2</sub>{{r|BFricke}}, które zwiększa reaktywność tego pierwiastka. Przykładowo wykazano, że reakcja oganesonu z fluorem ({{chem2|F2}}) z wytworzeniem {{chem2|OgF2}} wydzieliłaby energię 106 kcal/mol, z której około 46 kcal/mol wynikałoby właśnie z tego oddziaływania<!--{{r|hydride}} -->. Dla porównania sprzężenie spinowo-orbitalne podobnej cząsteczki {{chem2|RnF2}} odpowiada za około 10 kcal/mol z energii tworzenia wynoszącej 49 kcal/mol{{r|hydride}}. To samo oddziaływanie stabilizuje tetraedryczną geometrię T<sub>d</sub> {{chem2|OgF4}}, w odróżnieniu od płaskiej D<sub>4h</sub> [[tetrafluorek ksenonu|{{chem2|XeF4}}]]{{r|fluoride}}. Wiązanie {{chem2|Og\sF}} najprawdopodobniej będzie wykazywało charakter w większym stopniu [[wiązanie jonowe|jonowy]] niż [[wiązanie kowalencyjne|kowalencyjny]], czyniąc fluorki oganesonu nielotnymi{{r|Kaldor|Pitzer}}. Przewiduje się też, że oganeson powinien być zdolny do tworzenia wiązań {{chem2|Og\sCl}}{{r|Kaldor}} (spośród związków innych gazów szlachetnych znany jest na przykład {{chem2|[[dichlorek ksenonu|XeCl2]]}}, o budowie liniowej{{r|Proserpio}}). |
||
== Uwagi == |
== Uwagi == |
||
Wersja z 19:44, 20 cze 2019
| tenes ← oganeson → – | |||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||
| Nazwa, symbol, l.a. |
oganeson, Og, 118 | ||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||
| Masa atomowa |
294 u | ||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
| |||||||||||||||||||
Oganeson (Og) – niewystępujący naturalnie na Ziemi pierwiastek chemiczny z grupy transaktynowców o liczbie atomowej 118. Został otrzymany po raz pierwszy w 2002 w Zjednoczonym Instytucie Badań Jądrowych (JINR) w Dubnej przez zespół rosyjskich i amerykańskich naukowców. Odkrycie zostało zatwierdzone przez IUPAC i IUPAP w 2015, a w 2016 nowemu pierwiastkowi nadano nazwę oganesson[1][2]. Nazwa ta honoruje rosyjskiego fizyka jądrowego, Jurija Oganiesiana, który odegrał wiodącą rolę w odkryciu najcięższych pierwiastków układu okresowego i był kierownikiem zespołu, który dokonał syntezy oganesonu. Był to drugi (po seaborgu) przypadek nazwania pierwiastka na cześć osoby żyjącej[3].
Oganeson jest wysoce niestabilny. W latach 2002–2005 udało się uzyskać jedynie 3 lub 4 atomy izotopu 294
Og[4] o czasie połowicznego rozpadu ocenianym na mniej niż 1 milisekunda. Nie pozwoliło to na eksperymentalne zbadanie jego właściwości chemicznych, jednak liczne są ich przewidywania na podstawie obliczeń teoretycznych. Jest on pierwszym sztucznym przedstawicielem 18 grupy układu okresowego, czyli gazów szlachetnych, i prawdopodobnie wykazuje największą spośród nich reaktywność chemiczną. W przeszłości sądzono, że oganeson w warunkach standardowych będzie gazem, jednak obecne przewidywania wskazują na stały stan skupienia w tych warunkach, wynikający z efektów relatywistycznych[5]. W układzie okresowym leży w bloku p, będąc ostatnim pierwiastkiem siódmego okresu. W chwili pierwszej syntezy oganeson miał najwyższą liczbę atomową i największą masę atomową spośród wszystkich znanych pierwiastków.
Historia
Pierwsze spekulacje
Duński fizyk Niels Bohr w 1922 rozrysował własną wersję układu okresowego, w którym umieścił pierwiastek 118 jako siódmy gaz szlachetny[6]. W 1965 Aristid von Grosse opublikował swoje przewidywania dotyczące prawdopodobnych właściwości pierwiastka 118 na podstawie ekstrapolacji właściwości znanych pierwiastków. Pomimo że w tym czasie nie powstała jeszcze koncepcja wyspy stabilności, spekulacje von Grossego okazały się zgodne z późniejszymi obliczeniami. Rzeczywiste właściwości chemiczne oganesonu nie zostały jeszcze zbadane i nie wiadomo, czy rzeczywiście zachowuje się jak gaz szlachetny[7].
Nieudane próby syntezy
Pod koniec 1998 polski fizyk Robert Smolańczuk opublikował obliczenia dotyczące fuzji jąder atomowych w celu otrzymywania superciężkich atomów, w tym przyszłego oganesonu. Jego wyliczenia sugerowały, że synteza tego pierwiastka może zostać przeprowadzona poprzez fuzję ołowiu i kryptonu w kontrolowanych warunkach[8].
W 1999 badacze w Lawrence Berkeley National Laboratory wykorzystali jego przewidywania i ogłosili odkrycie liwermoru oraz oganesonu w „Physical Review Letters”[9], po czym bardzo szybko wyniki zostały opisane w „Science”[10]. Badacze stwierdzili, że udało im się przeprowadzić reakcję:
- 8636Kr + 20882Pb → 293118Og + 10n
Wkrótce jednak okazało się, że ani inne grupy naukowców, ani badacze samego laboratorium w Berkeley nie byli w stanie powtórzyć wyniku i po dwóch latach od publikacji doniesienie zostało wycofane przez autorów[11]. W czerwcu 2002 dyrektor laboratorium ogłosił, że twierdzenie o odkryciu dwóch nowych pierwiastków oparte zostało na danych sfabrykowanych przez głównego autora, Wiktora Ninowa[12][13].
Potwierdzona synteza
W 2002 zespół naukowców rosyjskich ze Zjednoczonego Instytutu Badań Jądrowych w Dubnej, we współpracy z grupą amerykańską z Lawrence Livermore National Laboratory, pod kierownictwem fizyka jądrowego Jurija Oganiesiana, opublikował wstępny raport informujący o otrzymaniu pierwiastka 118[14]. Pełen artykuł o udanej syntezie badacze przesłali do redakcji pisma Physical Review C 31 stycznia 2006 (ukazał się on 9 października 2006)[15].
Otrzymali oni 3 lub 4 jądra oganesonu-294 (jedno lub dwa w 2002[14] i dwa kolejne w 2005). Otrzymano je przez zderzanie atomów kalifornu-249 z jonami wapnia-48[16][17][18][19][20]:
- 24998Cf + 4820Ca → 294118Og + 310n

Z powodu bardzo małego prawdopodobieństwa fuzji jądrowej (przekrój czynny wynosi około 0,3–0,6 pb, tj. (3–6)×10−41 m²), konieczne było długotrwałe bombardowanie próbki kalifornu strumieniem jonów wapnia – w ciągu 4 miesięcy trwania eksperymentu, w celu uzyskania jednego atomu pierwiastka 118, użyto ich 2,5×1019[21]. Bombardowanie kontynuowano przez kolejne miesiące, uzyskując dwa następne atomy pierwiastka 118. Prawdopodobieństwo, że zaobserwowany wynik nie był związany z powstaniem pierwiastka 118, lecz wywołały go szumy lub zjawiska przypadkowe, oszacowano na mniej niż 1:100 000, wobec czego można było przyjąć z dużą pewnością, że rzeczywiście uzyskano oczekiwany pierwiastek[22].
W doświadczeniach tych zaobserwowano rozpad alfa 3 atomów. Zaproponowano również czwarty rozpad, będący spontanicznym rozpadem jądra. Czas połowicznego rozpadu obliczono na 0,89 ms. W wyniku emisji cząstki alfa z 294
Og powstaje liwermor (290
Lv). Jako że rozpadowi uległy jedynie 3 jądra atomowe, okres półtrwania wyliczony z ich obserwacji cechuje się znaczną niepewnością: 0,89 +1,07−0,31 ms[15]. W 2015, na podstawie danych zebranych dla większej liczby atomów, czas połowicznego rozpadu 294
Og wyznaczono na 0,7 ms[23].
- 294118Og → 290116Lv + 42He
Identyfikacja jądra 294
Og zweryfikowana została przez niezależne wytworzenie przewidywanego produktu rozpadu 290
Lv bezpośrednio poprzez bombardowanie kiuru 245
Cm jonami wapnia 48
Ca:
- 24596Cm + 4820Ca → 290116Lv + 310n
i sprawdzenie, że rozpad 290
Lv pasuje do łańcucha rozpadu 294
Og. Powstające z rozpadu oganesonu jądro 290
Lv jest bardzo niestabilne i rozpada się w czasie 14 ms z wytworzeniem flerowu 286
Fl, rozpadającego się spontanicznie lub w przemianie α z wytworzeniem koperniku 282
Cn, którego jądro z kolei także podlega spontanicznemu rozpadowi[15].
Na podstawie obliczeń uwzględniających model zjawiska tunelowego okres połowicznego rozpadu przemiany alfa 294
Og przewidywano na 0,66 +0,23−0,18 ms[24], wartość eksperymentalną opublikowano w 2004[25]. Wyliczenia z makroskopowo-mikroskopowego modelu Muntiana-Hofmana-Patyka-Sobiczewskiego daje nieco mniejszą, ale porównywalną wartość[26].
W 2011 Międzynarodowa Unia Chemii Czystej i Stosowanej orzekła, że trzy zdarzenia odnotowane dla izotopu o liczbie atomowej 118 mają bardzo dobrą powtarzalność, jednak zaobserwowane reakcje jądrowe nie przebiegają z wytworzeniem żadnego znanego jądra izotopu, przez co doniesienia nie spełniają warunków uznania odkrycia nowego pierwiastka[27]. Natomiast w grudniu 2015 Joint Working Party Międzynarodowej Unii Chemii Czystej i Stosowanej (IUPAC) i Międzynarodowej Unii Fizyki Czystej i Stosowanej (IUPAP) uznała odkrycie pierwiastka 118 za potwierdzone i przypisała pierwszeństwo jego syntezy zespołowi rosyjsko-amerykańskiemu z Dubnej i Livermore[28].
Nazwa

Zgodnie z tradycyjnym nazewnictwem nieznanych pierwiastków chemicznych pierwiastek 118, jako położony poniżej radonu w układzie okresowym, nazywany był eka-radonem (funkcjonowała też nazwa eka-emanacja, gdyż radon określano nazwą emanacji)[29]. W 1979 IUPAC opublikowała reguły wstępnego nazewnictwa nowych pierwiastków, wg których pierwiastek 118 otrzymał nazwę ununoctium i symbol Uuo[30][31]. W publikacjach zazwyczaj stosowano jednak określenie opisowe pierwiastek 118[4][10][11][13][16][32].
Przed odwołaniem odkrycia w 2002 badacze z Berkeley chcieli nazwać pierwiastek ghiorsium (Gh), honorując tym samym Alberta Ghiorso, wiodącego członka zespołu badawczego[33].
Rosyjscy odkrywcy donieśli o swej syntezie w 2006. Zgodnie z rekomendacjami IUPAC odkrywcy nowego pierwiastka mają prawo zasugerować dla niego nazwę[34]. W 2007 szef instytutu podał, że zespół rozważa dwie nazwy dla nowego pierwiastka: flyorium na pamiątkę Gieorgija Nikołajewicza Florowa, założyciela laboratorium badawczego w Dubnej, oraz moskovium w związku z obwodem moskiewskim, na terenie którego leży Dubna[35]. Propozycje te uzasadniał twierdząc, że choć pierwiastek 118 otrzymany został dzięki współpracy z Amerykanami, którzy zapewnili niezbędny kaliforn, to podmoskiewskie Laboratorium Reakcji Jądrowych im. G.N. Florowa było jedynym obiektem na świecie, w którym można było osiągnąć taki rezultat[36]. Ostatecznie obie te nazwy zostały wykorzystane dla innych nowych pierwiastków: flerowem nazwano pierwiastek 114, a nazwę moskow nadano pierwiastkowi 115[1] (nazwę tę proponowano też dla pierwiastka 116[37], który jednak ostatecznie został nazwany liwermor[1]).
Tradycyjnie nazwy gazów szlachetnych kończą się na „-on” (wyjątek stanowi hel – gdy nadawano mu nazwę nie był przypisany on do grupy gazów szlachetnych). IUPAC w 2002 zaleciła wprawdzie, aby wszystkie nazwy nowych pierwiastków miały jednolitą końcówkę „-ium”[38], jednak w 2016 ograniczono tę zasadę do grup 1–16, zalecając dla nowych fluorowców tradycyjną końcówkę „-ine”[a], a dla helowców końcówkę „-on”[38].
W czerwcu 2016 IUPAC ogłosiła, że planuje nadać nowemu pierwiastkowi nazwę oganesson (symbol Og), honorując rosyjskiego fizyka jądrowego Jurija Oganiesiana. Równocześnie zaproponowano nazwy dla pierwiastków 113 (nihon), 115 (moskow) i 117 (tenes)[3]. Wszystkie zostały zatwierdzone 28 listopada 2016[1]. Według wstępnej opinii Komisji Terminologii Chemicznej Polskiego Towarzystwa Chemicznego nazwą tego pierwiastka w języku polskim jest oganeson[39]. W polskich mediach pojawiła się również (oprócz „oganeson”[40]) nazwa „oganessjan”[41].
Właściwości
Stabilność i izotopy
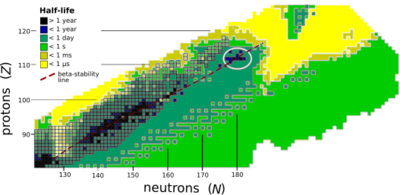
Stabilność jądra w znacznym stopniu maleje ze wzrostem liczby atomowej po plutonie, najcięższym z naturalnie występujących pierwiastków, wobec czego wszystkie izotopy o liczbie atomowej powyżej 101 (mendelew) szybko rozpadają się radioaktywnie (wyjątek stanowi dubn-268). Żaden pierwiastek o liczbie atomowej powyżej 82 (po ołowiu) nie ma stabilnych izotopów[42]. Niemniej, z powodu nie całkiem zrozumianych jeszcze przyczyn, stabilność jąder wzrasta nieznacznie wokół liczb atomowych od 110 (darmsztadt) do 114 (flerow), co w fizyce jądrowej określane jest jako wyspa stabilności (autor tej hipotezy, Glenn Seaborg proponuje możliwe przyczyny tego zjawiska, nie zostały one jednak powszechnie zaakceptowane)[43]. Oganeson jest radioaktywny. Jego czas połowicznego rozpadu wydaje się być mniejszy od milisekundy, jednak jest to czas i tak dłuższy, niż wynikało z niektórych przewidywań[24][44]. Wspiera to więc pogląd postulujący istnienie wyspy stabilności[44].
Wyliczenia z wykorzystaniem modelu tunelowania kwantowego przewidują istnienie kilku bogatych w neutrony izotopów oganesonu rozpadających się w przemianie α z okresem połowicznego rozpadu bliskim 1 ms[45][46].
Obliczenia teoretyczne związane z syntezą i dotyczące czasów półtrwania innych izotopów wykazały, że mogą istnieć nieco stabilniejsze izotopy od zsyntetyzowanego 294
Og, przy czym najprawdopodobniej są to 293
Og, 295
Og, 296
Og, 297
Og, 298
Og, 300
Og i 302
Og[24][47]. Z izotopów tych największe prawdopodobieństwo na posiadanie jąder o długim (w porównaniu z 294
Og) czasie połowicznego rozpadu wiąże się z 297
Og[24][47], wobec czego to na tym izotopie mogą się skupić przyszłe badania. Niektóre izotopy zawierające znacznie więcej neutronów (ulokowane około 313
Og), również mogą mieć jądra o dłuższym czasie półtrwania[48].
Obliczone właściwości atomowe i fizyczne
Oganeson należy do grupy 18, której pierwiastki cechują się zerową wartościowością. Są zazwyczaj niereaktywne w większości reakcji chemicznych, co jest spowodowane zapełnieniem powłoki walencyjnej (zawierającej 8 elektronów). Mają więc konfigurację o minimalnej energii, w której ich zewnętrzne elektrony są silnie związane[49]. Przypuszcza się, że oganeson będzie miał podobnie zapełnioną powłokę walencyjną o konfiguracji elektronowej 7s27p6[5]. W efekcie przewidywać można, że właściwościami fizycznymi i chemicznymi oganeson będzie przypominać inne pierwiastki swojej grupy (szczególnie radon, leżący nad nim w układzie okresowym)[50].
Podejrzewa się, że oganeson wykazywał będzie jak dotychczas najwyższą polaryzowalność ze wszystkich znanych pierwiastków układu okresowego (prawie dwukrotnie taką jak radon)[5]. Poprzez ekstrapolację danych dla innych gazów szlachetnych jego temperaturę wrzenia szacuje się na 320–380 K[5]. Wartość ta różni się znacznie od wcześniejszych oszacowań podających 263 K[51] bądź 247 K[52]. Nawet biorąc pod uwagę dużą niepewność tych obliczeń, wydaje się bardzo mało prawdopodobne, by oganeson w warunkach standardowych był gazem[5]. Z kolei zakres stanu ciekłego jest dla innych gazów szlachetnych bardzo wąski, między 2 i 9 K, wobec czego w warunkach standardowych pierwiastek ten powinien być ciałem stałym. Gdyby jednak oganeson w warunkach standardowych był gazem, to stanowiłby jedną z najgęstszych substancji gazowych w tych warunkach (nawet gdyby występował w postaci cząsteczek monoatomowych jak inne helowce).
Z powodu bardzo dużej polaryzowalności oganeson podejrzewa się o niezwykle małą energię jonizacji (podobną do obserwowanej u ołowiu, w przypadku którego wynosi ona 70% jej wartości dla radonu[53], jest ona znacznie mniejsza od energii jonizacji dla flerowu[54]) i standardowy stan skondensowany[5].
Przewidywane właściwości chemiczne
4, z prawej) byłby cząsteczką tetraedryczną
Zgodnie z zasadą okresowości oganeson powinien być nieco bardziej reaktywny od radonu, jednak obliczenia teoretyczne wykazały, że może on być nawet znacznie bardziej reaktywny[55]. Poza znacznie większą do radonu reaktywnością oganeson może być nawet bardziej reaktywny od flerowu czy koperniku[5]. Przyczyną znacznie zwiększonej reaktywności tego pierwiastka względem radonu jest destabilizacja energetyczna i zwiększenie rozmiarów ostatniej zapełnionej podpowłoki 7p. Precyzyjniej, poprzez między innymi sprzężenie spinowo-orbitalne między elektronami 7p a biernymi elektronami 7s2, dochodzi do zjawiska, w którym konfiguracja 7s27p2 flerowu jest na tyle stabilizowana, że można uważać ją za powłokę zapełnioną; tym samym zwiększenie liczby elektronów w atomie oganesonu będzie prowadziło do zmniejszenia jego stabilności[5]. Obliczono również, że oganeson, w przeciwieństwie do innych gazów szlachetnych, będzie wiązał elektron z uwolnieniem energii (będzie miał dodatnie powinowactwo elektronowe)[56][57], choć wprowadzenie poprawek kwantowo-elektrodynamicznych zmniejsza to powinowactwo dla jonu Og−
o 9% (co wskazuje, że uwzględnienie tego rodzaju poprawek w przypadku superciężkich pierwiastków jest istotne). Przyczyną wysokiego powinowactwa jest stabilizacja poziomu energetycznego 8s wynikająca z efektów relatywistycznych[58].
Dotychczas nie udało się zsyntetyzować żadnych związków oganesonu, jednak obliczenia teoretyczne ich dotyczące prowadzi się od 1964[29].
Obliczenia dotyczące cząsteczki dwuatomowej Og
2 wskazały wiązanie przypominające z grubsza Hg
2, z energią dysocjacji wynoszącą 6 kJ/mol (mniej więcej czterokrotnie większą od Rn
2). Ponadto wyliczona długość wiązania była mniejsza od długości wiązania w cząsteczce Rn
2 o 0,16 Å, co wskazuje na silne oddziaływanie tworzące wiązanie. Z drugiej strony OgH+
wykazuje energię dysocjacji (innymi słowy powinowactwo oganesonu do protonu) mniejsze niż RnH+
[5]. Przewidywane wiązanie między oganesonem a wodorem w OgH byłoby bardzo słabe i należałoby je nawet rozpatrywać raczej jako czyste oddziaływanie van der Waalsa niż jako rzeczywiste wiązanie chemiczne[53].
Obliczenia wskazują, że oganeson jest najbardziej elektroujemny z grupy gazów szlachetnych[55] i powinien być zdolny do wiązania się stabilniej z pierwiastkami wysoce elektroujemnymi, niż przykładowo kopernik lub flerow[53]. Przewiduje się stabilne stopnie utlenienia II i IV we fluorkach OgF
2 i OgF
4[55][59], które powinny być trwalsze niż analogiczne związki ksenonu i radonu dzięki opisanemu wyżej silnemu efektowi spinowo-orbitalnemu[55]. Stopień utlenienia VI byłby z kolei mniej stabilny z powodu tego samego silnego związania podpowłoki 7p1/2[7], które zwiększa reaktywność tego pierwiastka. Przykładowo wykazano, że reakcja oganesonu z fluorem (F
2) z wytworzeniem OgF
2 wydzieliłaby energię 106 kcal/mol, z której około 46 kcal/mol wynikałoby właśnie z tego oddziaływania. Dla porównania sprzężenie spinowo-orbitalne podobnej cząsteczki RnF
2 odpowiada za około 10 kcal/mol z energii tworzenia wynoszącej 49 kcal/mol[53]. To samo oddziaływanie stabilizuje tetraedryczną geometrię Td OgF
4, w odróżnieniu od płaskiej D4h XeF
4[59]. Wiązanie Og−F najprawdopodobniej będzie wykazywało charakter w większym stopniu jonowy niż kowalencyjny, czyniąc fluorki oganesonu nielotnymi[55][60]. Przewiduje się też, że oganeson powinien być zdolny do tworzenia wiązań Og−Cl[55] (spośród związków innych gazów szlachetnych znany jest na przykład XeCl
2, o budowie liniowej[61]).
Uwagi
- ↑ Wszystkie angielskie nazwy fluorowców mają końcówki „-ine”: fluorine, chlorine, bromine, iodine, astatine i tennessine. W nazwach polskich nie ma podobnej reguły: fluor, chlor, brom, jod, astat, tenes.
Przypisy
- ↑ a b c d IUPAC Announces the Names of the Elements 113, 115, 117, and 118 [online], International Union of Pure and Applied Chemistry, 30 listopada 2016 [dostęp 2017-06-10] (ang.).
- ↑ Nicholas St. Fleur, Four New Names Officially Added to the Periodic Table of Elements [online], New York Times, 31 maja 2017 [dostęp 2017-06-10] (ang.).
- ↑ a b IUPAC is Naming The Four New Elements Nihonium, Moscovium, Tennessine, And Oganesson [online], International Union of Pure and Applied Chemistry, 8 czerwca 2016 [dostęp 2017-06-10] (ang.).
- ↑ a b Alex Stone, 99. Element 118 Debuts On the Periodic Table, [w:] The Top 6 Physics Stories of 2006 [online], Discover Magazine, 7 stycznia 2007, s. 2 [dostęp 2017-05-30] (ang.).
- ↑ a b c d e f g h i Clinton S. Nash, Atomic and Molecular Properties of Elements 112, 114, and 118, „Journal of Physical Chemistry A”, 109 (15), 2005, s. 3493–3500, DOI: 10.1021/jp050736o, PMID: 16833687 (ang.).
- ↑ Mark R. Leach, The Internet Database of Periodic Tables [online] [dostęp 2017-06-10] (ang.).
- ↑ a b Burkhard Fricke, Superheavy elements: a prediction of their chemical and physical properties, „Recent Impact of Physics on Inorganic Chemistry”, 21, 1975, s. 89–144, DOI: 10.1007/BFb0116498 (ang.).
- ↑ Robert Smolanczuk, Production mechanism of superheavy nuclei in cold fusion reactions, „Physical Review C”, 59 (5), 1999, s. 2634–2639, DOI: 10.1103/PhysRevC.59.2634, Bibcode: 1999PhRvC..59.2634S.
- ↑ Viktor Ninov, Observation of Superheavy Nuclei Produced in the Reaction of Krypton-86 with Lead-208, „Physical Review Letters”, 83 (6), 1999, s. 1104–1107, DOI: 10.1103/PhysRevLett.83.1104, Bibcode: 1999PhRvL..83.1104N.
- ↑ a b R.F. Service, Berkeley Crew Bags Element 118, „Science”, 284 (5421), 1999, s. 1751, DOI: 10.1126/science.284.5421.1751.
- ↑ a b Public Affairs Department, Results of element 118 experiment retracted [online], Berkeley Lab, 21 lipca 2001 [dostęp 2017-05-30].
- ↑ R. Dalton, Misconduct: The stars who fell to Earth, „Nature”, 420 (6917), 2002, s. 728–729, DOI: 10.1038/420728a, PMID: 12490902, Bibcode: 2002Natur.420..728D.
- ↑ a b Element 118 disappears two years after it was discovered [online], Physicsworld.com [dostęp 2017-05-31] [zarchiwizowane z adresu 2007-10-12] (ang.).
- ↑ a b Yu.Ts. Oganessian i inni, Results from the first 249Cf+48Ca experiment, „Communication of the Joint Institute for Nuclear Research”, D7-2002-287, 2002 (ang.).
- ↑ a b c d Yu.Ts. Oganessian i inni, Synthesis of the isotopes of elements 118 and 116 in the 249Cf and 245Cm+48Ca fusion reactions, „Physical Review C”, 74 (4), 2006, s. 044602, DOI: 10.1103/PhysRevC.74.044602, Bibcode: 2006PhRvC..74d4602O (ang.).
- ↑ a b Anne M. Stark, Livermore scientists team with Russia to discover element 118 [online], Lawrence Livermore National Laboratory, 3 grudnia 2006 [dostęp 2017-05-31] (ang.).
- ↑ Yuri Oganessian, Synthesis and decay properties of superheavy elements, „Pure and Applied Chemistry”, 78 (5), 2006, s. 889–904, DOI: 10.1351/pac200678050889 (ang.).
- ↑ Katharine Sanderson, Heaviest element made – again, Nature News, 17 października 2006, DOI: 10.1038/news061016-4 (ang.).
- ↑ Phil Schewe, Ben Stein, Davide Castelvecchi, Elements 116 and 118 Are Discovered, [w:] Physics News Update [online], American Institute of Physics, 17 października 2006 [zarchiwizowane z adresu 2012-01-01] (ang.).
- ↑ Rick Weiss, Scientists Announce Creation of Atomic Element, the Heaviest Yet [online], Washington Post, 2006 [dostęp 2017-06-03] (ang.).
- ↑ Oganesson: historical information [online], WebElements Periodic Table [dostęp 2017-05-30] (ang.).
- ↑ Mitch Jacoby, Element 118 Detected, With Confidence [online], Chemical & Engineering News, 17 października 2006 [dostęp 2017-05-30] (ang.).
- ↑ Yuri Ts. Oganessian, Krzysztof P. Rykaczewski, A beachhead on the island of stability, „Physics Today”, 8, 68, 2015, s. 32, DOI: http://dx.doi.org/10.1063/PT.3.2880.
- ↑ a b c d Roy P. Chowdhury, C. Samanta, D.N. Basu, Alpha decay half-lives of new superheavy elements, „Physical Review C”, 73, 2006, s. 014612, DOI: 10.1103/PhysRevC.73.014612, Bibcode: 2006PhRvC..73a4612C, arXiv:nucl-th/0507054.
- ↑ Yu. Ts. Oganessian i inni, Measurements of cross sections and decay properties of the isotopes of elements 112, 114, and 116 produced in the fusion reactions 233,238U, 242Pu, and 248Cm+48Ca, „Physical Review C”, 70 (6), 2004, s. 064609, DOI: 10.1103/PhysRevC.70.064609, Bibcode: 2004PhRvC..70f4609O (ang.).
- ↑ C. Samanta, R.P. Chowdhury, D.N. Basu, Predictions of alpha decay half-lives of heavy and superheavy elements, „Nuclear Physics A”, 789, 2007, s. 142–154, DOI: 10.1016/j.nuclphysa.2007.04.001, Bibcode: 2007NuPhA.789..142S, arXiv:nucl-th/0703086 (ang.).
- ↑ Robert C. Barber i inni, Discovery of the elements with atomic numbers greater than or equal to 113 (IUPAC Technical Report), „Pure and Applied Chemistry”, 83 (7), 2011, s. 1, DOI: 10.1351/PAC-REP-10-05-01 (ang.).
- ↑ Discovery and Assignment of Elements with Atomic Numbers 113, 115, 117 and 118 [online], International Union of Pure and Applied Chemistry, 30 grudnia 2015 [dostęp 2017-04-01] (ang.).
- ↑ a b A.V. Grosse, Some physical and chemical properties of element 118 (Eka-Em) and element 86 (Em), „Journal of Inorganic and Nuclear Chemistry”, 27 (3), 1965, s. 509–519, DOI: 10.1016/0022-1902(65)80255-X.
- ↑ J. Chatt, Recommendations for the Naming of Elements of Atomic Numbers Greater than 100, „Pure and Applied Chemistry”, 51 (2), 1979, s. 381–384, DOI: 10.1351/pac197951020381 (ang.).
- ↑ M.E. Wieser, Atomic weights of the elements 2005 (IUPAC Technical Report), „Pure and Applied Chemistry”, 78 (11), 2006, s. 2051–2066, DOI: 10.1351/pac200678112051 (ang.).
- ↑ Transactinides and the future elements, [w:] Darleane C. Hoffman, Diana M. Lee, Valeria Pershina, The Chemistry of the Actinide and Transactinide Elements, wyd. 3, Dordrecht: Springer Science+Business Media, 2006, ISBN 1-4020-3555-1 (ang.).
- ↑ Discovery of New Elements Makes Front Page News [online], Berkeley Lab Research Review, 1999 [dostęp 2017-06-04] (ang.).
- ↑ W.H. Koppenol, Naming of new elements (IUPAC Recommendations 2002), „Pure and Applied Chemistry”, 74 (5), 2002, s. 787, DOI: 10.1351/pac200274050787 (ang.).
- ↑ Erika Niedowski, New chemical elements discovered in Russia’s Science City [online], 12 lutego 2007 [dostęp 2017-06-04] (ang.).
- ↑ Ася Емельянова, 118-й элемент назовут по-русски [online], Вести.ru, 17 grudnia 2006 [dostęp 2017-06-10] (ros.).
- ↑ Российские физики предложат назвать 116 химический элемент московием [online], РИА Новости, 26 marca 2011 [dostęp 2017-06-10] (ros.).
- ↑ a b Willem H. Koppenol i inni, How to name new chemical elements (IUPAC Recommendations 2016), „Pure and Applied Chemistry”, 88 (4), 2016, DOI: 10.1515/pac-2015-0802 (ang.).
- ↑ O nazwach pierwiastków 113, 115, 117 i 118 w języku polskim oraz o nazw tych odmianie [online], Komisji Terminologii Chemicznej PTChem [dostęp 2019-06-20] [zarchiwizowane z adresu 2019-06-20].
- ↑ Nowe nazwy dla nowych pierwiastków [online], Wyborcza.pl, 9 czerwca 2016 [dostęp 2017-06-10].
- ↑ Energia z kwarków? Kanadyjscy fizycy są na tropie chłodnej materii kwarkowej [online], Wyborcza.pl, 27 czerwca 2018 [dostęp 2018-06-28].
- ↑ Pierre de Marcillac i inni, Experimental detection of α-particles from the radioactive decay of natural bismuth, „Nature”, 422 (6934), 2003, s. 876–878, DOI: 10.1038/nature01541, PMID: 12712201, Bibcode: 2003Natur.422..876D.
- ↑ Glenn D. Considine, Peter H. Kulik, Van Nostrand’s Scientific Encyclopedia, wyd. 9, Wiley-Interscience, 2002, ISBN 978-0-471-33230-5, OCLC 223349096.
- ↑ a b Yu. Ts. Oganessian, Heaviest nuclei from 48Ca-induced reactions, „Journal of Physics G: Nuclear and Particle Physics”, 34 (4), 2007, R165–R242, DOI: 10.1088/0954-3899/34/4/R01, Bibcode: 2007JPhG...34..165O.
- ↑ Roy P. Chowdhury, C. Samanta, D.N. Basu, Search for long lived heaviest nuclei beyond the valley of stability, „Physical Review C”, 77 (4), 2008, s. 044603, DOI: 10.1103/PhysRevC.77.044603, Bibcode: 2008PhRvC..77d4603C.
- ↑ R.P. Chowdhury, C. Samanta, D.N. Basu, Nuclear half-lives for α -radioactivity of elements with 100 ≤ Z ≤ 130, „Atomic Data and Nuclear Data Tables”, 94 (6), 2008, s. 781–806, DOI: 10.1016/j.adt.2008.01.003, Bibcode: 2008ADNDT..94..781C.
- ↑ a b G. Royer, K. Zbiri, C. Bonilla, Entrance channels and alpha decay half-lives of the heaviest elements, „Nuclear Physics A”, 3–4, 730, 2004, s. 355–376, DOI: 10.1016/j.nuclphysa.2003.11.010, Bibcode: 2004NuPhA.730..355R, arXiv:nucl-th/0410048.
- ↑ S.B. Duarte i inni, Half-life predictions for decay modes of superheavy nuclei, „Journal of Physics G: Nuclear and Particle Physics”, 30 (10), 2004, s. 1487–1494, DOI: 10.1088/0954-3899/30/10/014, Bibcode: 2004JPhG...30.1487D.
- ↑ Richard F.W. Bader, An Introduction to the Electronic Structure of Atoms and Molecules [online], McMaster University [dostęp 2017-06-10] (ang.).
- ↑ Ununoctium (Uuo) – Chemical properties, Health and Environmental effects [online], Lenntech [zarchiwizowane z adresu 2008-01-16] (ang.).
- ↑ Glenn Theodore Seaborg, Modern Alchemy, World Scientific, 1994, s. 172, ISBN 981-02-1440-5 (ang.).
- ↑ N. Takahashi, Boiling points of the superheavy elements 117 and 118, „Journal of Radioanalytical and Nuclear Chemistry”, 251 (2), 2002, s. 299–301, DOI: 10.1023/A:1014880730282.
- ↑ a b c d Young-Kyu Han i inni, Spin–orbit effects on the transactinide p-block element monohydrides MH (M=element 113–118), „Journal of Chemical Physics”, 112 (6), 2000, s. 2684, DOI: 10.1063/1.480842, Bibcode: 2000JChPh.112.2684H (ang.).
- ↑ Clinton S. Nash, Bruce E. Bursten, Spin-Orbit Effects, VSEPR Theory, and the Electronic Structures of Heavy and Superheavy Group IVA Hydrides and Group VIIIA Tetrafluorides. A Partial Role Reversal for Elements 114 and 118, „Journal of Physical Chemistry A”, 1999 (3), 1999, s. 402–410, DOI: 10.1021/jp982735k.
- ↑ a b c d e f Uzi Kaldor, Stephen Wilson, Theoretical Chemistry and Physics of Heavy and Superheavy Elements, Springer, 2003, s. 105–106, DOI: 10.1007/978-94-017-0105-1_3, ISBN 1-4020-1371-X (ang.).
- ↑ Igor Goidenko i inni, QED corrections to the binding energy of the eka-radon (Z=118) negative ion, „Physical Review A”, 67 (2), 2003, 020102(R), DOI: 10.1103/PhysRevA.67.020102, Bibcode: 2003PhRvA..67b0102G (ang.).
- ↑ Ephraim Eliav i inni, Element 118: The First Rare Gas with an Electron Affinity, „Physical Review Letters”, 77 (27), 1996, s. 5350–5352, DOI: 10.1103/PhysRevLett.77.5350, PMID: 10062781, Bibcode: 1996PhRvL..77.5350E (ang.).
- ↑ Arie Landau i inni, Benchmark calculations of electron affinities of the alkali atoms sodium to eka-francium (element 119), „Journal of Chemical Physics”, 115 (6), 2001, s. 2389–2392, DOI: 10.1063/1.1386413, Bibcode: 2001JChPh.115.2389L [dostęp 2015-09-15].
- ↑ a b Young-Kyu Han, Yoon Sup Lee, Structures of RgFn (Rg = Xe, Rn, and Element 118. n = 2, 4.) Calculated by Two-component Spin-Orbit Methods. A Spin-Orbit Induced Isomer of (118)F4, „Journal of Physical Chemistry A”, 103 (8), 1999, s. 1104–1108, DOI: 10.1021/jp983665k.
- ↑ Kenneth S. Pitzer, Fluorides of radon and element 118, „Journal of the Chemical Society, Chemical Communications” (18), 1975, s. 760–761, DOI: 10.1039/C3975000760b.
- ↑ Davide M. Proserpio, Roald Hoffmann, Kenneth C. Janda, The xenon-chlorine conundrum: van der Waals complex or linear molecule?, „Journal of the American Chemical Society”, 113 (19), 1991, s. 7184–7189, DOI: 10.1021/ja00019a014.
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||