Wikiprojekt:Tłumaczenie artykułów/Metabolizm

Metabolizm to całokształt zachodzących w żywych komórkach reakcji chemicznych i związanych z nimi przemian energii, stanowiący podstawę wszelkich zjawisk biologicznych[1]. Procesy te pozwalają komórce na wzrost i reprodukcję, zarządzanie swoją strukturą wewnętrzną oraz odpowiadanie na bodźce zewnętrzne. Metabolizm można podzielić na dwie grupy procesów: katabolizm i anabolizm. Pierwsze z nich są źródłem energii, na przykład w procesie rozkładu wyższych związków organicznych do niższych, drugie zużywają powstałą w ten sposób energię do syntezy i konstrukcji elementów komórki, jak białka i kwasy nukleinowe.
Reakcje chemiczne składające się na metabolizm są zorganizowane w szlaki metaboliczne, w których związki chemiczne przekształcane są za pomocą określonej sekwencji reakcji chemicznych, w większości obsługiwanych przez enzymy. Enzymy pozwalają na przeprowadzanie niezbędnych, lecz bez ich udziału mało prawdopodobnych termodynamicznie reakcji, poprzez łączenie ich z odpowiednimi innymi reakcjami (dającymi odpowiedni efekt termodynamiczny netto lub elektrochemiczny). Pozwalają one również na regulację tempa metabolizmu w zależności od zmian środowiska komórki lub sygnałów pochodzących z innych komórek.
Charakterystyka metabolizmu danego organizmu decyduje o zakwalifikowaniu danej substancji jako "pożywnej" lub "trującaj", w zależności od możliwości jej przetworzenia i użycia. Dla przykładu, niektóre organizmy prokariotyczne (np. bakterie z rodzaju Beggiatoa) używają siarkowodoru jako źródła energii, włączając go w swoje szlaki metaboliczne, podczas gdy m.in. dla zwierząt gaz ten jest trujący[2] (H2S blokuje oksydazę cytochromową[3]). Tempo metabolizmu określa natomiast ilość pożywienia, jaka będzie niezbędna do prawidłowego funkcjonowania danego organizmu.
Szlaki metaboliczne nawet u gatunków o niezwykle dalekim pokrewieństwie jego wykazują duże podobieństwo. Przykładowo zestaw pośredników chemicznych, tożsamych w funkcji i niezwykle podobnych w strukturze, biorących udział w cyklu kwasu cytrynowego można znaleźć zarówno u jednokomórkowych bakterii Escherichia coli, jak i u dużych organizmów wielokomórkowych [4]. Ta uniwersalność szlaków metabolicznych jest prawdopodobnie efektem ich dużej wydajności, a więc istniejącej, dodatniej presji ewolucyjnej do ich podtrzymania, a także wczesnego pojawienia się w ewolucyjnej historii życia [5][6].
Podstawowe substancje[edytuj | edytuj kod]

Większość struktur tworzących ciała zwierząt, roślin i innych żywych organizmów zbudowana jest z trzech podstawowych typów molekuł: aminokwasów, węglowodanów oraz lipidów. Jako że cząsteczki te są niezbędne dla życia, w procesach anabolicznych organizm zajmuje się tworzeniem ich jako elementów budowy swoich komórek czy tkanek oraz - w przypadku pożywienia - katabolicznym rozkładem i czerpaniem z zawartej w nich energii, ewentualnie pozyskiwaniem prostszych związków na drodzę rozkładu bardziej złożonych. Wiele z tych substancji może łączyć się w polimery (np. DNA czy białka). Makrocząsteczki te stanowią niezbędny składnik każdego żywego organizmu. Niektóre z nich uwzględnione zostały w poniższej tabeli.
| Typ molekuły | Nazwa formy monomerycznej | Nazwa formy polimerycznej | Przykłady form polimerycznych |
|---|---|---|---|
| Aminokwasy | Aminokwasy | Białka (zwane też polipeptydami) | Białka fibrylarne i globuliny |
| Węglowodany | Monosacharydy | Polisacharydy | Skrobia, glikogen and celuloza |
| Kwasy nukleinowe | Nukleotydy | Polinukleotydy | DNA i RNA |
Aminokwasy i białka[edytuj | edytuj kod]
Białka zbudowane są z aminokwasów, połączonych liniowo wiązaniami peptydowymi. Wiele białek to enzymy katalizujące reakcje chemiczne metabolizmu. Inne pełnią funkcje strukturalne i mechaniczne, na przykład budują cytoszkielet stanowiący "rusztowanie" komórki[7]. Są również ważnym elementem procesów takich, jak sygnalizacja komórkowa, odpowiedź immunologiczna, adhezja komórkowa, transport aktywny pomiędzy błonami, cykl komórkowy i wiele innych[8]. Większość procesów komórkowych oparta jest na białkach.
Lipidy[edytuj | edytuj kod]
Lipidy to najbardziej zróżnicowana grupa substancji biochemicznych. Definiowane są jako hydrofobowe lub amfifilowe cząsteczki o znaczeniu biologicznym, rozpuszczalne w rozpuszczalnikach organicznych (na przykład benzenie czy chloroformie)[9]. Lipidy (u eukariota głównie fosfolipidy) budują błony biologiczne, jak błona komórkowa, oraz są alternatywnym źródłem energii [8]. Z kolei tłuszcze (trójglicerydy) to duża grupa lipidów zbudowanych z kwasów tłuszczowych oraz glicerolu. Cząsteczka glicerolu połączona jest z trzema cząsteczkami kwasów tłuszczowych[10]. W praktyce istnieje kilka wersji tej podstawowej struktury, zawierających na przykład dodatkowe grupy funkcyjne, takie jak fosforany w fosfolipidach. Steroidy, inna klasa lipidów, na przykład cholesterol czy estrogen, stanowią kolejne duże grupy lipidów produkowanych przez komórki[11].
Węglowodany[edytuj | edytuj kod]

Węglowodany to nierozgałęzione ketony lub aldehydy podstawione wieloma grupami hydroksylowymi i występujące w postaci łańcuchowej lub pierścieniowej. Są one najbardziej rozpowszechnionymi substancjami spośród wcześniej wymienionych i pełnią niezliczoną ilość funkcji, m.in. przechowywania i transportu energii (skrobia i glikogen), budowy jednostek strukturalnych (celuloza u roślin, chityna u zwierząt)[8]. Podstawowe monomery węglowodanowe, takie jak galaktoza, fruktoza i - najpopularniejsza - glukoza nazywane są monosacharydami. Mogą one łączyć się ze sobą na niemal nieograniczoną liczbę sposobów, tworząc polisacharydy[12].
Nukleotydy[edytuj | edytuj kod]
Polimery zwane DNA i RNA to długie łańcuchy nukleotydów. Molekuły te są niezbędne dla przechowywania i wykorzystywania informacji genetycznych, za pomocą procesów transkrypcji i biosyntezy białek[8]. Informacje te chronione są przez mechanizmy naprawy DNA i powielane w procesie replikacji. Genom niektórych wirusów zapisany jest przy pomocy kwasu RNA; przykładem jest HIV, który używa systemu odwrotnej transkrypcji aby utworzyć kopię DNA ze swojego genomu RNA[13]. RNA w postaci rybozymów, takich jak spliceosomy czy rybosomy, pełni funkcję podobną do enzymów, mianowicie katalizuje reakcje chemiczne. Poszczególne nukleozydy powstają podczas dołączania cukru rybozy do właściwej zasady heterocyklicznej. Zasady te to związki zwane purynami i pirymidynami: RNA tworzą adenina (A), uracyl (U, w cząsteczkach DNA zamiast uracylu występuje tymina - T), cytozyna (C) i guanina (G). Nukleotydy często pełnią też rolę koenzymów w reakcjach transferu grup metabolicznych[14].
Koenzymy[edytuj | edytuj kod]

Metabolizm składa się z reakcji różnego typu, większość z nich jednak można zakwalifikować do kilku podstawowych grup ze względu na rodzaj przenoszonej grupy funkcyjnej[15]. Pozwoliło to komórkom na wykształcenie odpowiednich elementów metabolizmu odpowiedzialnych właśnie za przenoszenie tych grup pomiędzy różnymi związkami[14]. Są one zwane koenzymami. Każdemu rodzajowi reakcji przyporządkowany jest określony koenzym; w komórce trwa nieprzerwanie proces tworzenia ich, więc po pewnym czasie są one rozkładane i wykorzystywane ponownie przez odpowiednie enzymy[16].
Przykładowym koenzymem jest adenozynotrójfosforan (ATP), nośnik energii chemicznej w komórkach. Nukleotyd ten używany jest do transferu energii chemicznej pomiędzy poszczególnymi reakcjami. Komórki zawierają stosunkowo niewielką ilość ATP, ale zapasy tego związku są nieprzerwanie odnawiane, toteż organizm ludzki zużywa w ciągu doby ilość ATP odpowiadającą masie jego ciała[16]. ATP stanowi łącznik pomiędzy katabolizmem i anabolizmem, jako że reakcje kataboliczne generują jego cząsteczki, zaś reakcje anaboliczne rozkładają je do ADP. Związek ten pełni także funkcję nośnika reszt fosforanowych w reakcjach fosforylacji.
Witaminy to [związki organiczne]] potrzebne organizmowi do prawidłowego funkcjonowania, jednak niemożliwe do wytworzenia w komórkach. U człowieka większość witamin funkcjonuje jako zmodyfikowane koenzymy; dla przykładu, wszystkie witaminy rozpuszczalne w wodzie występują w komórkach w postaci sfosforylizowanej lub są połączone z nukleotydami[17]. Dinukleotyd nikotynoamidoadeninowy (NADH), pochodna witaminy B3 (niacyny), jest ważnym koenzymem pełniącym funkcję akceptora wodoru. Setki różnych typów dehydrogenaz odbierają elektrony substratom reakcji i redukują NAD+ do NADH. Ta zredukowana postać koenzymu staje się następnie substratem przy tworzeniu różnych reduktaz, enzymów zajmujących się redukcją odpowiednich związków[18]. Dinukleotyd nikotynoamidoadeninowy występuje w komórce w dwóch powiązanych ze sobą formach, NADH i NADPH. Formy NAD+/NADH są częściej wykorzystywane w reakcjach katabolicznych, podczas gdy NADP+/NADPH mają duże znaczenie dla przebiegu reakcji anabolicznych.
Minerały i kofaktory[edytuj | edytuj kod]

Związki nieorganiczne pełnią ważną rolę w procesach metabolizmu; niektóre z nich występują w dość obfitych ilościach (na przykład sód i potas), podczas gdy inne zaspokajają w pełni potrzeby organizmu w ilościach zaledwie śladowych. Na około 99% masy ssaków składa się 9 pierwiastków: węgiel, wodór, tlen, azot, siarka, wapń, chlor, sód i potas[19]. Związki organiczne (białka, lipidy i węglowodany) skupiają większość węgla i azotu, podczas gdy największa część tlenu i wodoru zawarta jest w wodzie[19].
Główną część występujących w organizmie związków nieorganicznych stanowią jonowe elektrolity, takie jak sód, potas, wapń, magnez, chlorki, fosforany oraz wodorowęglany. Dokładne wartości stężeń poszczególnych jonów regulują mechanizmy ciśnienia osmotycznego i współczynnik pH[20]. Jony są również niezbędne dla prawidłowego funkcjonowanie nerwów i mięśni, jako że potencjał czynnościowy pobudzający je do działania powstaje podczas wymiany elektrolitów pomiędzy płynem pozakomórkowym a cytozolem[21]. Elektrolity dostają się do komórek i wydostają z nich poprzez pory tworzone przez białka błony komórkowej zwane kanałami jonowymi. Przykładowo, napięcie mięśniowe zależne jest od przepływu jonów wapnia, sodu i potasu przez owe kanały i tubule T (wpuklenia w błonie komórkowej włókien mięśniowych przyspieszające rozprzestrzenianie się impulsów elektrycznych)[22].
Metale przejściowe występują w organizmach w ilościach śladowych; najbardziej rozpowszechnione z nich to cynk i żelazo[23][24]. Metale te, występujące w niektórych białkach i kofaktorach, są również niezbędne dla funkcjonowania takich enzymów jak katalaza oraz białek transportujących tlen, na przykład hemoglobiny[25]. Kofaktory te związane są trwale z jednym typem proteiny; mimo że kofaktory enzymów mogą podczas katalizy ulegać modyfikacjom, po przeprowadzeniu reakcji zawsze wracają do postaci pierwotnej. Metale będące mikroelementami są przenoszone w głąb organizmu za pomocą specyficznych nośników i wiązane z białkami przechowującymi je, np. ferrytyną czy metallotioneiną[26][27].
Katabolizm[edytuj | edytuj kod]
Katabolizm stanowi grupa reakcji chemicznych prowadzących do uwolnienia energii. W jej skład wchodzą zarówno procesy rozkładania i utleniania cząsteczek pożywienia, jak i reakcje wiązania energii słonecznej. Ich wspólnym celem jest dostarczenie energii i składników niezbędnych dla reakcji anabolicznych. Szczegółowy charakter tych procesów zależy już od organizmu: cząstki organiczne stanowią żródło energii w odżywianiu organotroficznym, materia nieorganiczna - w litotroficznym, a organizmy fototroficzne wiążą energię słoneczną. Jednak wszystkie te formy metabolizmu mają na celu utworzenie potencjału redoks pozwalającego na przenoszenie elektronów pomiędzy zredukowanymi cząstkami (materią organiczną, amoniakiem, siarkowodorem, jonami żelaza) a akceptorami, na przykład tlenem, azotanami i siarczanami.[28] W metabolizmie zwierząt reakcje te prowadzą do rozbicia cząstek organicznych do prostych związków, najczęściej dwutlenku węgla i wody, z uwolnieniem energii. U organizmów fotosyntetycznych, takich jak rośliny i Cyanobacteria, transfer elektronów nie prowadzi do wydzielenia energii, a do przechowywania energii pochłoniętej ze światła słonecznego[8].
Najpowszechniejszy schemat reakcji katabolicznych w organizmach zwierząt można podzielić na trzy główne etapy. Podczas pierwszego z nich duże molekuły substancji organicznych - białek, polisacharydów czy lipidów są trawione w układzie pokarmowym na mniejsze cząsteczki. Następnie są one transportowane do komórek i rozkładane do jeszcze mniejszych elementów (najczęściej acetylo-CoA), podczas czego uwalniana jest energia. Wreszcie grupa acetylowa utleniana jest do wody i dwutlenku węgla podczas cyklu Krebsa i w łańcuchu oddechowym, wyzwalając energię przechowywaną poprzez redukcję enzymu dinukleotydu nikotynamidoadeninowego (NAD+) do NADH.
Trawienie[edytuj | edytuj kod]
Makromolekuły takie jak skrobia, celuloza czy białka nie mogą być bezpośrednio wchłonięte przez komórki, muszą więc zostać wcześniej rozłożone na mniejsze cząstki. Istnieje kilka rodzajów enzymów trawiących te polimery: proteazy rozkładające białka na aminokwasy, lipazy trawiące lipidy do kwasów tłuszczowych czy glukozydazy depolimeryzujące polisacharydy.
Mikroorganizmy wydzielają enzymy trawienne do swojego otoczenia[29][30], podczas gdy zwierzęta produkują je w odpowiednio wyspecjalizowanych komórkach[31]. Aminokwasy i cukry uwolnione przez te pozakomórkowe enzymy są następnie wtłaczane do wnętrza komórek za pomocą specjalnych białek transportu aktywnego[32][33].
Katabolizm związków organicznych[edytuj | edytuj kod]

Katabolizm węglowodanów polega głównie na rozkładaniu ich na mniejsze cząstki. Są one transportowane do komórek wkrótce po strawieniu do monosacharydów[34]. Kolejnym etapem katabolizmu jest glikoliza, podczas z cukrów takich jak glukoza czy fruktoza powstaje kwas pirogronowy, przy czym wydziela się wiązana w ATP energia[35]. Kwas pirogronowy jest elementem występującym w kilku szlakach metabolicznych, jednak zdecydowana większość jego cząsteczek jest przekształcana w acetylo-CoA i włączana w cykl kwasu cytrynowego. Mimo że podczas samego cyklu powstaje również kilka cząsteczek ATP, jego najważniejszym produktem jest NADH powstałe z NAD+ w chwili utleniania acetylo-CoA. Produktem ubocznym tego procesu jest CO2. W warunkach beztlenowych glikoliza produkuje kwas mlekowy za pomocą enzymu laktatodehydrogenazy, utleniającego ponownie NADH do NAD+ dla powtórnego użycia w glikolizie. Alternatywną drogą rozkładu glukozy jest szlak pentozofosforanowy, podczas którego następuje redukcja koenzymu NADPH i produkcja cukrów pentozowych takich jak ryboza, cukrowy komponent kwasu nukleinowego.
Katabolizm tłuszczy odbywa się poprzez proces hydrolizy, podczas którego uwalniane są kwasy tłuszczowe i glicerol. Glicerol przechodzi glikolizę, zaś kwasy tłuszczowe rozpadają się podczas beta-oksydacji i przechodzą w Acetylo-CoA, wchodzący następnie w cykl kwasu cytrynowego. Utlenianie kwasów tłuszczowych wyzwala więcej energii niż utlenianie glukozy, ponieważ węglowodany zawierają w swych strukturach więcej tlenu.
Aminokwasy mogą być użyte jako budulec dla białek i innch biomolekuł, lub też - po utlenieniu do mocznika i dwutlenku węgla - jako źródło energii[36]. Proces oksydacji zaczyna się usunięciem grupy aminowej podczas transaminazy. Wchodzi ona w cykl ornitynowy, pozostawiając zdeaminowany szkielet węglowy w postaci ketokwasu. Niektóre z tych kwasów pełnią później różne role w cyklu kwasu cytrynowego, na przykład deaminują glutamian - kwas alfa-ketoglutaryczny[37]. Aminokwasy glukogenne mogą również przekształcić się w glukozę w procesie glukogenezy (patrz poniżej)[38].
Fosforylacja oksydacyjna[edytuj | edytuj kod]
W procesie fosforylacji oksydacyjnej, elektrony pobrane z molekuł pożywienia w drodze m.in. cyklu kwasu cytrynowego przekazywane są cząsteczkom tlenu, a uwolniona energia używana jest do tworzenia ATP. U eukariotów dzieje się to za pośrednictwem grupy białek występujących w błonie mitochondriów, zwanych łańcuchem oddechowym. U prokariotów białka te znajdują się w błonie wewnętrznej komórki[39]. Proteiny te używają energii wytworzonej podczas przesyłania elektronów z cząsteczek zredukowanych (na przykład NADH) do molekuł tlenu, aby przetłaczać protony poprzez błonę komórkową[40].
"Wypompowywanie" protonów z mitochondriów wytwarza różnicę stężeń pomiędzy obiema stronami błony i generuje napięcie elektrochemiczne[41]. Przenosi ono protony z powrotem do mitochondriów poprzez enzym zwany syntazą ATP. Przepływ ładunków dodatnich wywołuje rotację osi enzymu, dzięki czemu centrum aktywne syntazy zmienia kształt i fosforyluje adenozynodifosforan do ATP[16].
Katabolizm związków nieorganicznych[edytuj | edytuj kod]
Chemolitotrofia to rodzaj metabolizmu charakterystyczny dla niektórych organizmów prokariotycznych; pozyskują one energię z utleniania związków nieorganicznych. Mogą one używać wodoru[42]. zredukowanych związków siarki (jonów S2-, siarkowodoru i tiosiarczanów S2O32-)[43], jonów żelaza (II) Fe2+[44] lub amoniaku[45]. jako źródła potencjału redukcyjnego i czerpać energię z utleniania tych związków kosztem akceptorów takich jak tlen czy azotany (III)[46]. Te mikrobiologiczne procesy mają ogromne znaczenie w globalnych cyklach biogeochemicznych, takich jak acetogeneza, nitryfikacja i denitryfikacja; od ich przebiegu zależy także żyzność gleb[47][48].
Wiązanie energii słonecznej[edytuj | edytuj kod]
Energia słoneczna może być wiązana przez rośliny, cyanobacteria, bakterie purpurowe, zielone bakterie siarkowe i niektóre protisty. Proces ten jest często utożsamiany z wiązaniem dwutlenku węgla do związków organicznych w toku fotosyntezy. Jednak te dwa mechanizmy mogą u prokariotów funkcjonować niezależnie - przykładowo bakterie purpurowe i zielone siarkowe używają światła jako źródła energii, podczas gdy równocześnie przeprowadzają procesy wiązania węgla i fermentacji związków organicznych[49][50].
Wiązanie energii słonecznej to proces stosunkowo podobny do fosforylacji oksydacyjnej, jako że w jego toku powstaje gradient stężenia protonów, których przepływ przez syntazę ATP powoduje wytwarzanie adenozynotrójfosforanu[16]. Elektrony potrzebne do napędzania łańcucha oddechowego pochodzą od światłoczułych białek zwanych fotosyntetycznym centrum reakcji. Proteiny te dzielą się na dwa rodzaje w zależności od rodzaju barwnika asymilacyjnego, przy czym u większości fotosyntetyzujących bakterii wyróżnia się jeden typ centrum reakcji, a u roślin i cyjanobakterii - dwa[51].
U roślin fotosystem II wykorzystuje energię słoneczną do odbierania elektronów wodzie, uwalniając tlen jako produkt uboczny reakcji. Elektrony te następnie przechodzą do kompleksu cytochromów b6f, używającego ich energii do przetłaczania protonów przez błoną [[tylakoid]ową w chloroplaście[52]. Protony te wracają przez błonę i napędzają oś syntazy ATP, tak jak uprzednio. Z kolei elektrony przechodzą do fotosystemu I, gdzie mogą być użyte do redukcji koenzymu NADP+ (co jest niezbędne dla przebiegu omówionego niżej cyklu Calvina) lub wykorzystane do późniejszego wytworzenia ATP[53].
Anabolizm[edytuj | edytuj kod]
Anabolizm to grupa konstruktywnych procesów metabolicznych, w których energia uwolniona podczas katabolizmu używana jest do syntezy złożonych molekuł. Te cząsteczki, budulec wszystkich żywych komórek, są tworzone krok po kroku z prostych związków o stosunkowo niewielkich rozmiarach. Można wyróżnić trzy podstawowe etapy anabolizmu: pierwszy obejmuje produkcję aminokwasów, monosacharydów, izoprenoidów i nukleotydów, czyli podstawowych elementów biomolekuł. W drugim etapie cząsteczki te są aktywowane do form reaktywnych energią pochodzącą z ATP, zaś etap trzeci to łączenie wytworzonych molekuł w cząstki złożone - białka, polisacharydy, lipidy i kwasy nukleinowe.
Poszczególne organizmy różnią się liczbą typów wytwarzanych molekuł. Autotrofy, na przykład rośliny, budują w swych komórkach złożone cząsteczki z prostych cząstek, takich jak dwutlenek węgla i woda. Heterotrofy z kolei potrzebują do ich produkcji substancji bardziej złożonych - monosacharydów czy aminokwasów. Typ źródła energii może posłużyć za kryterium klasyfikacji organizmów: fotoautotrofy i fotoheterotrofy pozyskują energię ze światła słonecznego, a chemoautotrofy i chemoheterotrofy - z reakcji utleniania związków nieorganicznych.
Wiązanie węgla[edytuj | edytuj kod]

Fotosynteza to synteza glukozy z energii słonecznej, dwutlenku węgla (CO2) i wody, której produktem ubocznym jest tlen. Proces ten zużywa ATP i NADPH, wyprodukowane przez opisane powyżej fotosyntetyczne centra reakcji, do syntezy aldehydu 3-fosfoglicerynowego mogącego być potem stosunkowo łatwo przekształconym w glukozę. Reakcja wiązania węgla zachodzi dzięki obecności enzymu RuBisCO w obrębie cyklu Calvina - Bensona[54]. Rośliny przeprowadzają trzy rodzaje fotosyntezy: C3, C4 i CAM. Zróżnicowanie to wynika z różnicy w drodze, jaką CO2 dostaje się do cyklu Calvina: w fotosyntezie C3 jest on wiązany bezpośrednio, podczas gdy w C4 i CAM jest najpierw przekształcany do mniej złożonych związków; 2 ostatnie wykształciły się jako reakcja adaptacyjna na zmienne warunki oświetleniowe i wodne[55].
U fotosyntezujących organizmów prokariotycznych mechanizmy wiązania węgla są bardziej zróżnicowane. Proces ten może zachodzić w cyklu Calvina - Bensona, odwrotnym cyklu Krebsa[56] lub podczas karboksylacji acetylo-CoA[57][58]. Prokariotyczne chemoautotrofy również wiążą CO2 poprzez cykl Calvina - Bensona, do napędzania reakcji używają jednak energii pochodzącej ze związków nieorganicznych[59].
Węglowodany i glikany[edytuj | edytuj kod]
W anabolizmie węglowodanów proste kwasy organiczne mogą być przekształcane w monosacharydy takie jak glukoza, a następnie łączone w polisacharydy - na przykład skrobię. Synteza glukozy ze związków takich jak kwas pirogronowy, kwas mlekowy, glicerol, aldehyd 3-fosfoglicerynowy i aminokwasy zwana jest glukogenezą. Podczas tego procesu, w niektórych etapach powiązanego z glikolizą, kwas pirogronowy przekształcany jest do glukozo-6-fosforanu za pomocą szeregu reakcji[35]. Jakkolwiek, nie jest to zwykłe odwrócenie procesu glikolizy, ponieważ pewne reakcje katalizowane są przez enzymy nieglikolityczne. Jest to ważne, ponieważ tworzy rozdział między tworzeniem i rozpadem glukozy oraz nie dopuszcza do jednoczesnego przebiegu obu tych procesów[60][61].
Mimo że tłuszcze są typowym środkiem magazynowania energii, u kręgowców takich jak człowiek kwasy tłuszczowe nie mogą być przetworzone na glukozę w procesie glukogenezy, ponieważ organizmy te nie potrafią przekształcać acetylo-CoA do kwasu pirogronowego[62]. W związku z tym długotrwały głód zmusza organizmy kręgowców do produkcji ciał ketonowych zastępujących glukozę w organach takich jak mózg, które nie potrafią metabolizować kwasów tłuszczowych[63]. Inne organizmy, na przykład rośliny i bakterie, rozwiązały ten problem wprowadzając do swego metabolizmu cykl glioksylanowy. Omija on etap dekarboksylacji w cyklu Krebsa i transformuje acetyl-CoA do kwasu szczawiooctowego, który może być wykorzystany do produkcji glukozy[64][62].
Polisacharydy i glikany powstają w wyniku sekwencyjnego dołączania monosacharydów przez enzym - glikozylotransferazę - od reaktywnego donora (np. urydynodifosforanu) do akceptora grup hydroksylowych na powstającym polisacharydzie. Jako że każda z grup hydroksylowych pierścienia monosacharydu może być akceptorem, łańcuchy polisacharydów mają często rozgałęzioną strukturę[65]. Wyprodukowane polisacharydy mogą samodzielnie pełnić funkcje metaboliczne; mogą też być przekształcone do lipidów lub białek przez enzymy nazywane oligosacharyltransferazami[66][67].
Kwasy tłuszczowe, izoprenoidy i steroidy[edytuj | edytuj kod]

Kwasy tłuszczowe powstają dzięki syntazie kwasów tłuszczowych, enzymowi polimeryzującemu i redukującemu jednostki acetylo-CoA. Ich łańcuchy acylowe są przedłużane w toku reakcji dołączania grup acylowych, redukowania ich do alkoholu, dehydrowania do grupy alkenowej i ponownej redukcji do alkanu. Enzymy biosyntezy kwasów tłuszczowych dzielą się na dwie grupy: u zwierząt i grzybów wszystkie te reakcje przeprowadzane są przez pojedyncze, multifunkcyjne białko typu I[68], podczas gdy w plastydach roślin i u bakterii poszczególne enzymy typu II przeprowadzają każdą reakcję z osobna[69][70].
Terpeny i izoprenoidy stanowią liczną grupę lipidów, w skład której wchodzą m.in. karotenoidy; tworzą one najliczniejszą klasę naturalnych produktów roślinnych[71]. Związki te powstają w procesie łączenia i modyfikowania jednostek izoprenowych dostarczanych przez pirofosforan izopentylu i pirofosforan dimetylallilu[72]. Owe pirofosforany mogą powstawać na różny sposób. u zwierząt i archeobakterii są syntezowane w szlaku kwasu mewalonowego z cząsteczek acetylo-CoA[73], podczas gdy u roślin i bakterii szlak niemewalanowy używa jako substratów kwasu pirogronowego i aldehydu 3-fosfoglicerynowego[74][72]. Jedną z ważniejszych reakcji jakim ulegają owe donory izoprenu jest reakcja biosyntezy steroidów. Jednostki izoprenowe łączą się tu tworząc skwalen, a następnie są przekształcane w grupę pierścieni lanosterolu[75]. Ten może następnie przechodzić w inne steroidy, np. cholesterol czy ergosterol[76][75].
Białka[edytuj | edytuj kod]
Poszczególne organizmy mogą różnić się pod względem umiejętności syntezy 20 podstawowych aminokwasów. Większość bakterii i roślin umie syntezować wszystkie z nich, jednak ssaki posiadają zdolność syntezy jedynie 10[8]. Pozostałe 10 aminokwasów, w dodatku niezbędnych dla funkcjonowania organizmu, musi być dostarczane wraz z pożywieniem. Wszystkie one powstają w procesie glikolizy, cyklu kwasu cytrynowego lub na szlaku pentozofosforanowym. Azot dostarczany jest przez kwas glutaminowy i glutaminę. Synteza aminokwasów uzależniona jest od uformowania się odpowiednich cząsteczek kwasu alfa-ketonowego, przechodzących w aminokwasy po transaminacji[77].
Aminokwasy przechodzą w białka w procesie łączenia ich wiązaniami peptydowymi w łańcuchy. Każde białko posiada unikalną sekwencję aminokwasów. Tak jak litery alfabetu mogą być łączone w niemal nieskończoną ilość kombinacji zwanych słowami, aminokwasy łączą się w sekwencje tworząc ogromne zróżnicowanie białek. Aminokwasy przed połączeniem muszą zostać aktywowane poprzez połączenie z cząsteczką tRNA za pomocą wiązania estrowego. Aminoacyl-tRNA powstaje w zależnej od ATP reakcji katalizowanej przez enzym - syntazę aminoacylu tRNA[78]. Ten aminoacyl-tRNA jest następnie włączany do powstającego łańcucha proteinowego według informacji zawartej w mRNA[79].
Synteza i utylizacja nukleotydów[edytuj | edytuj kod]
Nukleotydy powstają z aminokwasów, dwutlenku węgla i kwasu mrówkowego w procesach wymagających dużej ilości energii metabolicznej[80]. Z tego powodu większość organizmów wykształciła mechanizmy powtórnego wykorzystywania nukleotydów[80][81]. Puryny syntezowane są tak jak nukleozydy. Zarówno adenina, jak i guanina powstają z pierwotnego nukleozydu inozyny, tworzonego z aminokwasów glicyny i glutaminy oraz kwasu asparaginowego i jonów mrówczanowych pochodzących z koenzymu tetrahydrofolianu. Piramidyny zaś syntezowane są z kwasu orotowego, który powstaje z glutaminy i kwasu asparaginowego[82].
Ksenobiotyki i metabolizm reakcji redoks[edytuj | edytuj kod]
Wszystkie organizmy są nieustannie wystawione na działanie związków chemicznych, których nie mogą użyć jako pożywienia i które mogłyby być szkodliwe w wypadku ich dostania się do komórek, ponieważ nie pełnią one żadnych funkcji metabolicznych. Te potencjalnie niebezpieczne substancje zwane są ksenobiotykani[83]. Ksenobiotyki takie jak leki, narkotyki, trucizny naturalne i antybiotyki są detoksyfikowane za pomocą określonych enzymów ksenobiotyczno-metabolicznych. U człowieka są to m.in. oksydaza cytochromu P450s[84]. UDP-glukuronosyltransferaza[85] i S-transferaza glutationu[86]. Enzymy te działają w trzech etapach: utleniania ksenobiotyku (faza I), dołączania do jego cząsteczki grup hydrofilowych (faza II) i usuwania go z komórki wraz z wodą (u organizmów wielokomórkowych umożliwia to późniejsze strawienie), co stanowi fazę III. Reakcje te mają duże znaczenie dla sozologii, gdzie są podstawą biodegradacji substancji niebezpiecznych i bioremediacji skażonych gleb i wód[87]. Niezwykła różnorodność mikroorganizmów sprawia, że są one w stanie poradzić sobie z wszelkimi niemal typami ksenobiotyków[88].
Podobnym problemem dla organizmów tlenowych jest stres oksydacyjny[89]. Procesy takie jak fosforylacja oksydacyjna czy tworzenie wiązań disulidowych podczas budowy białek powodują powstawanie reaktywnych form tlenu, np. nadtlenku wodoru[90]. Oksydanty te, powodujące zniszczenia w strukturach m.in. protein i kwasów nukleinowych, są neutralizowane przez przeciwutleniacze i enzymy: katalazy i peroksydazy[91][92].
Termodynamika w organizmach żywych[edytuj | edytuj kod]
Żywe organizmy muszą przestrzegać zasad termodynamiki opisujących przepływ energii cieplnej i pracy. Według drugiej zasady termodynamiki całkowita wartość entropii (stopnia nieuporządkowania układu) wykazuje tendencję wzrostową. Mimo że wyjątkowa złożoność komórek zdaje się przeczyć temu prawu, faktem jest, że wszystkie żywe organizmy są tak naprawdę układami otwartymi wymieniającymi nieustannie materię i energię z otoczeniem. Nie pozostają one wprawdzie w stanie równowagi termodynamicznej, są jednak systemami dyssypatywnymi, utrzymującymi stan wysokiej złożoności dzięki zwiększaniu entropii swego otoczenia[93]. Jest to osiągane dzięki łączeniu spontanicznych (niewymagających doprowadzenia energii) reakcji katabolicznych z niespontanicznymi procesami anabolizmu. Mówiąc językiem termodynamiki, metabolizm utrzymuje uporządkowanie układu poprzez wytwarzanie nieuporządkowania w otoczeniu[94].
Regulacja i kontrola[edytuj | edytuj kod]
Ponieważ środowisko większości organizmów podlega nieustannym zmianom, reakcje metaboliczne muszą być dokładnie regulowane dla utrzymania w komórce stanu stałości warunków zwanego homeostazą[95][96]. Regulacja metaboliczna pozwala również organizmom na odpowiadanie na bodźce zewnętrzne oraz warunkuje interakcję ze środowiskiem[97]. Dla zrozumienia mechanizmów regulacji szlaków metabolicznych niezbędne są definicje dwóch kluczowych pojęć. Po pierwsze, "regulacja" szlaku przez enzym to sposób, w jaki tempo jego przebiegu wzrasta lub spada w odpowiedzi na bodźce. Po drugie, "kontrola" sprawowana przez enzym to efekt, jaki zmiany te wywierają na ogólny przebieg szlaku[98]. Dla przykładu, enzym wykazujący umiejętność znaczej modyfikacji aktywności nie będzie uwzględniony jako enzym kontrolujący dany szlak, jeśli ta modyfikacja aktywności wywierać będzie niewielki wpływ na ciąg procesów w tym szlaku[99].
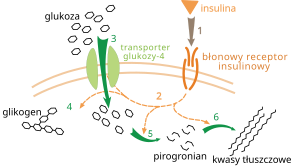
Regulacja metabolizmu zachodzi na wiele sposobów. W regulacji naturalnej szlak metaboliczny jest regulowany automatycznie w odpowiedzi na zmianę stężenia substratów; przykładowo, zmniejszenie ilości produktów może - dla równowagi - pobudzić przebieg reakcji[98]. Często w ten sposób zachodzi regulacja allosteryczna aktywności poszczególnych enzymów szlaku[100]. Regulacja zewnętrzna wywołuje zmiany w metabolizmie komórki za pomocą sygnałów pochodzących z innych komórek; sygnały te mają zwykle postać rozpuszczalnych w wodzie substancji, takich jak hormony i czynniki wzrostu i są odbierane przez określone receptory na powierzchni komórki[101]. Są one następnie przekazywane do wnętrza komórki przez drugi system informacyjny, m.in. za pośrednictwem fosforylacji protein[102].
Przykładem bardzo dobrze poznanego mechanizmu regulacji zewnętrznej jest wpływ insuliny na metabolizm glukozy[103]. Insulina jest hormonem produkowanym w odpowiedzi na podwyższenie poziomu glukozy w organizmie. Łączenie się hormonu z receptorem insulinowym aktywuje grupę kinaz białkowych, które pobudzają komórki do pobierania glukozy z krwi i przekształcania jej w substancje zapasowe (na przykład kwasy tłuszczowe i glikogen[104]. Metabolizm glikogenu jest z kolei kontrolowany przez fosforylazę, enzym rozbijający glikogen, oraz tworzącą go syntazę glikogenu. Enzymy te są regulowane w sposób obustronny - fosforylacja inhibuje syntazę glikogenu, aktywując jednocześnie fosforylazę. Insulina wywołuje syntezę glikogenu poprzez aktywację fosfatazy białkowej i hamowanie fosforylacji wymienionych enzynów[105].
Ewolucja[edytuj | edytuj kod]

Najważniejsze z opisanych wyżej szlaków metabolicznych, na przykład glikoliza czy cykl kwasu cytrynowego, występują u organizmów wszystkich trzech domen i musiały pojawić się już u ich ostatniego wspólnego przodka[106][4]. Był to organizm prokariotyczny, zapewne metanogen o zewnętrznym metabolizmie aminokwasów, węglowodanów, nukleotydów i kwasów tłuszczowych[107][108]. Zatrzymanie dalszego rozwoju wymienionych szlaków podczas ewolucji może być wynikiem ich optymalnej wydajności, minimalnej złożoności i zaspokajaniu podstawowych potrzeb metabolicznych.[5][6] Pierwsze szlaki metabolizmu oparte na działaniu enzymów mogły wchodzić w skład nukleotydowego metabolizmu puryn; wcześniejsze były zapewne jeszcze elementem dawnego świata RNA[109].
Powstało wiele hipotez tłumaczących mechanizm powstawania i ewolucji nowych szlaków metabolicznych. Zakładały one m.in. kolejne dodawanie nowych enzymów do krótkiego szlaku pierwotnego, duplikację i różnicowanie poszczególnych cykli, a także włączanie istniejących wcześniej enzymów do nowo powstających szlaków[110]. Wprawdzie względny udział tych mechanizmów w ewolucji nie został określony, badania genetyczne ujawniły jednak, że większość enzymów w obrębie danego szlaku ma zwykle wspólne pochodzenie, co wykazuje, że ich rozwój następował stopniowo i nowe funkcje powstawały na bazie już istniejących[111]. Inną możliwość stanowi istnienie uniwersalnych "modułów", które - używane w różnych szlakach - wywierają podobny wpływ na różne substancje[112].
Ewolucja organizmów może również skutkować zanikaniem szlaków metabolicznych. Dla przykładu, u niektórych pasożytów pewne procesy metaboliczne przestają być niezbędne do życia, jako że gotowe aminokwasy, nukleotydy i węglowodany mogą być wchłaniane bezpośrednio od żywiciela[113]. Podobnie zredukowany metabolizm obserwowany jest u form endosymbiotycznych[114].
Badania i manipulacje[edytuj | edytuj kod]

Metabolizm jest zazwyczaj rozpatrywany za pomocą metod redukcjonistycznych, skupiających się na analizie poszczególnych szlaków metabolicznych. Głównym sposobem takiej analizy jest badanie drogi podanej substancji radioaktywnej w organizmie, od momentu jej podania do powstania końcowych produktów metabolizmu[116]. Następnie enzymy katalizujące reakcje metaboliczne mogą zostać wyizolowane, co pozwala na zbadanie ich kinetyki i reakcji na inhibitory. Jednocześnie możliwa jest identyfikacja mniejszych cząsteczek biorących udział w procesach metabolizmu; zbiór wszystkich takich substancji nazywany metabolomami. Ogólnie rzecz biorąc, metoda ta jest skuteczna w przypadku badania struktury i funkcji prostych szlaków metabolicznych, zawodzi jednak przy procesach bardziej złożonych, np. całości metabolizmu komórki[117].
Sieci metaboliczne, ze względu na możliwą ilość interakcji pomiędzy partnerami oraz ilość samych partnerów, są zazwyczaj bardzo skomplikowane. Jakkolwiek, obecna technologia pozwala na rekonstruowanie całych sieci reakcji biochemicznych na podstawie informacji zawartych w genomie, co umożliwia budowanie holistycznych modeli matematycznych mogących wyjaśnić i przewidzieć ich przebieg[118]. Największą dokładność takich modeli uzyskuje się, łącząc klasyczne metody badania metabolizmu z pochodzącą z badań nad proteomiką i sekwencją DNA wiedzą o ekspresji genu[119].
Informacje te znajdują zastosowanie przede wszystkim w inżynierii genetycznej. Organizmy takie jak drożdże, rośliny i bakterie są modyfikowane genetycznie w celu wykorzystania ich do produkcji różnych substancji: antybiotyków, insuliny czy witamin[120]. Modyfikacje genetyczne zazwyczaj mają na celu zmniejszenie kosztów i zwiększenie wydajności procesu wytwarzania produktu oraz redukcję ilości produktów ubocznych[121].
Historia badań nad metabolizmem[edytuj | edytuj kod]

Termin "metabolizm" wywodzi się z greckiego słowa Μεταβολισμός – "Metabolismos" określającego zmianę, obalenie (np. rządu)[122]. Historia naukowych badań procesów metabolicznych obejmuje 400 lat, od początkowych badań nad zwierzętami do mikroskopowej analizy poszczególnych reakcji w nowoczesnej biochemii. Pierwsze eksperymenty mające na celu zbadanie ludzkiego metabolizmu wykonał i przedstawił w książce Ars de statica medecina Santorio Santorio[123]. Ważył on się przed i po jedzeniu, piciu, śnie, pracy, stosunku płciowym, poście i defekacji. Zauważył, że większość przyjmowanego pokarmu tracił poprzez - jak to określił - "nieświadomą perspirację".
Podczas tych wczesnych badań nie utożsamiano jeszcze procesów życiowych z funkcjami metabolicznymi; za czynnik ożywiający uznawano wówczas nieznaną siłę życiową[124]. W XIX wieku, podczas badań nad fermentacją alkoholową przeprowadzaną przez drożdże, Louis Pasteur zauważył, że proces ten katalizowany jest przez substancje zawarte w komórkach drożdży, które nazwał "fermentami". Z jego zapisków czytamy, że "fermentacja alkoholowa jest powiązana z procesami życiowymi i organizacją komórek drożdży, nie zaś z ich śmiercią czy rozkładem"[125]. Odkrycie to, które zbiegło się w czasie z pierwszą udaną syntezą związku organicznego (mocznika) z substancji nieorganicznych przeprowadzoną w 1828 r. przez Friedricha Wöhlera[126], udowodniło, że związki organiczne i reakcje zachodzące w komórkach nie różnią się ogólnym charakterem od innych zjawisk i substancji chemicznych.
Oddzielenie badań nad chemicznymi reakcjami metabolicznymi od nauki o biologii komórki nastąpiło wraz z odkryciem enzymów przez Eduarda Buchnera na początku XX wieku; chwila ta wyznacza umowny moment narodzin biochemii[127]. XX wiek przyniósł gwałtowny rozwój wiedzy z tej dziedziny, co w dużej mierze świat nauki zawdzięca Hansowi Krebsowi[128]. Odkrył on istnienie cykli: ornitynowego, kwasu cytrynowego i glioksylanowego (2 ostatnie wraz z Hansem Kornbergiem)[129][64]. Ogromny wpływ na tempo rozwoju biochemii wywarły takie technologie, jak chromatografia, rentgenografia strukturalna, spektroskopia NMR, mikroskopia elektronowa i symulacje dynamiki molekularnej. Pozwoliły one na identyfikację i szczegółową analizę wielu cząsteczek i przebiegających w komórkach szlaków metabolicznych.
Zobacz też[edytuj | edytuj kod]
Przypisy[edytuj | edytuj kod]
- ↑ Definicja metabolizmu w PWN. [dostęp 8 czerwca 2008]. (pol.).
- ↑ Friedrich C. Physiology and genetics of sulfur-oxidizing bacteria. „Adv Microb Physiol”. 39, s. 235-89, 1998. 9328649.
- ↑ David C. Dorman, Frederic J.M. Moulin, Brian E. McManus, Kristen C. Mahle, R. Arden James i Melanie F. Struve. Cytochrome Oxidase Inhibition Induced by Acute Hydrogen Sulfide Inhalation: Correlation with Tissue Sulfide Concentrations in the Rat Brain, Liver, Lung, and Nasal Epithelium. „Toxicological Sciences”. Tom 65, 2002. nr. s. 18-25.
- ↑ a b Smith E, Morowitz H. Universality in intermediary metabolism. „Proc Natl Acad Sci U S A”. 101, s. 13168-73, 2004. 15340153.
- ↑ a b Ebenhöh O, Heinrich R. Evolutionary optimization of metabolic pathways. Theoretical reconstruction of the stoichiometry of ATP and NADH producing systems. „Bull Math Biol”. 63, s. 21–55, 2001. 11146883.
- ↑ a b Meléndez-Hevia E, Waddell T, Cascante M. The puzzle of the Krebs citric acid cycle: assembling the pieces of chemically feasible reactions, and opportunism in the design of metabolic pathways during evolution. „J Mol Evol”. 43, s. 293–303, 1996. 8703096.
- ↑ Michie K, Löwe J. Dynamic filaments of the bacterial cytoskeleton. „Annu Rev Biochem”. 75, s. 467-92, 2006. 16756499.
- ↑ a b c d e f David L. Nelson, Michael M. Cox: Lehninger Principles of Biochemistry. 2005, s. 841. ISBN 0-7167-4339-6. Błąd w przypisach: Nieprawidłowy znacznik
<ref>; nazwę „Nelson” zdefiniowano więcej niż raz z różną zawartością - ↑ Fahy E, Subramaniam S, Brown H, Glass C, Merrill A, Murphy R, Raetz C, Russell D, Seyama Y, Shaw W, Shimizu T, Spener F, van Meer G, VanNieuwenhze M, White S, Witztum J, Dennis E. A comprehensive classification system for lipids. „J Lipid Res”. 46, s. 839-61, 2005. 15722563.
- ↑ Nomenclature of Lipids.
- ↑ Hegardt F. Mitochondrial 3-hydroxy-3-methylglutaryl-CoA synthase: a control enzyme in ketogenesis. „Biochem J”. 338 (Pt 3), s. 569-82, 1999. 10051425.
- ↑ Raman R, Raguram S, Venkataraman G, Paulson J, Sasisekharan R. Glycomics: an integrated systems approach to structure-function relationships of glycans. „Nat Methods”. 2, s. 817-24, 2005. 16278650.
- ↑ Sierra S, Kupfer B, Kaiser R. Basics of the virology of HIV-1 and its replication. „J Clin Virol”. 34, s. 233-44, 2005. 16198625.
- ↑ a b Wimmer M, Rose I. Mechanisms of enzyme-catalyzed group transfer reactions. „Annu Rev Biochem”. 47, s. 1031–78, 1978. 354490.
- ↑ Mitchell P. The Ninth Sir Hans Krebs Lecture. Compartmentation and communication in living systems. Ligand conduction: a general catalytic principle in chemical, osmotic and chemiosmotic reaction systems. „Eur J Biochem”. 95, s. 1–20, 1979. 378655.
- ↑ a b c d Dimroth P, von Ballmoos C, Meier T. Catalytic and mechanical cycles in F-ATP synthases. Fourth in the Cycles Review Series. „EMBO Rep”. 7, s. 276-82, 2006. 16607397.
- ↑ Ann Coulston, John Kerner, JoAnn Hattner, Ashini Srivastava. Stanford School of Medicine Nutrition Courses. „Nutrition Principles and Clinical Nutrition”, 2006.
- ↑ Pollak N, Dölle C, Ziegler M. The power to reduce: pyridine nucleotides—small molecules with a multitude of functions. „Biochem J”. 402, s. 205-18, 2007. 17295611.
- ↑ a b Heymsfield S, Waki M, Kehayias J, Lichtman S, Dilmanian F, Kamen Y, Wang J, Pierson R. Chemical and elemental analysis of humans in vivo using improved body composition models. „Am J Physiol”. 261, s. E190-8, 1991. 1872381.
- ↑ Sychrová H. Yeast as a model organism to study transport and homeostasis of alkali metal cations. „Physiol Res”. 53 Suppl 1, s. 91-8, 2004. 15119939.
- ↑ Levitan I. Modulation of ion channels in neurons and other cells. „Annu Rev Neurosci”. 11, s. 119-36, 1988. 2452594.
- ↑ Dulhunty A. Excitation-contraction coupling from the 1950s into the new millennium. „Clin Exp Pharmacol Physiol”. 33, s. 763-72, 2006. 16922804.
- ↑ Mahan D, Shields R. Macro- and micromineral composition of pigs from birth to 145 kilograms of body weight. „J Anim Sci”. 76, s. 506-12, 1998. 9498359.
- ↑ Husted S, Mikkelsen B, Jensen J, Nielsen N. Elemental fingerprint analysis of barley (Hordeum vulgare) using inductively coupled plasma mass spectrometry, isotope-ratio mass spectrometry, and multivariate statistics. „Anal Bioanal Chem”. 378, s. 171-82, 2004. 14551660.
- ↑ Finney L, O'Halloran T. Transition metal speciation in the cell: insights from the chemistry of metal ion receptors. „Science”. 300, s. 931-6, 2003. 12738850.
- ↑ Cousins R, Liuzzi J, Lichten L. Mammalian zinc transport, trafficking, and signals. „J Biol Chem”. 281, s. 24085-9, 2006. 16793761.
- ↑ Dunn L, Rahmanto Y, Richardson D. Iron uptake and metabolism in the new millennium. „Trends Cell Biol”. 17, s. 93–100, 2007. 17194590.
- ↑ Nealson K, Conrad P. Life: past, present and future. „Philos Trans R Soc Lond B Biol Sci”. 354, s. 1923–39, 1999. 10670014.
- ↑ Häse C, Finkelstein R. Bacterial extracellular zinc-containing metalloproteases. „Microbiol Rev”. 57, s. 823-37, 1993. 8302217.
- ↑ Gupta R, Gupta N, Rathi P. Bacterial lipases: an overview of production, purification and biochemical properties. „Appl Microbiol Biotechnol”. 64, s. 763-81, 2004. 14966663.
- ↑ Hoyle T. The digestive system: linking theory and practice. „Br J Nurs”. 6, s. 1285–91, 1997. 9470654.
- ↑ Souba W, Pacitti A. How amino acids get into cells: mechanisms, models, menus, and mediators. „JPEN J Parenter Enteral Nutr”. 16, s. 569-78, 1992. 1494216.
- ↑ Barrett M, Walmsley A, Gould G. Structure and function of facilitative sugar transporters. „Curr Opin Cell Biol”. 11, s. 496–502, 1999. 10449337.
- ↑ Bell G, Burant C, Takeda J, Gould G. Structure and function of mammalian facilitative sugar transporters. „J Biol Chem”. 268, s. 19161-4, 1993. 8366068.
- ↑ a b Bouché C, Serdy S, Kahn C, Goldfine A. The cellular fate of glucose and its relevance in type 2 diabetes. „Endocr Rev”. 25, s. 807-30, 2004. 15466941.
- ↑ Sakami W, Harrington H. Amino acid metabolism. „Annu Rev Biochem”. 32, s. 355-98, 1963. 14144484.
- ↑ Brosnan J. Glutamate, at the interface between amino acid and carbohydrate metabolism. „J Nutr”. 130, s. 988S-90S, 2000. 10736367.
- ↑ Young V, Ajami A. Glutamine: the emperor or his clothes?. „J Nutr”. 131, s. 2449S-59S; discussion 2486S-7S, 2001. 11533293.
- ↑ Hosler J, Ferguson-Miller S, Mills D. Energy transduction: proton transfer through the respiratory complexes. „Annu Rev Biochem”. 75, s. 165-87, 2006. 16756489.
- ↑ Schultz B, Chan S. Structures and proton-pumping strategies of mitochondrial respiratory enzymes. „Annu Rev Biophys Biomol Struct”. 30, s. 23–65, 2001. 11340051.
- ↑ Capaldi R, Aggeler R. Mechanism of the F(1)F(0)-type ATP synthase, a biological rotary motor. „Trends Biochem Sci”. 27, s. 154-60, 2002. 11893513.
- ↑ Friedrich B, Schwartz E. Molecular biology of hydrogen utilization in aerobic chemolithotrophs. „Annu Rev Microbiol”. 47, s. 351-83, 1993. 8257102.
- ↑ Friedrich C. Physiology and genetics of sulfur-oxidizing bacteria. „Adv Microb Physiol”. 39, s. 235-89, 1998. 9328649.
- ↑ Weber K, Achenbach L, Coates J. Microorganisms pumping iron: anaerobic microbial iron oxidation and reduction. „Nat Rev Microbiol”. 4, s. 752-64, 2006. 16980937.
- ↑ Jetten M, Strous M, van de Pas-Schoonen K, Schalk J, van Dongen U, van de Graaf A, Logemann S, Muyzer G, van Loosdrecht M, Kuenen J. The anaerobic oxidation of ammonium. „FEMS Microbiol Rev”. 22, s. 421-37, 1998. 9990725.
- ↑ Simon J. Enzymology and bioenergetics of respiratory nitrite ammonification. „FEMS Microbiol Rev”. 26, s. 285–309, 2002. 12165429.
- ↑ Conrad R. Soil microorganisms as controllers of atmospheric trace gases (H2, CO, CH4, OCS, N2O, and NO). „Microbiol Rev”. 60, s. 609-40, 1996. 8987358.
- ↑ Barea J, Pozo M, Azcón R, Azcón-Aguilar C. Microbial co-operation in the rhizosphere. „J Exp Bot”. 56, s. 1761–78, 2005. 15911555.
- ↑ van der Meer M, Schouten S, Bateson M, Nübel U, Wieland A, Kühl M, de Leeuw J, Sinninghe Damsté J, Ward D. Diel variations in carbon metabolism by green nonsulfur-like bacteria in alkaline siliceous hot spring microbial mats from Yellowstone National Park. „Appl Environ Microbiol”. 71, s. 3978–86, 2005. 16000812.
- ↑ Tichi M, Tabita F. Interactive control of Rhodobacter capsulatus redox-balancing systems during phototrophic metabolism. „J Bacteriol”. 183, s. 6344–54, 2001. 11591679.
- ↑ Allen J, Williams J. Photosynthetic reaction centers. „FEBS Lett”. 438, s. 5–9, 1998. 9821949.
- ↑ Nelson N, Ben-Shem A. The complex architecture of oxygenic photosynthesis. „Nat Rev Mol Cell Biol”. 5, s. 971-82, 2004. 15573135.
- ↑ Munekage Y, Hashimoto M, Miyake C, Tomizawa K, Endo T, Tasaka M, Shikanai T. Cyclic electron flow around photosystem I is essential for photosynthesis. „Nature”. 429, s. 579-82, 2004. 15175756.
- ↑ Miziorko H, Lorimer G. Ribulose-1,5-bisphosphate carboxylase-oxygenase. „Annu Rev Biochem”. 52, s. 507-35, 1983. 6351728.
- ↑ Dodd A, Borland A, Haslam R, Griffiths H, Maxwell K. Crassulacean acid metabolism: plastic, fantastic. „J Exp Bot”. 53, s. 569-80, 2002. 11886877.
- ↑ Hügler M, Wirsen C, Fuchs G, Taylor C, Sievert S. Evidence for autotrophic CO2 fixation via the reductive tricarboxylic acid cycle by members of the epsilon subdivision of proteobacteria. „J Bacteriol”. 187, s. 3020–7, 2005. 15838028.
- ↑ Strauss G, Fuchs G. Enzymes of a novel autotrophic CO2 fixation pathway in the phototrophic bacterium Chloroflexus aurantiacus, the 3-hydroxypropionate cycle. „Eur J Biochem”. 215, s. 633-43, 1993. 8354269.
- ↑ Wood H. Life with CO or CO2 and H2 as a source of carbon and energy. „FASEB J”. 5, s. 156-63, 1991. 1900793.
- ↑ Shively J, van Keulen G, Meijer W. Something from almost nothing: carbon dioxide fixation in chemoautotrophs. „Annu Rev Microbiol”. 52, s. 191–230, 1998. 9891798.
- ↑ Boiteux A, Hess B. Design of glycolysis. „Philos Trans R Soc Lond B Biol Sci”. 293, s. 5–22, 1981. 6115423.
- ↑ Pilkis S, el-Maghrabi M, Claus T. Fructose-2,6-bisphosphate in control of hepatic gluconeogenesis. From metabolites to molecular genetics. „Diabetes Care”. 13, s. 582-99, 1990. 2162755.
- ↑ a b Ensign S. Revisiting the glyoxylate cycle: alternate pathways for microbial acetate assimilation. „Mol Microbiol”. 61, s. 274-6, 2006. 16856935.
- ↑ Finn P, Dice J. Proteolytic and lipolytic responses to starvation. „Nutrition”. 22, s. 830-44, 2006. 16815497.
- ↑ a b Kornberg H, Krebs H. Synthesis of cell constituents from C2-units by a modified tricarboxylic acid cycle. „Nature”. 179, s. 988-91, 1957. 13430766.
- ↑ Rademacher T, Parekh R, Dwek R. Glycobiology. „Annu Rev Biochem”. 57, s. 785–838, 1988. 3052290.
- ↑ Opdenakker G, Rudd P, Ponting C, Dwek R. Concepts and principles of glycobiology. „FASEB J”. 7, s. 1330–7, 1993. 8224606.
- ↑ McConville M, Menon A. Recent developments in the cell biology and biochemistry of glycosylphosphatidylinositol lipids (review). „Mol Membr Biol”. 17, s. 1–16, 2000. 10824734.
- ↑ Chirala S, Wakil S. Structure and function of animal fatty acid synthase. „Lipids”. 39, s. 1045–53, 2004. 15726818.
- ↑ White S, Zheng J, Zhang Y. The structural biology of type II fatty acid biosynthesis. „Annu Rev Biochem”. 74, s. 791–831, 2005. 15952903.
- ↑ Ohlrogge J, Jaworski J. Regulation of fatty acid synthesis. „Annu Rev Plant Physiol Plant Mol Biol”. 48, s. 109–136, 1997. 15012259.
- ↑ Dubey V, Bhalla R, Luthra R. An overview of the non-mevalonate pathway for terpenoid biosynthesis in plants. „J Biosci”. 28, s. 637-46, 2003. 14517367.
- ↑ a b Kuzuyama T, Seto H. Diversity of the biosynthesis of the isoprene units. „Nat Prod Rep”. 20, s. 171-83, 2003. 12735695.
- ↑ Grochowski L, Xu H, White R. Methanocaldococcus jannaschii uses a modified mevalonate pathway for biosynthesis of isopentenyl diphosphate. „J Bacteriol”. 188, s. 3192–8, 2006. 16621811.
- ↑ Lichtenthaler H. The 1-Ddeoxy-D-xylulose-5-phosphate pathway of isoprenoid biosynthesis in plants. „Annu Rev Plant Physiol Plant Mol Biol”. 50, s. 47–65, 1999. 15012203.
- ↑ a b Schroepfer G. Sterol biosynthesis. „Annu Rev Biochem”. 50, s. 585–621, 1981. 7023367.
- ↑ Lees N, Skaggs B, Kirsch D, Bard M. Cloning of the late genes in the ergosterol biosynthetic pathway of Saccharomyces cerevisiae—a review. „Lipids”. 30, s. 221-6, 1995. 7791529.
- ↑ Arthur C. Guyton, John E. Hall: Textbook of Medical Physiology. 2006, s. 855-6. 0-7216-0240-1.
- ↑ Ibba M, Söll D. The renaissance of aminoacyl-tRNA synthesis. „EMBO Rep”. 2. 11375928.
- ↑ Lengyel P, Söll D. Mechanism of protein biosynthesis. „Bacteriol Rev”. 33, s. 264–301, 1969. 4896351.
- ↑ a b Rudolph F. The biochemistry and physiology of nucleotides. „J Nutr”. 124, s. 124S-127S, 1994. 8283301. Zrenner R, Stitt M, Sonnewald U, Boldt R. Pyrimidine and purine biosynthesis and degradation in plants. „Annu Rev Plant Biol”. 57, s. 805-36, 2006. 16669783.
- ↑ Stasolla C, Katahira R, Thorpe T, Ashihara H. Purine and pyrimidine nucleotide metabolism in higher plants. „J Plant Physiol”. 160, s. 1271–95, 2003. 14658380.
- ↑ Smith J. Enzymes of nucleotide synthesis. „Curr Opin Struct Biol”. 5, s. 752-7, 1995. 8749362.
- ↑ Testa B, Krämer S. The biochemistry of drug metabolism—an introduction: part 1. Principles and overview. „Chem Biodivers”. 3, s. 1053-101, 2006. 17193224.
- ↑ Danielson P. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. „Curr Drug Metab”. 3, s. 561-97, 2002. 12369887.
- ↑ King C, Rios G, Green M, Tephly T. UDP-glucuronosyltransferases. „Curr Drug Metab”. 1, s. 143-61, 2000. 11465080.
- ↑ Sheehan D, Meade G, Foley V, Dowd C. Structure, function and evolution of glutathione transferases: implications for classification of non-mammalian members of an ancient enzyme superfamily. „Biochem J”. 360, s. 1–16, 2001. 11695986.
- ↑ Galvão T, Mohn W, de Lorenzo V. Exploring the microbial biodegradation and biotransformation gene pool. „Trends Biotechnol”. 23, s. 497–506, 2005. 16125262.
- ↑ Janssen D, Dinkla I, Poelarends G, Terpstra P. Bacterial degradation of xenobiotic compounds: evolution and distribution of novel enzyme activities. „Environ Microbiol”. 7, s. 1868–82, 2005. 16309386.
- ↑ Davies K. Oxidative stress: the paradox of aerobic life. „Biochem Soc Symp”. 61, s. 1–31, 1995. 8660387.
- ↑ Tu B, Weissman J. Oxidative protein folding in eukaryotes: mechanisms and consequences. „J Cell Biol”. 164, s. 341-6, 2004. 14757749.
- ↑ Sies H. Oxidative stress: oxidants and antioxidants. „Exp Physiol”. 82, s. 291-5, 1997. 9129943.
- ↑ Vertuani S, Angusti A, Manfredini S. The antioxidants and pro-antioxidants network: an overview. „Curr Pharm Des”. 10, s. 1677–94, 2004. 15134565.
- ↑ von Stockar U, Liu J. Does microbial life always feed on negative entropy? Thermodynamic analysis of microbial growth. „Biochim Biophys Acta”. 1412, s. 191–211, 1999. 10482783.
- ↑ Demirel Y, Sandler S. Thermodynamics and bioenergetics. „Biophys Chem”. 97, s. 87–111, 2002. 12050002.
- ↑ Albert R. Scale-free networks in cell biology. „J Cell Sci”. 118, s. 4947–57, 2005. 16254242.
- ↑ Brand M. Regulation analysis of energy metabolism. „J Exp Biol”. 200, s. 193–202, 1997. 9050227.
- ↑ Soyer O, Salathé M, Bonhoeffer S. Signal transduction networks: topology, response and biochemical processes. „J Theor Biol”. 238, s. 416-25, 2006. 16045939.
- ↑ a b Salter M, Knowles R, Pogson C. Metabolic control. „Essays Biochem”. 28, s. 1–12, 1994. 7925313.
- ↑ Westerhoff H, Groen A, Wanders R. Modern theories of metabolic control and their applications (review). „Biosci Rep”. 4, s. 1–22, 1984. 6365197.
- ↑ Fell D, Thomas S. Physiological control of metabolic flux: the requirement for multisite modulation. „Biochem J”. 311 (Pt 1), s. 35-9, 1995. 7575476.
- ↑ Hendrickson W. Transduction of biochemical signals across cell membranes. „Q Rev Biophys”. 38, s. 321-30, 2005. 16600054.
- ↑ Cohen P. The regulation of protein function by multisite phosphorylation—a 25 year update. „Trends Biochem Sci”. 25, s. 596–601, 2000. 11116185.
- ↑ Lienhard G, Slot J, James D, Mueckler M. How cells absorb glucose. „Sci Am”. 266, s. 86–91, 1992. 1734513.
- ↑ Roach P. Glycogen and its metabolism. „Curr Mol Med”. 2, s. 101-20, 2002. 11949930.
- ↑ Newgard C, Brady M, O'Doherty R, Saltiel A. Organizing glucose disposal: emerging roles of the glycogen targeting subunits of protein phosphatase-1. „Diabetes”. 49, s. 1967–77, 2000. 11117996.
- ↑ Romano A, Conway T. Evolution of carbohydrate metabolic pathways. „Res Microbiol”. 147, s. 448-55, 1996. 9084754.
- ↑ Koch A. How did bacteria come to be?. „Adv Microb Physiol”. 40, s. 353-99, 1998. 9889982.
- ↑ Ouzounis C, Kyrpides N. The emergence of major cellular processes in evolution. „FEBS Lett”. 390, s. 119-23, 1996. 8706840.
- ↑ Caetano-Anolles G, Kim HS, Mittenthal JE. The origin of modern metabolic networks inferred from phylogenomic analysis of protein architecture. „Proc Natl Acad Sci USA”. 104, s. 9358-63, 2007. 17517598.
- ↑ Schmidt S, Sunyaev S, Bork P, Dandekar T. Metabolites: a helping hand for pathway evolution?. „Trends Biochem Sci”. 28, s. 336-41, 2003. 12826406.
- ↑ Light S, Kraulis P. Network analysis of metabolic enzyme evolution in Escherichia coli. „BMC Bioinformatics”. 5, s. 15, 2004. 15113413. Alves R, Chaleil R, Sternberg M. Evolution of enzymes in metabolism: a network perspective. „J Mol Biol”. 320, s. 751-70, 2002. 12095253.
- ↑ Spirin V, Gelfand M, Mironov A, Mirny L. A metabolic network in the evolutionary context: multiscale structure and modularity. „Proc Natl Acad Sci U S A”. 103, s. 8774–9, 2006. 16731630.
- ↑ Lawrence J. Common themes in the genome strategies of pathogens. „Curr Opin Genet Dev”. 15, s. 584-8, 2005. 16188434. Wernegreen J. For better or worse: genomic consequences of intracellular mutualism and parasitism. „Curr Opin Genet Dev”. 15, s. 572-83, 2005. 16230003.
- ↑ Pál C, Papp B, Lercher M, Csermely P, Oliver S, Hurst L. Chance and necessity in the evolution of minimal metabolic networks. „Nature”. 440, s. 667-70, 2006. 16572170.
- ↑ Sterck L, Rombauts S, Vandepoele K, Rouzé P, Van de Peer Y. How many genes are there in plants (... and why are they there)?. „Curr Opin Plant Biol”. 10, s. 199–203, 2007. 17289424.
- ↑ Rennie M. An introduction to the use of tracers in nutrition and metabolism. „Proc Nutr Soc”. 58, s. 935-44, 1999. 10817161.
- ↑ Phair R. Development of kinetic models in the nonlinear world of molecular cell biology. „Metabolism”. 46, s. 1489–95, 1997. 9439549.
- ↑ Borodina I, Nielsen J. From genomes to in silico cells via metabolic networks. „Curr Opin Biotechnol”. 16, s. 350-5, 2005. 15961036.
- ↑ Gianchandani E, Brautigan D, Papin J. Systems analyses characterize integrated functions of biochemical networks. „Trends Biochem Sci”. 31, s. 284-91, 2006. 16616498.
- ↑ Thykaer J, Nielsen J. Metabolic engineering of beta-lactam production. „Metab Eng”. 5, s. 56–69, 2003. 12749845. González-Pajuelo M, Meynial-Salles I, Mendes F, Andrade J, Vasconcelos I, Soucaille P. Metabolic engineering of Clostridium acetobutylicum for the industrial production of 1,3-propanediol from glycerol. „Metab Eng”. 7, s. 329-36, 2005. 16095939. Krämer M, Bongaerts J, Bovenberg R, Kremer S, Müller U, Orf S, Wubbolts M, Raeven L. Metabolic engineering for microbial production of shikimic acid. „Metab Eng”. 5, s. 277-83, 2003. 14642355.
- ↑ Koffas M, Roberge C, Lee K, Stephanopoulos G. Metabolic engineering. „Annu Rev Biomed Eng”. 1, s. 535-57, 1999. 11701499.
- ↑ Metabolism.
- ↑ Eknoyan G. Santorio Sanctorius (1561–1636) - founding father of metabolic balance studies. „Am J Nephrol”. 19, s. 226-33, 1999. 10213823.
- ↑ Williams, H. S. (1904) A History of Science: in Five Volumes. Volume IV: Modern Development of the Chemical and Biological Sciences Harper and Brothers (New York) Retrieved on 2007-03-26
- ↑ Dubos J.. Louis Pasteur: Free Lance of Science, Gollancz. Quoted in Manchester K. L. (1995) Louis Pasteur (1822 – 1895)—chance and the prepared mind.. „Trends Biotechnol”. 13, s. 511–515, 1951. id 8595136.
- ↑ Kinne-Saffran E, Kinne R. Vitalism and synthesis of urea. From Friedrich Wöhler to Hans A. Krebs. „Am J Nephrol”. 19, s. 290-4, 1999. 10213830.
- ↑ Eduard Buchner's 1907 Nobel lecture na http://nobelprize.org Accessed 2007-03-20
- ↑ Kornberg H. Krebs and his trinity of cycles. „Nat Rev Mol Cell Biol”. 1, s. 225-8, 2000. 11252898.
- ↑ Krebs H A, Henseleit K (1932) "Untersuchungen über die Harnstoffbildung im tierkorper." Z. Physiol. Chem. 210, 33 – 66. Krebs H, Johnson W. Metabolism of ketonic acids in animal tissues. „Biochem J”. 31, s. 645-60, 1937. 16746382.
Literatura uzupełniająca[edytuj | edytuj kod]
Wprowadzenie
- Rose, S. and Mileusnic, R., The Chemistry of Life. (Penguin Press Science, 1999), ISBN 0-14-027273-9
- Schneider, E. D. and Sagan, D., Into the Cool: Energy Flow, Thermodynamics, and Life. (University Of Chicago Press, 2005), ISBN 0-226-73936-8
- Lane, N., Oxygen: The Molecule that Made the World. (Oxford University Press, USA, 2004), ISBN 0-19-860783-0
Dla zaawansowanych
- Price, N. and Stevens, L., Fundamentals of Enzymology: Cell and Molecular Biology of Catalytic Proteins. (Oxford University Press, 1999), ISBN 0-19-850229-X
- Berg, J. Tymoczko, J. and Stryer, L., Biochemistry. (W. H. Freeman and Company, 2002), ISBN 0-7167-4955-6
- Cox, M. and Nelson, D. L., Lehninger Principles of Biochemistry. (Palgrave Macmillan, 2004), ISBN 0-7167-4339-6
- Brock, T. D. Madigan, M. T. Martinko, J. and Parker J., Brock's Biology of Microorganisms. (Benjamin Cummings, 2002), ISBN 0-13-066271-2
- Da Silva, J.J.R.F. and Williams, R. J. P., The Biological Chemistry of the Elements: The Inorganic Chemistry of Life. (Clarendon Press, 1991), ISBN 0-19-855598-9
- Nicholls, D. G. and Ferguson, S. J., Bioenergetics. (Academic Press Inc., 2002), ISBN 0-12-518121-3
Linki zewnętrzne[edytuj | edytuj kod]
Informacje ogólne
- Metabolism, Cellular Respiration and Photosynthesis
- The Biochemistry of Metabolism
- Advanced Animal Metabolism Calculators/ Interactive Learning Tools
- Microbial metabolism
- Metabolic Pathways of Biochemistry
- Chemistry for biologists
- Sparknotes SAT biochemistry
- MIT Biology Hypertextbook
- Artykuł o metabolizmie na The Encyclopœdia Britannica (en) - dostęp bezpłatny.
Glossariusze i słowniki
Metabolizm człowieka
- NetBiochem Topics (en) - przewodnik nt. szlaków metabolicznych człowieka. Poziom szkolny.
- THE Medical Biochemistry Page (en) - zasób materiałów nt. metabolizmu człowieka.
Bazy danych
- The BioCyc Collection of Pathway/Genome Databases
- Flow Chart of Metabolic Pathways
- The KEGG PATHWAY Database
- IUBMB-Nicholson Metabolic Pathways Chart
- Reactome - a knowledgebase of biological processes
Szlaki metaboliczne
- A general overview of the major metabolic pathways
- Glycolysis - poziom szkolny.
- Przeowodnik nt. fotosyntezy do pobrania (en) - poziom szkolny.
- What is Photosynthesis? - zasób artykułów nt. fotosyntezy.
{{link FA|en}} {{link FA|es}} {{link FA|he}} [[ar:استقلاب]] [[ca:Metabolisme]] [[cs:Metabolismus]] [[da:Stofskifte]] [[de:Stoffwechsel]] [[et:Metabolism]] [[en:Metabolism]] [[es:Metabolismo]] [[eo:Metabolo]] [[fa:دگرگشت]] [[fr:Métabolisme]] [[gl:Metabolismo]] [[ko:신진대사]] [[io:Metabolio]] [[id:Metabolisme]] [[is:Efnaskipti]] [[it:Metabolismo]] [[he:מטבוליזם]] [[lb:Metabolismus]] [[lt:Metabolizmas]] [[mk:Метаболизам]] [[nl:Stofwisseling]] [[ja:代謝]] [[no:Stoffskifte]] [[nn:Stoffskifte]] [[pt:Metabolismo]] [[ro:Metabolism]] [[ru:Метаболизм]] [[sq:Metabolizmi]] [[simple:Metabolism]] [[sk:Látková premena]] [[su:Métabolisme]] [[fi:Aineenvaihdunta]] [[sv:Metabolism]] [[th:กระบวนการสร้างและสลาย]] [[tr:Metabolizma]] [[uk:Обмін речовин]] [[vi:Trao đổi chất]]
