Koszatniczka pospolita: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
m Można nieco bardziej konstruktywnie usuwać stare znaczniki. Anulowanie wersji 73469154 autorstwa NiktWażny (dyskusja) Znaczniki: Anulowanie edycji Wycofane |
m przywrócenie, jedynie argument "bo wygląda ładnie" Znaczniki: Anulowanie edycji Wycofane |
||
| Linia 88: | Linia 88: | ||
! !! wymiar |
! !! wymiar |
||
|- |
|- |
||
| długość ciała z głową i ogonem || |
| długość ciała z głową i ogonem || 250–310 mm |
||
|- |
|- |
||
| długość ogona || |
| długość ogona || 65–130 mm |
||
|- |
|- |
||
| długość tylnej kończyny || |
| długość tylnej kończyny || 35–38 mm |
||
|- |
|- |
||
| długość ucha || |
| długość ucha || 24–32 mm |
||
|- |
|- |
||
| masa ciała || |
| masa ciała || 170–210 g{{r|Vasquez|Kenagy2002}}<br />lub 200–300 g{{r|Weir}}<br />200–250 g{{r|Davis}}<br /> Podawany jest także przedział 170–300 g{{r|Richardson}} |
||
|} |
|} |
||
Mimo znacznej zmienności w dostępie do pożywienia w poszczególnych porach roku masa ciała nie podlega istotnym wahaniom{{r|Bozinovic}}. W ukształtowaniu czaszki (''norma lateralis'') widoczne są wydatne puszki słuchowe (''bullae tympanicae''), które świadczą pośrednio o |
Mimo znacznej zmienności w dostępie do pożywienia w poszczególnych porach roku masa ciała nie podlega istotnym wahaniom{{r|Bozinovic}}. W ukształtowaniu czaszki (''norma lateralis'') widoczne są wydatne puszki słuchowe (''bullae tympanicae''), które świadczą pośrednio o |
||
| Linia 171: | Linia 171: | ||
Średnie wartości wyników [[Morfologia krwi|analiz morfologicznych]] krwi młodych i dorosłych koszatniczek pospolitych<br />na podstawie badań 35 zdrowych młodych (20 samców i 15 samic) w wieku 6–7 tygodni<br />oraz 35 zdrowych dorosłych koszatniczek pospolitych(20 samców i 15 samic) w wieku 1,25–3,5 roku (średnia 2,0)<br /><small>(V. Jekl, K. Hauptman, E. Jeklova, Z. Knotek, 2011)</small>{{r|Jekl2011_parametry}} |
Średnie wartości wyników [[Morfologia krwi|analiz morfologicznych]] krwi młodych i dorosłych koszatniczek pospolitych<br />na podstawie badań 35 zdrowych młodych (20 samców i 15 samic) w wieku 6–7 tygodni<br />oraz 35 zdrowych dorosłych koszatniczek pospolitych(20 samców i 15 samic) w wieku 1,25–3,5 roku (średnia 2,0)<br /><small>(V. Jekl, K. Hauptman, E. Jeklova, Z. Knotek, 2011)</small>{{r|Jekl2011_parametry}} |
||
|- style="background-color:DarkKhaki" |
|- style="background-color:DarkKhaki" |
||
| rowspan=2 | |
| rowspan=2 | '''Parametr''' |
||
| rowspan=2 | |
| rowspan=2 | '''j.m.''' |
||
| colspan=3 | |
| colspan=3 | '''Zwierzęta młode''' |
||
| colspan=3 | |
| colspan=3 | '''Zwierzęta dorosłe''' |
||
| rowspan=2 | |
| rowspan=2 | Wpływ<br />wieku |
||
|- style="background-color:Khaki" |
|- style="background-color:Khaki" |
||
| |
| średnia |
||
| |
| mediana |
||
| |
| przedział |
||
| |
| średnia |
||
| |
| mediana |
||
| |
| przedział |
||
|- |
|- |
||
| [[Erytrocyt|Czerwone krwinki]] |
| [[Erytrocyt|Czerwone krwinki]] |
||
| |
| x10<sup>12</sup>/l |
||
| |
| 7,3 |
||
| |
| 7,6 |
||
| |
| 4,72–9,01 |
||
| |
| 8,7 |
||
| |
| 8,98 |
||
| |
| 5,34–9,93 |
||
| width="35px" | |
| width="35px" | ↑ |
||
|- |
|- |
||
| [[Retikulocyt]]y |
| [[Retikulocyt]]y |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 7,4 |
||
| |
| 0,0 |
||
| |
| 0,0–80,24 |
||
| |
| 0,2 |
||
| |
| 0,0 |
||
| |
| 0,0–7,41 |
||
| |
| ↓ |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 0,1 |
||
| |
| 0,0 |
||
| |
| 0,0–0,17 |
||
| |
| 0,0 |
||
| |
| 0,0 |
||
| |
| 0,0–0,1 |
||
| |
| |
||
|- |
|- |
||
| [[Hemoglobina]] |
| [[Hemoglobina]] |
||
| |
| g/l |
||
| |
| 113,7 |
||
| |
| 116,0 |
||
| |
| 89,0–134 |
||
| |
| 117,6 |
||
| |
| 119,0 |
||
| |
| 99–131,0 |
||
| |
| |
||
|- |
|- |
||
| [[Hematokryt]] |
| [[Hematokryt]] |
||
| |
| l/l |
||
| |
| 0,4 |
||
| |
| 0,4 |
||
| |
| 0,32–0,51 |
||
| |
| 0,5 |
||
| |
| 0,46 |
||
| |
| 0,37–0,50 |
||
| |
| ↑ |
||
|- |
|- |
||
| [[MCV (wskaźnik)|MCV]] |
| [[MCV (wskaźnik)|MCV]] |
||
| |
| [[femto|fl]] |
||
| |
| 59,9 |
||
| |
| 58,6 |
||
| |
| 52,3–75,3 |
||
| |
| 51,4 |
||
| |
| 51,0 |
||
| |
| 47,2–64,5 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[MCH]] |
| [[MCH]] |
||
| |
| pg |
||
| |
| 15,8 |
||
| |
| 15,7 |
||
| |
| 13,6–19,5 |
||
| |
| 13,4 |
||
| |
| 13,3 |
||
| |
| 12,3–15,4 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[MCHC]] |
| [[MCHC]] |
||
| |
| g/l |
||
| |
| 264,5 |
||
| |
| 264,0 |
||
| |
| 240–291 |
||
| |
| 261,0 |
||
| |
| 263,0 |
||
| |
| 226–289 |
||
| |
| |
||
|- |
|- |
||
| [[Trombocyt|Płytki krwi]] |
| [[Trombocyt|Płytki krwi]] |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 453,4 |
||
| |
| 455,0 |
||
| |
| 57–896,0 |
||
| |
| 383,0 |
||
| |
| 362,0 |
||
| |
| 223–530 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Leukocyty|Białe krwinki]] |
| [[Leukocyty|Białe krwinki]] |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 7,2 |
||
| |
| 7,0 |
||
| |
| 2,0–12,3 |
||
| |
| 7,4 |
||
| |
| 7,1 |
||
| |
| 3,5–14,6 |
||
| |
| |
||
|- |
|- |
||
| [[Neutrofil]]e |
| [[Neutrofil]]e |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 0,1 |
||
| |
| 0,03 |
||
| |
| 0,0–1,0 |
||
| |
| 0,0 |
||
| |
| 0,0 |
||
| |
| 0,0–0,31 |
||
| |
| |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 1,0 |
||
| |
| 0,05 |
||
| |
| 0,0–6,0 |
||
| |
| 0,4 |
||
| |
| 0,0 |
||
| |
| 0,0–3,0 |
||
| |
| |
||
|- |
|- |
||
| [[Neutrofil]]e – formy segmentowane |
| [[Neutrofil]]e – formy segmentowane |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 2,2 |
||
| |
| 2,05 |
||
| |
| 0,38–4,8 |
||
| |
| 3,1 |
||
| |
| 2,89 |
||
| |
| 0,7–7,01 |
||
| |
| ↑ |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 32,0 |
||
| |
| 30,0 |
||
| |
| 11,0–63,0 |
||
| |
| 40,6 |
||
| |
| 40,5 |
||
| |
| 19,0–72,0 |
||
| |
| |
||
|- |
|- |
||
| [[Limfocyty]] |
| [[Limfocyty]] |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 4,6 |
||
| |
| 4,42 |
||
| |
| 0,96–10,2 |
||
| |
| 4,0 |
||
| |
| 3,9 |
||
| |
| 12,7–7,26 |
||
| |
| ↓ |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 63,2 |
||
| |
| 66,0 |
||
| |
| 33,0–85,0 |
||
| |
| 54,9 |
||
| |
| 54,9 |
||
| |
| 27,0–77,0 |
||
| |
| |
||
|- |
|- |
||
| [[Monocyt]]y |
| [[Monocyt]]y |
||
| |
| ×10<sup>9</sup>/l |
||
| |
| 0,1 |
||
| |
| 0,09 |
||
| |
| 0,0–0,41 |
||
| |
| 0,1 |
||
| |
| 0,07 |
||
| |
| 0,0–0,89 |
||
| |
| |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 1,9 |
||
| |
| 1,0 |
||
| |
| 0,0–5,0 |
||
| |
| 1,3 |
||
| |
| 1,0 |
||
| |
| 0,0–6,0 |
||
| |
| |
||
|- |
|- |
||
| [[Eozynofil]]e |
| [[Eozynofil]]e |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 0,1 |
||
| |
| 0,09 |
||
| |
| 0,0–0,47 |
||
| |
| 0,2 |
||
| |
| 0,15 |
||
| |
| 0,0–1,45 |
||
| |
| |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 1,8 |
||
| |
| 1,0 |
||
| |
| 0,0–8,0 |
||
| |
| 2,6 |
||
| |
| 2,0 |
||
| |
| 0,0–12,0 |
||
| |
| |
||
|- |
|- |
||
| [[Bazofil]]e |
| [[Bazofil]]e |
||
| |
| x10<sup>9</sup>/l |
||
| |
| 0,0 |
||
| |
| 0,0 |
||
| |
| 0,0–0,12 |
||
| |
| 0,0 |
||
| |
| 0,0 |
||
| |
| 0,0–0,19 |
||
| |
| |
||
|- |
|- |
||
| |
| |
||
| |
| % |
||
| |
| 0,1 |
||
| |
| 0,0 |
||
| |
| 0,0–2,0 |
||
| |
| 0,2 |
||
| |
| 0,0 |
||
| |
| 0,0–2,0 |
||
| |
| |
||
|} |
|} |
||
| Linia 410: | Linia 410: | ||
Średnie wartości wyników [[Badanie biochemiczne krwi|analiz biochemicznych]] [[Osocze krwi|osocza]] krwi młodych i dorosłych koszatniczek pospolitych<br />na podstawie badań 35 zdrowych młodych (20 samców i 15 samic) w wieku 6–7 tygodni<br />oraz 35 zdrowych dorosłych koszatniczek pospolitych (20 samców i 15 samic) w wieku 1,25–3,5 roku (średnia 2,0)<br /><small>(V. Jekl, K. Hauptman, E. Jeklova, Z. Knotek, 2011)</small>{{r|Jekl2011_parametry}} |
Średnie wartości wyników [[Badanie biochemiczne krwi|analiz biochemicznych]] [[Osocze krwi|osocza]] krwi młodych i dorosłych koszatniczek pospolitych<br />na podstawie badań 35 zdrowych młodych (20 samców i 15 samic) w wieku 6–7 tygodni<br />oraz 35 zdrowych dorosłych koszatniczek pospolitych (20 samców i 15 samic) w wieku 1,25–3,5 roku (średnia 2,0)<br /><small>(V. Jekl, K. Hauptman, E. Jeklova, Z. Knotek, 2011)</small>{{r|Jekl2011_parametry}} |
||
|- style="background-color:DarkKhaki" |
|- style="background-color:DarkKhaki" |
||
| rowspan=2 | |
| rowspan=2 | '''Parametr''' |
||
| rowspan=2 | |
| rowspan=2 | '''j.m.''' |
||
| colspan=3 | |
| colspan=3 | '''Zwierzęta młode''' |
||
| colspan=3 | |
| colspan=3 | '''Zwierzęta dorosłe''' |
||
| rowspan=2 | |
| rowspan=2 | Wpływ<br />wieku |
||
|- style="background-color:Khaki" |
|- style="background-color:Khaki" |
||
| |
| średnia |
||
| |
| mediana |
||
| |
| przedział |
||
| |
| średnia |
||
| |
| mediana |
||
| |
| przedział |
||
|- |
|- |
||
| [[Aldehyd 3-fosfoglicerynowy|GAP]] |
| [[Aldehyd 3-fosfoglicerynowy|GAP]] |
||
| |
| g/l |
||
| |
| 54,7 |
||
| |
| 53,8 |
||
| |
| 46,5–73,7 |
||
| |
| 63,1 |
||
| |
| 63,9 |
||
| |
| 45,8–77,7 |
||
| width="35px" | |
| width="35px" | ↑ |
||
|- |
|- |
||
| [[Albuminy]] |
| [[Albuminy]] |
||
| |
| g/l |
||
| |
| 34,0 |
||
| |
| 34,4 |
||
| |
| 28,6–40,6 |
||
| |
| 33,1 |
||
| |
| 33,3 |
||
| |
| 19,0–45,1 |
||
| |
| |
||
|- |
|- |
||
| [[Globuliny]] |
| [[Globuliny]] |
||
| |
| g/l |
||
| |
| 21,7 |
||
| |
| 20,2 |
||
| |
| 12,7–52,7 |
||
| |
| 30,0 |
||
| |
| 31,9 |
||
| |
| 16,5–47,8 |
||
| |
| ↑ |
||
|- |
|- |
||
| Albuminy:Globuliny |
| Albuminy:Globuliny |
||
| |
| |
||
| |
| 1,7 |
||
| |
| 1,7 |
||
| |
| 0,66–2,5 |
||
| |
| 1,2 |
||
| |
| 1,1 |
||
| |
| 0,4–2,58 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Glukoza]] |
| [[Glukoza]] |
||
| |
| mmol/l |
||
| |
| 9,4 |
||
| |
| 9,4 |
||
| |
| 5,6–14,1 |
||
| |
| 8,9 |
||
| |
| 8,9 |
||
| |
| 5,5–13,1 |
||
| |
| |
||
|- |
|- |
||
| [[Mocznik]] |
| [[Mocznik]] |
||
| |
| mmol/l |
||
| |
| 15,1 |
||
| |
| 15,9 |
||
| |
| 10,8–22,0 |
||
| |
| 10,1 |
||
| |
| 10,0 |
||
| |
| 6,6–14,9 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Kreatynina]] |
| [[Kreatynina]] |
||
| |
| μmol/l |
||
| |
| 56,5 |
||
| |
| 57,8 |
||
| |
| 34,4–87,2 |
||
| |
| 51,4 |
||
| |
| 51,0 |
||
| |
| 29,9–77,3 |
||
| |
| |
||
|- |
|- |
||
| [[Triacyloglicerole|Trójglicerydy]] |
| [[Triacyloglicerole|Trójglicerydy]] |
||
| |
| mmol/l |
||
| |
| 1,8 |
||
| |
| 1,5 |
||
| |
| 0,01–4,47 |
||
| |
| 1,9 |
||
| |
| 1,59 |
||
| |
| 0,44–4,85 |
||
| |
| |
||
|- |
|- |
||
| [[Cholesterol]] |
| [[Cholesterol]] |
||
| |
| mmol/l |
||
| |
| 2,5 |
||
| |
| 2,3 |
||
| |
| 1,8–4,9 |
||
| |
| 2,0 |
||
| |
| 2,1 |
||
| |
| 1,2–2,7 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Aminotransferaza alaninowa|Alat]] |
| [[Aminotransferaza alaninowa|Alat]] |
||
| |
| iu/l |
||
| |
| 33,5 |
||
| |
| 29,3 |
||
| |
| 12,57–107,19 |
||
| |
| 18,0 |
||
| |
| 18,0 |
||
| |
| 9,58–47,9 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Aminotransferaza asparaginianowa|Aspat]] |
| [[Aminotransferaza asparaginianowa|Aspat]] |
||
| |
| iu/l |
||
| |
| 61,1 |
||
| |
| 53,3 |
||
| |
| 10,18–192,81 |
||
| |
| 47,9 |
||
| |
| 36,5 |
||
| |
| 19,16–137,72 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Amylazy]] |
| [[Amylazy]] |
||
| |
| iu/l |
||
| |
| 892,8 |
||
| |
| 805,4 |
||
| |
| 409,58–1947,9 |
||
| |
| 820,4 |
||
| |
| 755,7 |
||
| |
| 481,44–1263,47 |
||
| |
| |
||
|- |
|- |
||
| [[Lipazy]] |
| [[Lipazy]] |
||
| |
| iu/l |
||
| |
| 43,7 |
||
| |
| 37,1 |
||
| |
| 16,77–111,98 |
||
| |
| 29,9 |
||
| |
| 26,4 |
||
| |
| 2,99–39,52 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Gamma-glutamylotranspeptydaza|GGTP]] |
| [[Gamma-glutamylotranspeptydaza|GGTP]] |
||
| |
| iu/l |
||
| |
| 9,08 |
||
| |
| 1,8 |
||
| |
| 1,8–10,18 |
||
| |
| 6,0 |
||
| |
| 1,8 |
||
| |
| 1,8–7,78 |
||
| |
| |
||
|- |
|- |
||
| [[Kinaza kreatynowa|CK]] |
| [[Kinaza kreatynowa|CK]] |
||
| |
| iu/l |
||
| |
| 1159,3 |
||
| |
| 1094,6 |
||
| |
| 215,57–16012,0 |
||
| |
| 958,1 |
||
| |
| 692,2 |
||
| |
| 120,96–4245,51 |
||
| |
| |
||
|- |
|- |
||
| [[Dehydrogenaza mleczanowa|LDH]] |
| [[Dehydrogenaza mleczanowa|LDH]] |
||
| |
| iu/l |
||
| |
| 1159,3 |
||
| |
| 1094,6 |
||
| |
| 35,33–1934,13 |
||
| |
| 562,9 |
||
| |
| 544,9 |
||
| |
| 313,17–894,01 |
||
| |
| |
||
|- |
|- |
||
| [[Sód]] |
| [[Sód]] |
||
| |
| mmol/l |
||
| |
| 142,3 |
||
| |
| 141,9 |
||
| |
| 131,6–156,5 |
||
| |
| 142,1 |
||
| |
| 142,7 |
||
| |
| 123,0–151,2 |
||
| |
| |
||
|- |
|- |
||
| [[Potas]] |
| [[Potas]] |
||
| |
| mmol/l |
||
| |
| 4,4 |
||
| |
| 4,3 |
||
| |
| 2,9–8,1 |
||
| |
| 3,8 |
||
| |
| 3,9 |
||
| |
| 3,1–4,7 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Chlorki]] |
| [[Chlorki]] |
||
| |
| mmol/l |
||
| |
| 104,9 |
||
| |
| 104,8 |
||
| |
| 91,2–116,4 |
||
| |
| 103,4 |
||
| |
| 103,2 |
||
| |
| 91,8–113,8 |
||
| |
| |
||
|- |
|- |
||
| [[Wapń]] |
| [[Wapń]] |
||
| |
| mmol/l |
||
| |
| 3,2 |
||
| |
| 3,1 |
||
| |
| 2,69–3,73 |
||
| |
| 2,5 |
||
| |
| 2,6 |
||
| |
| 2,01–2,96 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Fosforany]] |
| [[Fosforany]] |
||
| |
| mmol/l |
||
| |
| 2,2 |
||
| |
| 2,2 |
||
| |
| 1,09–3,73 |
||
| |
| 1,5 |
||
| |
| 1,5 |
||
| |
| 0,63–2,10 |
||
| |
| ↓ |
||
|- |
|- |
||
| [[Bilirubina]] |
| [[Bilirubina]] |
||
| |
| μmol/l |
||
| |
| 2,4 |
||
| |
| 2,4 |
||
| |
| 0,90–5,4 |
||
| |
| 2,8 |
||
| |
| 0,9 |
||
| |
| 0,9–5,4 |
||
| |
| |
||
|- |
|- |
||
| [[Kwasy żółciowe]] |
| [[Kwasy żółciowe]] |
||
| |
| μmol/l |
||
| |
| – |
||
| |
| – |
||
| |
| – |
||
| |
| 13,5 |
||
| |
| 8,2 |
||
| |
| 1,1–45,9 |
||
| |
| |
||
|} |
|} |
||
| Linia 668: | Linia 668: | ||
|- style="background-color:DarkKhaki" |
|- style="background-color:DarkKhaki" |
||
| |
| |
||
| colspan=2 | |
| colspan=2 | '''Samice''' |
||
| colspan=2 | |
| colspan=2 | '''Samce''' |
||
| colspan=2 | |
| colspan=2 | '''Średnia całej grupy''' |
||
|- style="background-color:Khaki" |
|- style="background-color:Khaki" |
||
| style="background-color:DarkKhaki” | |
| style="background-color:DarkKhaki” | '''Aktywność''' |
||
| |
| uczestniczące w rozrodzie<br />n= 22<br />[%] |
||
| |
| nie uczestniczące<br />n = 23<br />[%] |
||
| |
| uczestniczące w rozrodzie<br />n = 10<br />[%] |
||
| |
| nie uczestniczące<br />n = 23<br />[%] |
||
| |
| n = 78<br />[%] |
||
|- |
|- |
||
| Żerowanie |
| Żerowanie |
||
| |
| 51,5 |
||
| |
| 48,4 |
||
| |
| 34,9 |
||
| |
| 42,7 |
||
| |
| 45,8 |
||
|- |
|- |
||
| Czuwanie (na 4 łapach) |
| Czuwanie (na 4 łapach) |
||
| |
| 26,2 |
||
| |
| 25,9 |
||
| |
| 21,8 |
||
| |
| 26,6 |
||
| |
| 25,7 |
||
|- |
|- |
||
| Czuwanie (w pozycji wypionowanej) |
| Czuwanie (w pozycji wypionowanej) |
||
| |
| 2,5 |
||
| |
| 6,8 |
||
| |
| 4,6 |
||
| |
| 9,4 |
||
| |
| 6,1 |
||
|- |
|- |
||
| Razem czujność |
| Razem czujność |
||
| |
| 28,7 |
||
| |
| 32,6 |
||
| |
| 26,4 |
||
| |
| 36,0 |
||
| |
| 31,7 |
||
|- |
|- |
||
| Odpoczynek |
| Odpoczynek |
||
| |
| 10,1 |
||
| |
| 6,9 |
||
| |
| 17,0 |
||
| |
| 16,9 |
||
| |
| 7,5 |
||
|- |
|- |
||
| Przemieszczanie się |
| Przemieszczanie się |
||
| |
| 5,7 |
||
| |
| 10,6 |
||
| |
| 3,0 |
||
| |
| 6,8 |
||
| |
| 7,1 |
||
|- |
|- |
||
| Zaloty |
| Zaloty |
||
| |
| 4,3 |
||
| |
| 2,8 |
||
| |
| 2,2 |
||
| |
| 2,7 |
||
| |
| 3,1 |
||
|- |
|- |
||
| Kąpiele w piasku |
| Kąpiele w piasku |
||
| |
| 0,8 |
||
| |
| 0,5 |
||
| |
| 5,5 |
||
| |
| 0,6 |
||
| |
| 1,2 |
||
|- |
|- |
||
| Prace przy budowie nory |
| Prace przy budowie nory |
||
| |
| 0,3 |
||
| |
| 0,2 |
||
| |
| 0,4 |
||
| |
| 0,1 |
||
| |
| 0,2 |
||
|- |
|- |
||
| Interakcje społeczne |
| Interakcje społeczne |
||
| |
| 1,7 |
||
| |
| 3,7 |
||
| |
| 9,0 |
||
| |
| 1,8 |
||
| |
| 3,2 |
||
|} |
|} |
||
| Linia 801: | Linia 801: | ||
! !! Masa ciała |
! !! Masa ciała |
||
|- |
|- |
||
| przy urodzeniu || |
| przy urodzeniu || 14 g |
||
|- |
|- |
||
| po odstawieniu przez samicę || |
| po odstawieniu przez samicę || 77,4 g (przedział 40–122 g) |
||
|- |
|- |
||
| po osiągnięciu dojrzałości płciowej (samice) || |
| po osiągnięciu dojrzałości płciowej (samice) || 204,8 g (±10,4 g) |
||
|} |
|} |
||
| Linia 815: | Linia 815: | ||
Badania wykazały, że można odwrócić rytm dobowy koszatniczki pospolitej na nocny poprzez wywołanie u zwierzęcia reakcji na zmiany otoczenia (presja drapieżników, zmiany w dostępności pokarmu i temperatury). Ta umiejętność pozwala koszatniczkom dostosować się warunków bezpiecznych i wspomaga przetrwanie{{r|Kas}}. |
Badania wykazały, że można odwrócić rytm dobowy koszatniczki pospolitej na nocny poprzez wywołanie u zwierzęcia reakcji na zmiany otoczenia (presja drapieżników, zmiany w dostępności pokarmu i temperatury). Ta umiejętność pozwala koszatniczkom dostosować się warunków bezpiecznych i wspomaga przetrwanie{{r|Kas}}. |
||
'''Wykresy dobowej aktywności koszatniczek pospolitych w poszczególnych porach roku<br />w stacji badawczej Wydziału Nauk Rolniczych Universidad de Chile „Estación Experimental Rinconada de Maipú”<br />w latach 1996–1997'''<small>'''(za: Kenagy, Nespolo, Vasquez, Bozinovic (2002))'''{{r|Kenagy2002}}</small> |
|||
[[Plik:Daily acivity of O. degus in summer.png|x150px]] |
[[Plik:Daily acivity of O. degus in summer.png|x150px]] |
||
| Linia 873: | Linia 873: | ||
| |
| |
||
| |
| |
||
| |
| '''kwiecień 1975''' |
||
| |
| '''lipiec 1975''' |
||
| |
| '''sierpień 1975''' |
||
| |
| '''wrzesień 1975''' |
||
| |
| '''październik 1975''' |
||
| |
| '''listopad 1975''' |
||
| |
| '''grudzień 1975''' |
||
| |
| '''luty 1976''' |
||
| |
| '''marzec 1976''' |
||
|- style="background-color:Khaki" |
|- style="background-color:Khaki" |
||
| style="background-color:DarkKhaki" | |
| style="background-color:DarkKhaki" | '''Zawartość żołądków''' |
||
| style="background-color:DarkKhaki" | |
| style="background-color:DarkKhaki" | '''części roślin''' |
||
| |
| n = 12 |
||
| |
| n = 2 |
||
| |
| n = 10 |
||
| |
| n = 8 |
||
| |
| n = 14 <br /> <small>(w tym 7 młodych)</small> |
||
| |
| n = 11 |
||
| |
| n = 8 |
||
| |
| n = 7 |
||
| |
| n = 2 |
||
|- |
|- |
||
| style="background-color:Cornsilk" | '''[[krzew]]y:''' |
| style="background-color:Cornsilk" | '''[[krzew]]y:''' |
||
|- |
|- |
||
| ''[[Acacia caven]]'' |
| ''[[Acacia caven]]'' |
||
| |
| liście |
||
| |
| 12,3% |
||
| |
| 1,7% |
||
| |
| 2,5% |
||
| |
| 0,9% |
||
| |
| 0,4% |
||
| |
| 1,4% |
||
| |
| 3,3% |
||
| |
| 25,2% |
||
| |
| 3,0% |
||
|- |
|- |
||
| ''[[Lithraea caustica]]'' |
| ''[[Lithraea caustica]]'' |
||
| |
| liście |
||
| |
| 0,5% |
||
| |
| |
||
| |
| 0,8% |
||
| |
| 0,5% |
||
| |
| |
||
| |
| 0,8% |
||
| |
| 2,0% |
||
| |
| 7,4% |
||
| |
| |
||
|- |
|- |
||
| ''[[Quillaja saponaria]]'' |
| ''[[Quillaja saponaria]]'' |
||
| |
| liście |
||
| |
| 1,8% |
||
| |
| 6% |
||
| |
| 1,1% |
||
| |
| |
||
| |
| 0,2% |
||
| |
| 0,2% |
||
| |
| 0,6% |
||
| |
| |
||
| |
| |
||
|- |
|- |
||
| ''[[Colliguaya odorifera]]'' |
| ''[[Colliguaya odorifera]]'' |
||
| |
| liście |
||
| |
| 1,7% |
||
| |
| |
||
| |
| 0,2% |
||
| |
| |
||
| |
| |
||
| Linia 946: | Linia 946: | ||
|- |
|- |
||
| inne krzewy |
| inne krzewy |
||
| |
| liście |
||
| |
| |
||
| |
| 0,6% |
||
| <small |
| <small> śladowe<br /> ilości </small> |
||
| |
| |
||
| |
| 0,2% |
||
| |
| 0,2% |
||
| |
| |
||
| |
| |
||
| Linia 958: | Linia 958: | ||
|- |
|- |
||
| ''[[Acacia caven]]'' |
| ''[[Acacia caven]]'' |
||
| |
| [[Nasiono|nasiona]] |
||
| |
| 1,0% |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 0,4% |
||
| |
| |
||
| |
| |
||
| |
| 4,6% |
||
| |
| |
||
|- |
|- |
||
| ''[[Lithraea caustica]]'' |
| ''[[Lithraea caustica]]'' |
||
| |
| nasiona |
||
| |
| 0,7% |
||
| |
| |
||
| |
| 1,3% |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 3,2% |
||
| |
| 1,7% |
||
|- |
|- |
||
| ''[[Colliguaya odorifera]]'' |
| ''[[Colliguaya odorifera]]'' |
||
| |
| nasiona |
||
| |
| 1,0% |
||
| |
| 0,4% |
||
| <small |
| <small> śladowe<br /> ilości </small> |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 1,0% |
||
| |
| 3,1% |
||
| |
| |
||
|- |
|- |
||
| inne krzewy |
| inne krzewy |
||
| |
| nasiona |
||
| |
| 4,7% |
||
| |
| |
||
| |
| 0,1% |
||
| |
| 0,2% |
||
| |
| 0,1% |
||
| |
| 0,4% |
||
| |
| 0,8% |
||
| |
| 0,3% |
||
| |
| 3,7% |
||
|- |
|- |
||
| [[tkanka przewodząca]] krzewów |
| [[tkanka przewodząca]] krzewów |
||
| |
| |
||
| |
| 13,7% |
||
| |
| 2,9% |
||
| |
| 0,9% |
||
| |
| 0,3% |
||
| |
| 2,4% |
||
| |
| 1,2% |
||
| |
| 17,3% |
||
| |
| 14,3% |
||
| |
| 39,2% |
||
|- |
|- |
||
| style="background-color:Cornsilk" | '''[[zioła]] i [[wiechlinowate|trawy]]:''' |
| style="background-color:Cornsilk" | '''[[zioła]] i [[wiechlinowate|trawy]]:''' |
||
|- |
|- |
||
| [[iglica pospolita]] |
| [[iglica pospolita]] |
||
| |
| liście |
||
| |
| 0,2% |
||
| |
| 29,3% |
||
| |
| 45,1% |
||
| |
| 48,3% |
||
| |
| 26,5% |
||
| |
| 18,0% |
||
| |
| 21,3% |
||
| |
| 21,0% |
||
| |
| |
||
|- |
|- |
||
| [[astrowate]]: <br />''[[Haplppappus]]'' i [[starzec]] |
| [[astrowate]]: <br />''[[Haplppappus]]'' i [[starzec]] |
||
| |
| liście |
||
| |
| |
||
| |
| |
||
| Linia 1038: | Linia 1038: | ||
| |
| |
||
| |
| |
||
| |
| 0,5% |
||
| |
| 12,1% |
||
| |
| |
||
| |
| |
||
|- |
|- |
||
| [[oset]] ''[[Carduus pygnocephalus]]'' |
| [[oset]] ''[[Carduus pygnocephalus]]'' |
||
| |
| liście |
||
| |
| |
||
| |
| |
||
| |
| 0,5% |
||
| |
| 0,2% |
||
| <small |
| <small> śladowe<br /> ilości </small> |
||
| |
| |
||
| |
| |
||
| Linia 1056: | Linia 1056: | ||
|- |
|- |
||
| ''[[Pasithaea]]'' i ''[[Solenomelus]]'' |
| ''[[Pasithaea]]'' i ''[[Solenomelus]]'' |
||
| |
| liście |
||
| |
| |
||
| |
| |
||
| |
| 0,2% |
||
| |
| 0,3% |
||
| |
| 0,2% |
||
| |
| |
||
| |
| 0,9% |
||
| |
| |
||
| |
| |
||
|- |
|- |
||
| inne zioła |
| inne zioła |
||
| |
| liście |
||
| |
| 0,3% |
||
| |
| |
||
| |
| 0,3% |
||
| |
| 2,0% |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 0,2% |
||
| |
| |
||
|- |
|- |
||
| [[wiechlinowate|trawy]] z rodzaju [[stokłosa]] |
| [[wiechlinowate|trawy]] z rodzaju [[stokłosa]] |
||
| |
| liście |
||
| |
| 0,1% |
||
| |
| 45,0% |
||
| |
| 31,9% |
||
| |
| 37,3% |
||
| |
| 1,6% |
||
| |
| 9,9% |
||
| |
| 0,8% |
||
| |
| |
||
| |
| |
||
|- |
|- |
||
| ''[[Trisetobromus hirtus]]'' |
| ''[[Trisetobromus hirtus]]'' |
||
| |
| liście |
||
| <small |
| <small> śladowe<br /> ilości </small> |
||
| |
| |
||
| |
| |
||
| |
| 0,4% |
||
| |
| 0,2% |
||
| |
| 0,2% |
||
| |
| |
||
| |
| |
||
| Linia 1104: | Linia 1104: | ||
|- |
|- |
||
| [[kostrzewa]] |
| [[kostrzewa]] |
||
| |
| liście |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 0,5% |
||
| |
| |
||
| |
| 0,4% |
||
| |
| |
||
| |
| |
||
|- |
|- |
||
| inne trawy |
| inne trawy |
||
| |
| liście |
||
| |
| |
||
| |
| 2,6% |
||
| |
| 0,5% |
||
| |
| |
||
| |
| 0,2% |
||
| |
| |
||
| |
| 0,2% |
||
| |
| |
||
| |
| 1,3% |
||
|- |
|- |
||
| [[iglica pospolita]] |
| [[iglica pospolita]] |
||
| |
| nasiona |
||
| |
| 8,7% |
||
| |
| 0,9% |
||
| |
| 0,1% |
||
| |
| 0,7% |
||
| |
| 38,0% |
||
| |
| 10,2% |
||
| |
| 3,0% |
||
| |
| 3,5% |
||
| |
| |
||
|- |
|- |
||
| inne zioła |
| inne zioła |
||
| |
| nasiona |
||
| |
| 0,1% |
||
| |
| |
||
| |
| 1,1% |
||
| |
| 0,5% |
||
| |
| 3,0% |
||
| |
| 0,7% |
||
| |
| 1,7% |
||
| |
| 0,3% |
||
| |
| 1,0% |
||
|- |
|- |
||
| trawy |
| trawy |
||
| |
| nasiona |
||
| |
| 34,3% |
||
| |
| 1,3% |
||
| |
| 0,9% |
||
| |
| 3,4% |
||
| |
| 16,2% |
||
| |
| 46,9% |
||
| |
| 20,1% |
||
| |
| 21,2% |
||
| |
| 33,0% |
||
|- |
|- |
||
| style="background-color:Cornsilk" | [[stawonogi]] |
| style="background-color:Cornsilk" | [[stawonogi]] |
||
| |
| |
||
| |
| 0,2% |
||
| |
| |
||
| <small |
| <small> śladowe<br /> ilości </small> |
||
| |
| |
||
| |
| 0,1% |
||
| |
| 0,2% |
||
| |
| 0,8% |
||
| |
| 0,5% |
||
| |
| 0,4% |
||
|- |
|- |
||
| style="background-color:Cornsilk" | stawonogi |
| style="background-color:Cornsilk" | stawonogi |
||
| |
| [[larwa|larwy]] |
||
| |
| 0,3% |
||
| |
| |
||
| |
| |
||
| |
| |
||
| |
| 0,1% |
||
| |
| 0,5% |
||
| |
| 0,4% |
||
| |
| |
||
| |
| |
||
| Linia 1188: | Linia 1188: | ||
| style="background-color:Cornsilk" | przynęta |
| style="background-color:Cornsilk" | przynęta |
||
| |
| |
||
| |
| 10,3% |
||
| |
| |
||
| |
| 1,6% |
||
| |
| |
||
| |
| 1,0% |
||
| |
| 4,6% |
||
| |
| 6,1% |
||
| |
| 3,8% |
||
| |
| 0,7% |
||
|- |
|- |
||
| style="background-color:Cornsilk" | niezidentyfikowany materiał |
| style="background-color:Cornsilk" | niezidentyfikowany materiał |
||
| |
| |
||
| |
| 8,1% |
||
| |
| 9,3% |
||
| |
| 10,9% |
||
| |
| 4,7% |
||
| |
| 9,0% |
||
| |
| 3,7% |
||
| |
| 7,6% |
||
| |
| 10,3% |
||
| |
| 16,0% |
||
|} |
|} |
||
| Linia 1279: | Linia 1279: | ||
|- |
|- |
||
|odsetek nor wykazujących świeże ślady kopania (%) |
|odsetek nor wykazujących świeże ślady kopania (%) |
||
| |
|16,3 |
||
|5,4 |
|||
|<center>5,4</center> |
|||
|1,6 |
|||
|<center>1,6</center> |
|||
|4,7 |
|||
|<center>4,7</center> |
|||
|- |
|- |
||
|opady (mm) |
|opady (mm) |
||
| |
|58,6 |
||
| |
|12,2 |
||
|1,3 |
|||
|<center>1,3</center> |
|||
| |
|19,9 |
||
|- |
|- |
||
|wilgotność gleby na głębokości 5 cm (%) |
|wilgotność gleby na głębokości 5 cm (%) |
||
|8,3 |
|||
|<center>8,3</center> |
|||
| |
|12,4 |
||
|0,7 |
|||
|<center>0,7</center> |
|||
|0,4 |
|||
|<center>0,4</center> |
|||
|- |
|- |
||
|twardość gleby (N m<sup>−2</sup>) |
|twardość gleby (N m<sup>−2</sup>) |
||
| |
|58,6 |
||
| |
|12,2 |
||
|1,3 |
|||
|<center>1,3</center> |
|||
| |
|19,9 |
||
|} |
|} |
||
| Linia 1346: | Linia 1346: | ||
|- style="background-color:DarkKhaki" |
|- style="background-color:DarkKhaki" |
||
| |
| |
||
| colspan=2 | |
| colspan=2 | '''Wszystkie zwierzęta''' |
||
| colspan=2 | |
| colspan=2 | '''Zwierzęta starsze niż 2 lata''' |
||
| colspan=2 | |
| colspan=2 | '''Zwierzęta młodsze niż 2 lata''' |
||
|- style="background-color:Khaki" |
|- style="background-color:Khaki" |
||
| style="background-color:DarkKhaki" | |
| style="background-color:DarkKhaki" | '''Schorzenie''' |
||
| |
| n = 300 |
||
| |
| % |
||
| |
| n = 190 |
||
| |
| % |
||
| |
| n = 110 |
||
| |
| % |
||
|- |
|- |
||
| [[Zęby]] |
| [[Zęby]] |
||
| |
| 180 |
||
| |
| 60,00 |
||
| |
| 144 |
||
| |
| 75,80 |
||
| |
| 34 |
||
| |
| 30,91 |
||
|- |
|- |
||
| [[Skóra]] i sierść |
| [[Skóra]] i sierść |
||
| |
| 110 |
||
| |
| 36,67 |
||
| |
| 56 |
||
| |
| 29,47 |
||
| |
| 54 |
||
| |
| 49,09 |
||
|- |
|- |
||
| [[Oko|Oczy]] |
| [[Oko|Oczy]] |
||
| |
| 50 |
||
| |
| 16,67 |
||
| |
| 32 |
||
| |
| 16,84 |
||
| |
| 18 |
||
| |
| 16,36 |
||
|- |
|- |
||
| [[Układ pokarmowy]] |
| [[Układ pokarmowy]] |
||
| |
| 30 |
||
| |
| 9,33 |
||
| |
| 17 |
||
| |
| 8,95 |
||
| |
| 13 |
||
| |
| 11,82 |
||
|- |
|- |
||
| Problemy poporodowe |
| Problemy poporodowe |
||
| |
| 28 |
||
| |
| 9,33 |
||
| |
| 20 |
||
| |
| 10,53 |
||
| |
| 8 |
||
| |
| 7,27 |
||
|- |
|- |
||
| [[Urazy kości i stawów|Uszkodzenia kości]] |
| [[Urazy kości i stawów|Uszkodzenia kości]] |
||
| |
| 22 |
||
| |
| 7,33 |
||
| |
| 140 |
||
| |
| 7,37 |
||
| |
| 8 |
||
| |
| 7,27 |
||
|- |
|- |
||
| [[Nieżyt nosa]] |
| [[Nieżyt nosa]] |
||
| |
| 16 |
||
| |
| 5,33 |
||
| |
| 14 |
||
| |
| 7,37 |
||
| |
| 8 |
||
| |
| 7,27 |
||
|- |
|- |
||
| [[Cukrzyca]] |
| [[Cukrzyca]] |
||
| |
| 12 |
||
| |
| 4,00 |
||
| |
| 10 |
||
| |
| 5,26 |
||
| |
| 2 |
||
| |
| 1,82 |
||
|- |
|- |
||
| [[Otyłość]] |
| [[Otyłość]] |
||
| |
| 12 |
||
| |
| 4,00 |
||
| |
| 9 |
||
| |
| 4,74 |
||
| |
| 3 |
||
| |
| 2,73 |
||
|- |
|- |
||
| [[Ucho|Uszy]] |
| [[Ucho|Uszy]] |
||
| |
| 5 |
||
| |
| 1,67 |
||
| |
| 3 |
||
| |
| 1,58 |
||
| |
| 2 |
||
| |
| 1,82 |
||
|- |
|- |
||
| [[Niewydolność nerek]] |
| [[Niewydolność nerek]] |
||
| |
| 4 |
||
| |
| 1,33 |
||
| |
| 4 |
||
| |
| 2,11 |
||
| |
| 0 |
||
| |
| 0,00 |
||
|- |
|- |
||
| [[Padaczka]] (o nieznanej [[Etiologia|etiologii]]) |
| [[Padaczka]] (o nieznanej [[Etiologia|etiologii]]) |
||
| |
| 2 |
||
| |
| 67,00 |
||
| |
| 0 |
||
| |
| 0,00 |
||
| |
| 2 |
||
| |
| 1,82 |
||
|- |
|- |
||
| [[Udar cieplny|Przegrzanie]] |
| [[Udar cieplny|Przegrzanie]] |
||
| |
| 1 |
||
| |
| 33,00 |
||
| |
| 1 |
||
| |
| 53,00 |
||
| |
| 0 |
||
| |
| 0,00 |
||
|- |
|- |
||
| [[Agonia|Stan agonalny]] |
| [[Agonia|Stan agonalny]] |
||
| |
| 14 |
||
| |
| 4,67 |
||
| |
| 8 |
||
| |
| 4,21 |
||
| |
| 6 |
||
| |
| 5,45 |
||
|- |
|- |
||
| Zdrowe zwierzęta |
| Zdrowe zwierzęta |
||
| |
| 38 |
||
| |
| 12,67 |
||
| |
| 16 |
||
| |
| 8,42 |
||
| |
| 22 |
||
| |
| 20,00 |
||
|} |
|} |
||
[[Plik:O. degus eye (cataract).jpg|thumb|Oko koszatniczki z zaćmą]] |
[[Plik:O. degus eye (cataract).jpg|thumb|Oko koszatniczki z zaćmą]] |
||
Wersja z 19:02, 11 kwi 2024
| Octodon degus[1] | |||||
| (Molina, 1782) | |||||
| Okres istnienia: holocen | |||||
 Koszatniczka pospolita (Octodon degus) | |||||
| Systematyka | |||||
| Domena | |||||
|---|---|---|---|---|---|
| Królestwo | |||||
| Typ | |||||
| Podtyp | |||||
| Gromada | |||||
| Podgromada | |||||
| Infragromada | |||||
| Rząd | |||||
| Podrząd | |||||
| Infrarząd | |||||
| Nadrodzina | |||||
| Rodzina | |||||
| Rodzaj | |||||
| Gatunek |
koszatniczka pospolita | ||||
| |||||
| Kategoria zagrożenia (CKGZ)[7] | |||||
 | |||||
| Zasięg występowania | |||||
| |||||
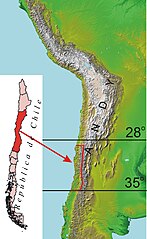
Koszatniczka pospolita[8], dawniej także: koszatniczka[9][10] (Octodon degus) – endemiczny gatunek gryzonia z rodziny koszatniczkowatych (Octodontidae)[2], zamieszkujący w Chile obszar między wybrzeżem Oceanu Spokojnego i zachodnimi zboczami Andów, najliczniej pomiędzy Vallenar a Curicó[11] (28–35°S)[2] do wysokości 1200 m n.p.m.[2][12], 1800 m n.p.m.[13][14] lub 2000 m n.p.m.[15]
Koszatniczka pospolita jest zwierzęciem silnie terytorialnym, wiedzie dzienny tryb życia w niewielkich grupach społecznych składających się z 2–5 samic i 1–2 samców, w ramach których osobniki wspólnie użytkują nory oraz tereny żerowania[16][17]. Buduje podziemne nory i spędza w nich znaczną część życia. Ma szereg cech morfologicznych i fizjologicznych, które ułatwiają jej prowadzenie życia pod ziemią i w półpustynnych warunkach panujących w jej zasięgu występowania. Wykorzystuje wodę w sposób bardzo efektywny (może przeżyć bez dostępu do wody nawet 13 dni)[18], jej układ oddechowy wykazuje stosunkowo małą reakcję na niedotlenienie, które grozi ssakom przebywającym przez dłuższy czas pod ziemią[19]. Grzbietowe części ciała są mocniej wybarwione niż brzuszne i mają istotny współczynnik odbicia promieniowania UV[20], a samo wybarwienie grzbietu stanowi dobry kamuflaż i pozwala w naturze wtopić się w tło i pozostać niezauważonym przez wroga[20][21].
Do laboratoriów Ameryki Północnej i Europy koszatniczki trafiły w połowie lat 60. XX wieku, jako zwierzęta do prowadzenia badań nad cukrzycą[22][23][24]. Insulina tych gryzoni ma odmienną strukturę[25][26] i wykazuje tylko 1–10% aktywności biologicznej w porównaniu z innymi ssakami[25], więc ich metabolizm nie pozwala na przyswajanie glukozy[24] i koszatniczki są bardzo podatne na tę chorobę[2][25]. Osobniki pochodzące z populacji sprowadzonych jako zwierzęta laboratoryjne do laboratoriów w USA i Wielkiej Brytanii trafiły z czasem do indywidualnych hodowców hobbystycznych[27][24][21]. W hodowli wymagają dużo wolnej przestrzeni[24]. Powinny być hodowane w jednopłciowych parach lub stadach do 4–5 osobników[21][28][29].
W Chile jest ssakiem o najliczniejszej populacji[30][31]. W Polsce wyjątkowo stwierdza się osobniki zdziczałe, występujące jako gatunek zawleczony[32][33]. Międzynarodowa Unia Ochrony Przyrody (IUCN) wymienia koszatniczkę pospolitą w Czerwonej księdze gatunków zagrożonych jako gatunek najmniejszej troski[7].
Historia odkrycia i badań



W 1782 roku, jako pierwszy badacz, koszatniczkę pospolitą opisał w swojej publikacji „Saggio sulla Storia Naturale del Cile” („Historia natury w Chile”) chilijski jezuita i przyrodnik Juan Ignacio Molina[35]. Molina nadał koszatniczce nazwę Sciurus Degus z synonimicznym oznaczeniem Myoxus[36] (które mogło sugerować związek gatunku z popielicą) i opisał ją jako gryzonia większego od domowych myszy – „pośredniego pomiędzy popielicami i szczurami”, o krótkiej głowie i długim ogonie zakończonym pękiem dłuższych włosów i z sierścią „blond” przemieszaną z włosem ciemniejszym. W krótkim opisie określa także lokalizację w okolicy stolicy Chile, podkreśla społeczny tryb życia zwierząt mieszkających w rozsianych na niewielkim obszarze norach, pomiędzy którymi utworzone są stałe trasy komunikacyjne, i porównuje ten obraz do topografii współczesnych mu wsi[35]. Na początku XIX w. Shaw zaproponował dla koszatniczki pospolitej nazwę Chilian squirrel[6], zaś w 1832 Edward Turner Bennett opisał na łamach „Proceedings of the Zoological Society of London” nowy gatunek – Octodon cumingii, wskazując na różnice, jakie odnotował w stosunku do znanych już koszatniczek[37]. W 1833 przyrodnik dr Franz Meyen zaproponował nazwę rodzajową Dendrobius[38] i opublikował opis Dendrobius degus, lecz Bennett szybko wydał sprostowanie, że jest to gryzoń tożsamy z opisanym przez niego Octodon cumingii[39][40]. W 1836 kurator muzeum Zoological Society of London William Martin opublikował analizę wypreparowanych okazów O. cumingii[41]. W 1846 Szwajcar Johann Tshudi napotkał koszatniczki koło peruwiańskiej wsi San Juan de Matucanas i nadał im nazwę Octodon cummingii (var.) peruana[5]. W 1843 Thomas Bridges opisał tryb życia koszatniczki pospolitej[42][2]. Kolejnym, solidnym opisem gatunku była wydana w 1846 roku słynna praca George’a Waterhouse’a Historia naturalna ssaków. Waterhouse uważał, że najprawdopodobniej opisany przez Wagnera O. pallidus winien być także uznany za tożsamy z O. degus[6] i zastrzegł jako poprawny epitet gatunkowy degus. W 1867 austriacki zoolog Leopold Fitzinger opisując koszatniczkę pospolitą użył nazwy Octodon alba. W 1940 Guillermo Mann Fischer opisał budowę anatomiczną koszatniczek pospolitych, zaś w roku 1943 opublikował dodatkowe odniesienia do mózgu[14]. Badanie wielu skupisk koszatniczek na przestrzeni lat powodowało sporo dywagacji na temat prawdopodobnych geograficznych odmian w obrębie gatunku i w konsekwencji powstawanie wielu równoległych i dodatkowych nazw. Ale − jak zauważał Wilfred Osgood[5] − w wielu przypadkach zamieszanie wprowadzała głównie zmienność ubarwienia koszatniczek w poszczególnych porach roku czy też różnice zewnętrzne w poszczególnych grupach wiekowych. Przykładowo proponowana w 1927 przez Oldfielda Thomasa nazwa Octodon degus cliviorum wynikała z przekonania Oldfielda o podziale gatunku na koszatniczki górskie i nizinne[5][14]. Hipoteza ta nie uzyskała potwierdzenia.
Systematyka

Nazwa gatunkowa degus została pierwszy raz użyta przez Juana Molina w „Historii natury w Chile”[35], a została utworzona ze słowa dewü, które w języku mapudungun oznacza szczura[43]. Molina błędnie sklasyfikował koszatniczkę jako gatunek wiewiórek (Sciurus) i użył dla niej nazwy Sciurus degus. Przyporządkowując i nazywając tak koszatniczkę, Molina kierował się oceną podobnego sposobu życia tych gryzoni. Przez lata próbowano klasyfikować O. degus razem z zajęczakami (Lagomorpha). Obecna klasyfikacja zalicza koszatniczkę pospolitą do jeżozwierzokształtnych (Hystricognathi)[4]. Nazwa rodzajowa Octodon (ośmio-, czy raczej ósemkowozębny), jak i pierwszy człon nazwy właściwej dla wszystkich koszatniczkowatych (Octodontidae), wynika z ukształtowania trzonowców (gr. ὀκτώ; ὀδούς, oktṓ = osiem; gr. ὀδούς, odoús = zęby[44])[33], a nie ilości zębów. Do rodzaju Octodon koszatniczkę zaliczył w 1848 roku brytyjski zoolog George Robert Waterhouse[6].
Do tego samego rodzaju zaliczane są także trzy kolejne gatunki. Koszatniczka nadbrzeżna (O. lunatus) i koszatniczka leśna (O. Bridgesi)[2][4] różnią się od O. degus nieznacznie – mają nieco większe wymiary, kitki na ogonach są mniej puszyste, a tylne trzonowce mają inaczej ukształtowane fałdy powierzchni bocznych[2]. Natomiast zamieszkującą chilijskie wyspy koszatniczkę pacyficzną, opisaną przez Rainera Hutterera w 1994[45], odróżnia także liczba chromosomów (2n=78, NF=128)[46].
Nazewnictwo
Żyjące w naturze koszatniczki pospolite lokalni mieszkańcy nazywają „szczurami ze szczotką na ogonie” (rata cola de cepillo). Jest to jedynie nazwa zwyczajowa, bowiem w rzeczywistości gryzonie te nie są spokrewnione ze szczurami. Używane w Chile inne nazwy to: chozchoris, rata de las cercas, ratón de tapias, ratón de trompeta, ratón de cola en trompeta, bori[2][14].
W Polsce, do określenia najliczniejszego gatunku z rodzaju Octodon – O. degus, używana była nazwa „koszatniczka”[9][10]. W wydanej w 2015 roku przez Muzeum i Instytut Zoologii Polskiej Akademii Nauk publikacji „Polskie nazewnictwo ssaków świata” nazwę „koszatniczka” zarezerwowano dla rodzaju tych gryzoni, zaś gatunkowi nadano nazwę koszatniczka pospolita[8]. Zwierzęta gatunku trafiały do Europy i Stanów Zjednoczonych jako zwierzęta laboratoryjne[33], zaś później hodowlane. Niestety nie ma pewności, czy okazy obecnie spotykane w hodowlach są czystymi gatunkowo przedstawicielami O. degus, czy też krzyżówkami z pozostałymi gatunkami rodzaju Octodon[27]. Polski biolog Erazm Majewski podał w wydanym w 1894 „Słowniku nazwisk zoologicznych i botanicznych polskich” określenie „koszatniczek” na oznaczenie rodzaju Octodon[47]. Koszatniczka, ze względu na podobną polską nazwę, może być czasem mylona z należącą do popielicowatych koszatką. Morfologicznie jest do niej nieco podobna[10].
Kopalne ślady występowania gatunku
Liczne, odkryte w centralnej części Chile skamieniałe ślady gatunku datowane są na wczesny holocen[48].
Kariotyp
Garnitur chromosomowy koszatniczki pospolitej tworzy 29 par (2n=58) chromosomów; FN=112[4] lub 116[2][46][49].

Budowa ciała
Koszatniczka pospolita jest zaliczana do gryzoni o małej[50][51] lub średniej wielkości[51]. Jest zwierzęciem o smukłej budowie ciała[11], zaokrąglonym pysku[6] i dużych oczach[52]. Bywa określana jako gryzoń podobny do jeżozwierza (ang. „porcupine-like”)[53][54]. Jej uszy są ciemno pigmentowane, nieowłosione[6] lub z małym futerkiem, mają średnią długość[2][24], a stosunkowo długi[52], ciemniejący ku końcowi ogon pokryty jest sztywną szczeciną i na zakończeniu ma charakterystyczny dla tego gatunku „pędzel”[2][24]. W sytuacji zagrożenia koszatniczki mogą odrzucić końcówkę ogona[55][30][56], przy stosunkowo małym krwawieniu[10]. Odrzucony ogon nie odrasta, jak to jest np. u jaszczurek[57][55]. Z tego samego powodu koszatniczki nie wolno chwytać za ogon[58][53]. Podczas biegu koszatniczki utrzymują ogony zadarte do góry[6].


Gryzoń ma miękką sierść[6] o barwie aguti. Ubarwienie sierści jest jednolite, brązowe przechodzące w szarości[24] (lub czarnobrązowojasnożółte[6]), na części brzusznej futro jest kremowobrązowe[24] (lub brudnożółte[6]), z jaśniejszymi obwódkami dookoła oczu[2][24]. Umaszczenie brzuszka zależy od pory roku. Zazwyczaj zimą jest jaśniejsze niż latem[2][24]. Grzbietowe części ciała, które są mocniej wybarwione niż brzuszne, mają istotny współczynnik odbicia promieniowania UV[20]. W hodowli przez krzyżowanie i ingerencje genetyczne uzyskano również koszatniczki o innych barwach sierści: białej, kremowej, czarnej czy nawet niebieskiej[2][24]. Zlokalizowane koło nosa, bardzo wrażliwe na bodźce dotykowe wibryssy są dla koszatniczki ważnym narządem dotyku i pozwalają poruszać się w nocy i w norach[59]. Łapy mają po pięć palców – cztery mocno rozwinięte, piąty słabiej. Palce zakończone są czarnymi pazurami[2].
| wymiar | |
|---|---|
| długość ciała z głową i ogonem | 250–310 mm |
| długość ogona | 65–130 mm |
| długość tylnej kończyny | 35–38 mm |
| długość ucha | 24–32 mm |
| masa ciała | 170–210 g[60][61] lub 200–300 g[12] 200–250 g[50] Podawany jest także przedział 170–300 g[58] |
Mimo znacznej zmienności w dostępie do pożywienia w poszczególnych porach roku masa ciała nie podlega istotnym wahaniom[62]. W ukształtowaniu czaszki (norma lateralis) widoczne są wydatne puszki słuchowe (bullae tympanicae), które świadczą pośrednio o tym, że zmysł słuchu koszatniczki odgrywa zasadniczą rolę w zdolności zachowania orientacji przestrzennej tego zwierzęcia[32].
W stanie spoczynku koszatniczki pospolite często przykucają na tylnych łapach, jak określał Waterhouse, „siadają na biodrach”[6].

| Wzór zębowy | I | C | P | M | |
|---|---|---|---|---|---|
| 20 | = | 1 | 0 | 1 | 3 |
| 1 | 0 | 1 | 3 | ||
Zęby
Koszatniczka pospolita ma uzębienie o charakterze elodontycznym, czyli rosnące przez całe życie zwierzęcia[63][64][54]. Jest ono przystosowane do diety o dużej zawartości włókna. Ten typ uzębienia wymaga ciągłego ścierania[64]. W środowisku naturalnym dieta koszatniczki składa się głównie z suchych roślin o wysokiej zawartości krzemianów oraz z kory, dzięki czemu zwierzęta są zmuszone do intensywnego gryzienia. Zęby trzonowe mają budowę hypsodontyczną (wysokokoronową), co oznacza zęby o krótkich korzeniach i masywnej koronie oraz wieloblaszkowe zęby policzkowe. Na powierzchni policzkowej i językowej zębów trzonowych leżą fałdy i wgłębienia, z których powodu powierzchnia żująca trzonowców uzyskuje charakterystyczny kształt ósemki. Łacińska nazwa rodziny (Octodontidae) nawiązuje do tej charakterystycznej cechy uzębienia rzeczonej grupy[63].



Powierzchnia rostralna siekaczy zdrowo odżywianych, dorosłych koszatniczek ma barwę pomarańczową[2][24][63]. Zawdzięcza ją komórkom szkliwotwórczym pochodzenia nabłonkowego, które wytwarzają tę powierzchnię w sposób ciągły. Wybarwiona na pomarańczowo warstwa sprawia, że siekacze są wzmocnione i mają większą odporność na ścieranie. Zęby młodych koszatniczek osiągają pomarańczową barwę dopiero po osiągnięciu wieku około 6 miesięcy życia. Większa odporność siekaczy sprawia, że koszatniczka może używać tych zębów do drążenia tuneli nory[63]. Białe siekacze u dorosłych koszatniczek mogą być oznaką problemów zdrowotnych. Wady zgryzu mogą być następstwem chowu wsobnego[58].
Uzębienie składa się z 2 par siekaczy, 2 par przedtrzonowców i 6 par trzonowców (o ósemkowym przekroju)[2].
Samce są zazwyczaj nieco większe niż samice[56][58]. Na wolności samice osiągają dojrzałość płciową nie wcześniej niż po 5 do 14 miesiącach od urodzenia, ale aktywność jajników obserwuje się w wieku 2 tygodni życia, mimo że otwór pochwy jest jeszcze niewidoczny. W warunkach hodowlanych dolną granicą osiągania dojrzałości płciowej jest wiek 5 tygodni (45 dni[53]). Samice mają 4 pary sutków[2], przy czym jedna para leży w położeniu pachwinowym, a pozostałe 3 pary – brzusznie[65].
Jądra wraz z najądrzami samca koszatniczki pospolitej są zamknięte wewnątrz jamy brzusznej[58][66][53]. Nasieniowody i pęcherzyki nasienne wiodą do cewki moczowej. Temperatura jąder jest podobna do temperatury ciała u tych zwierząt[66].
Rozpoznawanie płci koszatniczek stanowi częsty problem dla niedoświadczonych hodowców. Wygląd zewnętrznych cech płciowych jest bardzo podobny u przedstawicieli obu płci. Rozróżnienie jest możliwe głównie poprzez porównanie odległości między cewką moczową a odbytem (u samców wyraźnie większa[12] – rzędu 6–10 mm[58]) oraz dzięki posiadaniu przez samce fałdu skórnego między tymi narządami[24]. Wraz z dojrzewaniem cewka moczowa samicy uzyskuje kształt stożka, w którym widoczne są małe szczeliny sromu, zaś u samca cewka moczowa przybiera kształt penisa[58].

Czynności życiowe
Jak podaje Wild Animals Online[56], na wolności koszatniczki pospolite żyją dość krótko. Tylko 50% z nich dożywa wieku 1 roku, a zaledwie 1% populacji żyje 2 lata. W objętej badaniami populacji 5400 osobników tylko 1 przeżył 4 lata. Anna Sporon określa jednak możliwy do osiągnięcia na wolności wiek jako znacznie dłuższy[67]. Inni autorzy określają, że koszatniczki pospolite w stanie wolnym żyją od kilku miesięcy do 2[58] lub 4 lat[24]. Adrian Palacios zaznacza, że głównym powodem, dla którego niewiele koszatniczek osiąga wiek 2 lat, jest presja ze strony drapieżników. W niewoli zwierzęta mogą osiągać 5–7 lat[68], 5–8 lat[24][53], 5–9[58][64] lub 7–9 lat[69]. Rekordowy wiek 13 lat osiągnęła koszatniczka pospolita hodowana w ogrodzie zoologicznym w Houston w Teksasie w latach 1972–1985[70].
Poszczególni autorzy podawali różne normy temperatury ciała: 36,0–37,2 °C[66], 37,0 °C[61], 37,9 °C[2][53] lub 38 °C[58]. Najczęściej wskazywany był przedział 36,0–37,9 °C[71][66][61][2]. Roberto Refinetti wyjaśnił, że u koszatniczek pospolitych odnotowywana jest wewnątrzgatunkowa zmienność faz aktywności behawioralnej oraz temperatury ciała i na podstawie przeprowadzonych badań określił przedział temperatury ciała tych zwierząt: 36,7–38,3 °C[72]. Vladimir Jekl wskazał przedział temperatury ciała mierzonej w odbycie zwierzęcia 38,1–39,5 °C, ze średnią na poziomie 37 °C[54]. Regularne epizody aktywności dobowej odnotowywano o świcie i o zmierzchu[73][16]. Martien Kas i Dale Edgar po przebadaniu 13 koszatniczek pospolitych wykazali ścisły związek dobowej zmienności temperatury ciała tych zwierząt z ich aktywnością ruchową (zob. wykres)[71]. Podczas owulacji temperatura ciała samicy wzrasta nawet o ok. 4 °C[73].
Częstotliwość pulsu koszatniczki pospolitej bywa określana na 274 uderzeń na minutę[74] lub 100–150 na minutę[58]. Również publikowane informacje na temat liczby oddechów na minutę różnią się od siebie dość znacznie: 75/min[58], 123/min[74] lub 196–264/min[75].
Średni dzienny wydatek energetyczny koszatniczek pospolitych żyjących na wolności (samce i samice) został przez naukowców określony dla poszczególnych pór roku. W sezonie lęgowym wynosi 150,4 kJ na dzień, wiosną 155,9 kJ, a jesienią 150,98 kJ. Latem wydatek jest znacznie niższy niż w innych porach roku i wynosi około 125 kJ na dzień[62].
Przystosowania morfologiczne i fizjologiczne
Wzrok
Koszatniczka pospolita ma dobrze rozwinięty wzrok, bardzo czuły w porach dziennych. Cecha ta wyraźnie odróżnia koszatniczkę od przedstawicieli siostrzanego gatunku koszatniczka nadbrzeżna (O. lunatus), których wzrok wykazuje mniejszą wrażliwość w porach dziennych, ale dzięki szerokiemu polu widzenia obuocznego, nocą charakteryzuje się większym kontrastem wzrokowym i wrażliwością światłoczułą. Koszatniczka utrzymuje duża czułość i widzenie kolorów w wąskim zakresie kątowym (ok. 50°). Widzenie dzienne zapewnia największą czułość w miejscu, na które jest skierowany wzrok[76][77].
Koszatniczkę pospolitą wyróżnia zdolność do widzenia dwubarwnego[78]. Narząd wzroku tego gryzonia jest wyposażony w jeden typ pręcika (receptor siatkówki odpowiadający za postrzeganie kształtów i ruchu) i dwa rodzaje czopków (receptory umożliwiające widzenie barwne). W rezultacie koszatniczka pospolita widzi wyłącznie barwę zieloną (szczyt widma około 500 nm) światła oraz długości fal charakterystyczne dla ultrafioletu (362 nm)[20][77]. Umiejętność widzenia promieni UV jest stosunkowo rzadko spotykana u ssaków[20]. Siatkówka w oku koszatniczki pospolitej składa się z około 9 mln fotoreceptorów, z czego jedna trzecia receptorów to pręciki, a dwie trzecie to czopki. Proporcja pręcików odpowiedzialnych za widzenie w barwie zielonej do receptorów umożliwiających widzenie UV to 13:1[77]. Stosunek i rozmieszczenie pręcików i czopków siatkówki może różnić się w zależności od siedliska i stylu życia[78].
Przyczyny, dla których narząd wzroku koszatniczek pospolitych ukształtował się w taki sposób, nie są znane. Cecha ta z pewnością pomaga zwierzętom w realizacji doboru płciowego, żerowania, orientacji w terenie czy wykrywania śladów moczu na zajmowanym terytorium (świeży mocz koszatniczek ma silną zdolność do odbicia UV)[78].
Układ oddechowy
Koszatniczki pospolite nie są zwierzętami podziemnymi, ale żyjącymi w norach i znaczną część życia spędzają pod powierzchnią ziemi. Dla wielu gatunków ssaków taki tryb życia skutkuje przewlekłym niedotlenieniem i hiperkapnią. Organizm koszatniczek pospolitych przystosował się do tego trybu życia i w porównaniu z reakcją organizmu pokrewnych gryzoni kururo wykazują mniejszą od nich reakcję na niedotlenienie[19].
Gospodarka wodno-mineralna
Organizm koszatniczki pospolitej przystosował się do półpustynnych warunków panujących w jej zasięgu występowania i wykorzystuje wodę w sposób bardzo efektywny[18]. Stopień resorpcji wody w okrężnicy zwierzęcia jest bardzo wysoki[79] (około dwukrotnie wyższy niż u szczura laboratoryjnego), więc koszatniczka może pozyskać z pożywienia większą jej ilość[18]. Koszatniczki pospolite żyjące na wolności pozyskują wodę niemal wyłącznie ze zjadanego pokarmu stałego[75]. Równocześnie koszatniczka nie traci wody poprzez odparowywanie, bowiem nie ma gruczołów potowych i się nie poci[79][80]. Dzięki wysokiej sprawności akwaporyn w błonie śluzowej jamy nosowej przewody nosowe koszatniczki są przystosowane do kondensacji wody, co z kolei zapobiega utracie wody z wydychanym powietrzem[79]. Ograniczenie wydalania wody z moczem jest możliwe dzięki wzmacniaczowi przeciwprądowemu. Mechanizm ten opiera się na przepływie moczu przez kanaliki nerkowe tworzące pętlę Henlego w nerkach koszatniczki[81]. Dzięki temu wydalany mocz jest znacznie zagęszczony[79], z wysokimi stężeniami potasu i magnezu[2]. Organizm zdrowej koszatniczki pospolitej może obejść się bez wody nawet przez okres 13 dni[18]. Podczas przeprowadzanych badań (B.Fonda, 1975) pozbawiono koszatniczki dostępu do wody i po siedmiu dniach mocz uległ zagęszczeniu z 634 mOsmol/l do 4604 mOsmol/l. Stwierdzono także, że koszatniczki mają niezwykłą zdolność do większego zageszczania w moczu potasu niż sodu oraz zatrzymywania znacznej ilości magnezu[2].
Parametry morfologiczne i biochemiczne krwi
| Parametr | j.m. | Zwierzęta młode | Zwierzęta dorosłe | Wpływ wieku | ||||
| średnia | mediana | przedział | średnia | mediana | przedział | |||
| Czerwone krwinki | x1012/l | 7,3 | 7,6 | 4,72–9,01 | 8,7 | 8,98 | 5,34–9,93 | ↑ |
| Retikulocyty | x109/l | 7,4 | 0,0 | 0,0–80,24 | 0,2 | 0,0 | 0,0–7,41 | ↓ |
| % | 0,1 | 0,0 | 0,0–0,17 | 0,0 | 0,0 | 0,0–0,1 | ||
| Hemoglobina | g/l | 113,7 | 116,0 | 89,0–134 | 117,6 | 119,0 | 99–131,0 | |
| Hematokryt | l/l | 0,4 | 0,4 | 0,32–0,51 | 0,5 | 0,46 | 0,37–0,50 | ↑ |
| MCV | fl | 59,9 | 58,6 | 52,3–75,3 | 51,4 | 51,0 | 47,2–64,5 | ↓ |
| MCH | pg | 15,8 | 15,7 | 13,6–19,5 | 13,4 | 13,3 | 12,3–15,4 | ↓ |
| MCHC | g/l | 264,5 | 264,0 | 240–291 | 261,0 | 263,0 | 226–289 | |
| Płytki krwi | x109/l | 453,4 | 455,0 | 57–896,0 | 383,0 | 362,0 | 223–530 | ↓ |
| Białe krwinki | x109/l | 7,2 | 7,0 | 2,0–12,3 | 7,4 | 7,1 | 3,5–14,6 | |
| Neutrofile | x109/l | 0,1 | 0,03 | 0,0–1,0 | 0,0 | 0,0 | 0,0–0,31 | |
| % | 1,0 | 0,05 | 0,0–6,0 | 0,4 | 0,0 | 0,0–3,0 | ||
| Neutrofile – formy segmentowane | x109/l | 2,2 | 2,05 | 0,38–4,8 | 3,1 | 2,89 | 0,7–7,01 | ↑ |
| % | 32,0 | 30,0 | 11,0–63,0 | 40,6 | 40,5 | 19,0–72,0 | ||
| Limfocyty | x109/l | 4,6 | 4,42 | 0,96–10,2 | 4,0 | 3,9 | 12,7–7,26 | ↓ |
| % | 63,2 | 66,0 | 33,0–85,0 | 54,9 | 54,9 | 27,0–77,0 | ||
| Monocyty | ×109/l | 0,1 | 0,09 | 0,0–0,41 | 0,1 | 0,07 | 0,0–0,89 | |
| % | 1,9 | 1,0 | 0,0–5,0 | 1,3 | 1,0 | 0,0–6,0 | ||
| Eozynofile | x109/l | 0,1 | 0,09 | 0,0–0,47 | 0,2 | 0,15 | 0,0–1,45 | |
| % | 1,8 | 1,0 | 0,0–8,0 | 2,6 | 2,0 | 0,0–12,0 | ||
| Bazofile | x109/l | 0,0 | 0,0 | 0,0–0,12 | 0,0 | 0,0 | 0,0–0,19 | |
| % | 0,1 | 0,0 | 0,0–2,0 | 0,2 | 0,0 | 0,0–2,0 | ||
| Parametr | j.m. | Zwierzęta młode | Zwierzęta dorosłe | Wpływ wieku | ||||
| średnia | mediana | przedział | średnia | mediana | przedział | |||
| GAP | g/l | 54,7 | 53,8 | 46,5–73,7 | 63,1 | 63,9 | 45,8–77,7 | ↑ |
| Albuminy | g/l | 34,0 | 34,4 | 28,6–40,6 | 33,1 | 33,3 | 19,0–45,1 | |
| Globuliny | g/l | 21,7 | 20,2 | 12,7–52,7 | 30,0 | 31,9 | 16,5–47,8 | ↑ |
| Albuminy:Globuliny | 1,7 | 1,7 | 0,66–2,5 | 1,2 | 1,1 | 0,4–2,58 | ↓ | |
| Glukoza | mmol/l | 9,4 | 9,4 | 5,6–14,1 | 8,9 | 8,9 | 5,5–13,1 | |
| Mocznik | mmol/l | 15,1 | 15,9 | 10,8–22,0 | 10,1 | 10,0 | 6,6–14,9 | ↓ |
| Kreatynina | μmol/l | 56,5 | 57,8 | 34,4–87,2 | 51,4 | 51,0 | 29,9–77,3 | |
| Trójglicerydy | mmol/l | 1,8 | 1,5 | 0,01–4,47 | 1,9 | 1,59 | 0,44–4,85 | |
| Cholesterol | mmol/l | 2,5 | 2,3 | 1,8–4,9 | 2,0 | 2,1 | 1,2–2,7 | ↓ |
| Alat | iu/l | 33,5 | 29,3 | 12,57–107,19 | 18,0 | 18,0 | 9,58–47,9 | ↓ |
| Aspat | iu/l | 61,1 | 53,3 | 10,18–192,81 | 47,9 | 36,5 | 19,16–137,72 | ↓ |
| Amylazy | iu/l | 892,8 | 805,4 | 409,58–1947,9 | 820,4 | 755,7 | 481,44–1263,47 | |
| Lipazy | iu/l | 43,7 | 37,1 | 16,77–111,98 | 29,9 | 26,4 | 2,99–39,52 | ↓ |
| GGTP | iu/l | 9,08 | 1,8 | 1,8–10,18 | 6,0 | 1,8 | 1,8–7,78 | |
| CK | iu/l | 1159,3 | 1094,6 | 215,57–16012,0 | 958,1 | 692,2 | 120,96–4245,51 | |
| LDH | iu/l | 1159,3 | 1094,6 | 35,33–1934,13 | 562,9 | 544,9 | 313,17–894,01 | |
| Sód | mmol/l | 142,3 | 141,9 | 131,6–156,5 | 142,1 | 142,7 | 123,0–151,2 | |
| Potas | mmol/l | 4,4 | 4,3 | 2,9–8,1 | 3,8 | 3,9 | 3,1–4,7 | ↓ |
| Chlorki | mmol/l | 104,9 | 104,8 | 91,2–116,4 | 103,4 | 103,2 | 91,8–113,8 | |
| Wapń | mmol/l | 3,2 | 3,1 | 2,69–3,73 | 2,5 | 2,6 | 2,01–2,96 | ↓ |
| Fosforany | mmol/l | 2,2 | 2,2 | 1,09–3,73 | 1,5 | 1,5 | 0,63–2,10 | ↓ |
| Bilirubina | μmol/l | 2,4 | 2,4 | 0,90–5,4 | 2,8 | 0,9 | 0,9–5,4 | |
| Kwasy żółciowe | μmol/l | – | – | – | 13,5 | 8,2 | 1,1–45,9 | |
Tryb życia
Prowadzą dzienny tryb życia[13], w stosunkowo niewielkich grupach społecznych składających się 2–5 samic i 1–2 samców[16][17]. Liczebność grupy sezonowo wzrasta, wraz z pojawieniem się nowego miotu 5–10 młodych koszatniczek[68]. W ramach tej społeczności zwierzęta wspólnie użytkują nory oraz tereny żerowania[16][17], a wraz z sąsiadującymi grupami tworzą kolonie liczące do 100 osobników[58].
Koszatniczki pospolite prowadzą poligamiczny tryb życia. Charakterystyczną cechą gatunku są interakcje agonistyczne między członkami stada, które pozwalają na ustalanie hierarchii dominacji[83]. Koszatniczki z badanej przez naukowców populacji przeznaczały 3,2% swojego czasu dziennej aktywności na interakcje z przedstawicielami swojego gatunku. Zachowania przyjazne lub neutralne zajmowały około 2% czasu, a groźby, walki i potyczki około 1,2%. Najwięcej czasu na kontakty z innymi koszatniczkami swojego gatunku, bo aż 9%, poświęcały samce, które brały udział w rozrodzie. Ich aktywność w tym okresie była wyjątkowo duża – na kąpiele w piasku (dzięki którym pozostawiają swój zapach, ostrzegając potencjalnych intruzów[84]) przeznaczyły blisko 6% czasu, a na zachowania antagonistyczne około 7% czasu[85].
Samce znacznie chętniej (i częściej) tarzają się w piasku, który jeszcze nie jest oznaczony zapachem innego zwierzęcia tej samej płci. W badanej populacji w ciągu 10 minut samce kąpały się w piachu nawet 40–krotnie. Jeśli jednak piasek nosił już zapach innego samca, to w tym samym czasie tarzały się w pyle tylko 10–krotnie[84].
| Samice | Samce | Średnia całej grupy | ||||
| Aktywność | uczestniczące w rozrodzie n= 22 [%] |
nie uczestniczące n = 23 [%] |
uczestniczące w rozrodzie n = 10 [%] |
nie uczestniczące n = 23 [%] |
n = 78 [%] | |
| Żerowanie | 51,5 | 48,4 | 34,9 | 42,7 | 45,8 | |
| Czuwanie (na 4 łapach) | 26,2 | 25,9 | 21,8 | 26,6 | 25,7 | |
| Czuwanie (w pozycji wypionowanej) | 2,5 | 6,8 | 4,6 | 9,4 | 6,1 | |
| Razem czujność | 28,7 | 32,6 | 26,4 | 36,0 | 31,7 | |
| Odpoczynek | 10,1 | 6,9 | 17,0 | 16,9 | 7,5 | |
| Przemieszczanie się | 5,7 | 10,6 | 3,0 | 6,8 | 7,1 | |
| Zaloty | 4,3 | 2,8 | 2,2 | 2,7 | 3,1 | |
| Kąpiele w piasku | 0,8 | 0,5 | 5,5 | 0,6 | 1,2 | |
| Prace przy budowie nory | 0,3 | 0,2 | 0,4 | 0,1 | 0,2 | |
| Interakcje społeczne | 1,7 | 3,7 | 9,0 | 1,8 | 3,2 | |
Koszatniczki pospolite żyją w zhierarchizowanej społeczności, która opiera się na systemie dominacji. Poszczególne elementy zachowań odgrywają istotną rolę w potwierdzaniu lub zaprzeczaniu dominacji. Może być ona wyrażana przez wąchanie czy wskakiwanie na grzbiet współplemieńca, przez co wyrażana jest przewaga nad nim[86]. Zdaniem chilijskiego zoologa Mauricio Soto-Gamboa system socjalny koszatniczek pospolitych jest charakterystyczny i szczególnie ujawnia się w okresach rozrodczych, kiedy podniesiony poziom testosteronu samców przyczynia się do rywalizacji i potrzeby prezentowania dominacji[87].
System komunikacji koszatniczek pospolitych jest rozbudowany[16][88]. Zwierzęta komunikują się poprzez dotykanie się nosem w nos, zaloty i zachowania seksualne – w tym wskakiwanie sobie nawzajem na grzbiety (także między osobnikami tej samej płci) a także wspinanie się i „ujeżdżanie” drugiego osobnika bez czynności seksualnych. Koszatniczki mogą popychać się przednimi łapami, kopać tylnymi kończynami i okazywać wzburzenie uderzając ogonem o ziemię. Podczas uderzania o ziemię ogon wykonuje ruch góra-dół, co jest rozpoznawane jako wstęp do walki. Istotne, charakterystyczne zachowanie stanowi tarzanie się (suche kąpiele) w piasku, które jest praktykowane w grupach spokrewnionych (dość częste, bo nawet około 2 razy w ciągu minuty), podczas kontaktu z obcymi, ale także podczas zabaw z przedstawicielami synantropijnego gatunku szynszyloszczur stokowy[16]. Koszatniczki komunikują się także za pomocą znaków zapachowych moczu, dzięki którym zwierzęta mogą identyfikować poszczególne osobniki[89].
Bliskość w obrębie społeczności zauważalna jest także podczas wspólnych drzemek, kiedy zwierzęta wtulają się w siebie nawzajem[90]. Tulą się one do siebie także w chłodnych porach roku, co pozwala na zachowanie temperatury ciała i oszczędzanie energii[91].
Większość dobowej aktywności koszatniczek pospolitych, szczególnie żerowanie, odbywa się nad ziemią[52]. Zwierzęta spędzają 5–6 godzin dziennie na żerowaniu na powierzchni terenu, ze szczytami aktywności o świcie i zmierzchu[61]. W okresie letnim wykazują dwumodalny okres aktywności naziemnej z przerwą w południe, kiedy temperatura jest najwyższa[60]. Zimą szukają pożywienia tylko w słońcu, co pozwala na zmniejszenie wydatków energetycznych[62]. W porze nocnej wszyscy członkowie stada wspólnie pozostają w podziemnych norach[92]. Zmiany pokrycia roślinnego siedliska powodują dopasowanie zachowań defensywnych i czujności koszatniczek[51].

Suche kąpiele w piasku są typowym zachowaniem komfortowym. Koszatniczki pospolite tarzają się w szybszym tempie, rozgrzebują piasek i ocierają się o piaszczyste podłoże na przemian jednym i drugim bokiem. Czynność ta pozwala na oczyszczenie futra z zabrudzeń, które przeszkadzają w termoregulacji, pozbycie się pasożytów, ale także wzmacnianie więzi plemiennej poprzez tarzanie się w piasku, który już wcześniej służył innym członkom klanu i zawiera ich zapach oraz zapach moczu. Kąpiele w piasku są umiejętnością wrodzoną[17][93].
Częstotliwość kontaktów między rodzicami a potomstwem jest zmienna. Zainteresowanie samców kontaktami z dziećmi wzrasta z wiekiem potomstwa, podczas gdy matki od pierwszych tygodni po urodzeniu zmniejszają interakcje z młodymi. Jeśli młode wychowuje samotna samica, to nie rekompensuje młodym opieki ojca zwiększeniem swojej uwagi[94][95].
Stabilność lokalnych populacji
W obrębie poszczególnych populacji koszatniczek pospolitych odnotowywana jest duża okresowa zmienność liczebności. 85–90% dorosłych samic i samców nie dożywa do drugiego roku życia[78].
W latach 2005–2007 zespół naukowców badał stabilność populacji koszatniczek pospolitych w „Estación Experimental Rinconada de Maipú”, czyli stacji badawczej Wydziału Nauk Rolniczych Universidad de Chile. Okazało się, że na przestrzeni 2 lat z badanej grupy zniknęło 88% samic i prawie wszystkie dorosłe samce (99%). W młodszej, szczenięcej grupie wiekowej również nie było stabilności. Zniknęła większość samic (81%) i prawie wszystkie młode samce (98%). Zauważalna jest więc wyraźnie większa stabilność i wierność samic w stosunku do swojej grupy społecznej. Wpływ na tak dużą rotację w składzie populacji mają migracje (zarówno emigracje, jak i imigracje), początkowa wielkość grupy, obfitość żywności i zagęszczenie otwartych nor na danym terenie, a także aktywność lokalnych drapieżników. Niestabilność populacji uznano za cechę charakterystyczną koszatniczki pospolitej[96].
Kolejne badania przeprowadzone w okresie 2007–2008 w tej samej stacji badawczej uniwersytetu w Santiago wykazało, że z lokalnych grup społecznych zniknęło 75% potomstwa, a w przypadkach emigracji rodzeństwo najczęściej migrowało wspólnie. Równocześnie naukowcy odnotowali, że okres między wiosną a jesienią przetrwał niewielki odsetek młodych. Podkreślili równocześnie, że znacznie więcej zwierząt znikało, niż przybywało imigrantów, co w ich opinii potwierdza hipotezę, że większość zaginięć jest raczej związana ze znaczną aktywnością drapieżnictwa niż ze skutkami migracji[92]. Naukowcy zauważyli także istotną rolę więzi między młodymi wychowującymi się z tej samej norze jako czynnika spajającego społeczność koszatniczek. Jednak ze względu na znaczną umieralność pierwszorocznych zwierząt dokładne przebadanie mechanizmu było niemożliwe[92].



Cykl życiowy
Koszatniczki pospolite prowadzą poligamiczny tryb życia[83]. W stanie dzikim koszatniczki zwykle rozmnażają się raz na rok[56][62][98], choć epizodycznie (w latach, w których występuje znaczna ilość opadów) możliwy jest drugi miot jesienią[99]. Latem i jesienią (w Chile od stycznia do czerwca) trwa okres bierności seksualnej koszatniczek pospolitych. Okres rozrodczy rozpoczyna się zwykle pod koniec czerwca (jesienią)[17][62]. Krycie następuje od końca czerwca do lipca (początek zimy)[13] (lub w maju[98]), a młode rodzą się na wiosnę – od września do października[13] lub w sierpniu[98]. W latach mokrych koszatniczka pospolita może mieć drugi miot[57] w grudniu. Porody w październiku i listopadzie zdarzają się sporadycznie[13]. Etapy cyklu życiowego są ściśle związane z fazami cyklu fenologicznego roślin wchodzących w skład diety tych zwierząt. Do rozrodu O. degus przystępują, gdy rozwija się roślinność zielna i pojawiają się nowe liście na krzewach. Nowo narodzone koszatniczki wychodzą z nory na powierzchnię, gdy dojrzewają owoce, a liście krzewów i drzew są już w pełni rozwinięte. Wraz z rozwojem młodych i wzrostem liczebności stada i kolonii lokalna roślinność wydaje coraz więcej owoców (aż do maksimum owocowania)[98].
Okres godowy rozpoczyna się, gdy światło dzienne jest dostępne minimum od 7 rano do 19 (gdy następuje zrównanie dnia z nocą)[17]. Wraz z rozpoczęciem okresu rozrodczego samce podejmują wybór strategii. Samce należące do danego stada podejmują obronę swoich samic przed zalotami obcych samców, by zapewnić sobie ich zapłodnienie. Z kolei samce żyjące w grupach krążących w okolicy starają się włączyć do poszczególnych stad[87]. Znakowanie otoczenia moczem, wykorzystywane zazwyczaj przez obie płcie do obrony terytorium, wzmaga się u samców w okresie rozrodczym. Zalotnicy wykonują zazwyczaj rytuał obejmujący machanie ogonem i drżenie ciała, a na koniec, podnosząc tylne łapy, opryskują samice swoim moczem. Takie „oznakowanie” może służyć przyzwyczajeniu samicy do zapachu danego samca, co w przyszłości ma mu ułatwić kontynuację zalotów[88].
Samice O. degus nie wykazują regularnych cykli płciowych[12][22][100]. Poszczególni autorzy odnotowywali różne okresy otwarcia pochwy: od 3–5 aż po 3–21 dni[12][100][73]. Naukowcy przypuszczają, że owulacja jest indukowana obecnością samca[12][22][100][21]. W okresie owulacji temperatura ciała samicy może wzrosnąć o 4 °C[73]. Samica może być płodna już bezpośrednio po odbytym porodzie[12][68]. Na wolności samice urodzone jesienią przystępują do rozrodu latem następnego roku, czyli w wieku 8–9 miesięcy[100]. Młoda samica po osiągnięciu dojrzałości rozrodczej (wiek >5 miesięcy) bez doświadczenia seksualnego wykazuje 1-dniowy cykl zwiększonej aktywności co 18–22 dni[100]. Samice koszatniczki pospolitej mogą rodzić przez 4–4,5 roku, zaś samce pozostają płodne przez całe życie[68]. W niewoli porody mogą występować każdej porze roku[53].
Zdolność do rozrodu samica osiąga w wieku 6–8 tygodni[69][100][68]. Owulacja występuje zwykle między listopadem a styczniem[97]. Zwierzęta kopulują w maju następnego roku (badacze piszą także: późną jesienią, z zapłodnieniem do końca zimy, maksymalnie do początku wiosny[101]), a w sierpniu[98] (lub: „wczesną wiosną”[62][102]), po trwającej około 87–93 dni ciąży, rodzi się najczęściej 1–12 młodych. Koszatniczki pospolite rodzą się okryte gotowym futrem[100][68] lub delikatnym meszkiem, z lekko otwartymi[2] lub zamkniętymi oczami[12]; od razu są ruchliwe[100]. Mała koszatniczka pospolita waży po urodzeniu około 14–20 g[2]. Laktacja kończy się późną wiosną[61]. Okres karmienia małych koszatniczek przez samicę trwa 4–6 tygodni[12]. Tyle też minimalnie powinny być pod jej opieką. Młode wychodzą z nory późną wiosną, gdy jest już świeża trawa[61]. Po tym okresie są już zdolne do samodzielnego życia i łączenia się w jednopłciowe grupy[57]. W hodowli w wieku 7–8 tygodni należy miot rozdzielić według płci, bowiem już w tym wieku młode mogą być gotowe do rozrodu, co wiązałoby się z ryzykiem chowu wsobnego[69][100][68].
Po 3–4 godzinach od narodzin młode zaczynają samodzielnie chodzić. Po 1–2 dniach mała koszatniczka pospolita umie już samodzielne myć pyszczek, pocierając go przednimi kończynami, potrząsać głową, drapać się tylną łapą. Po raz pierwszy stały pokarm może zacząć próbować przyjmować już w pierwszych dniach. Naukowcy odnotowali zjadanie twardych elementów roślinnych już w 6 dniu, ale stwierdzili fakt gryzienia kawałków drewna w pierwszych dniach czy gryzienie przez 3-dniową koszatniczkę suchych odchodów[22]. Pokarm stały młode zaczynają przyjmować regularnie od 2 tygodnia życia, korzystając nadal z mleka matki[100]. Aktywność jajników nowo narodzonych samic zaznacza się już po około 2 tygodniach życia, mimo że otwór pochwy nie jest jeszcze widoczny[32]. W badanej populacji pochwy młodych samic zaczynały się otwierać w wieku 2 miesięcy, a w 3,5 miesiąca po narodzinach pochwy wszystkich badanych samic były już otwarte[100]. W porównaniu do innych przedstawicieli gryzoni koszatniczki pospolite dojrzewają powoli, proces ten przebiega wolniej niż u szczura, myszy lub chomika[103]. Dolna stwierdzona granica płodności samic to 7 tydzień życia[69] (określana także jako 46. dzień życia[94]), zaś u samców 12. tydzień[69]. Samice zazwyczaj osiągają dojrzałość płciową między 12. a 16. tygodniem życia, zaś samce około 16. tygodnia[103].
Dzięki wykształconemu od urodzenia systemowi sensorycznemu małe koszatniczki mogą reagować na znane i nowe bodźce środowiskowe[104]. Same wydają dźwięki już od pierwszych dni życia. Pierwsze sygnały to piski i gwizdy (wydawane podczas karmienia i zabaw z rodzeństwem) oraz dźwięki gaworzenia (wydawane podczas ważenia przez naukowców i odizolowania od matki). Piski składają się z dźwięków o częstotliwości 3,0–4,5 kHz trwających 50–70 ms powtarzanych w interwale rzędu 30–100 ms. Pojedyncze gwizdy (2,5–5,0 kHz) mogą trwać 135–200 ms, a gaworzenie ma formę nieco bardziej złożonej struktury harmonicznej z elementami trwającymi 100–250 ms w zakresie częstotliwości 1–10 kHz[22].
Młode wykazują silne przywiązanie do rodziców. Już od pierwszych dni potrafią rozpoznawać i reagują na głos matki[104][105]. Badania przeprowadzone na koszatniczkach pospolitych wykazały, że komunikacja głosowa między matką i dziećmi jest istotnym składnikiem rozwoju emocjonalnego i fizycznego zwierząt[105][106][107]. Naukowcy odnotowali liczne kontakty dotykowe między rodzicami i młodymi. Było to przytulanie lub nawet krótkotrwałe (1–2 sek) dotykanie nosem (lub wąchanie)[94]. Zabawy i interakcje między rodzeństwem były zaobserwowane już od trzeciego dnia. Malce komunikowały się ze sobą dotykając nosem o nos czy nawet próbowały jeździć na grzbiecie rodzeństwa lub rodzica[22].
W badaniach prowadzonych w warunkach laboratoryjnych[57] stwierdzono, że samica pozostaje w bliskości z małymi do dwóch tygodni po urodzeniu. Zaobserwowano, że samce w tym okresie są skłonne do bójek z dziećmi. Nie prowadziło to jednak do dzieciobójstwa[102]. Na wolności samce spędzają z młodymi cały pierwszy okres ich życia, czyli czas pierwszych tygodni, gdy wymagają karmienia, ogrzewania i szczególnej „niemowlęcej” opieki. Przez pierwsze 7 dni młode organizmy O. degus nie mają zdolności utrzymywania stałej temperatury ciała[2]. Młode koszatniczki pospolite zaczynają jeść stały pokarm w wieku około 2 tygodni, zaś rodzinną norę pierwszy raz opuszczają po trzecim tygodniu życia. Samice w obrębie klanu często wspólnie opiekują się dziećmi[108][57]. Chętnie wspólnie gniazdują i pielęgnują swoje młode[101][109][110][83], a siła więzi między samicami danego klanu osiąga apogeum w okresie laktacji i opieki nad młodymi[111]. Zazwyczaj w obrębie grupy samice są ze sobą spokrewnione. Wspólne gniazdowanie jest naturalnym odruchem zarówno dla samic żyjących na wolności, jak i w hodowlach[110][112]. W okresie laktacji organizm samicy wykazuje wzrost zdolności przyswajania pokarmu, dzięki czemu następuje zwiększenie masy w kilku narządach centralnych, w których magazynowane są nadwyżki, pozwalające na obsłużenie zwiększonych wydatków energetycznych w tym okresie[113]. Koszatniczki pospolite z zasady nie popełniają dzieciobójstwa[91] (w przeciwieństwie do chomików, u których takie zachowania są często obserwowane)[91]. Naukowcy sugerują, że koszatniczki pospolite nie popełniają dzieciobójstwa z powodu inercji filogenetycznej[102]. Także samce nie wykazują oznak agresji czy tendencji do kanibalizmu[68]. Dorosłe koszatniczki nie wykazują agresji także wobec nieznanych młodych[102]. Samice również wykazują nieco nietypowe zachowanie – nie są agresywne w stosunku do badacza czy hodowcy dotykającego jej dzieci[68].
Ciąża stanowi dla organizmu samicy bardzo duży wydatek energetyczny. Poziom glukozy we krwi w tym okresie zostaje rozregulowany, więc dla zwierząt podatnych na cukrzycę każda ciąża stanowi duże ryzyko. W hodowli zalecane jest więc unikanie łączenia w pary mieszane pod względem płci. Łączenie samic czy samców w dwu-trzyosobnikowe jednopłciowe stada jest dobrym, zalecanym rozwiązaniem[114][115][28][29], tym bardziej że w naturze w stadku dominuje samica i na kilkadziesiąt samiczek przypada jeden samczyk. Natomiast młode samce są ze stada wypędzane i, póki same nie utworzą stada, żyją w grupach kawalerów. Samce żyją zazwyczaj w grupach liczących od jednego do dwóch osobników, a samice w stadkach od dwóch do pięciu[57]. W stadach jednopłciowych żyją aż do osiągnięcia dojrzałości[103][57]. Naukowcy badający behawior koszatniczek pospolitych stwierdzili, że zwierzęta, które po odstawieniu przez matkę były trzymane w izolacji, wykazywały wyraźne, poważne zaburzenia nerwowe i behawioralne[103]. Jako zwierzęta stadne nie powinny więc być hodowane pojedynczo[114][115][29].
Proporcje płci u koszatniczek w badanej populacji[12] (B.J.Weir 1970) były następujące: na 110 urodzonych samiczek przypadało 100 samców[2]. Populacje osiągają maksymalną liczebność w październiku i listopadzie, gdy do dorosłych dołączają już pierwszoroczne koszatniczki[99].
| Masa ciała | |
|---|---|
| przy urodzeniu | 14 g |
| po odstawieniu przez samicę | 77,4 g (przedział 40–122 g) |
| po osiągnięciu dojrzałości płciowej (samice) | 204,8 g (±10,4 g) |
Badania porównawcze koszatniczek pochodzących z populacji stada żyjącego na wolności w okolicy Santiago w Chile oraz populacji z hodowli w Wielkiej Brytanii wykazały różnice w przyroście masy ciała noworodków obu populacji. Przyrost masy ciała młodych koszatniczek z Chile był mniejszy (1–2 g/dzień) niż u koszatniczek z Wielkiej Brytanii (2–3 g/dzień)[97].
Dobowy cykl życia
W latach 1996–1997 chilijscy naukowcy przeprowadzili serię badań na terenie – zlokalizowanej 30 km na zachód od stolicy Santiago – stacji badawczej wydziału rolniczego Uniwersytetu Chilijskiego. Uniwersytecka nieruchomość gruntowa o powierzchni 2,6 ha znajduje się w typowym obszarze formacji matorral, porośniętej niskimi krzewami, sukulentami i trawami. Naukowcy badali zmienność rytmu dobowej aktywności koszatniczek pospolitych w zależności od pory roku. Badania pozwoliły na zaobserwowanie, że latem, gdy temperatura powietrza może osiągać 40 °C, zwierzęta wykazywały dwa moduły aktywności z przerwą trwającą ponad 8 godzin. Poranne żerowanie trwało ok. 2,5 godziny, a wieczorne 2. Koszatniczki unikały słońca, więc na żer ruszały wówczas, gdy słońce było nisko. Jesienią i wiosną aktywność na powierzchni także odnotowywano w dwóch porach dnia, ale przerwa między nimi była już wyraźnie krótsza a zwierzęta nie unikały już słońca. W okresie zimowym aktywność na powierzchni terenu trwała w jednym paśmie czasowym i koszatniczki chętnie żerowały w pełnym słońcu. Zimą temperatura powietrza spada do około 0 °C[61].
Badania wykazały, że można odwrócić rytm dobowy koszatniczki pospolitej na nocny poprzez wywołanie u zwierzęcia reakcji na zmiany otoczenia (presja drapieżników, zmiany w dostępności pokarmu i temperatury). Ta umiejętność pozwala koszatniczkom dostosować się warunków bezpiecznych i wspomaga przetrwanie[71].
Wykresy dobowej aktywności koszatniczek pospolitych w poszczególnych porach roku
w stacji badawczej Wydziału Nauk Rolniczych Universidad de Chile „Estación Experimental Rinconada de Maipú”
w latach 1996–1997(za: Kenagy, Nespolo, Vasquez, Bozinovic (2002))[61]
Struktura społeczna
Koszatniczka pospolita jest zwierzęciem stadnym i wiedzie życie w rodzinnych grupach. Rodzinne klany łączą się razem w kolonie, które wspólnie zajmują dane siedlisko[2]. Po usamodzielnieniu się w wieku kilku tygodni młode koszatniczki łączą się w małe, jednopłciowe grupy, w których funkcjonują do czasu ich pierwszego sezonu lęgowego[57]. Docelowo zwierzęta te żyją w grupach społecznych składających się z kilku ściśle powiązanych samic i jednego lub więcej dorosłych samców[116]. Łączenie w grupy mieszane (pod względem płci) następuje w okresie rozrodczym, gdy samce toczą walki o poszczególne terytoria i samice. Do walk o przywództwo w stadzie mogą przystępować także samice. Odnotowywane przez naukowców przypadki maskulinizacji i agresywności samic wynikają z ekspozycji na androgeny w trakcie prenatalnego rozwoju osobniczego[83]. Osobniki należące do poszczególnych stad często funkcjonują na danym obszarze ze znacznym poczuciem tolerancji, ale w sezonie lęgowym wszyscy członkowie grupy stają się bardziej terytorialni[91]. W umacnianiu poczucia więzi i spójności grupy pomaga także często powtarzane tarzanie się w piasku, podczas którego członkowie „kąpią się” w pyle przesiąkniętym wzajemnymi znakami zapachowymi moczu[17][84]. Dla samców kąpiele w pyle są pomocnym narzędziem w obronie terytorialnej, zaś dla samic ten rytuał jest ważny ze względu na poczucie więzi w obrębie stada[17].
Zagęszczenie populacji waha się od 10 do 259 osobników na 1 hektar i najwyższe jest na wiosnę, kiedy kolonię zasilają młode[2]. Średnie zagęszczenie populacji określane jest na 75 zwierząt na 1 ha[22][16].
Znakowanie terenu
Terytorium jest oznaczane znakami zapachowymi moczu[117][89], ale trzeba pamiętać, że koszatniczki pospolite są w stanie odróżnić wzrokowo świeży mocz poprzez odbijanie się od niego promieni UV. Teren jest więc oznakowany także w sposób widoczny dla obcych koszatniczek[17][20].
Komunikacja
Wspomniane już znakowanie terenu moczem wynika z naturalnej potrzeby określania hierarchii organizacji społecznej. Samce oznaczają teren częściej niż samice. Taka prawidłowość jest odnotowywana już u młodych samców w wieku poniżej 2 miesięcy. Samce zmniejszają częstotliwość oddawania moczu, gdy napotykają teren oznaczony już w ten sposób przez innego samca. Jednak gdy napotykają zapach moczu samicy, nie zmniejszają częstotliwości oznaczania. Z kolei samica zwiększa oznaczanie terenu moczem, gdy napotka markery zapachowe innej samicy, ale nie wykazuje zmian, gdy ma do czynienia z zapachem moczu samca[118].
Koszatniczki pospolite mają dobrze rozwinięty wzrok[16], węch i słuch, przy czym samice mają lepszy węch od samców[121]. Zwierzęta używają tych zmysłów do komunikowania się między sobą[69]. Można rozróżnić 15 rodzajów sygnałów[119][120], wśród których występują sygnały alarmowe[122], godowe i służące komunikacji między rodzicami a małymi. Dobry wzrok jest ważnym zmysłem pomocnym w wypatrywaniu wrogów podczas żerowania. Podczas badań stwierdzono, że koszatniczki pospolite widzą długości fal charakterystyczne dla ultrafioletu, a ich świeży mocz odbija promieniowanie UV. Stąd przyjęto hipotezę, że znakowanie terenu moczem ma charakter nie tylko zapachowy, ale i wzrokowy[77].
Próbki moczu tych zwierząt objęto badaniami[20][123]. Okazało się, że świeży mocz koszatniczek pospolitych ma dużo większe zdolności do odbijania promieniowania UV, niż dłuższych fal[57]. Natomiast stary, wyschnięty mocz O. degus dobrze odbija dłuższe fale, lecz bardzo słabo fale UV. Wynika z tego, że koszatniczki pospolite są w stanie odróżnić wzrokowo świeże ślady współplemieńców od starych, a więc łatwiej im odnaleźć nowe kryjówki czy inne elementy intensywnie użytkowanego terytorium. Niestety, jak zauważają badacze, jest też uboczna, negatywna (między innymi dla koszatniczek) konsekwencja zdolności zwierząt do wzrokowego rejestrowania promieniowania UV. Mianowicie również dzienne ptaki drapieżne − w tym naturalni wrogowie koszatniczek − widzą promieniowanie ultrafioletowe, a tym samym, kierując się widocznymi dla nich śladami świeżego moczu, potrafią z daleka dostrzec terytorium, na którym warto zapolować. Części grzbietowe ciała koszatniczki pospolitej są mocniej wybarwione niż brzuszne i mają istotny współczynnik odbicia promieniowania UV[20]. Wybarwienie grzbietu koszatniczki pospolitej stanowi dobry kamuflaż i pozwala w naturze wtopić się w tło i pozostać niezauważonym przez wroga[20][21].
Koszatniczki pospolite zachowują czujność, wspólnie monitorują otoczenie i charakterystycznym piskiem alarmują inne koszatniczki przez zbliżającym się niebezpieczeństwem[84]. W sytuacji zagrożenia O. degus potrafi szybko uciekać, ale zdarza się, że zastyga bez ruchu, by zmylić drapieżnika, podejmując próbę wtopienia się w tło otoczenia i stania się w ten sposób „niewidocznym” dla napastnika[60].
Zdaniem naukowców główną zaletą społecznego trybu życia koszatniczek pospolitych jest zmniejszenie indywidualnego ryzyka drapieżnictwa. Stwierdzono, że im większe jest stado, tym szybciej podnoszony jest alarm o zbliżającym się niebezpieczeństwie, a zwierzęta mają więcej czasu na ucieczkę[91]. Wzajemne ostrzeganie się sygnałem głosowym stanowi umiejętność typową dla zwierząt tego gatunku[124]. Podczas ucieczki na otwartej przestrzeni koszatniczka jest w stanie rozwinąć prędkość rzędu 5,7 m/s[60].

Zdolności poznawcze i sprawność manualna
Koszatniczki pospolite mają wysoko rozwinięte zdolności poznawcze i dobrze rozwiniętą sprawność manualną, dzięki czemu potrafią użyć prostych narzędzi. Japońscy naukowcy wykazali, że koszatniczka pospolita potrafi sobie przyswoić umiejętność stosowania małego narzędzia, podobnego do grabi w kształcie litery T, do przysuwania pokarmu, który był trudno dostępny[125][126].
Rozmieszczenie geograficzne
Koszatniczki pospolite zasiedlają półpustynne regiony centralnego Chile[2][127], na zachodnim zboczu Andów na wysokości od 0 do 1200 m n.p.m.[2][12], 1800 n.p.m[13][14], lub do 2000 m n.p.m.[15]. Zdaniem niektórych autorów koszatniczki pospolite zasiedlają jednak także tereny wyżej położone (np. 2600 m n.p.m.), w których panuje klimat górski[128]. Waterhouse wspominał, że szwajcarski przyrodnik, badacz koszatniczek dr Johann Tshudi napotkał te zwierzęta koło peruwiańskiej wsi San Juan de Matucanas, położonej na wysokości 9000 stóp, czyli ok. 3132 m n.p.m.[6]. W Chile koszatniczka jest ssakiem o najliczniejszej populacji[30][31][129]. Najliczniej zamieszkuje obszar pomiędzy Vallenar a Curicó[11] (28–35°S)[2].
W Polsce O. degus występuje sporadycznie jako gatunek zawleczony. 1997 w stanowisku lęgowym płomykówki zwyczajnej (Tyto alba guttata) usytuowanym w wieży kościelnej w Będzinie odkryto wypluwki i trzy martwe gryzonie nieznanego gatunku, które stanowiły zapas pokarmowy dla wyklutych młodych płomykówek. Po przeprowadzeniu badań kośćca i badań kraniologicznych okazało się, że są to koszatniczki pospolite[32]. O. degus nie jest jednak uznawany za gatunek inwazyjny w tym kraju[65].
Ekologia



Pożywienie
Koszatniczki pospolite są roślinożercami[56][130]. Ich układ pokarmowy jest przystosowany do trawienia pokarmów roślinnych, bowiem jelita wytwarzają inwertazę – enzym, który hydrolizuje węglowodany z pokarmów roślinnych[103]. Istotnym elementem procesu trawienia jest fermentacja bakteryjna w kątnicy[131]. Koszatniczki pospolite przeważnie żywią się trawami, ziołami, liśćmi i korą wybranych gatunków krzewów i drzew, niektórymi warzywami oraz nasionami[80]. Na podstawie badań preferencji żywieniowych w populacji koszatniczek pospolitych z Palmas de Ocoa w Chile naukowcy zauważyli, że zwierzęta te najchętniej wybierały nasiona palmy jubea, których skład z punktu widzenia wymagań dietetycznych gatunku jest najkorzystniejszy. Zdaniem badaczy stwierdzona prawidłowość wskazuje na umiejętność doboru najlepszych składników diety[132]. Koszatniczki pospolite są dostosowane do sezonowej zmienności jakościowej i składu dostępnych pokarmów[62][127][133]. Latem O. degus żeruje na terenie obszarów o wysokim zagęszczeniu roślinności, ze znacznym udziałem suchych ziół[60]. W okresie letnim i jesiennym znaczny udział w diecie mają zielone liście krzewów, zaś w zimie i na wiosnę zioła oraz trawy[102]. Przeprowadzone obserwacje nie wykazały wpływu sezonowych zmian składu diety na zmniejszenie masy ciała tych gryzoni. W okresach, gdy pożywienie jest mniej energetyczne, koszatniczki zwiększają ilość zjadanego pokarmu i w ten sposób rekompensują sobie spadek jakości żeru[130]. Wykazują też skłonność do magazynowania pokarmu na zimę, ale podlega ona zmienności w poszczególnych populacjach i stopień jej intensywności może być wynikiem lokalnej adaptacji[128].
Standardowo koszatniczki pospolite wybierają pożywienie, które pozwala na ograniczenie ilości błonnika (mniej włókniste krzewy: Adesmia bedwellii, Baccharis paniculata czy Chenopodium petiolare), azotu i wilgotności w pokarmie[134][135]. Gdy dostają do wyboru młode lub stare pędy krzewów porastających matorral (np. Colliguaya odorifera, Kageneckia oblonga czy Quillaja saponaria) wybierają młode pędy[134][136], które mają mniejszą zawartość włókna[134].
Wśród ulubionych potraw koszatniczek pospolitych są kora Cestrum parqui i Acacia caven[98][2][57], liście i kora Proustia cuneifolia, Atriplex repunda i Acacia caven, rośliny jednoroczne takie jak: iglica pospolita, ostrożeń i zielone trawy[2][57]. W diecie znajdują się owoce Jubaea chilensis, złocienia[98], Porlieria chilensis i Proustia pungens[134]. Podczas badań stwierdzono, że koszatniczka w podeszłym wieku może także sporadycznie zjadać pokarm pochodzenia zwierzęcego[2][57].
W okresie od kwietnia 1975 do lipca 1976 zespół amerykańskich biologów (Peter L. Meserve, Robert E. Martin, Rodriguez M. Jaime) przeprowadzili długoterminowe badania ekologii populacji koszatniczek pospolitych żyjących w okolicy La Desha (El Monasterio) koło Cerro Manquehue w Chile. Siedlisko kolonii leży na wysokości 900 m n.p.m., charakteryzuje się klimatem śródziemnomorskim z chłodnymi mokrymi zimami i gorącymi i suchymi okresami letnimi (średnia temperatura powietrza w lipcu – 8,2 °C, a w styczniu 20,1 °C, zaś średnioroczne opady osiągają 346 mm). Okoliczna roślinność zdominowana jest przez: krzewy Acacia caven, Quillaja saponaria i Lithraea caustica, wiechlinowate (stanowiące 78,5% pokrywy zielonej) stokłosy i iglicę pospolitą. Grunt był częściowo pokryty skałami, pniami drzew i łodygami roślin. Naukowcy przebadali zawartość żołądków 74 koszatniczek. Większość schwytanych osobników była dorosła, jedynie 7 z 14 zwierząt złapanych w październiku 1975 było w wieku dziecięcym. Naukowcy nie odnotowali różnic w składzie diety u przedstawicieli obu płci[137].
| kwiecień 1975 | lipiec 1975 | sierpień 1975 | wrzesień 1975 | październik 1975 | listopad 1975 | grudzień 1975 | luty 1976 | marzec 1976 | ||
| Zawartość żołądków | części roślin | n = 12 | n = 2 | n = 10 | n = 8 | n = 14 (w tym 7 młodych) |
n = 11 | n = 8 | n = 7 | n = 2 |
| krzewy: | ||||||||||
| Acacia caven | liście | 12,3% | 1,7% | 2,5% | 0,9% | 0,4% | 1,4% | 3,3% | 25,2% | 3,0% |
| Lithraea caustica | liście | 0,5% | 0,8% | 0,5% | 0,8% | 2,0% | 7,4% | |||
| Quillaja saponaria | liście | 1,8% | 6% | 1,1% | 0,2% | 0,2% | 0,6% | |||
| Colliguaya odorifera | liście | 1,7% | 0,2% | |||||||
| inne krzewy | liście | 0,6% | śladowe ilości |
0,2% | 0,2% | |||||
| Acacia caven | nasiona | 1,0% | 0,4% | 4,6% | ||||||
| Lithraea caustica | nasiona | 0,7% | 1,3% | 3,2% | 1,7% | |||||
| Colliguaya odorifera | nasiona | 1,0% | 0,4% | śladowe ilości |
1,0% | 3,1% | ||||
| inne krzewy | nasiona | 4,7% | 0,1% | 0,2% | 0,1% | 0,4% | 0,8% | 0,3% | 3,7% | |
| tkanka przewodząca krzewów | 13,7% | 2,9% | 0,9% | 0,3% | 2,4% | 1,2% | 17,3% | 14,3% | 39,2% | |
| zioła i trawy: | ||||||||||
| iglica pospolita | liście | 0,2% | 29,3% | 45,1% | 48,3% | 26,5% | 18,0% | 21,3% | 21,0% | |
| astrowate: Haplppappus i starzec |
liście | 0,5% | 12,1% | |||||||
| oset Carduus pygnocephalus | liście | 0,5% | 0,2% | śladowe ilości |
||||||
| Pasithaea i Solenomelus | liście | 0,2% | 0,3% | 0,2% | 0,9% | |||||
| inne zioła | liście | 0,3% | 0,3% | 2,0% | 0,2% | |||||
| trawy z rodzaju stokłosa | liście | 0,1% | 45,0% | 31,9% | 37,3% | 1,6% | 9,9% | 0,8% | ||
| Trisetobromus hirtus | liście | śladowe ilości |
0,4% | 0,2% | 0,2% | |||||
| kostrzewa | liście | 0,5% | 0,4% | |||||||
| inne trawy | liście | 2,6% | 0,5% | 0,2% | 0,2% | 1,3% | ||||
| iglica pospolita | nasiona | 8,7% | 0,9% | 0,1% | 0,7% | 38,0% | 10,2% | 3,0% | 3,5% | |
| inne zioła | nasiona | 0,1% | 1,1% | 0,5% | 3,0% | 0,7% | 1,7% | 0,3% | 1,0% | |
| trawy | nasiona | 34,3% | 1,3% | 0,9% | 3,4% | 16,2% | 46,9% | 20,1% | 21,2% | 33,0% |
| stawonogi | 0,2% | śladowe ilości |
0,1% | 0,2% | 0,8% | 0,5% | 0,4% | |||
| stawonogi | larwy | 0,3% | 0,1% | 0,5% | 0,4% | |||||
| przynęta | 10,3% | 1,6% | 1,0% | 4,6% | 6,1% | 3,8% | 0,7% | |||
| niezidentyfikowany materiał | 8,1% | 9,3% | 10,9% | 4,7% | 9,0% | 3,7% | 7,6% | 10,3% | 16,0% |
Żerowanie odbywa się na powierzchni. Od połowy lata po wczesną zimę większość ze spożywanych wysuszonych ziół jest zjadana prawie wyłącznie w określonych, wybranych miejscach żerowania, które w znacznym stopniu pokryte są stosunkowo gęstą pokrywą roślinną[60]. Zaobserwowano również wspinaczkę na gałęzie krzewów w poszukiwaniu pożywienia[85].
Woda jest absorbowana z pokarmu w okrężnicy koszatniczki pospolitej[75]. Organizm tych zwierząt żyjących w naturze, w klimacie suchym jest przystosowany do bardzo efektywnej gospodarki wodnej. Parowanie wody przez skórę jest ograniczone, bowiem gryzonie te nie mają gruczołów potowych. Koszatniczki pospolite mają stosunkowo duże nerki, w związku z czym wydalany mocz jest mocno zagęszczony[62].

Koprofagia
Ze względu na stosunkowo niską jakość pożywienia dostępnego na wolności koszatniczki pospolite wykazują także skłonność do koprofagii[127]: przeżuwają one własne odchody. W ciągu 24 godzin zjadają nawet 38% swoich odchodów[75]. W porze suchej dieta koszatniczek pospolitych jest uzupełniana także o odchody bydła i koni[11]. W środowisku naturalnym cecha ta pozwalała na odzyskiwanie niewykorzystanych przez organizm składników odżywczych. Odchody koszatniczki są suche, małe, bez zapachu[127].
Drapieżnictwo
Do naturalnych wrogów koszatniczek pospolitych należą tacy drapieżcy jak: nibylis andyjski (kolpeo)[33][85][129], wąż z rodziny połozowatych Philodryas chamissonis, jaszczurka z rodziny tejowatych Callopistes palluma[85], płomykówka zwyczajna[33], uszatka błotna[2], sokół rdzawobrewy i pustułka amerykańska z rodziny sokołowatych oraz należące do jastrzębiowatych myszołowiec towarzyski, kaniuk amerykański[85], aguja wielka[60][91][129] oraz aguja rdzawogrzbieta[129]. Dla części drapieżników koszatniczki pospolite stanowią podstawę diety: aguja rdzawogrzbieta (57,6%), aguja wielka (57,7%), myszołowiec towarzyski (64,5%)[129].
Do drapieżników polujących w przeszłości na koszatniczki zaliczyć można także człowieka. O historycznych informacjach na temat polowania na koszatniczki dla ich mięsa przez lokalną ludność wspominał już Molina w 1782. Porównywał ten fakt do informacji o żywieniu się schwytanymi myszami przez Rzymian. Twierdził jednak, że współcześni mu Chilijczycy nie porzucili tego zwyczaju[35]. Historyczne dane archeologiczne potwierdzają, że w czasach prehistorycznych ludzie traktowali koszatniczki jako źródło pokarmu i polowali na nie w sposób zorganizowany. Simonetti[138] wskazuje nawet na technikę polowania, polegającą na zalewaniu nor wodą, tak by wypłoszone zwierzęta uciekając przed utopieniem wpadały w ręce polujących[138][91]. Podczas badania dwóch koleb na stanowiskach archeologicznych El Manzano 1 i La Batea 1 (33°34' S, 70°24' W) w okolicy Estero el Manzano na granicy Sierra de Ramon k. Santiago archeolodzy odkryli kilkadziesiąt prehistorycznych szczątków koszatniczek. Część z nich była zwęglona. Odkryte ślady świadczyły o tym, że zwierzęta te były chwytane z przeznaczeniem na pokarm. Znalezisko datowane jest na 4460–1520 p.n.e[138]. Presja ze strony człowieka przyczynia się do zmniejszania się zasięgu występowania. Wraz z postępującym rozwojem zmieniana jest funkcja terenów porośniętych niską roślinnością krzewiastą i zwierzęta są stamtąd wypierane[129].
Pasożyty
U wielu koszatniczek pospolitych chwytanych w Chile stwierdzano helmintozę wywołaną przez robaki[139]. Na organizmach O. degus żywią się zarówno pasożyty wewnętrzne jak i zewnętrzne. Naukowcy stwierdzili szereg gatunków pasożytujących na koszatniczkach pospolitych:
1. helminty
- nicienie:
- tasiemce:
- bąblowce (Echinococcus), np. tasiemiec bąblowcowy (E. granulosus)[140]
- Aprostatandrya octodonensis[139]
2. stawonogi:
3. pierwotniaki:
- świdrowiec amerykański[140]
- pierwotniaki z rodzaju Giardia[141]

Siedlisko
Koszatniczki pospolite są w Chile traktowane jako szkodniki niszczące uprawy. Prowadzą stadne życie w pobliżu zarośli i skał w półpustynnym, pokrytym zaroślami ekosystemie zwanym matorral[57], w koloniach liczących do 100 osobników[58]. Koszatniczki pospolite prowadzą dzienny tryb życia, z maksimum aktywności rano i późnym popołudniem. Budują rozległe systemy nor z głównym wejściem zlokalizowanym zwykle pod krzewami lub skałami. Koszatniczki mają bardzo silną organizację społeczną, z silnym przywódcą stada związanego z danym terenem[11]. Zasięg terytorialny danego klanu wynosi średnio 200 m, na hektar przypada około 75 osobników[57]. Siedlisko pojedynczej kolonii zajmuje stosunkowo mały obszar – średnio 0,04–0,71 ha[62].
Koszatniczki pospolite są zwierzętami terytorialnymi. Wspólnie zajmują przestrzeń życiową i żerują na przyległym terenie. Centrum bronionego terytorium stanowi nora[2]. Osobniki należące do poszczególnych stad często funkcjonują na danym obszarze ze znacznym poczuciem tolerancji, ale w sezonie lęgowym wszyscy członkowie grupy stają się bardziej terytorialni[91]. Okresowy wzrost poziomu testosteronu sprawia, że szczególnie samce stają się wówczas bardziej waleczne i chętnie przystępują do bijatyk z sąsiadami oraz demonstrują panowanie nad danym terenem[117][87].
Siedlisko stanowi matorral – formacja roślinna tworzona przez roślinność twardolistną, wiecznie zielone krzewy, małe drzewa, trawy i zioła[62][78]. Tereny zasiedlane przez koszatniczki pospolite charakteryzują się klimatem śródziemnomorskim z ciepłymi i suchymi porami letnimi i zimnymi, mokrymi zimami[91], ze średnią opadów rzędu 376 mm. Większość opadów (do 65%) występuje w okresie zimowym (czerwiec–sierpień). Latem, gdy temperatury powietrza sięgają 40 °C, ma miejsce jedynie około 3% rocznych opadów, czego skutkiem są susze[62].
Na swoje siedlisko koszatniczki pospolite wybierają raczej tereny otwarte lub porośnięte karłowatymi krzewami. Unikają terenów, na których krzewy pokrywają ponad 80% przestrzeni[129]. Populacje mieszkające na terenach silniej porośniętym krzewami wykazywały większą powierzchnię zasięgu, niż zwierzęta żyjące na obszarze z mniejszą pokrywą[116]. Siedlisko koszatniczek pospolitych porastają Baccharis, Proustia pungens i Acacia caven, a także trawy i zioła: Clarkia tenella, iglice, Helenium aromaticum, Madia sativa, Matricaria chamonilla, szczawiki i Senecio adenotrichius[91] oraz krzewy Trevoa trinervos, należąca do rodziny rdestowatych Muhlembeckia hastulata i sukulenty[13]. Spotykane także są: Trevoa trinervis, Baccharis linearis, Quillaja saponaria[61].

Nora
Schronienie przed drapieżnikami i ekstremalnymi temperaturami zapewnia koszatniczce pospolitej nora[91]. Podziemne systemy nor składają się z tuneli o średnicy 8–10 cm oraz głównej komory (20 cm średnicy). Same tunele mają łączną długość 1–2 metry i przebiegają na głębokości, która waha się od 15 do 50 cm[116][16] (lub do 60 cm[2][84]) pod powierzchnią ziemi. System nory, rozumiany jako grupa otworów pojedynczej podziemnej kryjówki, obejmuje zazwyczaj rejon o średnicy około 2–3 m[116][16]. Wejścia do tuneli są często przykryte krowim łajnem i patykami[2][84]. Dodatkowo dominujące samce zbierają gałązki, fragmenty roślin, kamienie i obornik, by wznieść u wylotu nory kopiec, którego wielkość ma świadczyć o ich statusie i dominacji na danym terenie[2][57]. Wyloty z poszczególnych nor są ze sobą połączone systemem wytyczonych, stałych tras[60][6], wzdłuż których toczy się codzienne życie koszatniczek. Przed samymi wlotami do nor zwierzęta tworzą wydeptane przestrzenie, na których odbywają się spotkania, koordynowane są prace naprawcze nor, toczą się walki, zabawy młodych, zaloty, kąpiele w piasku, stanowią one także miejsca odpoczynku[60][85].
Podczas budowy i remontów nor koszatniczki pospolite często pracują zespołowo[91]. W czasie, gdy jedno zwierzę kopie, drugie obserwuje teren u wylotu nory. Często wymieniają się przy pracy, a w jej trakcie komunikują się głosem[52]. Naukowcy zaobserwowali wiele zespołowych zachowań koszatniczek pospolitych, podczas których grupa wspólnie osiągała zamierzony cel[142]. Do spulchniania gleby podczas pracy pod ziemią koszatniczki używają najczęściej przednich kończyn i zębów, a usuwanie urobku odbywa się przez przesuwanie go przednimi i tylnymi kończynami w tył, za siebie. Naukowcy zaobserwowali także pracę zespołową, podczas której dwie lub trzy koszatniczki kopały tunel w tym samym miejscu[52]. Podejmując wspólne zadanie na jednym odcinku nory, kopacze koordynowali swoje wysiłki[84]. Koszatniczki pospolite wykazują znaczną inwencję i podczas kopania nor potrafią wykorzystywać różne części ciała. Przednie łapy są narzędziem podstawowym i w obserwowanej przez naukowców populacji wszystkie z 44 badanych koszatniczek pospolitych używały ich do drążenia tunelu. Spulchnioną ziemię przesuwały za siebie i 86,4% z nich (38 kopaczy) wyrzucało urobek tylnymi łapami, przesuwając go za siebie. W sytuacji, gdy grunt okazywał się szczególnie twardy, koszatniczki używały do drążenia także siekaczy – 59,1% (czyli 26 osobników), zaś w trzech przypadkach (6,8%) samice przebijały sklepienie tunelu głową[52]. Naukowcy prowadzący badania nie stwierdzili jednak, by podczas prac płeć kopiącego zwierzęcia miała wpływ na wykorzystywanie poszczególnych części ciała[52]. W trzech przypadkach naukowcy zaobserwowali przerywanie przez samców drążenia tunelu, by wspólnie zająć się usuwaniem dużej ilości urobku na zewnątrz tunelu. Podczas prac koszatniczki pospolite robią stosunkowo często krótkie przerwy, podczas których wychodzą z nory i u jej wylotu obserwują, czy nie zbliża się niebezpieczeństwo[52]. Prace przy budowie lub remontach nory zajmują znaczny odsetek (16,1–40%) dobowej aktywności. Prace te najczęściej wykonywane są w okresie zimowym, kiedy wilgotność gleby jest stosunkowo wysoka i drążenie w miękkim podłożu jest łatwiejsze[52].
| zmienna | zima | wiosna | lato | jesień |
|---|---|---|---|---|
| odsetek nor wykazujących świeże ślady kopania (%) | 16,3 | 5,4 | 1,6 | 4,7 |
| opady (mm) | 58,6 | 12,2 | 1,3 | 19,9 |
| wilgotność gleby na głębokości 5 cm (%) | 8,3 | 12,4 | 0,7 | 0,4 |
| twardość gleby (N m−2) | 58,6 | 12,2 | 1,3 | 19,9 |
Zdaniem Ebenspergera budowa anatomiczna, morfologia i fizjologia koszatniczek pospolitych zasadniczo nie wykazują szczególnych cech przystosowawczych do prac ziemnych[52], jednak Tomasco zwraca uwagę, że widoczne jest dostosowanie do niedotlenienia i hiperkapni, która grozi zwierzętom przebywającym długo w norach[19]. Zdaniem naukowców wydatek energetyczny tych zwierząt jest o 30% wyższy, niż zakładany dla podobnej wielkości nor innych ssaków[52].
Koszatniczki pospolite wykorzystują czasem nory wspólnie z gryzoniami sympatrycznego gatunku[22] szynszyloszczur stokowy (Abrocoma bennettii)[57][16].
Hodowla
Jednym z pierwszych z europejskich ośrodków, w których hodowano koszatniczki pospolite, był ogród zoologiczny we Frankfurcie nad Menem, gdzie w latach 1960–63 żyła populacja składająca się z około 12 osobników. Źródło pochodzenia populacji nie jest znane[27]. W kwietniu 1964 do Laboratory Animal Medicine Massachusetts Institute of Technology w USA trafiło 20 koszatniczek pospolitych odłowionych w Lampa w Chile[24][94]. Część potomstwa tych zwierząt trafiła do Narodowego Parku Zoologicznego i Uniwersytetu w Vermont. Stamtąd koszatniczki trafiły do Europy, najpierw do Instytutu Fizjologii Porównawczej w Londynie[27], a sukcesywnie także do indywidualnych hodowców hobbystycznych[27].
W 1975 Charles Woods i David Boraker wskazywali, że kolonia koszatniczek założona w University of Vermont w Burlington w stanie Vermont była największą kolonią koszatniczek pospolitych w Stanach Zjednoczonych, zaś największa chilijska była zlokalizowana przy Instituto de Medicina Experimental del Servicio Nacional de Salud Universidad de Chile w Santiago[2]. W 1971 4 dorosłe koszatniczki pospolite pozyskane z kolonii w Massachusetts Institute of Technology dały początek hodowli prowadzonej przez Smithsonian National Zoological Park w Waszyngtonie[94].
W poszczególnych hodowlach zauważalne były wyraźne różnice morfologiczne (wielkość, ubarwienie, pigmentacja uszu). Nie ma więc pewności, czy okazy obecnie spotykane w hodowlach są czystymi gatunkowo przedstawicielami O. degus, czy też krzyżówkami z pozostałymi gatunkami rodzaju Octodon[27].
Do Ameryki Północnej i Europy koszatniczki pospolite trafiły jako zwierzęta do prowadzenia badań nad cukrzycą[24], bowiem insulina w tej grupie gryzoni ma odmienną strukturę[25][26] i wykazuje tylko 1–10% aktywności biologicznej w porównaniu z innymi ssakami[25], więc ich metabolizm nie pozwala na przyswajanie cukru[24]. W konsekwencji koszatniczki są bowiem bardzo podatne na tę chorobę[2][25]. U zwierząt żyjących na wolności nie zawsze rozwija się cukrzyca. Prawdopodobnie dzięki naturalnemu składowi diety w środowisku, bogatej w białka i o niskiej zawartości węglowodanów. Natomiast u zwierząt żyjących w hodowli nawet niewielka zmiana ilości przyjmowanych węglowodanów prowadzi do rozwoju przewlekłej hiperglikemii i cukromoczu[78]. Koszatniczki pospolite w hodowli wymagają więc sporej opieki, dbałości o dietę, odpowiedniej ilości ruchu, który pozwala na lepsze spalanie nadmiaru cukru[24]. Jednym z pierwszych objawów pojawiającej się cukrzycy jest zaćma[25].
W związku z tym, że koszatniczki pospolite są zwierzętami stadnymi i bardzo żywotnymi, w hodowli wymagają dużo wolnej przestrzeni[24]. Powinny być hodowane w jednopłciowych parach[58][21][29] lub stadach do 4–5 osobników[21][29]. Hodowla pojedynczych osobników może skutkować ujawnieniem się zaburzeń zachowania – np. zachowań stereotypowych, samookaleczania się[143]. Zdaniem Richardsona parę mieszaną można hodować razem po wykastrowaniu samca. Z kolei koszatniczki hodowane pojedynczo są bardziej narażone na stres i podatne na infekcje[58]. Łączenie nie znających się koszatniczek winno być przeprowadzone etapami. Przez tydzień zwierzęta winny być trzymane blisko siebie, lecz bez kontaktu bezpośredniego. To pozwala na oswojenie się z zapachem przyszłego współtowarzysza. Po połączeniu zwierzęta mogą się bić, ale jest to typowe zachowanie związane z koniecznością ustalenia hierarchii w stadzie[58].


Koszatniczkom pospolitym należy zapewnić dostęp do wybiegu[67] oraz wyposażyć klatkę w kołowrotek dla gryzoni o wielkości minimum 28 cm[144]. Koszatniczki wymagają znacznej ilości ruchu. W ciągu dnia zwierzę korzystające z takiej karuzeli potrafi pokonać dystans 4,5 km[2], a biega z prędkością około 13 m/min (czyli 1,5 km/2h)[145]. Mieszkaniem może być duża klatka dla gryzoni lub terrarium[67]. Zdaniem Lianne McLeod, weterynarza specjalisty w zakresie hodowlanej opieki nad zwierzętami egzotycznymi, klatka dla dwóch koszatniczek pospolitych nie powinna być mniejsza niż 60 cm × 45 cm × 60 cm (24″ × 18″ × 24″)[144], a według innych źródeł 100 cm × 60 cm × 60 cm[146] lub 75 cm × 85 cm × 80 cm[21]. Konieczny jest pojemnik na pokarm oraz poidło[67][68]. W warunkach hodowlanych świeża woda powinna być dostępna na bieżąco, a poidła dezynfekowane, by zapobiec infekcji pałeczką ropy błękitnej[75]. Wskazane jest wstawienie do klatki konarów lub półek, które umożliwią wspinanie, oraz kawałków gałęzi dozwolonych gatunków drzew[58]. Wyposażenie nie powinno być wykonane z plastiku, bowiem szybko zostałoby zniszczone. Dno klatki jak i bieżnia kołowrotka[58] nie powinny mieć formy rusztu z kraty, bowiem między szczeblami mogą się klinować łapy, co mogłoby stanowić potencjalne zagrożenie dla zwierzęcia[144] oraz skutkować zapaleniem i ropniami opuszek palcowych lub urazami ogona[58]. Koszatniczki pospolite chętnie budują namiastkę nory z gniazdem[24]. Do tego celu może służyć mały drewniany domek[58] (o wymiarach rzędu 20 cm × 15 cm × 20 cm (6″ × 8″ × 6″)) i ścinki papieru czy też ręczników papierowych. Zwierzęta powinny mieć (kilka razy w tygodniu) zapewniony dostęp do pojemnika ze specjalistycznym piaskiem lub pyłem wulkanicznym (stosowanym także dla szynszyli) do regularnych suchych kąpieli[144][68] (10–15 minut 2 razy w tygodniu[53]). Koszatniczki nie są polecane jako zwierzęta do samodzielnego hodowania przez mniejsze dzieci[146].
Dno klatki powinno być wysypane materiałem ściółkowym, który umożliwiałoby wsiąkanie moczu, jednak nie powinny to być trociny, które mogłyby działać drażniąco na drogi oddechowe zwierząt i zwiększać ryzyko chorób układu oddechowego. Podłoże należy wymieniać co tydzień[58].
Optymalna temperatura otoczenia w hodowli: 18–20 °C[68] lub 17–18 °C, przy wilgotności powietrza rzędu 30–60% [75]. Wskazywany jest dobowy rytm oświetlania w proporcji 12:12 godzin[68]. Zalecana częstotliwość wymiany wody w poidle – 2[75] lub 3 razy w tygodniu[141]. Możliwe dobowe spożycie wody: 10–40 ml[75]. Koszatniczki są podatne na zakażenia bakteriami tlenowymi z rodzaju Pseudomonas, więc do czasu osiągnięcia wieku 3 miesięcy woda winna być lekko zakwaszona[68][141]. Wspomniane zakażenia mogą skutkować biegunką, a w konsekwencji jej wystąpienia – zgonem zwierzęcia[141].
Żywienie w hodowli
W hodowli podstawą żywienia koszatniczek pospolitych jest siano[64][58][147], które nie może być jednak ściółką. Ściółkę stanowić powinna warstwa drewnopochodnego prasowanego granulatu. Zwierzęta można karmić nasionami traw, liśćmi kilku dozwolonych[148] gatunków polskich drzew i krzewów (brzoza, grusza, grab, jabłoń, leszczyna, lipa, orzech włoski, wierzba płacząca) i ziołami[149] (dziurawiec pospolity, babka lancetowata, rumianek pospolity, rdest ptasi, pokrzywa zwyczajna, wrzos, mniszek lekarski (mlecz), nagietek lekarski, mięta pieprzowa, lucerna, krwawnik, koper włoski, melisa i majeranek), bulwami topinambura (słonecznik bulwiasty), owocami dzikiej róży, jak również specjalnymi karmami. Można karmić koszatniczki pospolite świeżymi i suszonymi warzywami – porem, selerem, marchewką i pietruszką (dwa ostatnie w niewielkich ilościach, marchewka zawiera cukry, pietruszka jest moczopędna)[58]. Zdaniem szwajcarskiego specjalisty zajmującego się zwierzętami egzotycznymi dr. wet. Marcusa Claussa nie ma potrzeby zastępowania siana jakimikolwiek karmami czy dodatkami. Podkreśla, że siano ma pożądany stosunek wapnia do fosforu, zawiera dobrą ilość włókna oraz białka, a jego znaczny udział w diecie zapewnia długotrwałe żucie pokarmu, co jest niezbędne dla prawidłowego ścierania uzębienia koszatniczek[147].
Prawidłowa dieta koszatniczki pospolitej wymaga, by proporcja wapna do fosforu była zbliżona do 2:1, zaś ilość tych pierwiastków w 1 kilogramie karmy nie była zbyt wysoka (12 g wapna i 6 g fosforu). Z kolei brak wapnia lub fosforu albo nieprawidłowa ich wzajemna proporcja mogą skutkować powstawaniem zwapnień w nerkach, przerastaniem siekaczy i trzonowców oraz korzeni zębów[150][151]. Karma koszatniczki pospolitej nie powinna także zawierać nadmiernych ilości białka, które powoduje przyjmowanie nadmiernej ilości wody[18].
Ze względu na wrodzoną skłonność do cukrzycy dieta koszatniczek winna być pozbawiona nadmiaru węglowodanów. Wykluczone jest podawanie słodyczy, owoców, a nawet korzeni warzyw korzeniowych [68][58]. Zalecane jest znaczne ograniczenie w diecie składników energetycznych, zawierających znaczne ilości tłuszczu czy węglowodanów: kukurydzy, nasion słonecznika czy orzechów[58]. Jak wykazują wyniki badań (Reyn Homan et all, 2010), u koszatniczki karmionej dietą bogatą w cholesterol może rozwinąć się miażdżyca[152]. Badania te potwierdzają, że koszatniczki są naturalnym modelem zwierzęcym do badania ludzkich chorób[78].
Choroby w hodowli
W 2011 V. Jekl, K. Hauptman i Z. Knotek opublikowali na łamach „Journal of Small Animal Practice” artykuł „Diseases in pet degus: a retrospective study in 300 animals”, w którym przedstawili wyniki badań i leczenia 300 koszatniczek pospolitych podczas praktyki weterynaryjnej w okresie od stycznia 2007 do grudnia 2009[64].




| Wszystkie zwierzęta | Zwierzęta starsze niż 2 lata | Zwierzęta młodsze niż 2 lata | ||||
| Schorzenie | n = 300 | % | n = 190 | % | n = 110 | % |
| Zęby | 180 | 60,00 | 144 | 75,80 | 34 | 30,91 |
| Skóra i sierść | 110 | 36,67 | 56 | 29,47 | 54 | 49,09 |
| Oczy | 50 | 16,67 | 32 | 16,84 | 18 | 16,36 |
| Układ pokarmowy | 30 | 9,33 | 17 | 8,95 | 13 | 11,82 |
| Problemy poporodowe | 28 | 9,33 | 20 | 10,53 | 8 | 7,27 |
| Uszkodzenia kości | 22 | 7,33 | 140 | 7,37 | 8 | 7,27 |
| Nieżyt nosa | 16 | 5,33 | 14 | 7,37 | 8 | 7,27 |
| Cukrzyca | 12 | 4,00 | 10 | 5,26 | 2 | 1,82 |
| Otyłość | 12 | 4,00 | 9 | 4,74 | 3 | 2,73 |
| Uszy | 5 | 1,67 | 3 | 1,58 | 2 | 1,82 |
| Niewydolność nerek | 4 | 1,33 | 4 | 2,11 | 0 | 0,00 |
| Padaczka (o nieznanej etiologii) | 2 | 67,00 | 0 | 0,00 | 2 | 1,82 |
| Przegrzanie | 1 | 33,00 | 1 | 53,00 | 0 | 0,00 |
| Stan agonalny | 14 | 4,67 | 8 | 4,21 | 6 | 5,45 |
| Zdrowe zwierzęta | 38 | 12,67 | 16 | 8,42 | 22 | 20,00 |

Na pierwszym miejscu statystyki znalazły się problemy z zębami, z którymi zgłoszono 60% pacjentów. Zdecydowanie częściej problemy występowały u zwierząt starszych (75,8%) niż u młodych (30,91%). Problemy zębowe wynikały przede wszystkim z przerastania siekaczy, jednak w opinii autorów istotne jest rozeznanie przyczyn i konsekwencji. Koszatniczki mają uzębienie elodontyczne, czyli stale rosnące i wymagające ciągłego ścierania. W środowisku naturalnym zwierzęta żywią się głównie zielnymi liśćmi, a sezonowo fragmentami krzewów, korą, trawą, ziołami i nasionami. Gdy jakość pożywienia i jego dostępność są wysokie, koszatniczki wybierają młode liście i pędy, które mają wyższą zawartość białka, ale wyraźnie mniejszą ilość włókna. Zwierzęta hodowane w niewoli nie chcą jeść siana, a hodowcy wybierają gotowe mieszanki, w których skład wchodzą granulki lucerny, kukurydza, mieszanki zbóż, ale także orzechy, rodzynki i inne słodycze. Taka dieta nie wymusza na zwierzętach ciągłego ścierania zębów. Karma jest bardziej energetyczna (a więc zwierzęta nie gryzą jej zbyt długo) i nie zawiera wystarczającej ilości grubego włókna. To jedna z przyczyn przerostu siekaczy, a w konsekwencji także i zębów trzonowych[64], zaś sama elodontoma jest najczęstszą przyczyną obturacyjnej choroby nosa u tych zwierząt. Koszatniczka z przerośniętym uzębieniem może zacząć oddychać wyłącznie pyszczkiem, co przyczynia się do odwadniania organizmu[143].

Na drugim miejscu pod względem odnotowanych schorzeń badanych koszatniczek pospolitych były problemy skórne, które odnotowano u 110 zwierząt, czyli 36,67% (49,09% u młodych i 29,47% u starszych koszatniczek). Przyczynami były[64]:
- wygryzanie sierści łap i na innych częściach ciała – także przez współtowarzyszy z klatki (40 przypadków), oraz
- podobna depilacja, jako konsekwencja problemów z zębami (20 przypadków)
- uszkodzenia i rany po walce (25 przypadków)
- uszkodzenie ogona w wyniku niewłaściwego obchodzenia się ze zwierzętami (32 przypadki)
- ropnie (8 przypadków)
- pasożyty skórne (2 przypadki)
- zapalenie mieszków włosowych (1)
- poparzenie prądem (1)
- grzybica – Trichophyton mentagrophytes (1)
- mięsak (1)
Problemy ze wzrokiem koszatniczek pospolitych były w większości związane z jedno- lub dwustronną zaćmą (40 przypadków). Inne schorzenia oczu dotyczyły: stanu zapalnego (2), nadżerek rogówki (6) i zespołu suchego oka (6)[64]. U koszatniczek, które spożywały karmy o wysokiej zawartości fosforu, naukowcy stwierdzili przerastanie zębów trzonowych. Podobnie w przypadku diety, w której proporcja wapnia do fosforu na poziomie 1:1, także stwierdzono rozwój chorób dentystycznych wiodących do dalszego uszczerbku na zdrowiu[153][151]. Ewentualny rozwój infekcji pyszczka można zahamować poprzez dodawanie do wody witaminy C w ilości 12,5 mg/100 ml[58]. Biegunki u koszatniczek mają zwykle związek z dietą. Biegunka może wynikać ze zbyt dużej ilości świeżych części zielonych roślin. Nowe elementy diety winny być wprowadzane stopniowo. W przypadku biegunki można zwierzętom podawać liście jeżyny, węgiel leczniczy lub przypalony fragment tosta[58].
Mimo że na wolności koszatniczki pospolite wytrzymują niskie temperatury otoczenia, to w hodowli może rozwijać się u nich stan zapalny górnych dróg oddechowych. Można odnotować wówczas kichanie oraz wzmożone pocieranie pyszczka przednimi łapami. Nieleczony stan zapalny górnych dróg oddechowych może skutkować rozwojem zapalenia płuc, któremu towarzyszą duszności, a osłuchowo słyszalne szmery i trzaski. Wówczas zalecana jest antybiotykoterapia. W leczeniu infekcji u koszatniczek można stosować enrofloksacynę. Pomocne mogą się okazać inhalacje[58]. Najczęściej spotykany u koszatniczek pospolitych nowotwór to rak wątrobowokomórkowy, który bywa najczęściej odnotowywany u osobników w wieku 5–6 lat[53]. Autorzy zwracają uwagę na fakt, iż znaczny odsetek wśród przyczyn zgonów koszatniczek w hodowlach związany jest z infekcjami pałeczki ropy błękitnej[75].
Koszatniczki jako zwierzęta laboratoryjne
Koszatniczki pospolite zostały sprowadzone do USA i Wielkiej Brytanii w połowie lat 60. XX wieku jako obiekt badań medycznych i fizjologicznych. Stopień rozwoju młodych koszatniczek po urodzeniu sprawia, że są chętnie używane do badań laboratoryjnych[22][23]. Używane są także do badań behawioralnych[22][125], neurologicznych[154][155][156], psychopatologicznych[157], badań nad cukrzycą i rozwojem zaćmy[103], chorobą Alzheimera[78][158][156], z zakresu genetyki i neurofizjologii[31], nad nowotworami[78], miażdżycą[152] i nad rozwojem rytmu dobowego w okresie dojrzewania[159]. Niektóre zachowania koszatniczki pospolitej wykazują znacznie wyższy stopień złożoności niż u szczurów i myszy. Dla naukowców interesujące są ich zachowania społeczne, komunikacji głosowa, sprawność manualna i umiejętność korzystania z niewielkiego narzędzia, a także reakcje neurologiczne[154]. Podobieństwo między koszatniczkami pospolitymi a człowiekiem powoduje, że te zwierzęta są uznawane za unikatowy model porównawczy używany w badaniach różnego rodzaju strategii i terapii[78].
Zagrożenia i ochrona
Międzynarodowa Unia Ochrony Przyrody (IUCN) wymienia koszatniczkę pospolitą w Czerwonej księdze gatunków zagrożonych jako gatunek najmniejszej troski[7]. Prawo stanowe Kalifornii[160], Georgii[161] i Alaski uznają koszatniczki pospolite za gatunek inwazyjny i zabraniają posiadania ich jako zwierzę domowe[162].
Rezerwat:
W 1983 w okolicy miasta Illapel w chilijskiej prowincji Choapa (region Coquimbo) powstał Rezerwat Narodowy Las Chinchillas – (hiszp.) Reserva Nacional Las Chinchillas. Wśród gatunków tam występujących można spotkać koszatniczki[163].
Przypisy
- ↑ Octodon degus, [w:] Integrated Taxonomic Information System (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar Charles A. Woods, Dawid K. Boraker. Octodon degus. „Mammalian Species”. 67, s. 1–5, 1975. [zarchiwizowane z adresu]. (ang.).
- ↑ a b c Leopold Fitzinger, Versuch einer naturlichen Anordnung der Nageihiere (Rodentia), Königlich Bayerische Akademie der Wissenschaften, 1867, s. 130–131 (niem.).
- ↑ a b c d e f g h i j Wilson Don E. & Reeder DeeAnn M. (red.) Octodon degus. w: Mammal Species of the World. A Taxonomic and Geographic Reference (Wyd. 3.) [on-line]. Johns Hopkins University Press, 2005. (ang.) [dostęp 15 sierpnia 2014]
- ↑ a b c d e f g h i j k Wilfred H. Osgood: The mammals of Chile. Field Museum of Natural History, Chicago 1943.; dostęp 20 września 2010
- ↑ a b c d e f g h i j k l m n George Robert Waterhouse: The natural History of the Mammalia, Rodentia. Londyn: Hyppolite Baillyere, 1846.
- ↑ a b c Octodon degus, [w:] The IUCN Red List of Threatened Species (ang.).
- ↑ a b Włodzimierz Cichocki, Agnieszka Ważna, Jan Cichocki, Ewa Rajska, Artur Jasiński, Wiesław Bogdanowicz: Polskie nazewnictwo ssaków świata. Warszawa: Muzeum i Instytut Zoologii Polskiej Akademii Nauk, 2015, s. 297. ISBN 978-83-88147-15-9.
- ↑ a b Zygmunt Kraczkiewicz: SSAKI. Wrocław: Polskie Towarzystwo Zoologiczne – Komisja Nazewnictwa Zwierząt Kręgowych, 1968, s. 81, seria: Polskie nazewnictwo zoologiczne.
- ↑ a b c d Kazimierz Kowalski (redaktor naukowy), Adam Krzanowski, Henryk Kubiak: Mały słownik zoologiczny: Ssaki. Warszawa: Wiedza Powszechna, 1973. ISBN 83-214-0637-8.
- ↑ a b c d e Degu (Octodon degus). Comparative Mammalian Brain Collections. [dostęp 2012-12-02]. (ang.).
- ↑ a b c d e f g h i j k l Barbara J. Weir. The management and breeding of some more hystricomorph rodents. „Laboratory Animals”. 4 (83), s. 83–97, 1970. ISSN 1758-1117. [dostęp 2014-07-06].
- ↑ a b c d e f g Mariana A. Rojas, M. A. Montenegro, B. Morales. Embryonic development of the degu, Octodon degu. „Journal of Reproduction and Fertility”. 66, s. 31–38, 1982. ISSN 1741-7899. (ang.).
- ↑ a b c d e Guillermo Mann Fischer: Los Pequeños Mamíferos de Chile. Concepcion: Universidad de Concepcion, 1978.
- ↑ a b R. Garcia-Allegue, P. Lax, A. Madriaga, J. Madrid. Locomotor and feeding activity rhythms in a light-entrained diurnal rodent, Octodon degus. „American Journal of Physiology”. 277, s. 523–531, 1999. merican Physiological Society. DOI: 10.1152/ajpregu.1999.277.2.r523. ISSN 1522-1563. (ang.).
- ↑ a b c d e f g h i j k l George Fulk. Notes on the activity, reproduction, and social behavior of Octodon degus. „Journal of Mammalogy”. 57 (3), s. 495–505, 1976. DOI: 10.2307/1379298. JSTOR: 1379298.
- ↑ a b c d e f g h i Luis A. Ebensperger, Andrea Caiozzi. Male degus, Octodon degus , modify their dustbathing behavior in response to social familiarity of previous dustbathing marks. „Revista Chilena de Historia Natural”. 75, s. 157–163, 2002. ISSN 0716-078X. (ang.).
- ↑ a b c d e Arturo Cortes, Carlos Zuleta, Mario Rosenmann. Comparative water economy of sympatric rodents in a Chilean semi-arid habitat. „Comparative Biochemistry and Physiology”. 91 (4), s. 711–714, 1988. ISSN 1096-4959. PMID: 2907435. (ang.).
- ↑ a b c I. H. Tomasco, R. Del Río, R. Iturriaga, F. Bozinovic. Comparative respiratory strategies of subterranean and fossorial octodontid rodents to cope with hypoxic and hypercapnic atmospheres. „Journal of Comparative Physiology. B”. 180 (6), s. 877–884, 2010. DOI: 10.1007/s00360-010-0465-y. ISSN 0174-1578. (ang.).
- ↑ a b c d e f g h i Andrés Chávez, Francisco Bozinovic, Leo Peichl, Adrián G. Palacios. Retinal spectral sensitivity, fur coloration and urine reflectance in the genus Octodon (Rodentia): Implications for visual ecology. „Investigative Ophthalmology & Visual Science”. 44 (5), s. 2290–2296, 2003. Association for Research in Vision and Ophthalmology. ISSN 1552-5783. [zarchiwizowane z adresu]. (ang.).
- ↑ a b c d e f g h Elisabetta Mancinelli, Wendy Bament. Chinchillas, guinea pigs and degus: what vets need to know. „Veterinary Times”. 8, s. 4–5, 2014. ISSN 1352-9374. (ang.).
- ↑ a b c d e f g h i j Thomas J. Reynolds, John W. Wright. Early postnatal physical and behavioural development of degus (Octodon degus). „Laboratory Animals”. 13 (2), s. 93–99, 1979. ISSN 1758-1117. (ang.).
- ↑ a b W. Jeffrey, C. Hargett. Isoflurane anesthesia in the Octodon degus. „Army Aeromedical Research Lab Fort Rucker AL”. 89 (23), s. 19, 1989. United States Army Aeromedical Research Laboratory. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u Sharon Lynn Vanderlip: Degus. Complete pet owner's manual. Barron's Educational Series, Londyn, 2001. ISBN 978-0-7641-1600-1.
- ↑ a b c d e f g Juan C. Opazo, Mauricio Soto-Gamboa, Francisco Bozinovic. Blood glucose concentration in caviomorph rodents. „Comparative Biochemistry and Physiology A”. 137, s. 57–64, 2004. Elsevier. DOI: 10.1016/j.cbpb.2003.09.007. ISSN 1095-6433. (ang.).
- ↑ a b M. Nishi, D. Steiner. Cloning of complementary DNA's encoding islet amyloid polypeptide, insulin, and glucagon precursors from a New World rodent, the degu, Octodon degus. „Molecular Endocrinology”. 4 (8), s. 1192–1198, 2003. Elsevier. DOI: 10.1210/mend-4-8-1192. ISSN 0888-8809. PMID: 2293024. (ang.).
- ↑ a b c d e f Barbara Gneiser. Abdominale Sonographie beim Degu ( Octodon degus , Molina 1782). „Inaugural-Dissertation”, 2006. Ludwig-Maximilians-Universität München. (niem.).
- ↑ a b Degu. Care sheet. Petco Animal Supplies, Inc. [dostęp 2017-08-27]. (ang.).
- ↑ a b c d e Anndrea Hatcher: Exotic Pet Guide: DEGU. Olive Branch Parke Veterinary Clinic. [dostęp 2014-07-28]. (ang.).
- ↑ a b c Degu. Smithsonian National Zoological Park. [dostęp 2012-12-02]. (ang.).
- ↑ a b c José Luis Yañez, Fabián Jaksic: Historia natural de Octodon degus (Molina) (Rodentia, Octodontidae). Santiago: Museo Nacional de Historia Natural, 1978, seria: Publicaciones ocasionales del Museo Nacional de Historia Natural, no. 27.
- ↑ a b c d Andrzej Lech Ruprecht, Robert Kościów, Grzegprz Kłys. Koszatniczka Octodon degus (Molina , 1782) , Octodontidae (Rodentia) nowym gatunkiem w faunie ssaków Polski. „Chrońmy przyrodę ojczystą”. LXI (61), s. 69–76, 2005. Instytut Ochrony Przyrody PAN. (pol.).
- ↑ a b c d e Andrzej L. Ruprecht, Robert Kościów, Grzegorz Kłys: Koszatniczka „Octodon degus” (Molina, 1782), Octodontidae (Rodentia). 2005.
- ↑ Alfred Brehm: Brehms Thierleben. Allgemeine Kunde des Thierreichs. Leipzig: Verlag des Bibliographischen Instituts, 1883.
- ↑ a b c d Giovanni Ignazio Molina: Saggio sulla storia naturale del Chili. Masi, 1810.
- ↑ Wilson Don E. & Reeder DeeAnn M. (red.) Glis. w: Mammal Species of the World. A Taxonomic and Geographic Reference (Wyd. 3.) [on-line]. Johns Hopkins University Press, 2005. (ang.) [dostęp 20 lipca 2014]
- ↑ Edward Turner Bennett. Characters of a New Genus of Rodent Mammalia, from Chili, presented by Mr. Cuming. „Proceedings of the Zoological Society of London”. 1, s. 46–48, 1832. Zoological Society of London. (ang.).
- ↑ Dendrobius Meyen, 1833. The Global Biodiversity Information Facility. [dostęp 2014-08-17]. (ang.).
- ↑ Edward Turner Bennett. Notice of some recent Publications on the Chinchillidae. „The Zoological Journal”. 5, 1835. (ang.).
- ↑ C. Knight: The Penny Cyclopædia of the Society for the Diffusion of Useful Knowledge – (tom: CHA-DIO). Londyn: Uniwersytet Wisconsin – Madison, 1837.
- ↑ David Brewster: Philosophical Magazine and Journal of Science. Oxford: Uniwersytet Oksfordzki, 1836.
- ↑ Thomas Bridges. On the habits of some of the smaller species of Chiliean Rodents. „Proceedings of the Zoological Society of London”, s. 129–132, 1843. (ang.).
- ↑ Carolina Villagrán, Rodrigo Villa, Luis Felipe Hinojosa, Gilberto Sánchez i inni. Etnozoología Mapuche: un estudio preliminar. „Revista Chilena de Historia Natural”. 72, s. 595–627, 1999. (ang.).
- ↑ Theodore Sherman Palmer: Index generum mammalium: a list of the genera and families of mammals. Waszyngton: United States Government Publishing Office, 1904, s. 469, seria: U.S. Dept. of Agriculture. Division of biological survey. North American fauna no. 23. DOI: 10.5962/bhl.title.39809.
- ↑ Barbara Saavedra, D. Quiroz, J. Iriarte. Past and present small mammals of Isla Mocha (Chile). „Mammalian Biology”. 68, s. 365–371, 2003. Elsevier. ISSN 1616-5047. (ang.).
- ↑ a b Angel E. Spotorno, Laura I. Walker, Luis Contreras, Juan C. Torres i inni. Chromosome divergence of Octodon lunatus and Abrocoma bennetti and the origins of Octodontoidea (Rodentia: Histricognathi). „Revista Chilena de Historia Natural”. 68, s. 227–239, 1995. (ang.).
- ↑ Erazm Majewski: Słownik nazwisk zoologicznych i botanicznych polskich: zawierający ludowe oraz naukowe nazwy i synonimy polskie, używane dla zwierząt i roślin od XV-go wieku aż do chwili obecnej, źródłowo zebrane i zestawione z synonimami naukowemi łacińskiemi w podwójnym porządku alfabetycznym i pomnożone porównawczym materyałem, zaczerpniętym z innych języków słowiańskich, Tom 2. Warszawa: Nakładem Autora; Skład Główny w Warszawie w księgarni E. Wendego i S-ki, 1894.
- ↑ Barbara Saavedra, Javier A. Simonetti. Holocene distribution of Octodontid rodents in central Chile. „Revista chilena de historia natural”. 76 (3), s. 383–389, 2003. DOI: 10.4067/S0716-078X2003000300004. ISSN 0716-078X. (ang.).
- ↑ Waldo Venegas. Los cromosomas somáticos de Octodon bridgesi Waterhouse (Rodentia, Octodontidae). „Boletín de la sociedad de biología de concepción”. XLIX, s. 6–15, 1975. Sociedades de Biología y de Bioquímica de Concepción. ISSN 0037-850X. (hiszp.).
- ↑ a b Todd McLin Davis. Effects of familiarity on agonistic encounter behavior in male degus (Octodon degus). „Behavioral Biology”. 14 (4), s. 511–517, 1975. Elsevier. DOI: 10.1016/s0091-6773(75)90696-3. ISSN 0091-6773. PMID: 1172435. (ang.).
- ↑ a b c Luis A. Ebensperger, Maria Jose Hurtado. On the relationship between herbaceous cover and vigilance activity of degus ( Octodon degus ). „Ecology”. 111, s. 593–608, 2005. Ecological Society of America. ISSN 0012-9658. (ang.).
- ↑ a b c d e f g h i j k l Luis A. Ebensperger, Francisco Bozinovic. Energetics and burrowing behaviour in the semifossorial degu Octodon degus (Rodentia: Octodontidae). „Journal of Zoology”. 252, s. 179–186, 2000. The Zoological Society of London. [zarchiwizowane z adresu 2015-01-02]. (ang.).
- ↑ a b c d e f g h i Ron E. Banks, Julie M. Sharp, Sonia D. Doss, Deborah A. Vanderford: Exotic Small Mammal Care and Husbandry. Ames: John Wiley & Sons, 2009. ISBN 978-0-8138-2059-0.
- ↑ a b c Vladimir Jekl, Karel Hauptman, Misa Skoric, Edita Jeklova i inni. Elodontoma in a Degu (Octodon degus). „Journal of Exotic Pet Medicine”. 17 (3), s. 216–222, 2008. Elsevier. DOI: 10.1053/j.jepm.2008.04.001. ISSN 1557-5063. (ang.).
- ↑ a b K. O. Henkel. Observaciones aceica de un fenomeno de autotomia en el Degu (Octodon degus). „Revista Chilena de Historia Natural”. 42, s. 286–289, 1939. (hiszp.).
- ↑ a b c d e Degu ( Octodon degus ) – Degu information – Degu facts, pictures, photos. WildAnimalsOnline.com. [dostęp 2012-12-02]. (ang.).
- ↑ a b c d e f g h i j k l m n o p M.Hejna i P.Myers: Octodon degus. (On-line), Animal Diversity Web, 2006. [dostęp 2010-11-15]. (ang.).
- ↑ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac Degus. W: Virginia C. G. Richardson: Diseases of Small Domestic Rodents. Oxford: Blackwell Publishing, 2003, s. 75–90. ISBN 1-4051-0921-1.
- ↑ Chloe Long: Degutopia's Compact Guide to Degu Care. ISBN 978-1-4710-3764-1.
- ↑ a b c d e f g h i Rodrigo A. Vásquez, Luis A. Ebensperger, Francisco Bozinovic. The influence of habitat on travel speed, intermittent locomotion and vigilance in a diurnal rodent. „Behavioural Ecology”. 13 (2), s. 182–187, 2001. International Society for Behavioral Ecology. DOI: 10.1093/beheco/13.2.182. ISSN 1465-7279. [zarchiwizowane z adresu 2020-05-06]. (ang.).
- ↑ a b c d e f g h i G. Kenagy, R. Nespolo, R. Vasquez, F. Bozinovic. Daily and seasonal limits of time and temperature to activity of degus. „Revista Chilena de Historia Natural”. 75, s. 567–581, 2002. DOI: 10.4067/S0716-078X2002000300008. ISSN 0716-078X. (ang.).
- ↑ a b c d e f g h i j k Francisco Bozinovic, Leonardo Bacigalupe, Rodrigo Vasquez, Henk Visserc i inni. Cost of living in free-ranging degus (Octodon degus). „Comparative Biochemistry and Physiology Part A”. 137, s. 597–604, 2004. Elsevier. ISSN 1096-4959. [zarchiwizowane z adresu]. (ang.).
- ↑ a b c d Chloe V. Long. Common dental disorders of the degu (Octodon degus). „Journal of Veterinary Dentistry”. 29 (3), s. 158–165, 2012. American Veterinary Dental Society; Academy of Veterinary Dentistry (U.S.); American Veterinary Dental College. ISSN 0898-7564. (ang.).
- ↑ a b c d e f g h i Vladimir Jekl, Karel Hauptman, Zdenek Knotek. Diseases in pet degus: a retrospective study in 300 animals. „Journal of Small Animal Practice”. 52 (2), s. 107–12, 2011. British Small Animal Veterinary Association. ISSN 1748-5827. (ang.).
- ↑ a b Octodon degus (Molina) – Koszatniczka – Degu. Instytut Ochrony Przyrody PAN. [dostęp 2018-04-16]. (pol.).
- ↑ a b c d Luis Contreras, E. Bustos-Obregón. Anatomy of reproductive tract in Octodon degus Molina: a nonscrotal rodent. „Systems Biology in Reproductive Medicine”. 4 (2), s. 115–124, 1980. DOI: 10.3109/01485018008986477. (ang.).
- ↑ a b c d Anna Sporon, Michael Mettler: Koszatniczki wesołe i towarzyskie. Multico, 2005. ISBN 83-7073-366-2.
- ↑ a b c d e f g h i j k l m n o Adrian G. Palacios, Theresa M. Lee. Husbandry and Breeding in the Octodon degu (Molina 1782). „Cold Spring Harbor Protocols”. 4, s. 350–353, 2013. Cold Spring Harbor Laboratory Press. DOI: 10.1101/pdb.prot073577. ISSN 1559-6095. (ang.).
- ↑ a b c d e f Katharina Braun, P. Kremz, W. Wetzel, T. Wagner i inni. Influence of parental deprivation on the behavioural development in Octodon degus: Modulation by maternal vocalisations. „Developmental Psychobiology”. 42, s. 237–245, 2003. ISSN 1098-2302. PMID: 12621649. (ang.).
- ↑ Richard Weigl: Longevity of mammals in captivity; from the Living Collections of the world. A list of mammalian longevity in captivity. Stuttgart: Schweizerbart Science Publishers, 2005, seria: Tom 48 z Kleine Senckenberg-Reihe. ISBN 978-3-510-61379-3.
- ↑ a b c Martien J. H. Kas, Dale M. Edgar. A Nonphotic Stimulus Inverts the Diurnal–Nocturnal Phase Preference in Octodon degus. „The Journal of Neuroscience”. 19 (1), s. 328–333, 1999. Society for Neuroscience. ISSN 0270-6474. (ang.).
- ↑ Roberto Refinetti. Rhythms of body temperature and temperature selection are out of phase in a diurnal rodent, Octodon degus. „Physiology & Behavior”. 60 (3), s. 959–961, 1996. Elsevier. DOI: 10.1016/0031-9384(96)00147-3. ISSN 0031-9384. (ang.).
- ↑ a b c d Susan Labyak, Theresa Lee. Estrus and steroid induced changes in circadian rhythms in a diurnal rodent, Octodon degus. „Physiology and Behaviour”. 58 (3), s. 573–585, 1995. Elsevier. ISSN 0031-9384. (ang.).
- ↑ a b Chloe V. Long: Degu Cardio-Pulmonary Values. [w:] Judah, V., Nuttall, K. „Exotic Animal Care and Management”. Boston: Thomson Delmar Learning, 2007, seria: Veterinary Technology Series. ISBN 978-1-4180-4198-4.
- ↑ a b c d e f g h i j k l Mark A. Suckow, Karla A. Stevens, Ronald P. Wilson: The Laboratory Rabbit, Guinea Pig, Hamster, and Other Rodents. Waltham, Massachusetts: Academic Press (Elsevier), 2012. ISBN 978-0-12-380920-9.
- ↑ Tomas Vega-Zuniga, Felipe S. Medina, Felipe Fredes, Claudio Zuniga i inni. Does nocturnality drive binocular vision? Octodontine rodents as a case study. „PLoS ONE”. 31 8:e84199 (12), 2013. DOI: 10.1371/journal.pone.0084199. (ang.).
- ↑ a b c d Jacobs, G. H., Calderone, J. B., Fenwick, J. A., Krogh, K., Williams, G. A.. Visual adaptations in a diurnal rodent, Octodon degus. „Journal of Comparative Physiology A”. 189, s. 347–361, 2003. Springer-Verlag. DOI: 10.1007/s00359-003-0408-0. ISSN 0340-7594. (ang.).
- ↑ a b c d e f g h i j Alvaro O. Ardiles, John Ewer, Monica L. Acosta, Alfredo Kirkwood i inni. Octodon degus (Molina 1782): A Model in Comparative Biology and Biomedicine. „Cold Spring Harbor Protocols”. 4, s. 312–318, 2013. Cold Spring Harbor Laboratory Press. DOI: 10.1101/pdb.emo071357. ISSN 1559-6095. PMID: 23547147. (ang.).
- ↑ a b c d Pedro Gallardo, Nancy Olea, Francisco V. Sepúlveda. Distribution of aquaporins in the colon of Octodon degus, a South American desert rodent. „American Journal of Physiology – Regulatory, Integrative and Comparative Physiology”. 283, s. R779–R788, 2002. DOI: 10.1152/ajpregu.00218.2002. (ang.).
- ↑ a b Francisco Bozinovic, P. A. Gallardo, G. H. Visser, A. Cortes. Seasonal acclimatization in water flux rate, urine osmolality and kidney water channels in free-living degus: Molecular mechanisms, physiological processes and ecological implications. „Journal of Experimental Biology”. 206, s. 2959–2966, 2003. The Company of Biologists. DOI: 10.1242/jeb.00509. ISSN 1477-9145. (ang.).
- ↑ G. B. Diaz, R.A. Ojeda, E.L. Rezende. Renal morphology, phylogenetic history and desert adaptation of South American hystricognath rodents. „Functional Ecology”. 20 (4), s. 609–620, 2006. JSTOR: 3806609. (ang.).
- ↑ a b Vladimir Jekl, Karel Hauptman, Edita Jeklova, Zdenek Knotek. Selected haematological and plasma chemistry parameters in juvenile and adult degus (Octodon degus). „Veterinary Record”. 169, 2011. DOI: 10.1136/vr.d2360. ISSN 0042-4900. (ang.).
- ↑ a b c d L.A. Correa, M.J. Frugone, M. Soto-Gamboa. Social dominance and behavioral consequences of intrauterine position in female groups of the social rodent Octodon degus. „Physiology & Behavior”. 119, s. 161–167, 2013. Elsevier. DOI: 10.1016/j.physbeh.2013.06.002. ISSN 0031-9384. (ang.).
- ↑ a b c d e f g Luis A. Ebensperger, Francisco Bozinovic. Communal Burrowing in the Hystricognath Rodent, Octodon degus: A Benefit of Sociality?. „Behavioral Ecology and Sociobiology”. 47 (5), s. 365–369, 2000. Springer. ISSN 0340-5443. (ang.).
- ↑ a b c d e f g Luis A. Ebensperger, Maria J. Hurtado. Seasonal changes in the time budget of degus, Octodon degus. „Behaviour”. 142, s. 91–112, 2005. Brill. ISSN 0005-7959. (ang.).
- ↑ Robert Friedle, Robert Fischer. Responses to salivary olfactants in relation to dominance of the degu (Octodon degus). „Perceptual and Motor Skills”. 62 (1), s. 192–194, 1986. DOI: 10.2466/pms.1986.62.1.192. PMID: 3960660. (ang.).
- ↑ a b c Mauricio Soto-Gamboa, Manuel Villalon, Francesco Bozinovic. Social cues and hormone levels in male Octodon degus (Rodentia): A field test of the Challenge Hypothesis. „Hormonal Behaviour”. 47 (3), s. 311–318, 2005. Elsevier. DOI: 10.1016/j.yhbeh.2004.11.010. ISSN 0018-506X. [zarchiwizowane z adresu]. (ang.).
- ↑ a b Susan C. Wilson, Devra G. Kleiman. Eliciting Play: A Comparative Study. „American Zoologist”. 14, s. 341–370, 1974. ISSN 0003-1569. (ang.).
- ↑ a b Robert B. Fischer, Gary F. Meunier. Responses to conspecifics' urine by the degu (Octodon degus). „Physiology & Behavior”. 34 (6), s. 999–1001, 1985. Elsevier. DOI: 10.1016/0031-9384(85)90027-7. ISSN 0031-9384. (ang.).
- ↑ Irina Ziabreva, Gerd Poeggel, Reinhild Schnatel, Katharina Braun. Separation-induced receptor changes in the hippocampus and amygdala of Octodon degus: Influence of maternal vocalisations. „Journal of Neuroscience”. 23, s. 5329–5336, 2003. Society for Neuroscience. ISSN 0270-6474. (ang.).
- ↑ a b c d e f g h i j k l Luis A. Ebensperger, Petra K. Wallem. Grouping increases the ability of the social rodent, Octodon degus, to detect predators when using exposed microhabitats. „OIKOS”. 98, s. 491–497, 2002. ISSN 0030-1299. (ang.).
- ↑ a b c Verónica Quirici, Sylvain Faugeron, Loren D. Hayes, Luis A. Ebensperger. Absence of kin structure in a population of the group-living rodent Octodon degus. „Behavioral Ecology”. 22 (2), s. 248–254, 2011. DOI: 10.1093/beheco/arq196. [zarchiwizowane z adresu 2020-05-06]. (ang.).
- ↑ Luis A. Ebensperger. Dustbathing and intra-sexual communication of social degus, Octodon degus (Rodentia: Octodontidae). „Revista Chilena de Historia Natural”. 73, s. 359–365, 2000. ISSN 0716-078X. (ang.).
- ↑ a b c d e Susan C. Wilson. Contact-promoting behavior, social development, and relationship with parents in sibling juvenile degus (Octodon degus). „Developmental Psychobiology”. 15 (3), s. 257–268, 1982. ISSN 1098-2302. PMID: 7095291. (ang.).
- ↑ Wladimir Ovtscharoff, Carina Helmeke, Katharina Braun. Lack of paternal care affects synaptic development in the anterior cingulate cortex. „Brain Research”. 1116, s. 58–63, 2006. Elsevier. DOI: 10.1016/j.brainres.2006.07.106. (ang.).
- ↑ Luis A. Ebensperger, Adrian S. Chesh, Rodrigo A. Castro, Liliana Ortiz Tolhuysen i inni. Instability Rules Social Groups in the Communal Breeder Rodent Octodon degus. „Ethology”. 115, s. 540–554, 2009. Blackwell Verlag GmbH. DOI: 10.1111/j.1439-0310.2009.01635.x. ISSN 1439-0310. [zarchiwizowane z adresu]. (ang.).
- ↑ a b c Chloe V. Long, Luis A. Ebensperger. Pup growth rates and breeding female weight changes in two populations of captive bred degus (Octodon degus), a precocial caviomorph rodent. „Reproduction in Domestic Animals”. 45 (6), s. 975–982, 2009. DOI: 10.1111/j.1439-0531.2009.01470.x. (ang.).
- ↑ a b c d e f g Sergio Zunin, Francisco Saiz, Leslie R. Yates. U so del espacio, densidad de Octodon degus y oferta de recursos en Ocoa, Parque Nacional La Campana, Chile. „Revista Chilena de Historia Natural”. 65, s. 343–355, 1992. ISSN 0716-078X. (hiszp.).
- ↑ a b Peter L. Meserve, Robert E. Martin, Jaime Rodríguez. Comparative ecology of the caviomorph rodent Octodon degus in two Chilean Mediterranean-type communities. „Revista Chilena de Historia Natural”. 57, s. 79–89, 1984. Sociedad de Biología de Chile. ISSN 0716-078X. (ang.).
- ↑ a b c d e f g h i j k Megan M. Mahoney, Brooke V. Rossi, Megan H. Hagenauer, Theresa M. Lee. Characterization of the Estrous Cycle in Octodon degus. „Biology of Reproduction”. 84 (4), s. 664–671, 2011. DOI: 10.1095/biolreprod.110.087403. ISSN 1529-7268. PMCID: PMC3062035. (ang.).
- ↑ a b Luis A. Ebensperger, Claudio Veloso, Petra K. Wallem. Do female degus communally nest and nurse their pups?. „Journal of Ethology”. 20, s. 143–146, 2002. Japan Ethological Society & Springer-Verlag. DOI: 10.1007/s10164-002-0063-x. ISSN 1439-5444. (ang.).
- ↑ a b c d e Luis Ebensperger. No infanticide in the hystricognath rodent, Octodon degus: Does ecology play a role?. „Acta Ethologica”. 3 (2), s. 89–93, 2001. Springer-Verlag. DOI: 10.1007/s102110000032. ISSN 0873-9749.
- ↑ a b c d e f Theresa M. Lee. Octodon degus: A diurnal, social and long-lived rodent. „ILAR Journal”. 45 (1), s. 14–24, 2004. ISSN 1930-6180. (ang.).
- ↑ a b Carina Helmeke, Vladimir Ovtscharoff, Gerd Poeggel, Katharina Braun. Juvenile emotional experience alters synaptic inputs on pyramidal neurons in the anterior cingulate cortex. „Cerebral Cortex”. 11 (8), s. 717–727, 2001. ISSN 1460-2199. [zarchiwizowane z adresu 2020-05-06]. (ang.).
- ↑ a b Gerd Poeggel, Katharina Braun. Early auditory filial learning in degus (Octodon degus): behavioral and autoradiographic studies. „Brain Research”. 743 (1–2), s. 162–170, 1996. ISSN 0006-8993. PMID: 9017243. (ang.).
- ↑ S. Braun, H. Scheich. Influence of experience on the representation of the “mothering call” in frontoparietal and auditory cortex of pups of the rodent Octodon degus : FDG mapping. „Journal of Comparative Physiology A: Neuroethology, Sensory, Neural, and Behavioral Physiology”. 181 (6), s. 697–709, 1997. Springer-Verlag. DOI: 10.1007/s003590050151. ISSN 1432-1351. PMID: 9449828. (ang.).
- ↑ Katharina Braun, Gerd Poeggel. Recognition of Mother’s voice evokes metabolic activation in the medial prefrontal cortex and lateral thalamus of Octodon degus pups. „Neuroscience”. 103, s. 861–864, 2001. ISSN 0306-4522. PMID: 11301196. (ang.).
- ↑ Stephanie A. Jesseau, Warren G. Holmes, Theresa M. Lee. Mother – offspring recognition in communally nesting degus, Octodon degus. „Animal Behaviour”. 75, s. 573–582, 2008. Elsevier. DOI: 10.1016/j.anbehav.2007.06.015. ISSN 0003-3472. (ang.).
- ↑ María Inés Becker, Alfredo E. De Ioannes, Cecilia León, Luis A. Ebensperger. Females of the communally breeding rodent, Octodon degus, transfer antibodies to their offspring during pregnancy and lactation. „Journal of Reproductive Immunology”. 74, s. 68–77, 2007. Elsevier. DOI: 10.1016/j.jri.2007.01.002. ISSN 1600-0897. [zarchiwizowane z adresu]. (ang.).
- ↑ a b Luis A. Ebensperger, María José Hurtado, Mauricio Soto-Gamboa, Eileen A. Lacey i inni. Communal nesting and kinship in degus (Octodon degus). „Natur wissenschaften”. 91 (8), s. 391–395, 2004. Springer-Verlag. DOI: 10.1007/s00114-004-0545-5. ISSN 1432-1904. (ang.).
- ↑ Tina W. Wey, Joseph R. Burger, Luis A. Ebensperger, Loren D. Hayes. Reproductive correlates of social network variation in plurally breeding degus (Octodon degus). „Animal Behaviour”. 85 (6), s. 1407-1414, 2013. ELSEVIER. ISSN 0003-3472. (ang.).
- ↑ Stephanie A. Jesseau, Warren G. Holmes, Theresa M. Lee. Communal nesting and discriminative nursing by captive degus, Octodon degus. „Animal Behaviour”. 78 (5), s. 1183-1188, 2009. ELSEVIER. ISSN 0003-3472. (ang.).
- ↑ Daniel E. Naya, Luis E. Ebensperger, Pablo Sabat, F. Bozinovic. Digestive and Metabolic Flexibility Allows Female Degus to Cope with Lactation Costs. „Physiological and Biochemical Zoology”. 81 (2), s. 186–194, 2008. DOI: 10.1086/527453. ISSN 1537-5293. (ang.).
- ↑ a b Degu Information Sheet. eRodent. [dostęp 2014-07-27]. (ang.).
- ↑ a b Before you buy a Degu. eRodent. [dostęp 2014-07-27]. (ang.).
- ↑ a b c d Loren D. Hayes, Adrian S. Chesh, Luis A. Ebensperger. Ecological Predictors of Range Areas and Use of Burrow Systems in the Diurnal Rodent, Octodon degus. „Ethology”. 113, s. 155–165, 2007. Blackwell Verlag. DOI: 10.1111/j.1439-0310.2006.01305.x. ISSN 1439-0310. (ang.).
- ↑ a b Mauricio Soto-Gamboa. Free and total testosterone levels in field males of Octodon degus (Rodentia, Octodontidae): accuracy of the hormonal regulation of behavior. „Revista Chilena de Historia Natural”. 78, s. 229–238, 2005. ISSN 0716-078X. (ang.).
- ↑ Devra G. Kleiman. The Effects of Exposure to Conspecific Urine on Urine-Marking in Male and Female Degus (Octodon degus). „Behavioral Biology”. 14, s. 519–526, 1975. ISSN 0091-6773. (ang.).
- ↑ a b c d e Chloe V. Long, Vocalisations of the degu ( Octodon degus ), a social Caviomorph rodent, t. 16, Bioacoustics, 2007, s. 223–244.
- ↑ a b c d e Chloe V. Long. Pups of the degu ( Octodon degus ) include ultrasonic frequencies in care-eliciting calls. „Proceedings of the Institute of Acoustics”. 31, s. 237–244, 2009.
- ↑ Tammy Jechura, Jacquelynn M. Walsh, Theresa M. Lee. Testosterone suppresses circadian responsiveness to social cues in the diurnal rodent Octodon degus. „Journal of Biological Rhythms”. 18 (1), s. 43–50, 2003. Sage Publ.. DOI: 10.1177/0748730402239675. PMID: 12568243. (ang.).
- ↑ Dźwięki wydawane przez Octodon degus. Degu Sfera. [dostęp 2018-11-05]. [zarchiwizowane z tego adresu]. (pol.).
- ↑ Tammy J. Jechura, Megan M. Mahoney, C. D. Stimpson, Theresa M. Lee. Odor-specific effects on reentrainment following phase advances in the diurnal rodent, Octodon degus. „The American Journal of Physiology – Regulatory, Integrative and and Comparative Physiology”. 291 (6), s. 1808–1816, 2006. ISSN 1522-1490. PMID: 16840658. (ang.).
- ↑ Erin L. Shelley, Daniel T. Blumstein. The evolution of vocal alarm communication in rodents. „Behavioural Ecology”. 16 (1), s. 169–177, 2006. DOI: 10.1093/beheco/arh148. [zarchiwizowane z adresu 2020-05-06]. (ang.).
- ↑ a b Noriko Kumazawa-Manita, Hiroshi Hama, Atsushi Miyawaki, Atsushi Iriki. Tool Use Specific Adult Neurogenesis and Synaptogenesis in Rodent (Octodon degus) Hippocampus. „PLOS ONE”. 8 (3), s. 1–9, 2013. DOI: 10.1371/journal.pone.0058649. ISSN 1932-6203. PMCID: PMC3596278. (ang.).
- ↑ Kazuo Okanoya, Naoko Tokimoto, Noriko Kumazawa, Sayaka Hihara i inni. Tool-Use Training in a Species of Rodent: The Emergence of an Optimal Motor Strategy and Functional Understanding. „PLOS ONE”. 3 (3), 2008. plosone.org. DOI: 10.1371/journal.pone.0001860. (ang.).
- ↑ a b c d G. J. Kenagy, Claudio Veloso, Francisco Bozinovic. Daily rhythms of food intake and feces reingestion in the degu, an herbivorous Chilean rodent: optimizing digestion through coprophagy. „Physiological and Biochemical Zoology”. 72 (1), s. 78–86, 1999. PubMed. DOI: 10.1086/316644. ISSN 1537-5293. (ang.).
- ↑ a b René Quispe, Camila P. Villavicencio, Arturo Cortés, Rodrigo A. Vásquez. Inter-Population Variation in Hoarding Behaviour in Degus, Octodon degus. „Ethology”. 115 (5), s. 465–474, 2009. DOI: 10.1111/j.1439-0310.2009.01621.x. (ang.).
- ↑ a b c d e f g Javier A. Simonetti. The carnivorous predatory guild of central Chile: a human-induced community trait?. „Revista Chilena de Historia Natural”, s. 23–25, 1988. Sociedad de Biología de Chile. DOI: 10.1007/BF00540599. ISSN 0716-078X. (ang.).
- ↑ a b Francisco Bozinovic, Fernando Novoa, Pablo Sabat. Feeding and digesting fiber and tannins by an herbivorous rodent, Octodon degus (Rodentia:Caviomorpha). „Comparative Biochemistry and Physiology – Part A: Physiology”. 118 (3), s. 625–630, 1997. PMID: 9406439. (ang.).
- ↑ Mark S. Edwards. Nutrition and Behavior of Degus (Octodon degus). „Veterinary Clinics of North America: Exotic Animal Practice”. 12 (2), s. 237-253, 2009. Elsevier. DOI: 10.1016/j.cvex.2009.01.003. ISSN 1094-9194. (ang.).
- ↑ Leslie R. Yates, Francisco Saiz, Sergio Zunin. Octodon degus: Valor nutricional y preferencia del recurso trofico en el Palmar de Ocoa, Parque Nacional La Campana, Chile. „Revista Chilena de Historia Natural”. 67, s. 89–99, 1994. (hiszp.).
- ↑ Hugo Torres-Contreras, Francisco Bozinovic. Food selection in an herbivorous rodent: Balancing nutrition with thermoregulation. „Ecology”. 78 (7), s. 2230–2237, 1997. Ecological Society of America. DOI: 10.1890/0012-9658(1997)078. ISSN 0012-9658. (ang.).
- ↑ a b c d Julio R. Gutiérrez, Francisco Bozinovic. Diet selection in captivity by a generalist herbivorous rodent (Octodon degus) from the Chilean coastal desert. „Journal of Arid Environments”. 39 (4), s. 601–607, 1998. ISSN 1095-922X. (ang.).
- ↑ Francisco Bozinovic. Diet selection in rodents: an experimental test of the effect of dietary fiber and tannins on feeding behavior. „Revista Chilena de Historia Natural”. 70 (3), s. 67–71, 1997. (ang.).
- ↑ Javier A. Simonetti, Gloria Montenegro. Food preferences by Octodon degus (Rodentia caviomorpha): Their role in the chilean matorral composition. „Oecologia”. 51 (2), s. 189–190, 1981. Springer-Verlag. DOI: 10.1007/BF00540599. ISSN 1432-1939. (ang.).
- ↑ a b Peter L. Meserve, Robert E. Martin, Rodriguez M. Jaime. Feeding Ecology of Two Chilean Caviomorphs in a Central Mediterranean Savanna. „Journal of Mammalogy”. 64 (2), s. 322 - 325, 1983. DOI: 10.2307/1380568. ISSN 1545-1542. JSTOR: 1380568. (ang.).
- ↑ a b c Javier A. Simonetti, Luis E. Cornejo. Archaeological Evidence of Rodent Consumption in Central Chile. „Latin American Antiquity”. 2 (1), s. 92–96, 1991. Society for American Archaeology. ISSN 1045-6635. (ang.).
- ↑ a b c d e Bert B. Babero, Pedro E. Cattan, Carlos Cabello. Trichuris bradleyi sp. n., a Whipworm from Octodon degus in Chile. „The Journal of Parasitology”. 61 (6), s. 1061–1063, 1975. The American Society of Parasitologists. ISSN 1937-2345. (ang.).
- ↑ a b c d e f g h i j k l m n Bert B. Babero, Pedro E. Cattan. Parasitos del roedor degu Octodon degus Molina, 1782 con la descripcion de tres neuvas especies. „Boletin Chileno de parasitologia”. 30, s. 68–76, 1975. Programa de Parasitología. Instituto de Ciencias Biomédicas. Facultad de Medicina. Universidad de Chile. ISSN 0365-9402. (hiszp.).
- ↑ a b c d Thomas M. Donnelly, Fred W. Quimby: Biology and Diseases of Other Rodents [w: James G. Fox; James G. Fox; Lynn C. Anderson; Franklin M. Loew; Fred W. Quimby: „Laboratory Animal Medicine”]. Londyn: Elsevier Science, 2002, s. 900. ISBN 0-12-263951-0.
- ↑ Naoko Tokimoto, Kazuo Okanoya. Spontaneous construction of “Chinese boxes” by Degus (Octodon degu): A rudiment of recursive intelligence?. „Japanese Psychological Research”. 46 (3), s. 255–261, 2004. DOI: 10.1111/j.1468-5584.2004.00257.x. (ang.).
- ↑ a b Vladimir Jekl, Tomas Zikmund, Karel Hauptman. Dyspnea in a Degu (Octodon degu) Associated with Maxillary Cheek Teeth Elongation. „Journal of Exotic Pet Medicine”. 25 (2), s. 128–132, 2016. Elsevier. DOI: 10.1053/j.jepm.2016.03.003. ISSN 1557-5063. (ang.).
- ↑ a b c d Lianne McLeod, DVM: Degus as Pets. exoticpets.about.com. [dostęp 2014-07-19]. (ang.).
- ↑ Martien J. H. Kas, Dale M. Edgar. Scheduled Voluntary Wheel Running Activity Modulates Free-Running Circadian Body Temperature Rhythms in Octodon degus. „The Journal of Biological Rhythms”. 16 (1), s. 328–333, 2001. Sage Publications, Inc.. ISSN 0270-6474. (ang.).
- ↑ a b Degu. „Handle with Care”, s. 1–2. Royal Society for the Prevention of Cruelty to Animals (RSPCA). [zarchiwizowane z adresu 2020-05-06]. (ang.).
- ↑ a b Marcus Clauss. Clinical Technique: Feeding Hay to Rabbits and Rodents. „Journal of Exotic Pet Medicine”. 21, s. 80-86, 2012. Elsevier. DOI: 10.1053/j.jepm.2011.11.005. ISSN 1557-5063. (ang.).
- ↑ „Justyna”: Lista drzew i krzewów. koszatniczka.org.pl. [dostęp 2018-11-05]. [zarchiwizowane z tego adresu (2022-12-03)]. (pol.).
- ↑ „Junoo”: Zioła. koszatniczka.org.pl. [dostęp 2018-11-05]. [zarchiwizowane z tego adresu (2022-12-03)]. (pol.).
- ↑ M. Gumpenberger, Edita Jeklova, Misa Skoric, Karel Hauptman i inni. Impact of a high-phosphorous diet on the sonographic and CT appearance of kidneys in degus, and possible concurrence with dental problems. „Veterinary Record”. 170, s. 1–4, 2014. DOI: 10.1136/vr.100257. (ang.).
- ↑ a b Vladimir Jekl, Lenka Krejcirova, Marcela Buchtova, Zdenek Knotek. Effect of high phosphorus diet on tooth microstructure of rodent incisors. „Bone”. 49, s. 479–484, 2011. Elsevier. DOI: 10.1016/j.bone.2011.04.021. ISSN 8756-3282. (ang.).
- ↑ a b R. Homan, J. C. Hanselman, S. Bak-Mueller, M. Washburn i inni. Atherosclerosis in Octodon degus (degu) as a model for human disease. „Atherosclerosis”. 212 (1), s. 48–54, 2010. DOI: 10.1016/j.atherosclerosis.2010.06.004. PMID: 20630529. (ang.).
- ↑ Vladimir Jekl, M. Gumpenberger, Edita Jeklova, K. Hauptman i inni. Impact of pelleted diets with different mineral compositions on the crown size of mandibular cheek teeth and mandibular relative density in degus (Octodon degus). „Veterinary Record”. 168 (24), 2011. DOI: 10.1136/vr.d2012. ISSN 0042-4900. PMID: 21672952. (ang.).
- ↑ a b Noriko Kumazawa-Manita, Mariko Katayama, Tsutomu Hashikawa, Atsushi Iriki. Three-dimensional reconstruction of brain structures of the rodent Octodon degus: a brain atlas constructed by combining histological and magnetic resonance images. „Experimental Brain Research”. 231 (1), s. 65–74, 2013. Springer-Verlag. DOI: 10.1007/s00221-013-3667-1. ISSN 1432-1106. (ang.).
- ↑ Katharina Braun, E. Lange, M. Metzger, G. Poeggel. Maternal separation followed by early social deprivation affects the development of monoaminergic fiber systems in the medial prefrontal cortex of Octodon degus. „Neuroscience”. 95 (1), s. 309–318, 1999. Elsevier. DOI: 10.1016/s0306-4522(99)00420-0. ISSN 0306-4522. PMID: 10619487. (ang.).
- ↑ a b Nibaldo C. Inestrosa, Ariel E. Reyes, Marcelo A. Chacon, Waldo Cerpa i inni. Human-like rodent amyloid-beta-peptide determines Alzheimer pathology in aged wild-type Octodon degus. „Neurobiology of Aging”. 26 (7), s. 1023–1028, 2004. Elsevier. DOI: 10.1016/j.neurobiolaging.2004.09.016. ISSN 0197-4580. (ang.).
- ↑ Valentina Colonnello, Paolo Iacobucci, Thomas Fuchs, Ruth C. Newberry i inni. Octodon degus . A useful animal model for social-affective neuroscience research: Basic description of separation distress, social attachments and play. „Neuroscience and Biobehavioral Reviews”. 35, s. 1854–1863, 2011. Elsevier. DOI: 10.1016/j.neubiorev.2011.03.014. ISSN 0149-7634. (ang.).
- ↑ Rafael Castro-Fuentes, Rosario Socas-Pérez. Octodon Degus: A Strong Attractor for Alzheimer Research. „Basic and Clinical Neuroscience”. 4 (1), s. 91–97, 2013. ISSN 2008-126x. (ang.).
- ↑ Daniel L. Hummer, Tammy J. Jechura, Megan M. Mahoney, Theresa M. Lee. Gonadal hormone effects on entrained and free-running circadian activity rhythms in the developing diurnal rodent Octodon degus. „American Journal of Physiology – Regulatory, Integrative and Comparative Physiology”. 292, s. 586–597, 2007. American Physiological Society. DOI: 10.1152/ajpregu.00043.2006. ISSN 1522-1563. (ang.).
- ↑ California Code of Regulations,Title 14, Section 671: Illegal pets in California. California Department of Fish and Wildlife. [dostęp 2017-08-27]. (ang.).
- ↑ Georgia Wildlife Resources Division: Wild Animals / Exotics. Georgia Department of Natural Resources. [dostęp 2017-08-27]. (ang.).
- ↑ Terri Ann Swallow: Where are Degus Legal / Illegal in the United States. degucage.com. [dostęp 2014-08-31]. (ang.).
- ↑ Arturo Cortes, Carlos Pino, Mario Rosenmann. Balance hídrico del ensamble de micromamíferos de dos localidades de la región mediterránea árida del norte de Chile central: un estudio de campo. „Revista Chilena de Historia Natural”. 67, s. 65–77, 1994. (hiszp.).




