Tellur
| antymon ← tellur → jod | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| srebrzystoszary | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Widmo emisyjne telluru | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. |
tellur, Te, 52 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia |
−II, −I, IV, VI[3] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości tlenków | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan skupienia |
stały | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gęstość |
6240 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia |
449,51 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia |
988 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Tellur (Te, łac. tellurium) – pierwiastek chemiczny, tlenowiec z grupy półmetali w układzie okresowym. Nazwa pochodzi od łacińskiej nazwy Ziemi – tellus.
Charakterystyka[edytuj | edytuj kod]
Tellur w postaci krystalicznej jest srebrzystobiały, miękki i kruchy[5] (handlowo dostępny jest w postaci szarego proszku[6]). Jest półprzewodnikiem[5]. Reaguje ze stężonym kwasem azotowym, tworząc kwas tellurawy (H
2TeO
3), w reakcji telluru z wodą królewską powstaje kwas tellurowy (H
2TeO
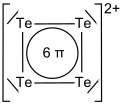
4). Ze stężonym gorącym kwasem siarkowym tellur reaguje, tworząc roztwór o barwie czerwonej, zawierający kationy tetratellurowe Te2+
4. Zabarwienie wynika z obecności 6 zdelokalizowanych elektronów π w płaskiej, kwadratowej strukturze kationów tetratellurowych. Kationy te pod wpływem wody hydrolizują z wydzieleniem czarnego osadu telluru.
Tworzy tellurki M
2Te, telluryny M
2TeO
3 i tellurany M
2TeO
4 (gdzie M – kation metalu jednowartościowego). Tellurowodór H
2Te jest nietrwałym, trującym gazem, o nieprzyjemnym zapachu. Pył i pary telluru działają szkodliwie przy ich wdychaniu, drażnią także oczy.
Występowanie[edytuj | edytuj kod]
W skorupie ziemskiej występuje on w ilości 0,005 ppm. Minerałem tego pierwiastka jest np. telluryt (TeO
2).
Odkrycie[edytuj | edytuj kod]
Związki zawierające tellur zostały odkryte w 1782 w kopalni złota w dawnej Kleinschlatten (Transylwania), a obecnie w Zlatnej (Rumunia) przez austriackiego mineraloga Franza-Josepha Müllera von Reichensteina[7][8], nazwany przez Martina Heinricha Klaprotha[7] w 1798.
Zastosowanie[edytuj | edytuj kod]
Tellur używany jest przede wszystkim jako składnik stopów z żelazem, miedzią i ołowiem. Dodatek telluru powoduje, że stop jest łatwiejszy do obróbki. Jest również używany do produkcji półprzewodników, a także w procesie wulkanizacji[9] gumy i jako przeciwstukowy składnik benzyn[9]. Tellurek kadmu używany do produkcji paneli fotowoltaicznych[10], a niektóre związki wykorzystywane są do środków owadobójczych[9].
Uwagi[edytuj | edytuj kod]
- ↑ Znane są próbki geologiczne, w których pierwiastek ten ma skład izotopowy odbiegający od występującego w większości źródeł naturalnych. Masa atomowa pierwiastka w tych próbkach może więc różnić się od podanej w stopniu większym niż wskazana niepewność (patrz:
 Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
Przypisy[edytuj | edytuj kod]
- ↑ a b David R. Lide (red.), CRC Handbook of Chemistry and Physics, wyd. 90, Boca Raton: CRC Press, 2009, s. 4-36, ISBN 978-1-4200-9084-0 (ang.).
- ↑ Tellurium (nr 264865) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-10-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ N.N. Greenwood, A. Earnshaw: Chemistry of the elements. Oxford; New York: Pergamon Press, 1984, s. 893. ISBN 0-08-022057-6.
- ↑ Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.).
- ↑ a b tellur, [w:] Encyklopedia techniki. Chemia, Władysław Gajewski (red.), Warszawa: Wydawnictwa Naukowo-Techniczne, 1965, s. 701, OCLC 33835352.
- ↑ Tellurium (nr 264865) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2011-10-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b tellur, [w:] Encyklopedia PWN [dostęp 2021-03-04].
- ↑ Ignacy Eichstaedt: Księga pierwiastków. Warszawa: Wiedza Powszechna, 1973, s. 317. OCLC 839118859.
- ↑ a b c Tellur i polon – Principles of Chemistry [online], www.malecki.chemia.us.edu.pl [dostęp 2021-03-04].
- ↑ M. Sibiński, Polycrystalline solar cells based on CdTe, „Zeszyty Naukowe. Elektryka / Politechnika Łódzka”, z. 115, 2008, s. 111–116, ISSN 0374-4817 [dostęp 2021-03-04] (ang.).
Bibliografia[edytuj | edytuj kod]
- Jerzy Minczewski, Zygmunt Marczenko: Chemia analityczna. T. 1: Podstawy teoretyczne i analiza jakościowa. Warszawa: Wydawnictwo Naukowe PWN, 2001. ISBN 83-01-13499-2.
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||


