Ołów
| tal ← ołów → bizmut | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Wygląd | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| niebieskawoszary | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Widmo emisyjne ołowiu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nazwa, symbol, l.a. |
ołów, Pb, 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Grupa, okres, blok | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stopień utlenienia |
II, IV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości metaliczne | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Właściwości tlenków |
średnio zasadowe | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atomowa | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Stan skupienia |
stały | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gęstość |
11340 kg/m³ | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura topnienia |
327,5 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Temperatura wrzenia |
1749 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą warunków normalnych (0 °C, 1013,25 hPa) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Ołów (Pb, łac. plumbum) – pierwiastek chemiczny o liczbie atomowej 82. Należy do metali ciężkich, jest miękki i kowalny, ma też względnie niską temperaturę topnienia. Świeżo cięty jest białawo-niebieski, na powietrzu matowieje do matowej szarości. Ma najwyższą liczbę atomową ze wszystkich stabilnych pierwiastków, kończy trzy szeregi rozpadu cięższych pierwiastków promieniotwórczych.
Jest względnie niereaktywnym metalem grup głównych. Jego słaby metaliczny charakter ilustrują właściwości amfoteryczne; ołów i tlenki ołowiu reagują z kwasami i zasadami, ma on tendencję do tworzenia wiązań kowalencyjnych. Związki chemiczne zazwyczaj zawierają ołów na stopniu utlenienia raczej +2 niżeli +4, częstszym u lżejszych przedstawicieli węglowców. Wyjątki ograniczają się głównie do związków organicznych. Może tworzyć łańcuchy, pierścienie i struktury wielościenne.
Ołów łatwo otrzymać z rudy, wiedziano o tym już w prehistorycznej Azji Zachodniej. Główna ruda ołowiu, galena, często zawiera srebro, zainteresowanie którym pomogło zapoczątkować szeroko rozpowszechnione wydobycie i użytkowanie ołowiu w Starożytnym Rzymie. Produkcja ołowiu spadła po upadku Cesarstwa, nie osiągając porównywalnych poziomów aż do rewolucji przemysłowej. W 2014 globalna roczna produkcja wyniosła około 10 milionów ton, z czego ponad połowa pochodziła z recyklingu. Wysoka gęstość ołowiu, niska temperatura topnienia, przewodność i względnie mała podatność na utlenianie stanowią o jego użyteczności. Cechy te, w połączeniu z jego względną obfitością i niskimi kosztami, skutkowały jego powszechnym użyciem w budowlach, hydraulice, bateriach, nabojach i śrucie, wagach, lutownictwie, pewterze i innych stopach, białych farbach, benzynie i osłonach przed promieniowaniem.
Pod koniec XIX wieku odkryto zatrucie ołowiem. Od tego czasu użycie ołowiu wycofano z wielu zastosowań. Ołów jest neurotoksyną, akumuluje się w tkankach miękkich i kościach, uszkadza układ nerwowy i krew. Szczególnie szkodzi dzieciom: nawet w przypadku znormalizowanego w wyniku leczenia stężenia we krwi może dojść do trwałego uszkodzenia mózgu.
Właściwości fizyczne[edytuj | edytuj kod]
Atomowe[edytuj | edytuj kod]
Atom ołowiu liczy 82 elektrony o konfiguracji [Xe]4f145d106s26p2. Połączone pierwsza i druga energia jonizacji – całkowita energia potrzebna do usunięcia dwóch elektronów z orbitalu 6p – leży blisko analogicznej wartości dla cyny, węglowca leżącego w układzie okresowym pierwiastków nad ołowiem. Nie jest to częste zjawisko, zazwyczaj energia jonizacji spada wraz ze schodzeniem w dół danej grupy, kiedy to zewnętrzne elektrony kolejnych pierwiastków leżą coraz dalej od jądra atomowego i są coraz bardziej ekranowane przez bliższe orbitale. Podobieństwo energii jonizacji spowodowane jest kontrakcją lantanowców – spadkiem promienia atomu od lantanu (o liczbie atomowej 57) do lutetu (71) – i względnie małymi promieniami pierwiastków po hafnie (72). Wynika to ze słabego ekranowania jądra przez elektrony 4f lantanowców. Dodane pierwsze cztery energie jonizacji ołowiu przekraczają rzeczoną wartość dla cyny[4], co stoi w sprzeczności do przewidywań na podstawie układu okresowego. Do tego efektu przyczyniają się efekty relatywistyczne, odgrywające znaczniejszą rolę w cięższych pierwiastkach. Około 10% kontrakcji lantanowców przypisano takim właśnie efektom[5]. Należy do nich inert pair effect: elektrony 6s ołowiu niechętnie tworzą wiązania chemiczne, co czyni odległości pomiędzy najbliższymi sobie atomami w sieci krystalicznej niezwykle długimi[6].
Lżejsi od ołowiu członkowie jego grupy tworzą stabilne bądź metastabilne odmiany alotropowe o tetraedrycznej powiązanej kowalencyjnie strukturze przestrzennej diamentu. Poziomy energetyczne ich zewnętrznych orbitali s i p leżą wystarczająco blisko, by umożliwić hybrydyzację do orbitali sp³. W przypadku ołowiu inert pair effect zwiększa rozdział między orbitalami s i p. Przerwa między nimi nie może zostać przezwyciężona przez energię, która wydzieli się przez tworzenie dodatkowych wiązań dzięki hybrydyzacji[7]. Raczej niż przestrzenna struktura diamentu, w ołowiu wytwarzają się wiązania metaliczne, w których jedynie zdelokalizowane elektrony p są dzielone między jonami Pb2+. W efekcie ołów przyjmuje układ regularny, jak podobnej wielkości atomy dwuwartościowych metali wapń czy stront[8]. Tetraedryczna forma alotropowa cyny zwie się cyną α lub szarą i jest stabilna jedynie w temperaturze ≤ 13,2 °C. Powyżej tej wartości stabilną jest forma β, biała cyna o zniekształconej strukturze układu regularnego, którą można wyprowadzić poprzez zgniecenie czworościanu cyny szarej wzdłuż osi sześciennych. Cyna biała ma efektywnie strukturę pośrednią między tetraedryczną strukturą cyny szarej i regularną strukturą ołowiu, zgodnie z ogólnym trendem zwiększania się własności metalicznych w dół grupy[9]. Kwazikrystaliczna cienkowarstwowa forma alotropowa ołowiu o symetrii pentagonalnej odkryta została w 2013. Uzyskano ją przez odkładanie atomów ołowiu na powierzchni ikozaedrycznego kwazikryształu srebra, indu i iterbu. Nie odnotowano przewodnictwa tej postaci[10][11].
Makroskopowe[edytuj | edytuj kod]
Czysty ołów jest jasno-srebrny z nutą niebieskiego[12]. W kontakcie z wilgotnym powietrzem matowieje, przyjmując matową barwę o odcieniu zależnym od warunków. Charakterystyczne cechy ołowiu obejmują wysoką gęstość, kowalność i małą podatność na korozję z powodu pasywacji[13].

Ciasno upakowana regularna struktura i wysoka masa atomowa stanowią o gęstości ołowiu[14] wynoszącej 11,34 g/cm³, przekraczającej gęstość popularnych metali, takich jak żelazo (7,87 g/cm³), miedź (8,93 g/cm³) i cynk (7,14 g/cm³)[15]. Gęstość ta stała się źródłem anglojęzycznego idiomu to go over like a lead balloon[16][17], w wersji brytyjskiej to go down like a lead balloon (iść w dół jak ołowiany balon). Gęstsze są niektóre rzadsze metale: wolfram i złoto osiągają 19,3 g/cm³, a osm – najgęstszy z metali o znanej gęstości – 22,59 g/cm³, prawie 2 razy tyle, co ołów[18].
Jest to miękki metal, któremu przypisuje się twardość w skali Mohsa 1,5. Można zarysować go paznokciem[19]. Jest dość kowalny i nieco elastyczny[20] (kowalność oznacza łatwość deformacji przy ściskaniu, elastyczność natomiast przy rozciąganiu). Współczynnik sprężystości objętościowej, miara łatwości kompresji, wynosi dla ołowiu 45,8 GPa. Dla porównania dla glinu jest on równy 75,2 GPa, dla miedzi 137,8 GPa, a dla stali niskowęglowej 160–169 GPa[21]. Wytrzymałość na rozciąganie przy 12–17 MPa jest niska (sześciokrotnie mniejsza od aluminiowej, dziesięciokrotnie od miedziowej, a 15 razy od wytrzymałości stali niskowęglowej). Można go wzmocnić, dodając niewielką ilość miedzi bądź antymonu[22].
Temperatura topnienia ołowiu wynosi 327,5 °C[1], co w porównaniu z wieloma innymi metalami czyni ją wielce niską[14]. Mokry palec wkładano do roztopionego ołowiu bez oparzenia[23]. Temperatura wrzenia wartości 1749 °C[1] jest najniższa wśród węglowców. Oporność elektryczna w 20 °C to 192 nanoomometr, prawie rząd wielkości więcej, iż u innych metali przemysłowych (miedź ma 15,43 nΩm; złoto 20,51 nΩm, a glin 24,15 nΩm)[24]. Ołów zyskuje zdolności nadprzewodnika w temperaturach niższych od 7,19 K[25], jest to najwyższa temperatura krytyczna wszystkich nadprzewodników typu I i trzecia wśród nadprzewodników pierwiastkowych[26].
Izotopy[edytuj | edytuj kod]
Naturalny ołów składa się z czterech stabilnych izotopów o liczbach masowych 204, 206, 207 i 208[27] oraz śladowych ilości pięciu izotopów o krótkim okresie półtrwania[28]. Wysoka liczba izotopów zgadza się z parzystą liczbą atomową ołowiu (parzysta liczba protonów lub neutronów zwiększa stabilność jądra, żaden pierwiastek o nieparzystej liczbie atomowej nie posiada więcej niż dwóch stabilnych izotopów, te o parzystych liczbach mają zaś wiele stabilnych izotopów, np. cyna o liczbie atomowej 50 posiada ich najwięcej, aż 10[27]). Ołów ma magiczną liczbę protonów (82), dla której model powłokowy jądra atomowego trafnie przewiduje szczególną stabilność jądra. Izotop 208 ma 126 neutronów, co może wyjaśniać, czemu jest niezwykle stabilny[29].
Ze swą wysoką liczbą atomową, ołów jest najcięższym pierwiastkiem, którego naturalne izotopy uznaje się za stabilne. Izotop 208 ma najcięższe stabilne jądro. Tytuł ten poprzednio przysługiwał bizmutowi o liczbie atomowej 83, nim wykryto powolny rozpad jego jedynego uznawanego za stabilny izotopu 209 w 2003. Określony eksperymentalnie okres połowicznego zaniku wyniósł 1,9×1019 lat[30]. Kilogram naturalnego bizmutu miałby więc aktywność szacunkowo 0,003 bekereli (rozpadów na s), podczas gdy aktywność naturalnego promieniowania w ciele ludzkim wynosi około 65 Bq/kg[31]. 4 stabilne izotopy ołowiu mogą teoretycznie przechodzić rozpad alfa do izotopów rtęci z uwolnieniem energii, jednak dotychczas przemian takich nie zaobserwowano. Przewidywane okresy półtrwania mieszczą się w zakresie od 1035 do 10189 lat[32].
Trzy ze stabilnych izotopów leżą w trzech z czterech głównych łańcuchach rozpadów promieniotwórczych: 206, 207 i 208 są izotopami kończącymi rozpad uranu 238, uranu 235 i toru 232. Łańcuchy te nazywa się serią uranową, aktynową i torową. Stężenie izotopów w skałach naturalnych zależy w dużym stopniu od obecności wspomnianych izotopów uranu i toru. Przykładowo względna obfitość ołowiu 208 może sięgać od 52% w zwykłych próbkach do 90% w rudach toru[33]. Z tej przyczyny standardowa masa atomowa ołowiu podawana jest z tylko jednym miejscem po przecinku[34]. Z biegiem czasu iloczyn ilości izotopów 206 i 207 w stosunku do 204 narasta, jako że dwa pierwsze są uzupełniane przez rozpad radioaktywny cięższych pierwiastków, w przeciwieństwie do ołowiu 204. Pozwala to na datowanie metodą ołów-ołów. Gdy uran rozpada się do ołowiu, względna ilość tego ostatniego rośnie. Stanowi to z kolei podstawę metody datowania uran-ołów[35].

Poza stabilnymi izotopami, z których składa się prawie cały występujący naturalnie ołów, istnieją również śladowe ilości kilku izotopów promieniotwórczych. Należy do nich ołów 210; chociaż jego okres półtrwania wynosi jedynie 22,3 roku[27], niewielkie jego ilości występują w naturze, gdyż powstaje on w długiej serii rozpadów rozpoczynającej się uranem 238, obecnym na Ziemi od miliardów lat. Izotopy 211, 212 i 214 obecne są w łańcuchach odpowiednio rozpadu uranu 235, toru 232 i uranu 238, wobec czego śladowe ilości wszystkich trzech występują naturalnie. Niewielkie ślady ołowiu 209 powstają z bardzo rzadkiego rozpadu klasterowego radu 223, którego jednym z produktów jest naturalny uran 235. Ołów 210 jest szczególnie użyteczny w identyfikacji wieku próbek poprzez pomiar jego stosunku do ołowiu 206 (oba izotopy występują w jednym łańcuchu rozpadu)[36].
W sumie zsyntetyzowano 43 izotopy ołowiu o liczbach masowych 178–220[27]. Najstabilniejszym z nich jest ołów 205 o okresie połowicznego rozpadu 15 milionów lat. Rozpada się on wyłącznie przez wychwyt elektronu, co oznacza, że kiedy nie ma dostępnych żadnych elektronów i atom jest w pełni zjonizowany (jądro bez żadnego z 82 elektronów), nie może się rozpaść. W pełni zjonizowany tal 205, do którego rozpada się ołów 205, nie jest stabilny i może rozpadać się dalej do ołowiu 205[37]. Drugi najbardziej stabilny jest ołów 202 o czasie połowicznego zaniku 53000 lat, a więc dłuższym, niż ma którykolwiek z naturalnych śladowych radioizotopów[27].
Chemia[edytuj | edytuj kod]

Bryła ołowiu wystawiona na działanie wilgotnego powietrza wytwarza ochronną warstwę zewnętrzną o zmiennym składzie. Często należy doń węglan ołowiu(II)[38][39][40], siarczan ołowiu(II) i chlorek ołowiu(II) również mogą się wytworzyć w miastach nad morzem[41]. Warstwa ta czyni ołów chemicznie niereaktywnym w stosunku do powietrza[41]. Sproszkowany na drobno, jak wiele metali, jest piroforyczny[42] – spala się niebieskawobiałym płomieniem[43].
Fluor reaguje z ołowiem w temperaturze pokojowej, tworząc fluorek ołowiu(II). Podobna jest reakcja z chlorem, ale wymaga podgrzewania, gdyż powstająca warstwa chlorku zmniejsza reaktywność[41]. Stopiony ołów reaguje z tlenowcami, dając związki ołowiu na II stopniu utlenienia[44].
Metaliczny ołów jest oporny na działanie kwasów siarkowego i fosforowego, ale nie chlorowodorowego i azotowego. Wynik zależy od nierozpuszczalności i następującej pasywacji powstającej soli[45]. Kwasy organiczne, jak kwas octowy, roztwarzają ołów w obecności tlenu[41]. Stężone zasady roztwarzają ołów z wytworzeniem ołowianów[46].
Związki nieorganiczne[edytuj | edytuj kod]
Ołów występuje na dwóch głównych stopniach utlenienia: +4 i +2. Czterowartościościowość jest częsta u węglowców. Dwuwartościowość występuje rzadko w przypadku węgla i krzemu, mniej istotna od czterowartościowości w germanie, ważna (choć nie przeważająca) w cynie i najważniejsza dla ołowiu[41]. Przypisuje się to efektom relatywistycznym, zwłaszcza inert pair effect, który manifestuje się w przypadku dużej różnicy elektroujemnośći między ołowiem a anionami tlenkowymi, halogenkowymi czy azotkowymi, prowadząc do zgromadzenia się znacznego cząstkowego dodatniego ładunku elektrycznego na ołowiu. W rezultacie dochodzi do silniejszej kontrakcji orbitalu 6s niż 6p, co czyni go niereaktywnym w związkach jonowych. W mniejszym stopniu stosuje się to do związków, w których ołów tworzy wiązanie kowalencyjne z pierwiastkiem o podobnej elektroujemności, takim jak węgiel w związkach ołowioorganicznych, w tych ostatnich orbitale 6s i 6p przyjmują podobny rozmiar i hybrydyzacja sp³ jest ciągle opłacalna energetycznie. W takich związkach ołów, na wzór węgla, jest przeważnie czterowartościowy[47].
Istnieje względnie duża różnica w elektroujemności ołowiu (II): 1,87 i ołowiu (IV): 2,33. Różnica oznacza odwrócenie trendu zwiększania stabilności stopnia utlenienia +4 w dół grupy węglowców. Dla porównania cyna ma wartość 1,80 na +2 i 1,96 na +4[48].

ołowiu(II)[edytuj | edytuj kod]
Związki ołowiu(II) charakterystyczne są dla chemii nieorganicznej tego pierwiastka. Nawet silne utleniacze jak fluor czy chlor reagują z ołowiem z wytworzeniem jedynie PbF2 i PbCl2[41]. Jony ołowiu(II) są zwykle bezbarwne w roztworach[49] i częściowo hydrolizują do Pb(OH)+ i w końcu Pb4(OH)4 (w którym aniony hydroksylowe działają jako ligandy mostkujące)[50][51], ale nie są reduktorami jak kationy cyny (II). Techniki identyfikacji obecności kationów Pb2+ w wodzie ogólnie polegają na ich wytrąceniu w postaci chlorku ołowiu (II) z wykorzystaniem rozcieńczonego kwasu solnego. Jako że chlorek ołowiu(II) jest jako tako rozpuszczalny w wodzie, następnie stosowana jest precypitacja siarczku ołowiu(II) przez przepuszczenie siarkowodoru przez roztwór[52].
Tlenek ołowiu(II) występuje w dwóch formach, czerwonej α-PbO i żółtej β-PbO, ta ostatnia jest stabilna tylko powyżej około 488 °C. Jest to najczęściej używany związek ołowiu[53]. Wodorotlenek ołowiu(II) występuje tylko w roztworze, tworzy aniony ołowianowe[54]. Ołów powszechnie reaguje z cięższymi tlenowcami. Siarczek ołowiu to półprzewodnik, fotoprzewodnik i niezwykle czuły wykrywacz promieniowania podczerwonego. Selenek ołowiu i tellurek ołowiu podobnie są fotoprzewodnikami. Niezwykłe jest to, że ich kolor rozjaśnia się w dół grupy[55].

Halogenki ołowiu są dobrze opisane. Zaliczają się doń dwuastatek[56] i halogenki mieszane, jak PbFCl. Względna nierozpuszczalność tych ostatnich tworzy użyteczną podstawę grawimetrycznego wykrywania fluoru. Difluorek był pierwszym odkrytym stałym jonowym związkiem przewodzącym, odkrył go w 1834 Michael Faraday[57]. Inne dwuhalogenki rozkładają się pod działaniem ultrafioletu bądź światła widzialnego – zwłaszcza jodek ołowiu (II)[58]. Znanych jest wiele pseudohalogenków[55]. Istnieje znaczna różnorodność halogenowych związków kompleksowych ołowiu(II), jak [PbCl4]2−, [PbCl6]4− i łańcuchowy anion [Pb2Cl9]n5n−[58].
Siarczan ołowiu(II) nie rozpuszcza się w wodzie, podobnie jak siarczany innych ciężkich kationów dwuwartościowych. Azotan ołowiu(II) i octan ołowiu(II) są dobrze rozpuszczane, co wykorzystano w syntezie innych związków ołowiu[59].
ołowiu(IV)[edytuj | edytuj kod]
Znanych jest kilka nieorganicznych związków ołowiu na IV stopniu utlenienia, istnieją one jedynie w silnie kwaśnych roztworach[60]. Utleniany dalej tlenek ołowiu(II) przechodzi w tlenek mieszany, Pb3O4 określany jako tlenek ołowiu (II, IV), bądź zapisywany wzorem 2PbO·PbO2. Jest to najlepiej poznany związek ołowiu o mieszanej wartościowości. Dwutlenek ołowiu ma silne właściwości utleniające, potrafi utlenić kwas solny do gazowego chloru. Dzieje się tak, ponieważ oczekiwany produkt reakcji PbCl4 jest niestabilny i spontanicznie rozpada się do PbCl2 i Cl2. Analogicznie do PbO dwutlenek ołowiu zdolny jest do przechodzenia w aniony ołowianowe. Siarczek ołowiu(IV)[61] i jego selenek[62] stanowią związki stabilne jedynie przy wysokich ciśnieniach. Tetrafluorek ołowiu to żółty krystaliczny proszek, stabilny, aczkolwiek mniej od dwufluorku (fluorku ołowiu (II)). Chlorek ołowiu(IV), żółta ciecz, rozkłada się w temperaturze pokojowej. Bromek ołowiu(IV) jest jeszcze mniej stabilny, a istnienie tetrajodku ołowiu w ogóle podlega dyskusji[63].

Inne stopnie utlenienia[edytuj | edytuj kod]
W niektórych związkach ołów występuje w formalnym stopniu utlenienia innym niż +4 lub +2. Ołów(III) uzyskać można w stanie przejściowym pomiędzy stopniami II i IV, w dużych kompleksach organicznych. Ten stopień utlenienia nie jest stabilny, zarówno jeśli idzie o jon ołowiu(III), jak i duże kompleksy zawierające go są rodnikami[65][66][67]. To samo stosuje się do ołowiu(I)[68].
Znane są liczne mieszane tlenki ołowiu(II,IV). Kiedy podgrzewa się PbO2 w powietrzu, przechodzi on w Pb12O19 w 293 °C, w Pb12O17 w 351 °C, w Pb3O4 w 374 °C i w końcu w PbO w 605 °C. Dalszy Pb2O3 można otrzymać w wysokim ciśnieniu, wraz z kilkoma innymi fazami niestechiometrycznymi. Wiele z nich wykazuje ułomne struktury fluorytu, z których pewne atomy tlenu usunięto: PbO można uznać za taką strukturę, w której każda alternatywna warstwa atomów tlenu została usunięta[69].
Ujemne stopnie utleniania występować mogą w fazach Zintla, jako wolne aniony ołowiu, jak w Ba2Pb, gdzie ołowiowi przypisuje się formalny stopień utlenienia −IV[70], lub w tlenoczułych pierścieniowatych bądź wielościennych jonach klasterowych, jak podwójna piramida Pb52−, gdzie 2 atomy ołowiu są na stopniu utlenienia −I i 3 na 0[71]. W takich anionach każdy atom leży w wierzchołku wielościanu i bierze udział dwoma elektronami w każdym wiązaniu kowalencyjnym wzdłuż brzegu z ich orbitali sp³, inne 2 tworzą zewnętrzną wolną parę[50]. Można otrzymać je w ciekłym amoniaku poprzez redukcję ołowiu sodem[72].
węgiel
wodór
ołów
Związki organiczne[edytuj | edytuj kod]
Ołów może tworzyć łańcuchy, którą to własność dzieli ze swym homologiem węglem. Jednakże jest ona u ołowiu wyrażona znacznie słabiej, bowiem wiązanie cechuje się energią ponad trzyipółkrotnie mniejszą niż C–C[44]. Atomy ołowiu mogą tworzyć ze sobą wiązania, budując łańcuchy do trzech atomów[73]. Ołów tworzy też związki ołowioorganiczne z węglem, podobne do typowych związków organicznych, ale ogólnie mniej stabilne[74] z uwagi na słabość wiązania Pb–C[50]. Czyni to chemię organiczną ołowiu znacznie mniej szeroką niż w przypadku cyny[75]. Przeważają organiczne związki ołowiu (IV), nawet przy wyjściu z nieorganicznych związków ołowiu (II). Znanych jest bardzo niewiele organicznych związków ołowiu (II). Najlepiej opisanym wyjątkiem są Pb[CH(SiMe3)2]2 czy też Pb(η5-C5H5)2[75].
Ołowiowym analogiem najprostszego związku organicznego, metanu, jest plumban. Można go otrzymać w reakcji pomiędzy metalicznym ołowiem i wodorem atomowym[76]. Dwie proste pochodne, tetrametyloołów i tetraetyloołów, to najbardziej znaczne związki ołowioorganiczne. Są one względnie stabilne: tetraetyloołów zaczyna rozpadać się dopiero po podgrzaniu[77] bądź ekspozycji na światło słoneczne bądź UV[78]. Tetrafenyloołów jest nawet stabilniejszy termicznie, rozpadając się w 270 °C[75]. Z sodem ołów łatwo tworzy równomolowy stop reagujący z hologenkami alkilowymi z wytworzeniem związków metaloorganicznych, jak tetraetyloołów[79]. Zdolność do utleniania wielu organicznych związków ołowiu jest pożytecznie wykorzystywana. Octan ołowiu(IV) to ważny laboratoryjny utleniacz w chemii organicznej[80]. Tetraetyloołów niegdyś produkowano w większej ilości niż inne związki ołowioorganiczne[75]. Inne organiczne związki ołowiu są mniej stabilne[74]. W przypadku wielu związków organicznych ich ołowiowy analog w ogóle nie istnieje[76].
Pochodzenie i występowanie[edytuj | edytuj kod]
| Liczba atomowa | Pierwiastek | Względna ilość |
|---|---|---|
| 42 | Molibden | 0,798 |
| 46 | Pallad | 0,440 |
| 50 | Cyna | 1,146 |
| 78 | Platyna | 0,417 |
| 80 | Rtęć | 0,127 |
| 82 | Ołów | 1 |
| 90 | Tor | 0,011 |
| 92 | Uran | 0,003 |
W kosmosie[edytuj | edytuj kod]
Ołów w Układzie Słonecznym występuje w ilości cząsteczek 0,121 ppb[81] (względem krzemu 3,258). Jest to dwa i pół raza więcej od platyny, 8 razy więcej od rtęci i 17 razy więcej od złota[81]. Obfitość ołowiu we Wszechświecie powoli rośnie[82], ponieważ cięższe pierwiastki (które wszystkie są niestabilne) stopniowo rozpadają się do ołowiu[83]. Obfitość ołowiu w Układzie Słonecznym od jego powstania 4,5 miliarda lat temu wzrosła o około 0,75%[84]. W Układzie Słonecznym ołów – pomimo względnie dużej liczby atomowej – jest powszechniejszy, niż większość pierwiastków o liczbie atomowej przekraczającej 40[81].
Pierwotny ołów, zawierający izotopy 204, 206, 207 i 208, powstał w większości w efekcie powtarzanych procesów wychwytu neutronu zachodzących w gwiazdach. Dwa główne sposoby wychwytu zwane są procesami s i r[85].
W procesie s (od angielskiego slow, „wolny”) kolejne wychwyty rozdzielają lata i dekady, co pozwala mniej stabilnym jądrom atomowym na rozpad beta. Stabilne jądro talu-203 może wychwycić neutron, stając się talem-204. Przechodzi on rozpad β, stając się stabilnym ołowiem-204. Wychwytując kolejny neutron, przechodzi znowuż w ołów-205 o czasie połowicznego zaniku 15 milionów lat. Dalsze wychwyty prowadzą do izotopów ołowiu 206, 207 i 208. Łapiąc kolejny neutron, ołów 208 przechodzi w 209, który szybko rozpada się do bizmutu-209. Łapiąc znów neutron, bizmut-209 staje się bizmutem-210, który β-rozpada się do polonu-210, przechodzącego z kolei rozpad alfa do ołowiu-206. W taki sposób cykl kończy się ołowiem 206, 207, 208 i bizmutem 209[86].

W procesie r (r od angielskiego rapid, „szybki”) wychwyt następuje szybciej, niż jądro zdąży się rozpaść. Zjawisko to zachodzi w środowiskach o dużej gęstości neutronów, jak supernowa bądź połączenie się dwóch gwiazd neutronowych. Strumień neutronów uczestniczących w tym procesie może być rzędu 1022 neutronów na cm²s[87]. Proces r nie tworzy tak dużo ołowiu, jak proces s. Ma tendencję do zatrzymywania się, gdy bogate w neutrony jądro osiągnie 126 neutronów. W tym miejscu neutrony całkowicie zapełniają powłoki w jądrze atomowym i zebranie większej ich ilości jest trudniejsze, wymaga większej energii. Kiedy strumień neutronów obniża się, jądra te podlegają rozpadowi β do stabilnych izotopów osmu, irydu i platyny[88].
Na Ziemi[edytuj | edytuj kod]
Ołów klasyfikuje się wśród chalkofili w klasyfikacji Goldschmidta, co oznacza, że ogólnie spotyka się go w połączeniu z siarką[89]. Rzadko występuje jako metal[90]. Wiele minerałów ołowiu jest względnie lekkich i w przebiegu historii Ziemi pozostało w skorupie ziemskiej, nie zatapiając się głębiej we wnętrzu planety. Odpowiada to za względnie dużą obfitość ołowiu w skorupie ziemskiej 14 ppm; co czyni ołów 38 najpospolitszym pierwiastkiem skorupy Ziemi[91] (choć oszacowania te są przybliżone i dokładne wartości liczbowe mogą różnić w zależności od źródła[92]).
Głównym minerałem zawierającym ołów jest galena (PbS), najczęściej spotykana w rudach cynku[93]. Większość innych minerałów ołowiu związanych jest w pewien sposób z galeną. Boulangeryt, Pb5Sb4S11, stanowi mieszany siarczek pochodzący od galeny. Anglezyt, PbSO4, to produkt utleniania galeny. Cerusyt, czyli biel ołowiana, PbCO3, stanowi produkt rozpadu galeny. Częstymi zanieczyszczeniami minerałów ołowiu są arsen, cyna, antymon, srebro, złoto, miedź i bizmut[93].

Zasoby ołowiu szacuje się na ponad 2 miliardy ton. Znaczne pokłady znajdują się w Australii, Chinach, Irlandii, Meksyku, Peru, Portugalii, Federacji Rosyjskiej i USA. Zasoby ekonomicznie możliwe do wydobycia to w sumie 88 milionów ton w 2016, z czego 35 milionów przypada na Australię, 17 milionów na Chiny i 6,4 miliona na Rosję[94].
Zazwyczaj stężenie ołowiu nie przekracza 0,1 μg/m³ w atmosferze, 100 mg/kg w glebie, 5 μg/L w wodzie[95].
Etymologia[edytuj | edytuj kod]
Współczesne angielskie słowo „lead” ma pochodzenie germańskie. Pochodzi od średnioangielskiego leed i staroangielskiego lēad (kreska na e oznacza, że chodzi o samogłoskę długą)[96]. Słowo staroangielskie pochodzi z hipotetycznego zrekonstruowanego pragermańskiego *lauda-[97]. Zgodnie z teorią lingwistyczną słowo to ma swych następców w wielu językach germańskich o dokładnie takim samym znaczeniu[97].
Społeczność językoznawców nie zgadza się co do pochodzenia pragermańskiego *lauda-. Jedna z hipotez wywodzi je od praindoeuropejskiego *lAudh- (kapitalizacja również oznacza samogłoskę długą)[98]. Inna hipoteza sugeruje przejście z praceltyckiego *ɸloud-io-, oba te słowa oznaczają ołów. To ostatnie wiąże się z łacińskim plumbum, od którego pochodzi symbol pierwiastka Pb. *ɸloud-io- uważane jest za pierwowzór pragermańskiego *bliwa- (także znaczącego ołów), od którego bierze się niemieckie Blei[99].
Historia[edytuj | edytuj kod]

Lata wtecz (Years B.P.) = lata przed rokiem 1950[100]
Prehistoria i wczesna historia[edytuj | edytuj kod]
Złoża metalicznego ołowiu znajdywano w Azji Mniejszej od 7000–6500 p.n.e. Może chodzić o pierwszy przykład wytapiania metali[101]. W tamtym czasie ołów miał niewiele zastosowań, jeśli w ogóle takie istniały. Powodem była jego miękkość i matowy wygląd[101]. Główna przyczyna rozprzestrzenienia się produkcji ołowiu leżała w jego powiązaniach ze srebrem, które można otrzymać przez palenie galeny[102]. Starożytni Egipcjanie jako pierwsi wykorzystywali ołów w kosmetykach. Zastosowanie takie rozprzestrzeniło się w Starożytnej Grecji i okolicach[103]. Egipcjanie mogli używać ołowiu do produkcji ciężarków sieci rybnych, glazur, szkła, emalii i zdobień[102]. Różne cywilizacje Żyznego Półksiężyca wykorzystywały ołów jako materiał piszący, środek płatniczy i w budownictwie[102]. W Starożytnych Chinach dwór królewski używał ołowiu jako stymulanta[102], środka płatniczego[104] i antykoncepcyjnego[105]. Cywilizacja Doliny Indusu i mieszkańcy Mezoameryki[102] czynili zeń amulety. Afrykanie ze wschodu i południa kontynentu robili zeń druty (wire drawing)[106].
Antyk[edytuj | edytuj kod]
Ponieważ srebro szeroko używano jako materiału dekoracyjnego i środka wymiennego, pokłady ołowiu zaczęto obrabiać w Azji Mniejszej od 3000 p.n.e. Później działo się na Wyspach Egejskich i w Lawrio. Te 3 regiony kolektywnie zdominowały produkcję wydobywanego z ziemi ołowiu, przed około 1200 p.n.e.[107] Od 2000 p.n.e. Fenicjanie obrabiali pokłady na Półwyspie Iberyjskim. Do 1600 p.n.e. górnictwo ołowiu istniało na Cyprze, w Grecji i na Sardynii[108].
Ekspansja terytorialna Rzymu w Europie i wokół Morza Śródziemnego i rozwój górnictwa doprowadziły Rzym do stania się największym producentem ołowiu czasów klasycznych. Szacuje się roczny wynik na do 80 000 ton. Jak ich poprzednicy, Rzymianie otrzymywali ołów głównie jako produkt uboczny wytopu srebra[100][109]. Górnictwo ołowiu pojawiło się w Europie Środkowej, Brytanii, na Bałkanach, w Grecji, Anatolii i Hiszpanii, w tej ostatniej osiągając 40% światowej produkcji[100].
Ołów wykorzystywano do budowy rur wodnych w Cesarstwie Rzymskim. Łacińskie słowo określające ten metal, plumbum, stał się pierwowzorem anglojęzycznego „plumbing”. Łatwość pracy i niepodatność na korozję[110] umocniły jego szerokie zastosowanie do innych rzeczy, w tym w farmacji, dekarstwie, handlu i sztuce wojennej[111][112][113]. Ówcześni pisarze, jak Kato Starszy, Columella i Pliniusz Starszy, zalecali ołowiane bądź pokryte ołowiem naczynia do sporządzania słodzików i konserwantów dodawanych do wina i żywności. Ołów nadawał się dzięki sympatycznemu smakowi powodowanemu tworzeniem się octanu ołowiu(II), kiedy miedź czy brąz powodowały gorycz, tworząc grynszpan[114].
Rzymski autor Witruwiusz odnotował związane z ołowiem zagrożenia zdrowia[115]. Współcześni autorzy zasugerowali, że zatrucie ołowiem odgrywało istotną rolę w upadku Cesarstwa Rzymskiego[116][117] (fakt, że Gajusz Juliusz Cezar spłodził tylko jedno dziecko, jak też domniemana bezpłodność jego następcy, Oktawiana, przypisywano właśnie zatruciu tym metalem[118]). Inni badacze krytykowali takie poglądy, zwracając uwagę na przykład na to, że nie każdy ból brzucha wywołany jest ołowiem[119][120]. Wedle badań archeologicznych rzymskie ołowiane rury wodne zwiększały stężenie ołowiu w wodzie, jednak efekt ten nie był prawdopodobnie naprawdę groźny[121][122]. Kiedy naprawdę dochodziło do zatrucia ołowiem, ofiary zwano saturninami, ciemnymi i cynicznymi, po diabolicznym ojcu bogów, Saturnie. Dzięki temu skojarzeniu ołów określano ojcem wszystkich metali[123]. Jego status w społeczeństwie rzymskim był niski, gdyż łatwo go było dostać[124] dzięki niskiej cenie[125].

Mylenie z cyną i antymonem[edytuj | edytuj kod]
W czasach klasycznych i później aż do XVII wieku często nie odróżniano cyny od ołowiu. Rzymianie określali ołów słowami plumbum nigrum (dosłownie ołów czarny), cynę zaś plumbum candidum (ołów jasny). Związek między cyną a ołowiem uwidacznia się także w innych językach: czeskie słowo olovo tłumaczy się jako „ołów”, jednak rosyjski wyraz pokrewny олово (olovo) oznacza cynę[126]. Co więcej, bliska relacja wiąże ołów z antymonem. Oba pierwiastki występują pospolicie w formie siarczków (galena i antymonit), często razem. Pliniusz błędnie napisał, że podgrzewany antymonit uwolni ołów miast antymonu[127]. W krajach takich jak Turcja czy Indie pierwotne perskie miano surma może odnosić się do siarczku antymonu lub siarczku ołowiu[128] i w niektórych językach, jak rosyjski, stosuje się je do antymonu (сурьма)[129].
Średniowiecze i odrodzenie[edytuj | edytuj kod]
Po upadku Zachodniego Cesartwa Rzymskiego górnictwo ołowiu upadło w Europie Zachodniej. Jedynym regionem, w którym ostało się znaczące wydobycie, była arabska Al-Andalus[130][131]. Największa produkcja ołowiu odbywała się W Azji Południowej i Wschodniej, zwłaszcza na terenie Chin i w Indiach, gdzie górnictwo ołowiu znacznie wzrosło[131].

W Europie produkcja ołowiu zaczęła ożywiać się w XI i XII wieku, kiedy znowu zaczęto używać tego metalu do produkcji dachów i rur. Począwszy od XIII wieku ołów zaczął być używany do tworzenia barwionego szkła[133]. W europejskiej i arabskiej tradycji alchemicznej ołów (w tej pierwszej o symbolu ![]() )[134] uznawano za metal podstawowy, który, poprzez rozdzielanie, oczyszczanie i równoważenie jego elementarnych esencji, może zostać transmutowany w czyste i nieniszczejące złoto[135]. W tym okresie ołowiu coraz więcej używano jako dodatku do win. Używanie tak doprawionych win w obrządku chrześcijańskim zostało zabronione bullą papieską w 1498, ale pito je dalej, co skutkowało masowymi zatruciami aż do późnego XVIII stulecia[130][136]. Ołów był kluczowym materiałem w częściach maszyny drukarskiej, wynalezionej w 1440; pył ołowiany często inhalowali drukarze, narażając się na zatrucie[137]. Mniej więcej w tym samym czasie wymyślono broń palną i ołów, mimo że droższy od żelaza, stał się głównym surowcem do produkcji kul. W mniejszym stopniu uszkadzał lufy, cechował się większą gęstością (pozwalającą na lepszą retencję prędkości) i niższą temperaturą topnienia, co ułatwiało produkcję, umożliwiając użycie w niej ognia ze spalanego drewna[138]. W formie weneckiej bieli ołowianej ołów był szeroko wykorzystywany w kosmetykach przez arystokrację Europy Zachodniej do wybielania twarzy, jako że wybielone twarze uznawano za oznakę skromności[139][140]. Praktyka ta później rozszerzyła się do białych peruk i kresek do oczu i zamarła w końcu z rewolucją francuską pod koniec XVIII wieku. Podobny zwyczaj funkcjonował w Japonii, pojawiwszy się w XVIII stuleciu z powstaniem gejsz. Praktykę kontynuowano aż do XX wieku. Białe twarze kobiet reprezentować miały kobiecą cnotę Japonek[141], do wybielania znowu służył ołów[142].
)[134] uznawano za metal podstawowy, który, poprzez rozdzielanie, oczyszczanie i równoważenie jego elementarnych esencji, może zostać transmutowany w czyste i nieniszczejące złoto[135]. W tym okresie ołowiu coraz więcej używano jako dodatku do win. Używanie tak doprawionych win w obrządku chrześcijańskim zostało zabronione bullą papieską w 1498, ale pito je dalej, co skutkowało masowymi zatruciami aż do późnego XVIII stulecia[130][136]. Ołów był kluczowym materiałem w częściach maszyny drukarskiej, wynalezionej w 1440; pył ołowiany często inhalowali drukarze, narażając się na zatrucie[137]. Mniej więcej w tym samym czasie wymyślono broń palną i ołów, mimo że droższy od żelaza, stał się głównym surowcem do produkcji kul. W mniejszym stopniu uszkadzał lufy, cechował się większą gęstością (pozwalającą na lepszą retencję prędkości) i niższą temperaturą topnienia, co ułatwiało produkcję, umożliwiając użycie w niej ognia ze spalanego drewna[138]. W formie weneckiej bieli ołowianej ołów był szeroko wykorzystywany w kosmetykach przez arystokrację Europy Zachodniej do wybielania twarzy, jako że wybielone twarze uznawano za oznakę skromności[139][140]. Praktyka ta później rozszerzyła się do białych peruk i kresek do oczu i zamarła w końcu z rewolucją francuską pod koniec XVIII wieku. Podobny zwyczaj funkcjonował w Japonii, pojawiwszy się w XVIII stuleciu z powstaniem gejsz. Praktykę kontynuowano aż do XX wieku. Białe twarze kobiet reprezentować miały kobiecą cnotę Japonek[141], do wybielania znowu służył ołów[142].
Poza Eurazją[edytuj | edytuj kod]
W Nowym Świecie produkowano ołów już niedługo po przybyciu osadników z Europy. Najwcześniejsza odnotowana produkcja ołowiu datuje się na 1621 w angielskiej Kolonii Virginii, 14 lat po jej założeniu[143]. W Australii pierwsza kopalnia, jaką założyli koloniści, wydobywała właśnie ołów. Wydarzyło się to w 1841[144]. W Afryce górnictwo i wytop ołowiu znane były w Benue Trough[145] i w dolnym Basenie Kongo, gdzie ołowiu używano w handlu z Europejczykami jako środek płatniczy do XVII wieku[146].

Rewolucja przemysłowa[edytuj | edytuj kod]
W II połowie XVIII wieku w Brytanii i później w Europie kontynentalnej i USA doszło do rewolucji przemysłowej. Po raz pierwszy produkcja ołowiu przekroczyła osiągniętą w Starożytnym Rzymie[100]. Wiodącym producentem stała się Brytania, tracąc ten status w środku XIX wieku z uszczupleniem kopalń i rozwojem górnictwa ołowiu w Niemczech, Hiszpanii i USA[147]. Do 1900 USA stały się globalnym leaderem produkcji ołowiu, a inne nieeuropejskie kraje, jak Kanada, Meksyk, Australia, rozpoczęły produkcję na istotnym poziomie. Produkcja poza Europą przekroczyła europejską[148]. Wielki udział w zapotrzebowaniu na ołów miały instalacje wodne i malowanie – w regularnym użyciu były farby ołowiowe[149]. W tym czasie wiele osób należących do klasy pracującej było eksponowanych na ten metal, co prowadziło do coraz liczniejszych zatruć. Skutkowało to badaniami nad efektami przyjęcia ołowiu. Udowodniono, że ten metal jest bardziej niebezpieczny w oparach, niż jako ciało stałe. Połączono zatrucie ołowiem i dnę moczanową. Brytyjski lekarz Alfred Baring Garrod zauważył, że jedna trzecia jego pacjentów z dną zajmowała się malarstwem lub hydrauliką. Efekty przewlekłego przyjmowania ołowiu, w tym zaburzenia psychiczne, badano także w XIX stuleciu. Pierwsze prawa skupiające się na zmniejszeniu ilości zatruć ołowiem w fabrykach powołano do istnienia w latach siedemdziesiątych i osiemdziesiątych XIX wieku w Zjednoczonym Królestwie[149].

Czasy współczesne[edytuj | edytuj kod]
Dalsze dowody na zagrożenie, jakie stwarza ołów zdrowiu człowieka, odkryto pod koniec XIX wieku i na początku XX. Lepiej zrozumiano mechanizmy uszkodzeń, udokumentowano ślepotę ołowianą, pierwiastek wycofano z publicznego użytku w USA i Europie. UK wprowadziło obowiązkowe inspekcje fabryk w 1878. W 1889 powołano pierwszego medycznego inspektora fabryk. W efekcie pomiędzy 1900 a 1944 odnotowano dwudziestopięciokrotny spadek przypadków zatrucia ołowiem[150]. Ostatnia większa ekspozycja człowieka na ołów wiązała się z dodawaniem tetraetylołowiu do benzyny jako antydetonatora, co rozpoczęto w USA w 1921. Benzynę ołowiową wycofano w USA i Unii Europejskiej do 2000[149]. Większość państw europejskich zabroniło używania farb ołowiowych, wcześniej powszechnie wykorzystywanych z powodu nieprzezroczystości i wodoodporności[151], we wnętrzach do 1930[152].
W latach siedemdziesiątych XX wieku USA i państwa Europy Zachodniej wprowadziły prawa zmierzające do redukcji zatrucia powietrza ołowiem[153][154]. Sprawa była istotna: badanie przeprowadzone przez Centers for Disease Control and Prevention w USA w latach 1976–1980 wykazało, że 77,8% populacji ma podniesiony poziom ołowiu we krwi. Badanie z lat 1991–1994 przeprowadzone przez ten sam instytut wykazało, że udział ludzi o tak wysokim poziomie spadł do 2,2%[155]. Głównym produktem z ołowiu pod koniec XX wieku był akumulator kwasowo-ołowiowy[156], który nie stwarza bezpośredniego zagrożenia dla człowieka. Od 1960 do 1990 produkcja ołowiu w bloku zachodnim wzrosła o jedną trzecią[157]. Udział w światowej produkcji ołowiu bloku wschodniego zwiększył się od 10% do 30% od 1950 do 1990, ZSRR stał się największym na świecie producentem od połowy lat siedemdziesiątych do osiemdziesiątych, a Chiny zaczęły większą produkcję ołowiu pod koniec XX wieku[158]. W przeciwieństwie do europejskich państw komunistycznych Chiny były do połowy XX wieku w większości nieuprzemysłowione. W 2004 udało im się zająć miejsce Australii jako największego producenta ołowiu na świecie[159]. Jak to było podczas uprzemysławiania Europy, ołów odegrał negatywny efekt na zdrowie Chińczyków[160].
Produkcja[edytuj | edytuj kod]
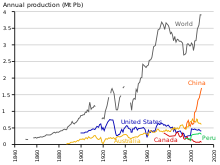
Światowa produkcja ołowiu wzrasta z powodu jego użycia w akumulatorach kwasowo-ołowiowych[161]. Istnieją dwie główne kategorie produkcji: pierwotna z rud oraz wtórna ze złomu. W 2014 4,58 miliona ton ołowiu wytworzyła produkcja pierwotna oraz 5,64 miliona – produkcja wtórna. Trzech największych producentów wydobywanego ołowiu w tym roku to Chiny, Australia i USA. W przypadku ołowiu rafinowanego to Chiny, USA i Korea Południowa[162]. Wedle International Resource Panel Metal Stocks in Society report z 2010 całkowita ilość ołowiu w użyciu, w zapasach, zbytecznego bądź rozrzuconego w środowisku, globalnie wynosi 8 kg na głowę. Duża część z tego znajduje się w krajach rozwiniętych (20–150 kg na głowę) w przeciwieństwie do rozwijających się (1–4 kg na głowę)[163].
Procesy produkcyjne w pierwotnym i wtórnym wytwarzaniu ołowiu są podobne. Część zakładów pierwotnej produkcji obecnie uzupełnia ją odzyskiem ze złomu, trend ten prawdopodobnie będzie wzrastał z czasem. Przy odpowiedniej technice ołowiu pozyskanego wtórnie nie można odróżnić od pierwotnego. Złom ołowiany z budownictwa jest zazwyczaj czysty i poddaje się przetapianiu bez potrzeby wytapiania, choć czasami wymaga oczyszczania. Wobec powyższego wtórna produkcja ołowiu kosztuje mniej energii, niż pierwotna, często nawet o połowę lub więcej mniej[164].
Pierwotna[edytuj | edytuj kod]
Większość rud ołowiu zawiera niewielki procent pierwiastka (bogate w ołów rudy zawierają go zwykle 3–8%), muszą więc zostać poddane wzbogaceniu przed dalszą obróbką[165]. Ruda poddawana jest kruszeniu, wstępnej separacji, flotacji i suszeniu. Powstający koncentrat zawiera 30–80% masowych ołowiu (zwykle 50–60%)[165].
Dalsze główne etapy uzyskiwania ołowiu to: dwuetapowy proces obejmujący prażenie i następnie redukcję w piecu hutniczym, przeprowadzane w oddzielnych procesach, oraz proces bezpośredni, w którym redukcja koncentratu zachodzi jednoetapowo. Ten drugi sposób stosuje się powszechniej, chociaż pierwszy nadal pozostaje istotny[166].
| Kraj | Wydobycie (Mg) |
|---|---|
| Chiny | 2400 |
| Australia | 500 |
| USA | 335 |
| Peru | 310 |
| Meksyk | 250 |
| Federacja Rosyjska | 225 |
| Indie | 135 |
| Boliwia | 80 |
| Szwecja | 76 |
| Turcja | 75 |
| Iran | 41 |
| Kazahstan | 41 |
| Polska | 40 |
| RPA | 40 |
| Korea Północna | 35 |
| Irlandia | 33 |
| Macedonia | 33 |
| inne | 170 |
Proces dwuetapowy[edytuj | edytuj kod]
Wpierw koncentrat siarczku praży się z dodatkiem powietrza celem utlenienia[167]:
- 2 PbS + 3 O2 → 2 PbO + 2 SO2↑
Jako że pierwotny koncentrat nie był czystym siarczkiem ołowiu (II), w wyniku prażenia otrzymuje się mieszaninę tlenku ołowiu (II), siarczanów i krzemianów ołowiu, jak też innych metali wchodzących w skład rudy[168]. Zanieczyszczony tlenek ołowiu (II) redukuje się w koksowym piecu hutniczym do, zanieczyszczonego, surowego metalu[169]:
- 2 PbO + C → 2 Pb + CO2↑
Zanieczyszczenia składają się w większości z arsenu, antymonu, bizmutu, cynku, miedzi, srebra i złota. Wytop traktuje się w piecu płomieniowym powietrzem, parą i siarką, utleniając zanieczyszczenia poza srebrem, złotem i bizmutem. Utlenione zanieczyszczenia wypływają na wierzch metalu i są zbierane[170][171]. Metaliczne srebro i złoto usuwa się i odzyskuje w procesie Parkesa, w którym do ołowiu dodaje się cynku. Cynk rozpuszcza srebro i złoto, które nie mieszają się z ołowiem, można więc je rozdzielić i odzyskać[172][171]. Odsrebrzony ołów uwalniany jest z bizmutu w procesie Betterton–Kroll wykorzystującym metaliczne wapń i magnez. Zanieczyszczenia bizmutu można w efekcie zebrać[171].
Bardzo czysty ołów można uzyskać poddając wytopiony ołów procesom elektrolitycznym, wykorzystując proces Bettsa. Anody z surowego ołowiu i katody z czystego ołowiu umieszcza się w elektrolicie, fluorokrzemianie ołowiu (PbSiF6). Przykłada się napięcie elektryczne i zanieczyszczony ołów anody roztwarza się, osadzając na katodzie, pozostawiając zanieczyszczenia w roztworze[171][173].
Proces bezpośredni[edytuj | edytuj kod]
W tym procesie surowy ołów otrzymywany jest bezpośrednio z koncentratu. Koncentrat siarczku ołowiu (II) jest topiony w piecu i utleniany, tworzy się tlenek ołowiu (II). Węgiel (koks bądź gaz koksowniczy) dodaje się do stopionej zawartości wraz z topnikiem. Tlenek ołowiu redukuje się do metalicznego ołowiu[166].
W przypadku koncentratów bardzo bogatych w ołów, surowy ołów może zawierać do 80% tego metalu. Pozostałe 20% tworzy żużel bogaty w tlenek ołowiu (II). W przypadku ubogiego koncentratu cały ołów może zostać utleniony do bogatego w ołów żużlu[166]. Metaliczny ołów otrzymuje się następnie z wysokoołowiowego (25–40%) żużlu przez redukcję paliwem w piecu hutniczym lub redukcję w piecu elektrycznym bądź ich kombinację[166].
Alternatywy[edytuj | edytuj kod]
Badania nad czystą, mniej energochłonną metodą pozyskiwania ołowiu trwają. Główną ich wadą jest strata dużej części ołowiu bądź też otrzymany produkt zawiera zbyt dużo siarki. Potencjał przedstawia sobą metoda hydrometalurgiczna, w której anoda z zanieczyszczonego ołowiu zostaje zanurzona w elektrolicie a czysty ołów osadza się na katodzie[174].
Wtórna[edytuj | edytuj kod]
Wytapianie, kluczowa część pierwotnej produkcji ołowiu, możne zostać często pominięta w produkcji wtórnej. Przeprowadza się ją tylko, jeśli metaliczny ołów jest bardzo utleniony[164]. Proces przypomina produkcję pierwotną w piecu hutniczym lub piecu obrotowym. Kluczowa różnica polega na większej różnorodności urobku. Bardziej współczesną metodą jest proces Isasmelt, stosowany jako rozszerzenie produkcji pierwotnej; ze zużytych baterii ołowiowych usuwa się siarkę poprzez potraktowanie ich zasadą, a następnie umieszcza w opalanym węglem piecu w obecności tlenu, co dostarcza zanieczyszczonego – najczęściej antymonem – ołowiu[175]. Rafinacja wtórnego ołowiu przebiega ponownie do rafinacji ołowiu pierwotnego. Niektóre procesy można pominąć w zależności od poddawanego recyklingowi materiału i jego potencjalnych zanieczyszczeń, najczęściej akceptowanymi zanieczyszczeniami są bizmut i srebro[175].
Ze źródeł ołowiu wtórnego najważniejsze są baterie, ważne znaczenie mają też rury, płyty i kable[164].
Zastosowania[edytuj | edytuj kod]

Wbrew popularnemu poglądowi rysiki ołowiowych ołówków nigdy nie były robione z ołowiu. Kiedy stworzono ołówek jako przyrząd do pisania z opakowanego grafitu, szczególny rodzaj grafitu zwano plumbago, co dosłownie znaczy za ołów[177].
Pierwiastek[edytuj | edytuj kod]
Metaliczny ołów ma kilka użytecznych mechanicznych własności. Należą do nich duża gęstość, niska temperatura topnienia, giętkość i względna niereaktywność. Wiele metali wyprzedza ołów w tych aspektach, ale są ogólnie mniej powszechne i trudniejsze w ekstrakcji z macierzystych rud. Toksyczność ołowiu doprowadziła do zamiany w pewnych zastosowaniach[178].
Ołów wykorzystywano w pociskach od ich wynalezienia w średniowieczu. Jest niedrogi. Niska temperatura topnienia oznacza możliwość odlewania niewielkiej amunicji czy śrutu z użyciem minimalnego wyposażenia technicznego. Większa niż w przypadku większości metali gęstość pozwala mu lepiej nabierać prędkości. Istnieją jednak obawy przed zanieczyszczeniem środowiska wywołanym stosowaniem ołowianych pocisków do polowań. Kalifornia wprowadziła zakazy ich używania od lipca 2015[179].
Wysoka gęstość i oporność na korozję wykorzystane zostały na liczne sposoby. Ołów służy jako balast w łodziach[180]. Jego ciężar pozwala na zrównoważenie działania wiatru. Dzięki dużej gęstości zajmuje niewielką objętość co minimalizuje opór wody. Służy nurkom do obciążania pasów, by przeciwdziałać wyporowi wody[181]. W 1993 podstawę Krzywej Wieży w Pizie ustabilizowano za pomocą 600 ton ołowiu[182]. Dzięki oporności na korozję robi się z niego osłony kabli podwodnych[183].

Ołów ma wiele zastosowań w przemyśle konstrukcyjnym. Płyty ołowiane służą w architekturze jako materiał dachowy, okładzina, blacha, rynna i spojenia rynien oraz gzyms[184][185]. Dokładnie wykonane listwy służą jako motywy dekoracyjne przytrzymujące płyty ołowiowe. Cały czas robi się zeń pomniki i rzeźby[186], w tym stelaż[187]. W przeszłości często używano go do wyważania opon, z przyczyn środowiskowych zaprzestano tego, wprowadzając inne materiały[94].
Ołów dodany do stopów miedzi takich jak mosiądz czy brąz poprawia skrawność i ma też własności lubrykantu. Praktycznie nierozpuszczalny w miedzi tworzy stałe krople w skazach stopu, jak na granicach ziaren. W małych stężeniach, działając jako lubrykant, krople utrudniają tworzenie wiórów przy produkcji stopu, poprawiając skrawność. Stopy o większym stężeniu ołowiu służą do konstrukcji łożysk. Ołów zapewnia w nich lubrykację[188].
Duża gęstość, liczba atomowa i odkształcalność stanowią podstawy użycia ołowiu w barierach przeciw dźwiękom, wibracjom, promieniowaniu[189]. Ołów nie posiada naturalnych częstotliwości rezonansowych[189]; w efekcie płyty ołowiu służą do wygaszania dźwięków w ścianach, podłogach i sufitach studiów dźwiękowych[190]. Piszczałki organowe są często robione ze stopów ołowiu, zmieszanego z różnoraką ilością cyny w celu kontroli dźwięku każdej z nich[191][192]. Ołów służy wykonywaniu przeciwpromiennych osłon przy badaniach jądrowych i przy wykonywaniu prześwietleń rentgenowskich[193] dzięki swej gęstości i wysokiej zdolności absorpcyjnej[194]. Stopiony wykorzystywany jest jako chłodziwo w reaktorach chłodzonych ołowiem[195].
Największe użycie ołowiu na początku XXI wieku dotyczy jednak baterii kwasowo-ołowiowych. Zachodzą w nich reakcje pomiędzy ołowiem, dwutlenkiem ołowiu i kwasem siarkowym (VI), które dostarczają pewnego źródła napięcia[196]. Ołów w bateriach nie kontaktuje się bezpośrednio z człowiekiem, wobec czego zagrożenia wynikające z jego toksyczności są nieznaczne. Superkondensatory obejmujące baterie kwasowo-ołowiowe dostarczające kilowatów i megawatów budowano w Australii, Japonii i USA dla regulacji częstotliwości, energetyce słonecznej i wiatrowej oraz w innych zastosowaniach[197]. Baterie te mają małą gęstość energii i wydajność w porównaniu z bateriami litowymi, są jednak od nich znacznie tańsze[198].
Ołów wykorzystuje się coraz rzadziej w wysokonapięciowych kablach jako osłonę zabezpieczającą przed wodą[199]. Podobnie wycofuje się go w niektórych krajach z użycia w lucie celem redukcji odpadów zanieczyszczających środowisko[200]. Ołów należy do trzech metali używanych w teście Oddy’ego dla materiałów muzealnych, pomagając wykrywać kwasy organiczne, aldehydy i kwaśne gazy[201][202].
Związki[edytuj | edytuj kod]
Związki ołowiu służą jako lub w barwnikach, oksydantach, plastikach, świecach, szkle i półprzewodnikach. Ołowiowe barwniki używane są w glazurze i szkle, zwłaszcza w przypadku odcieni czerwieni i żółci[203]. Octan ołowiu (IV) i dwutlenek ołowiu służą jako utleniacze w chemii organicznej. Ołów często służy w pokrywaniu przewodów elektrycznych poli(chlorkiem winylu)[204][205]. Można nim potraktować knoty świec w celu zapewnienia dłuższego, bardziej wyrównanego spalania. Z powodu toksyczności wytwórcy europejscy i amerykańscy wykorzystują alternatywne środki, jak cynk[206][207]. Szkło ołowiowe składa się w 12–28% z tlenku ołowiu (II), który zmienia jego właściwości optyczne i redukuje przepuszczalność dla promieniowania jonizującego[208]. Oparte o ołów półprzewodniki takie jak tellurek ołowiu i selenek ołowiu służą w komórkach fotowoltaicznych i detektorach promieniowania podczerwonego[209].
Efekty biologiczne[edytuj | edytuj kod]

Ołów nie odgrywa żadnej potwierdzonej funkcji w biologii[210]. Dorosły człowiek zawiera w swym ciele około 120 mg (liczba ta znacznie zależy od państwa[211]), jednak wśród metali ciężkich wyprzedzają go tylko cynk (2500 mg) i żelazo (4000 mg)[212]. Organizm wydajnie wchłania sole ołowiu[213]. Niewielka ilość (1%) jest przechowywana w kościach. Reszta opuszcza organizm z moczem bądź kałem w kilka tygodni po ekspozycji. Dziecko wydala jedynie jedną trzecią ołowiu. Ciągła ekspozycja skutkować może bioakumulacją[214].
Toksyczność[edytuj | edytuj kod]
Ołów to metal wysoce toksyczny, czy to wdychany, czy połykany. Wpływa na prawie każdy narząd i układ ciała człowieka[215]. W powietrzu stężenie 100 mg/m³ jest IDLH (natychmiastowym zagrożeniem życia i zdrowia)[216]. Większość przyjętego ołowiu przechodzi do krwiobiegu[217]. Główna przyczyna toksyczności ołowiu leży w jego zdolności do zaburzania pracy enzymów, co czyni, wiążąc się do grup SH wielu z nich[218], bądź też zastępując inne metale w ich kofaktorach w wielu reakcjach enzymatycznych[219]. Wśród metali niezbędnych dla organizmu ołów wchodzi w interakcje z wapniem, żelazem i cynkiem[220]. Wysokie stężenia wapnia i żelaza mogą zapewniać pewną ochronę przed zatruciem ołowiem, niskie ich stężenia zwiększają podatność[213].
Efekty[edytuj | edytuj kod]
Ołów może poważnie uszkadzać mózg i nerki, prowadząc w końcu do zgonu. Udając wapń, przekracza barierę krew-mózg. Niszczy osłonki mielinowe neuronów, zmniejsza ich liczbę, zaburza neurotransmisję, upośledza wzrost neuronów[218].
Objawy zatrucia ołowiem obejmują nefropatię, kolkowe bóle brzucha i być może uczucie słabości w palcach dłoni, nadgarstkach i stawach skokowych. Ciśnienie tętnicze wzrasta, zwłaszcza u pacjentów w wieku średnim bądź podeszłym, może wystąpić niedokrwistość. Pewne badania, w większości przekrojowe, znalazły związek między zwiększoną ekspozycją na ołów a zmniejszoną zmiennością rytmu serca[221]. U kobiet w ciąży znaczna ekspozycja może prowadzić do poronienia. Wykazano też, że przewlekła wysoka ekspozycja wywołuje bezpłodność samców[222].

W mózgu rozwijającego się dziecka ołów utrudnia tworzenie się synaps w korze, rozwój neurochemiczny (w tym dotyczący neuroprzekaźników) oraz organizację kanałów jonowych[223]. Ekspozycja we wczesnym dzieciństwie zwiększa ryzyko zaburzeń snu i nadmiernej senności za dnia w późniejszym dzieciństwie[224]. Wysokie stężenie we krwi wiąże się z opóźnionym dojrzewaniem u dziewcząt[225]. Wzrost i spadek w ekspozycji na ołów w powietrzu ze spalania tetraetyloołowiu w benzynie w XX wieku powiązano z historycznym wzrostem i spadkiem liczby przestępstw, jednak hipoteza ta nie została powszechnie przyjęta[226].
Źródła ekspozycji[edytuj | edytuj kod]
Ekspozycja na ołów jest sprawą globalną, jako że wydobycie i wytop ołowiu oraz wytwarzanie, wyrzucanie i recykling baterii występują pospolicie w wielu krajach. Ołów dostaje się do organizmów przez wdychanie, połykanie bądź skórę. Prawie cały zainhalowany ołów jest absorbowany, w przypadku połknięcia wchłania się 20–70%, u dzieci więcej, niż u dorosłych[227].
Zatrucie zazwyczaj wynika ze spożycia pokarmu lub wody zanieczyszczonej ołowiem, rzadziej po przypadkowym połknięciu skażonej gleby, pyłu bądź farby[228]. Produkty z wody morskiej mogą zawierać ołów za sprawą okolicznych wód przemysłowych[229]. Owoce i warzywa mogą ulec skażeniu wysokimi poziomami ołowiu w glebach, na których rosną. Glebę skazić może ołów z rur, farb i resztkowej emisji z benzyny ołowiowej[230].
Używanie ołowiu do budowy rur jest problematyczne na obszarach o miękkiej bądź kwaśnej wodzie[231]. Twarda woda tworzy nieprzepuszczalną warstwę w rurach, podczas gdy miękka bądź kwaśna woda roztwarza ołów z rur[232]. Rozpuszczony w wodzie dwutlenek węgla może reagować, tworząc wodorowęglan. Utlenowana woda może podobnie roztwarzać ołów do wodorotlenku ołowiu (II)[233]. Picie takiej wody może z czasem doprowadzić do problemów zdrowotnych wiążących się z toksycznością roztworzonego ołowiu. Im twardsza woda, czyli im więcej wodorowęglanu wapnia i siarczanu (VI) wapnia zawiera, tym bardziej wnętrze rur pokryje ochronna warstwa węglanu lub siarczanu (VI) ołowiu[234].
Połknięcie farby stanowi główną przyczynę ekspozycji u dzieci, głównie wynika z brania do ust starych parapetów okiennych. W inny sposób kiedy położona sucha farba starzeje się, przechodzi w pył i następnie dostaje się do organizmu przez kontakt rąk z ustami bądź zanieczyszcza jedzenie, wodę lub alkohol. Połknięcie pewnych tradycyjnych leków domowych może również skutkować ekspozycją na ołów lub jego związki[235].
Drugą drogą ekspozycji jest wdychanie, dotyczące palaczy i szczególnie pracowników zawodów związanych z ołowiem[217]. Dym papierosowy zawiera wśród innych substancji radioaktywny izotop 210 ołowiu[236].
Ekspozycja skóry może być znaczna u ludzi pracujących z organicznymi związkami ołowiu. W przypadku związków nieorganicznych ołowiu wchłanianie przez skórę jest mniejsze[237].
Leczenie[edytuj | edytuj kod]
Leczenie zatrucia ołowiem obejmuje zazwyczaj podanie dimerkaprolu i kwasu 2,3-ditiobursztynowego[238]. Ostre przypadki wymagać mogą użycia EDTA, chelatu wapniowego mającego od wapnia większe powinowactwo do ołowiu, w wyniku czego tworzy się chelat ołowiu wydalany z moczem, a w organizmie zostaje niegroźny wapń[239].
Wpływ na środowisko[edytuj | edytuj kod]

Ekstrakcja, produkcja, wykorzystanie i usuwanie ołowiu i jego produktów doprowadziło do poważnego skażenia ziemskich gleb i wód. Emisje do atmosfery były największe w czasie rewolucji przemysłowej, a okres stosowania benzyny ołowiowej przypada na drugą połowę XX wieku. Podwyższone stężenia ołowiu utrzymują się w glebach i osadach terenów miejskich lub poprzemysłowych. Emisje przemysłowe, wliczając w to efekt spalania węgla[240], trwają w wielu częściach świata, szczególnie w krajach rozwijających się[241].
Ołów może akumulować się w glebie, zwłaszcza w przypadku dużej zawartości związków organicznych – pozostaje wtedy setki do tysięcy lat. Potrafi zajmować miejsca innych metali w roślinach i akumulować się na ich powierzchni, spowalniając w tenże sposób fotosyntezę, uniemożliwiając wzrost i doprowadzając roślinę do śmierci. Skażenie gleb i roślin dotyka również mikroorganizmów i zwierząt, u których obniża zdolność tworzenia czerwonych krwinek, doprowadzając tym sposobem do niedokrwistości[242].
Metody analityczne służące wykrywaniu ołowiu w środowisku obejmują spektrofotometrię, fluorescencję w zakresie promieniowania rentgenowskiego, spektroskopię atomową i metody elektrochemiczne Specyficzne elektrody jonoselektywne utworzono w oparciu o jonofor S,S'-metyleno-bis-(N,N-diizobutylo)ditiokarbaminian[243].
Ograniczenia i rekultywacja[edytuj | edytuj kod]

Do połowy lat 80. XX wieku nastąpiła znacząca zmiana użytkowania ołowiu. W USA regulacje środowiskowe zredukowały bądź wyeliminowały w ogóle wykorzystanie ołowiu w produktach innych od baterii, wliczając w to benzynę, farby, lut i systemy wodne. Elektrownie czerpiące energię ze spalania węgla stosować mogą różne urządzenia wychwytujące emitowany ołów[240]. Dalej użytkowanie ołowiu ogranicza unijna dyrektywa RoHS[244]. Używania śrutu ołowianego w polowaniach i strzelectwie sportowym zabroniła Holandia w 1993, wywołując tym samym znaczący spadek emisji ołowiu z 230 ton w 1990 do 47,5 tony w 1995[245].
W USA istnieje granica dopuszczalnej ekspozcji na ołów w miejscu pracy, obejmuje ona ołów metaliczny, nieorganiczne związki ołowiu i mydła ołowiu, a wynosi 0,05 mg/m³ dla 8-godzinnego dnia pracy. Zalecane stężenie ołowiu we krwi ma górną granicę 0,04 mg na 100 g masy ciała[217]. Ołów może być wciąż obecny w szkodliwych ilościach w wyrobach kamionkowych[246], winylowych[247] (jak te używane do produkcji rur i izolacji przewodów elektrycznych) w chińskim mosiądzu, w istocie stopie miedzi i cynku z dodatkiem ołowiu, żelaza, cyny i czasami antymonu[248]. Stare domy mogą być wciąż pokryte ołowianymi farbami[247]. Biała farba ołowiana została wycofana ze sprzedaży w krajach uprzemysłowionych, utrzymały się jednak specjalistyczne zastosowania innych pigmentów, na przykład żółtego chromianu (VI) ołowiu (II)[151]. Zdrapywanie starej farby podczas szlifowania produkuje pył, które może zostać wdechnięty[249]. Programy redukcji ołowiu zostały wprowadzone przez niektóre władze w nieruchomościach związanych z małymi dziećmi[250].
Odpady zawierające ołów, w zależności od jurysdykcji i natury samych odpadów, można traktować jako odpady komunalne (co ułatwia złagodzenie wymagań utylizacji[251]) bądź jako potencjalnie niebezpieczne odpady wymagające specjalnego obchodzenia się i składowania[252]. Przeprowadzono badania dotyczące usuwania ołowiu z układów biologicznych za pomocą metod biologicznych. Kości rybie posiadają zdolność bioremediacji ołowiu ze skażonej gleby[253][254]. Kropidlak różnobarwny jest efektywny w usuwaniu jonów ołowiu[255]. Przebadano zdolności kilku bakterii do usuwania ołowiu ze środowiska, wliczając w to bakterie redukujące siarczany Desulfovibrio i Desulfotomaculum, oba rodzaje wysoce efektywne w roztworach wodnych[256].
Ołów i jego związki w Unii Europejskiej zostały uznane za substancje priorytetowe w dziedzinie polityki wodnej[257].
Uwagi[edytuj | edytuj kod]
- ↑ Podana wartość stanowi przybliżoną standardową względną masę atomową (ang. abridged standard atomic weight) publikowaną wraz ze standardową względną masą atomową, która wynosi [206,14; 207,94] (patrz:
 Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)). Z uwagi na zmienność abundancji izotopów pierwiastka w naturze, wartości w nawiasach klamrowych stanowią zakres wartości względnej masy atomowej dla naturalnych źródeł tego pierwiastka (patrz:
Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)). Z uwagi na zmienność abundancji izotopów pierwiastka w naturze, wartości w nawiasach klamrowych stanowią zakres wartości względnej masy atomowej dla naturalnych źródeł tego pierwiastka (patrz:  Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.)).
Przypisy[edytuj | edytuj kod]
- ↑ a b c d Lide 2005 ↓, s. 12–219.
- ↑ Lead (nr 391352) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2011-10-02]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Thomas Prohaska i inni, Standard atomic weights of the elements 2021 (IUPAC Technical Report), „Pure and Applied Chemistry”, 94 (5), 2021, s. 573–600, DOI: 10.1515/pac-2019-0603 (ang.).
- ↑ Lide 2005 ↓, s. 10–179.
- ↑ Pyykkö 1988 ↓, s. 563–94.
- ↑ Norman 1996 ↓, s. 36.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 226–27, 374.
- ↑ Christensen 2002 ↓, s. 867.
- ↑ Parthé 1964 ↓, s. 13.
- ↑ Sharma i in. 2013 ↓.
- ↑ Sharma i in. 2014 ↓, s. 174710.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 372.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 372–73.
- ↑ a b Thornton, Rautiu i Brush 2001 ↓, s. 6.
- ↑ Lide 2005 ↓, s. 12–35, 12–40.
- ↑ Brenner 2003 ↓, s. 396.
- ↑ Jones 2014 ↓, s. 42.
- ↑ Lide 2005 ↓, s. 4–13, 4–21, 4–33.
- ↑ Vogel i Achilles 2013 ↓, s. 8.
- ↑ Anderson 1869 ↓, s. 341–43.
- ↑ Gale i Totemeier 2003 ↓, s. 15–2–15–3.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 8.
- ↑ Willey 1999 ↓.
- ↑ Lide 2005 ↓, s. 12–45.
- ↑ Blakemore 1985 ↓, s. 272.
- ↑ Webb, Marsiglio i Hirsch 2015 ↓.
- ↑ a b c d e IAEA - Nuclear Data Section 2017 ↓.
- ↑ University of California, Berkeley Nuclear Forensic Search Project ↓.
- ↑ Stone 1997 ↓.
- ↑ Marcillac i in. 2003 ↓, s. 876–78.
- ↑ World Nuclear Association 2015 ↓.
- ↑ Beeman, Bellini i Cardani 2013 ↓.
- ↑ Smirnov, Borisevich i Sulaberidze 2012 ↓.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 368.
- ↑ Levin 2009 ↓, s. 40–41.
- ↑ Fiorini 2010 ↓, s. 7–8.
- ↑ Takahashi i in. 1987 ↓.
- ↑ Thürmer, Williams i Reutt-Robey 2002 ↓, s. 2033–35.
- ↑ Tétreault, Sirois i Stamatopoulou 1998 ↓, s. 17–32.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 10–11.
- ↑ a b c d e f Greenwood i Earnshaw 1998 ↓, s. 373.
- ↑ Bretherick 2016 ↓, s. 1442.
- ↑ Harbison, Bourgeois i Johnson 2015 ↓, s. 132.
- ↑ a b Greenwood i Earnshaw 1998 ↓, s. 374.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 11–12.
- ↑ Polyanskiy 1986 ↓, s. 20.
- ↑ Kaupp 2014 ↓, s. 9–10.
- ↑ Dieter i Watson 2009 ↓, s. 509.
- ↑ Hunt 2014 ↓, s. 215.
- ↑ a b c King 1995 ↓, s. 43–63.
- ↑ Bunker i Casey 2016 ↓, s. 89.
- ↑ Whitten, Gailey i David 1996 ↓, s. 904–5.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 384.
- ↑ Wiberg, Wiberg i Holleman 2001 ↓, s. 916.
- ↑ a b Greenwood i Earnshaw 1998 ↓, s. 389.
- ↑ Zuckerman i Hagen 1989 ↓, s. 426.
- ↑ Funke 2013 ↓.
- ↑ a b Greenwood i Earnshaw 1998 ↓, s. 382.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 388.
- ↑ Toxicological Profile for Lead 2007 ↓, s. 277.
- ↑ Macintyre 1992 ↓, s. 3775.
- ↑ Silverman 1966 ↓, s. 2067–69.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 381.
- ↑ Yong, Hoffmann i Fässler 2006 ↓, s. 4774–78.
- ↑ Becker i in. 2008 ↓, s. 9965–78.
- ↑ Mosseri, Henglein i Janata 1990 ↓, s. 2722–26.
- ↑ Konu i Chivers 2011 ↓, s. 391–92.
- ↑ Hadlington 2017 ↓, s. 59.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 384–86.
- ↑ Röhr 2017 ↓.
- ↑ Alsfasser 2007 ↓, s. 261–63.
- ↑ Greenwood i Earnshaw 1998 ↓, s. 393.
- ↑ Stabenow, Saak i Weidenbruch 2003 ↓.
- ↑ a b Polyanskiy 1986 ↓, s. 43.
- ↑ a b c d Greenwood i Earnshaw 1998 ↓, s. 404.
- ↑ a b Wiberg, Wiberg i Holleman 2001 ↓, s. 918.
- ↑ Toxicological Profile for Lead 2007 ↓, s. 287.
- ↑ Polyanskiy 1986 ↓, s. 44.
- ↑ Windholz 1976 ↓.
- ↑ Zýka 1966 ↓, s. 569.
- ↑ a b c d Lodders 2003 ↓, s. 1222–23.
- ↑ Roederer i in. 2009 ↓, s. 1963–80.
- ↑ Lochner, Rohrbach i Cochrane 2005 ↓, s. 12.
- ↑ Lodders 2003 ↓, s. 1224.
- ↑ Burbidge i in. 1957 ↓, s. 608–615.
- ↑ Burbidge i in. 1957 ↓, s. 608–609.
- ↑ Frebel 2015 ↓, s. 114–15.
- ↑ Burbidge i in. 1957 ↓, s. 582, 609–615.
- ↑ Langmuir i Broecker 2012 ↓, s. 183–184.
- ↑ Davidson i in. 2014 ↓, s. 4–5.
- ↑ Emsley 2011 ↓, s. 286, passim.
- ↑ Cox 1997 ↓, s. 182.
- ↑ a b Davidson i in. 2014 ↓, s. 4.
- ↑ a b c United States Geological Survey 2017 ↓, s. 97.
- ↑ Rieuwerts 2015 ↓, s. 225.
- ↑ Merriam-Webster ↓.
- ↑ a b Kroonen 2013 ↓, *lauda-.
- ↑ Nikolayev 2012 ↓.
- ↑ Kroonen 2013 ↓, *bliwa- 2.
- ↑ a b c d Hong i in. 1994 ↓, s. 1841–43.
- ↑ a b Rich 1994 ↓, s. 4.
- ↑ a b c d e Winder 1993b ↓.
- ↑ History of Cosmetics ↓.
- ↑ Yu i Yu 2004 ↓, s. 26.
- ↑ Toronto museum explores 2003 ↓.
- ↑ Bisson i Vogel 2000 ↓, s. 105.
- ↑ Rich 1994 ↓, s. 5.
- ↑ United States Geological Survey 1973 ↓.
- ↑ de Callataÿ 2005 ↓, s. 361–72.
- ↑ Rich 1994 ↓, s. 6.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 179–84.
- ↑ Bisel i Bisel 2002 ↓, s. 459–60.
- ↑ Retief i Cilliers 2006 ↓, s. 149–51.
- ↑ Grout 2017 ↓.
- ↑ Hodge 1981 ↓, s. 486–91.
- ↑ Gilfillan 1965 ↓, s. 53–60.
- ↑ Nriagu 1983 ↓, s. 660–63.
- ↑ Frankenburg 2014 ↓, s. 16.
- ↑ Scarborough 1984 ↓.
- ↑ Waldron 1985 ↓, s. 107–08.
- ↑ Reddy i Braun 2010 ↓, s. 1052.
- ↑ Delile i in. 2014 ↓, s. 6594–99.
- ↑ Finger 2006 ↓, s. 184.
- ↑ Lewis 1985 ↓, s. 15.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 183.
- ↑ Polyanskiy 1986 ↓, s. 8.
- ↑ Thomson 1830 ↓, s. 74.
- ↑ Oxford English Dictionary ↓, surma.
- ↑ Vasmer 1950 ↓, сурьма.
- ↑ a b Winder 1993a ↓.
- ↑ a b Rich 1994 ↓, s. 7.
- ↑ Kellett 2012 ↓, s. 106–07.
- ↑ Rich 1994 ↓, s. 8.
- ↑ Ede i Cormack 2016 ↓, s. 54.
- ↑ Cotnoir 2006 ↓, s. 35.
- ↑ Samson 1885 ↓, s. 388.
- ↑ Sinha i in. 1993 ↓.
- ↑ Ramage 1980 ↓, s. 8.
- ↑ Tungate 2011 ↓, s. 14.
- ↑ Donnelly 2014 ↓, s. 171–172.
- ↑ Ashikari 2003 ↓, s. 65.
- ↑ Nakashima i in. 1998 ↓, s. 59.
- ↑ Rabinowitz 1995 ↓, s. 66.
- ↑ Gill i Libraries Board of South Australia 1974 ↓, s. 69.
- ↑ Bisson i Vogel 2000 ↓, s. 85.
- ↑ Bisson i Vogel 2000 ↓, s. 131–32.
- ↑ Lead mining ↓.
- ↑ Rich 1994 ↓, s. 11.
- ↑ a b c Riva i in. 2012 ↓, s. 11–16.
- ↑ Hernberg 2000 ↓, s. 246.
- ↑ a b Crow 2007 ↓.
- ↑ Markowitz i Rosner 2000 ↓, s. 37.
- ↑ More i in. 2017 ↓.
- ↑ American Geophysical Union 2017 ↓.
- ↑ Centers for Disease Control and Prevention 1997 ↓.
- ↑ Rich 1994 ↓, s. 117.
- ↑ Rich 1994 ↓, s. 17.
- ↑ Rich 1994 ↓, s. 91–92.
- ↑ United States Geological Survey 2005 ↓.
- ↑ Zhang i in. 2012 ↓, s. 2261–73.
- ↑ Tolliday 2014 ↓.
- ↑ Guberman 2016 ↓.
- ↑ Graedel 2010 ↓.
- ↑ a b c Thornton, Rautiu i Brush 2001 ↓, s. 56.
- ↑ a b Davidson i in. 2014 ↓, s. 6.
- ↑ a b c d Davidson i in. 2014 ↓, s. 17.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 51.
- ↑ Davidson i in. 2014 ↓, s. 11–12.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 51–52.
- ↑ Davidson i in. 2014 ↓, s. 25.
- ↑ a b c d Primary Lead Refining ↓.
- ↑ Pauling 1947 ↓.
- ↑ Davidson i in. 2014 ↓, s. 34.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 52–53.
- ↑ a b Thornton, Rautiu i Brush 2001 ↓, s. 57.
- ↑ Street i Alexander 1998 ↓, s. 181.
- ↑ Evans 1908 ↓, s. 133–79.
- ↑ Baird i Cann 2012 ↓, s. 537–38, 543–47.
- ↑ California Department of Fish and Wildlife ↓.
- ↑ Parker 2005 ↓, s. 194–95.
- ↑ Krestovnikoff i Halls 2006 ↓, s. 70.
- ↑ Street i Alexander 1998 ↓, s. 182.
- ↑ Jensen 2013 ↓, s. 136.
- ↑ Think Lead research ↓.
- ↑ Weatherings to Parapets ↓.
- ↑ Lead garden ornaments 2016 ↓.
- ↑ Putnam 2003 ↓, s. 216.
- ↑ Copper Development Association ↓.
- ↑ a b Rich 1994 ↓, s. 101.
- ↑ Guruswamy 2000 ↓, s. 31.
- ↑ Audsley 1965 ↓, s. 250–51.
- ↑ Palmieri 2006 ↓, s. 412–13.
- ↑ National Council on Radiation Protection and Measurements 2004 ↓, s. 16.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 7.
- ↑ Tuček, Carlsson i Wider 2006 ↓, s. 1590.
- ↑ Progressive Dynamics, Inc. ↓.
- ↑ Olinsky-Paul 2013 ↓.
- ↑ Gulbinska 2014 ↓.
- ↑ Rich 1994 ↓, s. 133–34.
- ↑ Zhao 2008 ↓, s. 440.
- ↑ Beiner i in. 2015 ↓.
- ↑ Szczepanowska 2013 ↓, s. 84–85.
- ↑ Burleson 2001 ↓, s. 23.
- ↑ Zweifel 2009 ↓, s. 438.
- ↑ Wilkes i in. 2005 ↓, s. 106.
- ↑ Randerson 2002 ↓.
- ↑ Nriagu i Kim 2000 ↓, s. 37–41.
- ↑ Amstock 1997 ↓, s. 116–19.
- ↑ Rogalski 2010 ↓, s. 485–541.
- ↑ Emsley 2011 ↓, s. 280.
- ↑ World Health Organization 2000 ↓, s. 149–53.
- ↑ Emsley 2011 ↓, s. 280, 621, 255.
- ↑ a b Luckey i Venugopal 1979 ↓, s. 177–78.
- ↑ Toxic Substances Portal ↓.
- ↑ United States Food and Drug Administration 2015 ↓, s. 42.
- ↑ National Institute for Occupational Safety and Health ↓.
- ↑ a b c Occupational Safety and Health Administration ↓.
- ↑ a b Rudolph i in. 2003 ↓, s. 369.
- ↑ Dart, Hurlbut i Boyer-Hassen 2004 ↓, s. 1426.
- ↑ Kosnett 2006 ↓, s. 238.
- ↑ Ana Navas-Acien, Lead Exposure and Cardiovascular Disease–A Systematic Review, „Environmental Health Perspectives”, 115 (3), 2007, s. 472–482, DOI: 10.1289/ehp.9785, PMID: 17431501, PMCID: PMC1849948.
- ↑ Sokol 2005 ↓, s. 133, passim.
- ↑ Mycyk, Hryhorczuk i Amitai 2005 ↓, s. 462.
- ↑ Liu i in. 2015 ↓, s. 1869–74.
- ↑ Schoeters i in. 2008 ↓, s. 168–75.
- ↑ Casciani 2014 ↓.
- ↑ Tarragó 2012 ↓, s. 16.
- ↑ Toxicological Profile for Lead 2007 ↓, s. 4.
- ↑ Bremner 2002 ↓, s. 101.
- ↑ Agency for Toxic Substances and Disease Registry ↓.
- ↑ Thornton, Rautiu i Brush 2001 ↓, s. 17.
- ↑ Moore 1977 ↓, s. 109–15.
- ↑ Polyanskiy 1986 ↓, s. 32.
- ↑ Wiberg, Wiberg i Holleman 2001 ↓, s. 914.
- ↑ Tarragó 2012 ↓, s. 11.
- ↑ Centers for Disease Control and Prevention 2015 ↓.
- ↑ Wani, Ara i Usman 2015 ↓, s. 57, 58.
- ↑ Prasad 2010 ↓, s. 651–52.
- ↑ Masters, Trevor i Katzung 2008 ↓, s. 481–83.
- ↑ a b Trace element emission 2012 ↓.
- ↑ United Nations Environment Programme 2010 ↓, s. 11–33.
- ↑ Greene 2014 ↓.
- ↑ Hauser 2017 ↓, s. 49–60.
- ↑ Smith i Flegal 1995 ↓, s. 21–23.
- ↑ Deltares i Netherlands Organisation for Applied Scientific Research 2016 ↓.
- ↑ Grandjean 1978 ↓, s. 303–21.
- ↑ a b Levin i in. 2008 ↓, s. 1288.
- ↑ Duda 1996 ↓, s. 242.
- ↑ Marino i in. 1990 ↓, s. 1183–85.
- ↑ Schoch 1996 ↓, s. 111.
- ↑ United States Environmental Protection Agency 2000 ↓.
- ↑ Lead in Waste 2016 ↓.
- ↑ Freeman 2012 ↓, s. a20–a21.
- ↑ Young 2012 ↓.
- ↑ Acton 2013 ↓, s. 94–95.
- ↑ Park i in. 2011 ↓, s. 162–74.
- ↑ Dyrektywa 2000/60/WE Parlamentu EUROPEJSKIEGO i Rady z dnia 23 października 2000 r. ustanawiająca ramy wspólnotowego działania w dziedzinie polityki wodnej (Dz.U. L 327 z 22.12.2000, s. 1) [online].
Bibliografia[edytuj | edytuj kod]
- Q.A. Acton: Issues in Global Environment–Pollution and Waste Management: 2012 Edition. ScholarlyEditions, 2013. ISBN 978-1-4816-4665-9.
- Agency for Toxic Substances and Disease Registry: Information for the Community: Lead Toxicity. [dostęp 2017-02-11].
- R. Alsfasser: Moderne anorganische Chemie (Modern inorganic chemistry). Walter de Gruyter, 2007. ISBN 978-3-11-019060-1. (niem.).
- American Geophysical Union: Human Activity Has Polluted European Air for 2000 Years. [w:] Eos Science News [on-line]. 2017. [dostęp 2017-10-23]. [zarchiwizowane z tego adresu (2017-06-27)].
- J.S. Amstock, Handbook of Glass in Construction, McGraw-Hill Professional, 1997, ISBN 978-0-07-001619-4.
- J. Anderson. Malleability and ductility of metals. „Scientific American”. 21 (22), s. 341–343, 1869. DOI: 10.1038/scientificamerican11271869-341.
- M. Ashikari. The memory of the women’s white faces: Japaneseness and the ideal image of women. „Japan Forum”. 15 (1), s. 55–79, 2003. DOI: 10.1080/0955580032000077739.
- G.A. Audsley: The Art of Organ Building. T. 2. Courier, 1965. ISBN 978-0-486-21315-6.
- C. Baird, N. Cann: Environmental Chemistry. Wyd. 5th. W.H. Freeman and Company, 2012. ISBN 978-1-4292-7704-4.
- M. Becker i inni, Persistent radicals of trivalent tin and lead, „Inorganic Chemistry”, 47 (21), 2008, s. 9965–78, DOI: 10.1021/ic801198p, PMID: 18823115.
- J.W. Beeman, F. Bellini, L. Cardani. New experimental limits on the α decays of lead isotopes. „European Physical Journal A”. 49 (50), 2013.
- G.G. Beiner i inni, Oddy Tests: Adding the Analytical Dimension, „Collection Forum”, 29 (1–2), 2015, s. 22–36, DOI: 10.14351/0831-4985-29.1.22, ISSN 0831-4985.
- S.C. Bisel, J. F. Bisel: Health and nutrition at Herculaneum. W: W.F. Jashemski, F.G. Meyer: The Natural History of Pompeii. Cambridge University Press, 2002, s. 451–475. ISBN 978-0-521-80054-9.
- M.S. Bisson, J.O. Vogel: Ancient African Metallurgy: The Sociocultural Context. Rowman & Littlefield, 2000. ISBN 978-0-7425-0261-1.
- J.S. Blakemore: Solid State Physics. Cambridge University Press, 1985. ISBN 978-0-521-31391-9.
- M. Burleson: The Ceramic Glaze Handbook: Materials, Techniques, Formulas. New York, NY: Sterling, 2001.
- H.A. Bremner: Safety and Quality Issues in Fish Processing. Elsevier, 2002. ISBN 978-1-85573-678-8.
- G.A. Brenner: Webster’s New World American Idioms Handbook. John Wiley & Sons, 2003. ISBN 978-0-7645-2477-6.
- L. Bretherick: Bretherick’s Handbook of Reactive Chemical Hazards. Elsevier, 2016. ISBN 978-1-4831-6250-8.
- B.C. Bunker, W.H. Casey: The Aqueous Chemistry of Oxides. Oxford University Press, 2016. ISBN 978-0-19-938425-9.
- E.M. Burbidge, G.R. Burbidge, W.A. Fowler, F. Hoyle. Synthesis of the Elements in Stars. „Reviews of Modern Physics”. 29 (4), s. 547–654, 1957. DOI: 10.1103/RevModPhys.29.547. Bibcode: 1957RvMP...29..547B.
- California Department of Fish and Wildlife, Nonlead Ammunition in California [online] [dostęp 2017-05-17] [zarchiwizowane z adresu 2020-05-10].
- F. de Callataÿ. The Graeco-Roman economy in the super long-run: Lead, copper, and shipwrecks. „Journal of Roman Archaeology”. 18, s. 361–372, 2005. DOI: 10.1017/S104775940000742X.
- D. Casciani: Did removing lead from petrol spark a decline in crime?. BBC News, 2014. [dostęp 2017-01-30].
- Centers for Disease Control and Prevention. Update: blood lead levels--United States, 1991-1994. „Morbidity and Mortality Weekly Report”. 46 (7), s. 141–146, 1997. ISSN 0149-2195. PMID: 9072671.
- Centers for Disease Control and Prevention: Radiation and Your Health. 2015. [dostęp 2017-02-28].
- N.E. Christensen: Relativistic Solid State Theory. W: Relativistic Electronic Structure Theory – Fundamentals. Schwerdtfeger P. (red.). Elsevier, 2002, s. 867–868. ISBN 978-0-08-054046-7.
- Copper Development Association, Leaded Coppers [online] [dostęp 2016-07-10].
- B. Cotnoir: The Weiser Concise Guide to Alchemy. Weiser Books, 2006. ISBN 978-1-57863-379-1.
- P.A. Cox: The Elements: Their Origin, Abundance and Distribution. Oxford University Press, 1997. ISBN 978-0-19-855298-7.
- J.M. Crow: Why use lead in paint?. Chemistry World, 2007. [dostęp 2017-02-22].
- Lead. W: R.C. Dart, K.M. Hurlbut, L.V. Boyer-Hassen: Medical Toxicology. Wyd. 3rd. Lippincott Williams & Wilkins, 2004, s. 1426. ISBN 978-0-7817-2845-4.
- Lead. W: A. Davidson, J. Ryman, C.A. Sutherland, E.F. Milner, R.C. Kerby, H. Teindl, A. Melin, H.M. Bolt: UllMann’s Encyclopedia of Industrial Chemistry. 2014. DOI: 10.1002/14356007.a15_193.pub3. ISBN 978-3-527-30673-2.
- H. Delile, J. Blichert-Toft, J.-P. Goiran, Simon Keay i inni. Lead in ancient Rome’s city waters. „Proceedings of the National Academy of Sciences”. 111 (18), s. 6594–6599, 2014. DOI: 10.1073/pnas.1400097111. ISSN 0027-8424. PMID: 24753588. PMCID: PMC4020092. Bibcode: 2014PNAS..111.6594D.
- Deltares, Netherlands Organisation for Applied Scientific Research: Lood en zinkemissies door jacht. 2016. [dostęp 2017-02-18]. (niderl.).
- R.K. Dieter, R.T. Watson: Transmetalation reactions producing organocopper compounds. W: Z. Rappoport, I. Marek: The Chemistry of Organocopper Compounds. T. 1. John Wiley & Sons, 2009, s. 443–526. ISBN 978-0-470-77296-6.
- J. Donnelly: Deep Blue. Hachette Children’s Group, 2014. ISBN 978-1-4449-2119-9.
- M.B. Duda: Traditional Chinese Toggles: Counterweights and Charms. Editions Didier Millet, 1996. ISBN 978-981-4260-61-9.
- A. Ede, L.B. Cormack: A History of Science in Society, Volume I: From the Ancient Greeks to the Scientific Revolution, Third Edition. University of Toronto Press, 2016. ISBN 978-1-4426-3503-6.
- J. Emsley: Nature’s Building Blocks: An A-Z Guide to the Elements. Oxford University Press, 2011. ISBN 978-0-19-960563-7.
- H.R. Eschnauer, M. Stoeppler: Wine–An enological specimen bank. W: M. Stoeppler: Hazardous Materials in the Environment. Elsevier Science, 1992, s. 49–72 (58). ISBN 978-0-444-89078-8.
- J.W. Evans. V.– The meanings and synonyms of plumbago. „Transactions of the Philological Society”. 26 (2), s. 133–179, 1908. DOI: 10.1111/j.1467-968X.1908.tb00513.x.
- S. Finger: Doctor Franklin’s Medicine. University of Pennsylvania Press, 2006. ISBN 978-0-8122-3913-3.
- E. Fiorini, 2.000 years-old Roman Lead for physics, ASPERA, 2010, s. 7–8 [dostęp 2016-10-29] [zarchiwizowane z adresu 2018-04-26].
- F.R. Frankenburg: Brain-Robbers: How Alcohol, Cocaine, Nicotine, and Opiates Have Changed Human History. ABC-CLIO, 2014. ISBN 978-1-4408-2932-1.
- A. Frebel: Searching for the Oldest Stars: Ancient Relics from the Early Universe. Princeton University, 2015. ISBN 978-0-691-16506-6.
- K.S. Freeman. Remediating soil lead with fishbones. „Environmental Health Perspectives”. 120 (1), s. a20–a21, 2012. DOI: 10.1289/ehp.120-a20a. PMID: 22214821. PMCID: PMC3261960.
- K. Funke. Solid State Ionics: from Michael Faraday to green energy–the European dimension. „Science and Technology of Advanced Materials”. 14 (4), s. 1–50, 2013. DOI: 10.1088/1468-6996/14/4/043502. Bibcode: 2013STAdM..14d3502F.
- W.F. Gale, T.C. Totemeier: Smithells Metals Reference Book. Butterworth-Heinemann, 2003. ISBN 978-0-08-048096-1.
- S.C. Gilfillan. Lead poisoning and the fall of Rome. „Journal of Occupational Medicine”. 7 (2), s. 53–60, 1965. ISSN 0096-1736. PMID: 14261844.
- T. Gill, Libraries Board of South Australia: The history and topography of Glen Osmond, with map and illustrations. Libraries Board of South Australia, 1974.
- T.E. Graedel: Metal stocks in Society – Scientific Synthesis. International Resource Panel, 2010, s. 17. ISBN 978-92-807-3082-1. [dostęp 2017-04-18].
- P. Grandjean. Widening perspectives of lead toxicity. „Environmental Research”. 17 (2), s. 303–321, 1978. DOI: 10.1016/0013-9351(78)90033-6. PMID: 400972. Bibcode: 1978ER.....17..303G.
- D. Greene: Effects of lead on the environment. 2014. [dostęp 2016-10-30].
- N.N. Greenwood, A. Earnshaw: Chemistry of the Elements. Wyd. 2nd. Butterworth-Heinemann, 1998. ISBN 978-0-7506-3365-9.
- J. Grout: Lead poisoning and Rome. Encyclopaedia Romana, 2017. [dostęp 2017-02-15].
- D.E. Guberman: 2014 Minerals Yearbook. United States Geological Survey, 2016. [dostęp 2017-05-08].
- M.K. Gulbinska: Lithium-ion Battery Materials and Engineering: Current Topics and Problems from the Manufacturing Perspective. Springer, 2014, s. 96. ISBN 978-1-4471-6548-4.
- S. Guruswamy: Engineering properties and applications of lead alloys. Marcel Dekker, 2000. ISBN 978-0-8247-8247-4.
- T.J. Hadlington: On the Catalytic Efficacy of Low-Oxidation State Group 14 Complexes. Springer, 2017. ISBN 978-3-319-51807-7.
- R.D. Harbison, M.M. Bourgeois, G.T. Johnson: Hamilton and Hardy’s Industrial Toxicology. John Wiley & Sons, 2015. ISBN 978-0-470-92973-5.
- Analytical Methods for the Determination of Lead in the Environment. W: P.C. Hauser: Lead: Its Effects on Environment and Health. Astrid S., Helmut S., Sigel R. K. O. (editor). T. 17. de Gruyter, 2017, seria: Metal Ions in Life Sciences. DOI: 10.1515/9783110434330-003.
- S. Hernberg, Lead Poisoning in a Historical Perspective, „American Journal of Industrial Medicine”, 38 (3), 2000, s. 244–54, DOI: 10.1002/1097-0274(200009)38:3<244::AID-AJIM3>3.0.CO;2-F, PMID: 10940962 [dostęp 2017-03-01] [zarchiwizowane z adresu 2013-04-13].
- A History of Cosmetics from Ancient Times. Cosmetics Info. [dostęp 2016-07-18].
- T.A. Hodge. Vitruvius, lead pipes and lead poisoning. „American Journal of Archaeology”. 85 (4), s. 486–491, 1981. Archaeological Institute of America. DOI: 10.2307/504874. JSTOR: 504874.
- S. Hong, J.-P. Candelone, C.C. Patterson, C.F. Boutron. Greenland ice evidence of hemispheric lead pollution two millennia ago by Greek and Roman civilizations. „Science”. 265 (5180), s. 1841–1843, 1994. DOI: 10.1126/science.265.5180.1841. PMID: 17797222. Bibcode: 1994Sci...265.1841H.
- A. Hunt: Dictionary of Chemistry. Routledge, 2014. ISBN 978-1-135-94178-9.
- IAEA - Nuclear Data Section: Livechart – Table of Nuclides – Nuclear structure and decay data. International Atomic Energy Agency, 2017. [dostęp 2017-03-31].
- C.F. Jensen: Online Location of Faults on AC Cables in Underground Transmission. Springer, 2013. ISBN 978-3-319-05397-4.
- P.A. Jones: Jedburgh Justice and Kentish Fire: The Origins of English in Ten Phrases and Expressions. Constable, 2014. ISBN 978-1-47211-389-4.
- M. Kaupp: Chemical bonding of main-group elements. W: G. Frenking, S. Shaik: The Chemical Bond: Chemical Bonding Across the Periodic Table. John Wiley & Sons, 2014. DOI: 10.1002/9783527664658.ch1.
- C. Kellett: Poison and Poisoning: A Compendium of Cases, Catastrophes and Crimes. Accent Press, 2012. ISBN 978-1-909335-05-9.
- R.B. King: Inorganic Chemistry of Main Group Elements. VCH Publishers, 1995. ISBN 978-1-56081-679-9.
- J. Konu, T. Chivers: Stable Radicals of the Heavy p-Block Elements. W: R.G. Hicks: Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. John Wiley & Sons, 2011. ISBN 978-0-470-77083-2.
- M.J. Kosnett: Lead. W: K.R. Olson: Poisoning and Drug Overdose. Wyd. 5. McGraw-Hill Professional, 2006, s. 238. ISBN 978-0-07-144333-3.
- M. Krestovnikoff, M. Halls: Scuba Diving. Dorling Kindersley, 2006. ISBN 978-0-7566-4063-7.
- G. Kroonen: Etymological Dictionary of Proto-Germanic. T. 11. Brill, 2013, seria: Leiden Indo-European Etymological Dictionary Series. ISBN 978-90-04-18340-7.
- C.H. Langmuir, W.S. Broecker: How to Build a Habitable Planet: The Story of Earth from the Big Bang to Humankind. Princeton University Press, 2012. ISBN 978-0-691-14006-3.
- Lead sling bullet; almond shape; a winged thunderbolt on one side and on the other, in high relief, the inscription DEXAI „Catch!”. The British Museum. [dostęp 2012-04-30]. [zarchiwizowane z tego adresu (2012-02-14)].
- Lead garden ornaments. H. Crowther Ltd, 2016. [dostęp 2017-02-20].
- Lead in Waste Disposal [online], United States Environmental Protection Agency, 2016 [dostęp 2017-02-28].
- Lead mining. The Northern Echo. [dostęp 2016-02-16].
- H.L. Levin: The Earth Through Time. John Wiley & Sons, 2009. ISBN 978-0-470-38774-0.
- R. Levin i inni, Lead exposures in U.S. children, 2008: Implications for prevention, „Environmental Health Perspectives”, 116 (10), 2008, s. 1285–93, DOI: 10.1289/ehp.11241, PMID: 18941567, PMCID: PMC2569084.
- J. Lewis, Lead Poisoning: A Historical Perspective, „EPA Journal”, 11 (4), United States Environmental Protection Agency, 1985, s. 15–18 [dostęp 2017-01-31].
- D.R. Lide: CRC Handbook of Chemistry and Physics. Wyd. 85th. CRC Press, 2005. ISBN 978-0-8493-0484-2.
- J. Liu i inni, Early blood lead levels and sleep disturbance in preadolescence, „Sleep”, 38 (12), 2015, s. 1869–74, DOI: 10.5665/sleep.5230, PMID: 26194570, PMCID: PMC4667382.
- J.C. Lochner, G. Rohrbach, K. Cochrane: What is Your Cosmic Connection to the Elements?. Goddard Space Flight Center, 2005. [dostęp 2017-07-02]. [zarchiwizowane z tego adresu (29 grudnia 2016)].
- K. Lodders. Solar System abundances and condensation temperatures of the elements. „The Astrophysical Journal”. 591 (2), s. 1220–1247, 2003. DOI: 10.1086/375492. ISSN 0004-637X. Bibcode: 2003ApJ...591.1220L.
- J.E. Macintyre: Dictionary of Inorganic Compounds. CRC Press, 1992. ISBN 978-0-412-30120-9.
- P. de Marcillac, N. Coron, G. Dambier, J. Leblanc i inni. Experimental detection of α-particles from the radioactive decay of natural bismuth. „Nature”. 422 (6934), s. 876–878, 2003. DOI: 10.1038/nature01541. PMID: 12712201. Bibcode: 2003Natur.422..876D.
- P.E. Marino i inni, A case report of lead paint poisoning during renovation of a Victorian farmhouse, „American Journal of Public Health”, 80 (10), 1990, s. 1183–85, DOI: 10.2105/AJPH.80.10.1183, PMID: 2119148, PMCID: PMC1404824.
- G. Markowitz, D. Rosner. „Cater to the children”: the role of the lead industry in a public health tragedy, 1900–55. „American Journal of Public Health”. 90, s. 36–46, 2000. DOI: 10.2105/ajph.90.1.36. PMID: 10630135. PMCID: PMC1446124.
- S.B. Masters, A.J. Trevor, B.G. Katzung: Katzung & Trevor’s Pharmacology: Examination & Board Review. Wyd. 8th. McGraw-Hill Medical, 2008. ISBN 978-0-07-148869-3.
- J. Meija i inni, Atomic weights of the elements 2013 (IUPAC Technical Report), „Pure and Applied Chemistry”, 88 (3), 2016, s. 265–291, DOI: 10.1515/pac-2015-0305.
- Merriam-Webster: Definition of LEAD. [dostęp 2016-08-12].
- M.R. Moore. Lead in drinking water in soft water areas–health hazards. „Science of the Total Environment”. 7 (2), s. 109–115, 1977. DOI: 10.1016/0048-9697(77)90002-X. PMID: 841299.
- A.F. More i inni, Next-generation ice core technology reveals true minimum natural levels of lead (Pb) in the atmosphere: Insights from the Black Death, „GeoHealth”, 1 (4), 2017, s. 211–219, DOI: 10.1002/2017GH000064, ISSN 2471-1403.
- S. Mosseri, A. Henglein, E. Janata. Trivalent lead as an intermediate in the oxidation of lead(II) and the reduction of lead(IV) species. „Journal of Physical Chemistry”. 94 (6), s. 2722–2726, 1990. DOI: 10.1021/j100369a089.
- M. Mycyk, D. Hryhorczuk, Y. Amitai: Lead. W: T.B. Erickson, W.R. Ahrens, S. Aks: Pediatric Toxicology: Diagnosis and Management of the Poisoned Child. McGraw-Hill Professional, 2005. ISBN 978-0-07-141736-5.
- T. Nakashima, H. Hayashi, H. Tashiro, T. Matsushita. Gender and hierarchical differences in lead-contaminated Japanese bone from the Edo period. „Journal of Occupational Health”. 40 (1), s. 55–60, 1998. DOI: 10.1539/joh.40.55.
- National Council on Radiation Protection and Measurements, Structural Shielding Design for Medical X-ray Imaging Facilities, 2004, ISBN 978-0-929600-83-3.
- National Institute for Occupational Safety and Health: NIOSH Pocket Guide to Chemical Hazards – Lead. CDC. [dostęp 2016-11-18].
- S. Nikolayev: Indo-European Etymology. 2012. [dostęp 2016-08-21].
- N.C. Norman: Periodicity and the s- and p-Block Elements. Oxford University Press, 1996. ISBN 978-0-19-855961-0.
- J.O. Nriagu. Saturnine gout among Roman aristocrats – Did lead poisoning contribute to the fall of the Empire?. „The New England Journal of Medicine”. 308 (11), s. 660–663, 1983. DOI: 10.1056/NEJM198303173081123. PMID: 6338384.
- J.O. Nriagu, M-J. Kim. Emissions of lead and zinc from candles with metal-core wicks. „Science of the Total Environment”. 250 (1–3), s. 37–41, 2000. DOI: 10.1016/S0048-9697(00)00359-4. PMID: 10811249.
- Occupational Safety and Health Administration: Substance data sheet for occupational exposure to lead. [dostęp 2017-07-01].
- T. Olinsky-Paul: East Penn and Ecoult battery installation case study webinar. Clean Energy States Alliance, 2013. [dostęp 2017-02-28].
- R. Palmieri: The Organ. Psychology Press, 2006. ISBN 978-0-415-94174-7.
- Oxford English Dictionary, wyd. 2, Oxford University Press, 2009.
- J.H. Park, N. Bolan, M. Meghara, R. Naidu i inni. Bacterial-assisted immobilization of lead in soils: Implications for remediation. „Pedologist”, s. 162–174, 2011. [zarchiwizowane z adresu 2015-11-26].
- R.B. Parker: The New Cold-Molded Boatbuilding: From Lofting to Launching. WoodenBoat Books, 2005. ISBN 978-0-937822-89-0.
- E. Parthé: Crystal Chemistry of Tetrahedral Structures. CRC Press, 1964. ISBN 978-0-677-00700-7.
- L. Pauling: General Chemistry. W. H. Freeman and Company, 1947. ISBN 978-0-486-65622-9.
- N.G. Polyanskiy: Analytical Chemistry of the Elements: Lead. Fillipova, N. A. Nauka, 1986. (ros.).
- P.J. Prasad: Conceptual Pharmacology. Universities Press, 2010. ISBN 978-81-7371-679-9. [dostęp 2012-06-21].
- Primary Lead Refining Technical Notes [online], LDA International [dostęp 2007-04-07] [zarchiwizowane z adresu 2007-03-22].
- Progressive Dynamics, Inc: How Lead Acid Batteries Work: Battery Basics. [dostęp 2016-07-03].
- B. Putnam: The Sculptor’s Way: A Guide to Modelling and Sculpture. Dover Publications, 2003. ISBN 978-0-486-42313-5.
- P. Pyykkö. Relativistic effects in structural chemistry. „Chemical Reviews”. 88 (3), s. 563–594, 1988. DOI: 10.1021/cr00085a006.
- M.B. Rabinowitz: Imputing lead sources from blood lead isotope ratios. W: M.E. Beard, S.D. Allen Iske: Lead in Paint, Soil, and Dust: Health Risks, Exposure Studies, Control Measures, Measurement Methods, and Quality Assurance. ASTM, 1995, s. 63–75. ISBN 978-0-8031-1884-3.
- C.K. Ramage: Lyman Cast Bullet Handbook. Wyd. 3rd. Lyman Products Corporation, 1980.
- J. Randerson. Candle pollution. „New Scientist”, 2002. [dostęp 2007-04-07].
- A. Reddy, C.L. Braun. Lead and the Romans. „Journal of Chemical Education”. 87 (10), s. 1052–1055, 2010. DOI: 10.1021/ed100631y. Bibcode: 2010JChEd..87.1052R.
- F. Retief, L.P. Cilliers. Lead poisoning in ancient Rome. „Acta Theologica”. 26 (2), s. 147–164 (149–51), 2006. DOI: 10.4314/actat.v26i2.52570.
- V. Rich: The International Lead Trade. Woodhead Publishing, 1994. ISBN 978-0-85709-994-5.
- J. Rieuwerts: The Elements of Environmental Pollution. Routledge, 2015. ISBN 978-0-415-85919-6.
- M.A. Riva, A. Lafranconi, M.I. d’Orso, G. Cesana. Lead poisoning: Historical aspects of a paradigmatic „occupational and environmental disease”. „Safety and Health at Work”. 3 (1), s. 11–16, 2012. DOI: 10.5491/SHAW.2012.3.1.11. PMID: 22953225. PMCID: PMC3430923.
- I.U. Roederer i inni, The end of nucleosynthesis: Production of lead and thorium in the early galaxy, „The Astrophysical Journal”, 698 (2), The American Astronomical Society, 2009, s. 1963–80, DOI: 10.1088/0004-637X/698/2/1963, Bibcode: 2009ApJ...698.1963R, arXiv:0904.3105 [dostęp 2016-07-18].
- A. Rogalski: Infrared Detectors. Wyd. 2nd. CRC Press, 2010. ISBN 978-1-4200-7671-4. [dostęp 19-112016].
- Binäre Zintl-Phasen (Binary Zintl Phases). W: C. Röhr: Intermetallische Phasen (Intermettallic Phases). Universität Freiburg, 2017. [dostęp 2017-02-18]. (niem.).
- Lead. W: A.M. Rudolph, C.D. Rudolph, M.K. Hostetter, George E. Lister, Norman J. Siegel: Rudolph’s Pediatrics. Wyd. 21st. McGraw-Hill Professional, 2003, s. 369. ISBN 978-0-8385-8285-5.
- G.W. Samson: The divine law as to wines. J.B. Lippincott & Co., 1885.
- J. Scarborough. The myth of lead poisoning among the Romans: An essay review. „Journal of the History of Medicine and Allied Sciences”. 39 (4), s. 469–475, 1984. DOI: 10.1093/jhmas/39.4.469. PMID: 6389691.
- R.M. Schoch: Case Studies in Environmental Science. West Publishing, 1996. ISBN 978-0-314-20397-7.
- G. Schoeters, E. Den Hond, W. Dhooge, N. Van Larebeke i inni. Endocrine disruptors and abnormalities of pubertal development. „Basic & Clinical Pharmacology & Toxicology”. 102 (2), s. 168–175, 2008. DOI: 10.1111/j.1742-7843.2007.00180.x. PMID: 18226071.
- H.R. Sharma i inni, Templated three-dimensional growth of quasicrystalline lead, „Nature Communications”, 4 (2715), 2013, DOI: 10.1038/ncomms3715, Bibcode: 2013NatCo...4E2715S.
- H.R. Sharma i inni, Crystalline and quasicrystalline allotropes of Pb formed on the fivefold surface of icosahedral Ag-In-Yb, „The Journal of Chemical Physics”, 140 (170), 2014, s. 174710, DOI: 10.1063/1.4873596, Bibcode: 2014JChPh.140q4710S.
- M.S. Silverman. High-pressure (70-k) synthesis of new crystalline lead dichalcogenides. „Inorganic Chemistry”. 5 (11), s. 2067–2069, 1966. DOI: 10.1021/ic50045a056.
- S.P. Sinha i inni, Neurotoxic effects of lead exposure among printing press workers, „Bulletin of Environmental Contamination and Toxicology”, 51 (4), 1993, s. 490–93, DOI: 10.1007/BF00192162.
- A.Yu. Smirnov, V.D. Borisevich, A. Sulaberidze. Evaluation of specific cost of obtainment of lead-208 isotope by gas centrifuges using various raw materials. „Theoretical Foundations of Chemical Engineering”. 46 (4), s. 373–378, 2012. DOI: 10.1134/s0040579512040161.
- D.R. Smith, A.R. Flegal. Lead in the biosphere: Recent trends. „AMBIO”. 24, s. 21–23, 1995. JSTOR: 4314280.
- R.C. Sokol: Lead exposure and its effects on the reproductive system. W: M.S. Golub: Metals, Fertility, and Reproductive Toxicity. CRC Press, 2005, s. 117–153. ISBN 978-0-415-70040-5.
- F. Stabenow, W. Saak, M. Weidenbruch. Tris(triphenylplumbyl)plumbate: An anion with three stretched lead–lead bonds. „Chemical Communications”, s. 2342–2343, 2003. DOI: 10.1039/B305217F.
- R. Stone, An Element of Stability, „Science”, 278 (5338), 1997, s. 571–2, DOI: 10.1126/science.278.5338.571, Bibcode: 1997Sci...278..571S.
- A. Street, W. Alexander: Metals in the Service of Man. Wyd. 11th. Penguin Books, 1998. ISBN 978-0-14-025776-2.
- H.M. Szczepanowska: Conservation of Cultural Heritage: Key Principles and Approaches. Routledge, 2013. ISBN 978-0-415-67474-4.
- K. Takahashi, R.N. Boyd, G.J. Mathews, K. Yokoi. Bound-state beta decay of highly ionized atoms. „Physical Review C”. 36 (4), 1987. American Institute of Physics for the American Physical Society. OCLC 1639677. [dostęp 2013-08-27]. [zarchiwizowane z adresu 21 October 2014].
- A. Tarragó: Case Studies in Environmental Medicine (CSEM) Lead Toxicity. Agency for Toxic Substances and Disease Registry, 2012.
- J. Tétreault, J. Sirois, E. Stamatopoulou. Studies of lead corrosion in acetic acid environments. „Studies in Conservation”. 43 (1), s. 17–32, 1998. DOI: 10.2307/1506633. JSTOR: 1506633.
- The Lead Sheet Association, Think Lead research summary [online] [dostęp 2017-02-20] [zarchiwizowane z adresu 2017-02-20].
- Thomas Thomson: The History of Chemistry. Henry Colburn and Richard Bentley, 1830.
- I. Thornton, R. Rautiu, S.M. Brush: Lead: The Facts. International Lead Association, 2001. ISBN 978-0-9542496-0-1. [dostęp 2017-02-05].
- K. Thürmer, E. Williams, J. Reutt-Robey. Autocatalytic oxidation of lead crystallite surfaces. „Science”. 297 (5589), s. 2033–2035, 2002. DOI: 10.1126/science.297.5589.2033. PMID: 12242437. Bibcode: 2002Sci...297.2033T.
- B. Tolliday: Significant growth in lead usage underlines its importance to the global economy. 2014. [dostęp 2017-02-28]. [zarchiwizowane z tego adresu (2017-02-28)]. Cytat: Global demand for lead has more than doubled since the early 1990s and almost 90% of use is now in lead-acid batteries
- Toronto museum explores history of contraceptives. ABC News, 2003. [dostęp 2016-02-13].
- Agency for Toxic Substances and Disease Registry: Toxic Substances Portal – Lead. [zarchiwizowane z tego adresu (6 czerwca 2011)].
- Toxicological Profile for Lead, [w:] Agency for Toxic Substances and Disease Registry/Division of Toxicology and Environmental Medicine [online], 2007 [zarchiwizowane z adresu 2017-07-02].
- IEA Clean Coal Centre: Trace element emission from coal. 2012. [dostęp 2017-03-01].
- K. Tuček, J. Carlsson, H. Wider. Comparison of sodium and lead-cooled fast reactors regarding reactor physics aspects, severe safety and economical issues. „Nuclear Engineering and Design”. 236 (14–16), s. 1589–1598, 2006. DOI: 10.1016/j.nucengdes.2006.04.019.
- M. Tungate: Branded Beauty: How Marketing Changed the Way We Look. Kogan Page Publishers, 2011. ISBN 978-0-7494-6182-9.
- United Nations Environment Programme: Final review of scientific information on lead. Chemicals Branch, Division of Technology, Industry and Economics, 2010. [dostęp 2017-01-31].
- United States Environmental Protection Agency, Regulatory Status of Waste Generated by Contractors and Residents from Lead-Based Paint Activities Conducted in Households (August 2000) [online], 2000 [dostęp 2017-02-28].
- United States Food and Drug Administration: Q3D Elemental Impurities Guidance for Industry. 2015. s. 41. [dostęp 2017-02-15].
- United States Geological Survey, Geological Survey Professional Paper, United States Government Publishing Office, 1973, s. 314.
- United States Geological Survey, Lead [online], 2005 [dostęp 2016-02-20].
- United States Geological Survey, Lead, [w:] Mineral Commodities Summaries [online], 2017 [dostęp 2017-05-08].
- University of California, Berkeley Nuclear Forensic Search Project: Decay Chains. Nuclear Forensics: A Scientific Search Problem. [dostęp 2015-11-23].
- M. Vasmer: O.N. Trubachyov, B.O. Larin: Этимологический словарь русского языка. Wyd. 2. Progress. [dostęp 2017-03-04]. (ros.).
- T.D. Luckey, B. Venugopal: Physiologic and Chemical Basis for Metal Toxicity. Plenum Press, 1979. ISBN 978-1-4684-2952-7.
- N.A. Vogel, R. Achilles: The Preservation and Repair of Historic Stained and Leaded Glass. 2013. [dostęp 2016-10-30].
- H.A. Waldron. Lead and lead poisoning in antiquity. „Medical History”. 29 (1), s. 107–108, 1985. DOI: 10.1017/S0025727300043878. PMCID: PMC1139494.
- A.L. Wani, A. Ara, J.A. Usman, Lead toxicity: A review, „Interdisciplinary Toxicology”, 8 (2), 2015, s. 55–64, DOI: 10.1515/intox-2015-0009, PMID: 27486361, PMCID: PMC4961898.
- R.C. Weast, M.J. Astle, W.H. Beyer: CRC Handbook of Chemistry and Physics: A Ready-reference Book of Chemical and Physical Data. CRC Press, 1983. ISBN 978-0-8493-0464-4.
- The Lead Sheet Association: Weatherings to Parapets and Cornices. [dostęp 2017-02-20]. [zarchiwizowane z tego adresu (2017-02-20)].
- G.W. Webb, F. Marsiglio, J.E. Hirsch. Superconductivity in the elements, alloys and simple compounds. „Physica C: Superconductivity and its Applications”. 514, s. 17–27, 2015. DOI: 10.1016/j.physc.2015.02.037. arXiv:1502.04724. Bibcode: 2015PhyC..514...17W.
- K.W. Whitten, K.D. Gailey, R.E. David: General chemistry with qualitative analysis. Wyd. 3rd. Saunders College, 1996. ISBN 978-0-03-012864-6.
- E. Wiberg, N. Wiberg, A.F. Holleman: Inorganic Chemistry. Academic Press, 2001. ISBN 978-0-12-352651-9.
- C.E. Wilkes, J.W. Summers, C.A. Daniels, M.T. Berard: PVC Handbook. Hanser, 2005. ISBN 978-1-56990-379-7.
- D.G. Willey. The physics behind four amazing demonstrations – CSI. „Skeptical Inquirer”. 23 (6), 1999. [dostęp 2016-09-06].
- C. Winder. The history of lead – Part 1. „LEAD Action News”. 2 (1), 1993a. ISSN 1324-6011. [dostęp 2016-02-05]. [zarchiwizowane z adresu 31 August 2007].
- C. Winder. The history of lead – Part 3. „LEAD Action News”. 2 (3), 1993b. ISSN 1324-6011. [dostęp 2016-02-12]. [zarchiwizowane z adresu 31 August 2007].
- M. Windholz: Merck Index of Chemicals and Drugs. Wyd. 9. Merck & Co., 1976. Monograph 8393. ISBN 978-0-911910-26-1.
- Lead. W: World Health Organization: Air quality guidelines for Europe. Regional Office for Europe, 2000, s. 149–153. ISBN 978-92-890-1358-1. OCLC 475274390.
- World Nuclear Association: Nuclear Radiation and Health Effects. 2015. [dostęp 12-112015].
- L. Yong, S.D. Hoffmann, T.F. Fässler. A low-dimensional arrangement of [Pb9]4− clusters in [K(18-crown-6)]2K2Pb9·(en)1.5. „Inorganica Chimica Acta”. 359 (15), s. 4774–4778, 2006. Elsevier. DOI: 10.1016/j.ica.2006.04.017.
- S. Young: Battling lead contamination, one fish bone at a time. [w:] Compass [on-line]. 2012. [dostęp 2017-02-11]. [zarchiwizowane z tego adresu (2013-06-14)].
- L. Yu, H. Yu: Chinese Coins: Money in History and Society. Long River Press, 2004. ISBN 978-1-59265-017-0.
- Zhang XX. i inni, Impacts of lead/zinc mining and smelting on the environment and human health in China, „Environmental Monitoring and Assessment”, 184 (4), 2012, s. 2261–73, DOI: 10.1007/s10661-011-2115-6, PMID: 21573711.
- F. Zhao: Information Technology Entrepreneurship and Innovation. IGI Global, 2008, s. 440. ISBN 978-1-59904-902-1.
- J.J. Zuckerman, A.P. Hagen: Inorganic Reactions and Methods, the Formation of Bonds to Halogens. John Wiley & Sons, 1989. ISBN 978-0-471-18656-4.
- H. Zweifel: Plastics Additives Handbook. Hanser, 2009. ISBN 978-3-446-40801-2.
- J. Zýka. Analytical study of the basic properties of lead tetraacetate as oxidizing agent. „Pure and Applied Chemistry”. 13 (4), s. 569–581, 1966. DOI: 10.1351/pac196613040569.
| Układ okresowy pierwiastków | ||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 2 | 3[i] | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |||||||||||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||||||||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||||||||||
| 8 | Uue | Ubn | ✱ | |||||||||||||||||||||||||||||||||||||||||
| ✱ | Ubu | Ubb | Ubt | Ubq | Ubp | Ubh | Ubs | ...[ii] | ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||


