Płazy
| Amphibia | |||
| L., 1758 | |||
| Okres istnienia: dewon późny–dziś | |||
 Rzekotka zielonoliściowa, Notophthalmus viridescens, gruboskórzec meksykański, sejmuria | |||
| Systematyka | |||
| Domena | |||
|---|---|---|---|
| Królestwo | |||
| Typ | |||
| Podtyp | |||
| Gromada |
płazy | ||
| Podgromady | |||
|
| |||
Płazy (Amphibia) – gromada zmiennocieplnych kręgowców z grupy czworonogów. Zamieszkują różnorodne siedliska, większość gatunków żyje na lądzie, w gruncie, na drzewach bądź w wodach słodkich. W rozwoju przechodzą stadium larwalne, w czasie którego prowadzą wodny tryb życia, choć niektóre gatunki wykształciły adaptacje behawioralne pozwalające ominąć to ograniczenie. Kijanki przechodzą przeobrażenie, w wyniku którego oddychająca skrzelami larwa staje się dorosłym osobnikiem oddychającym płucami. Wymiana gazowa następuje również przez skórę. Niektóre niewielkie ogoniaste, jak i bezogonowe nie mają płuc i prowadzą całą wymianę gazową przez skórę. Pokrojem ciała przypominają gady, jednak w odróżnieniu od nich nie mają błon płodowych w rozwoju ontogenetycznym, w związku z czym ich rozwój musi przebiegać w środowisku wodnym. W związku ze swym rozwojem złożonym i przepuszczalną skórą płazy są wrażliwe na zmiany warunków siedliskowych i zanieczyszczenie środowiska, dlatego stanowią dobre gatunki wskaźnikowe. W ostatnich dekadach odnotowano drastyczny spadek liczebności oraz wyginięcie wielu gatunków płazów na całym świecie.
Pierwsze płazy pojawiły się w dewonie, ewoluując z ryb mięśniopłetwych, których kości oparte były na szkielecie za pośrednictwem obręczy barkowej i miednicznej, i posiadających worki płucne. Cechy te ułatwiały im bytowanie w płytkich, okresowych zbiornikach wodnych i umożliwiały krótkotrwałe wycieczki na ląd. Wczesne płazy szybko się zróżnicowały. Wśród kręgowców lądowych dominowały w okresie karbonu i permu, później liczniejsze stały się gady i inne owodniowce. Z biegiem czasu zmniejszała się liczba taksonów wyższej rangi płazów. Ostatecznie pozostała tylko jedna podgromada – Lissamphibia. Obejmuje ona trzy współczesne rzędy: płazy bezogonowe, płazy ogoniaste i płazy beznogie. Całkowita liczba znanych gatunków płazów wynosi około 8500[1], z czego 90% należy do bezogonowych. Najmniejszym z płazów i jednocześnie najmniejszym kręgowcem jest nowogwinejski płaz bezogonowy Paedophryne amauensis osiągający 7,7 mm długości. Z kolei największym dzisiejszym płazem jest mierząca 1,8 m długości salamandra olbrzymia chińska. Nie może się ona równać z wymarłym dziewięciometrowym prionozuchem z gwadalupu z Brazylii. Płazami zajmuje się nauka zwana batrachologią, natomiast dziedzina wiedzy obejmująca płazy i gady to herpetologia.
Ewolucja[edytuj | edytuj kod]
Najstarsze ślady Tetrapodomorpha to tropy z Zachełmia. Liczą one 397 milionów lat (eifel, dewon środkowy[3]). Zmieniły one wyobrażenie o ewolucji tej grupy, gdyż przed dokonaniem tego odkrycia nie podejrzewano, że jej przedstawiciele żyli tak wcześnie[4]. Opisali je w 2012 w czasopiśmie Nature: Grzegorz Niedźwiedzki, Piotr Szrek, Katarzyna Narkiewicz, Marek Narkiewicz i Per E. Ahlberg. Poprzedzają one o 10 milionów lat grupę Elpidostegalia, do której należy choćby Tiktaalik, są 18 milionów lat starsze od najstarszych znanych skamieniałości ciał czworonogów, pochodzących z franu (dewon późny)[3]. W 2012 odkryto jednak jeszcze wcześniejsze skamieniałości bezpośrednich przodków płazów: szczątki Tungsenia paradoxa, przypominającego rybę czworonoga, datowane na około 409 milionów lat temu (prag, dewon wczesny), są prawdopodobnie pozostałościami najstarszego ze znanych czworonogów[5].
Pierwsze płazy pojawiły się w późnym dewonie, około 370 milionów lat temu. Wyewoluowały one z mięśniopłetwych, ryb przypominających dzisiejsze celakantokształtne czy dwudyszne[6]. Miały one wielostawowe, przypominające kończyny płetwy, wsparte na kościach mających oparcie na kręgosłupie, i zakończone palcami, umożliwiające pełzanie po dnie morskim. Niektóre z ryb wykształciły prymitywne płuca pomagające im oddychać tlenem atmosferycznym w wodach stojących dewońskich bagien, ubogich w tlen. Gdy wymagały tego warunki, zwierzęta te mogły przejść na ląd z pomocą swych silnych płetw. Ostatecznie ich wzmocnione kością płetwy przekształciły się w kończyny. Ryby mięśniopłetwe są najprawdopodobniej przodkami wszystkich czworonogów, a więc, włącznie z płazami, także gadów, ptaków i ssaków. Choć były zdolne do pełzania po lądzie, większość tych dawnych, zaliczanych już do Tetrapodomorpha ryb ciągle spędzała większość czasu w wodzie. Rozpoczął się już u nich rozwój płuc, ale oddychały one głównie skrzelami[7].
Ichtiostega należała do pierwszych, prymitywnych płazów, posiadających nozdrza zewnętrzne i bardziej wydajne płuca. Miała cztery mocne łapy, szyję, opatrzony w płetwy ogon i czaszkę przypominającą tę spotykaną u mięśniopłetwej ryby eustenopterona[6]. Płazy wykształciły przystosowania (adaptacje) umożliwiające im przetrwanie dłuższego czasu poza wodą. Poprawiała się wydajność ich płuc. Ponieważ w środowisku półwodnym lub lądowym siła wyporu wody nie zapewniała oparcia dla ich ciała, oparcie to stopniowo przejmował szkielet i płetwy, które w wyniku doboru naturalnego stawały się mocniejsze i cięższe. W rezultacie w toku ewolucji płetwy przekształciły się w kończyny przednie i tylne zakończone pięcioma bądź większą liczbą palców[8]. Pokrycie ciała (skóra) ewoluowało w kierunku zwiększenia zdolności zatrzymywania płynów ciała i przeciwdziałania wysychaniu[7]. Rybia kość hyomandibula (część łuku gnykowego) w okolicy gnykowej za skrzelami zmniejszyła się, przekształcając w strzemiączko płaziego ucha. Poprawiło to zdolności odbierania dźwięków na lądzie przenoszonych przez powietrze[9]. Wielokrotnie pofałdowane płazie zęby przypominają zęby ryb doskonałokostnych (tzw. zęby labiryntowe), podobnie parzyste kości nadoczodołowe na tyle głowy; żadnej z tych struktur nie znaleziono u innego organizmu z królestwa zwierząt[10].

Pod koniec okresu dewońskiego, 360 milionów lat temu, morza, rzeki i jeziora obfitowały w życie. Na lądzie panowały wczesne rośliny lądowe. Nie było nań kręgowców[10] poza tymi, jak wspomniana ichtiostega, które mogły czasami wychodzić z wody. Uważa się, że kręgowce te na lądzie poruszały się nieporadnie, ciągnąc ciało przednimi kończynami i wlokąc tylną część ciała w podobny sposób, jak czynią to dziś lwy morskie[8].
W karbonie klimat był ciepły i wilgotny. Lądy porastały mchy, paprocie, skrzypy, w tym kalamity. Istniały rozległe bagna. Oddychające tlenem atmosferycznym stawonogi ewoluowały i zajmowały lądy, dzięki czemu również na lądzie mięsożerne płazy mogły znaleźć obfite źródła pokarmu. Presja selekcyjna na powstawanie i udoskonalanie przystosowań do środowiska lądowego nasiliła się. Na lądzie nie było wtedy innych czworonogów i płazy znajdowały się na szczycie łańcuchów pokarmowych. Zajmowana przez nie nisza ekologiczna była podobna do tej, jaką współcześnie zajmują krokodyle. Większość ówczesnych płazów cechowała się stożkowatą budową ciała, silnym ogonem, miała kończyny (przednie i tylne) i worki płucne – mogły więc oddychać powietrzem atmosferycznym[10]. Jako szczytowi drapieżnicy niekiedy osiągały kilka metrów długości. Polowały na wiele rodzajów ryb i karbońskie stawonogi lądowe, wśród których były gatunki cechujące się wielkimi rozmiarami. Cały czas musiały jednak powracać do wody w celu złożenia pozbawionych skorupek jaj. Także dziś większość płazów przechodzi całkowicie wodne stadium larwalne, w którego czasie oddychają skrzelami, jak ich rybi przodkowie. Dopiero rozwój jaj wyposażonych w błony płodowe chroniące zarodek przed wysychaniem umożliwił gadom reprodukcję na lądzie i stopniowo zapewnił im dominację w tym środowisku[6].
W triasie (250–200 milionów lat temu) gady zaczęły wypierać płazy. Wedle Carrolla liczba rodzin zmniejszała się, osiągając minimum w jurze. Zgodnie z zapisem kopalnym Lissamphibia, jedyna przetrwała grupa zawierająca wszystkie dzisiejsze płazy, mogła oddzielić się od wymarłych grup temnospondyli i lepospondyli pomiędzy karbonem późnym (pensylwan) a triasem wczesnym. Względna rzadkość skamieniałości uniemożliwia precyzyjne datowanie[7], jednak niedawne analizy molekularne, bazujące na sekwencjonowaniu wielu loci genowych, sugerują jako czas powstania tej grupy późny karbon/wczesny perm[11]. Do synapomorfii tej grupy zalicza się niektóre cechy zębów (tzw. pedeicellate teeth) i uszu (papillae). Ich najbliższymi krewnymi wedle Wellsa jest grupa temnospondyli z rodziny Dissorophidae czy nadrodziny Dissorophoidea, zawierającą także Branchiosauridae[12] (rodzina ta obejmuje takie rodzaje, jak Apateon czy Melanerpeton[13]). Także pogląd o zmniejszeniu się rozmiarów płazów nie został potwierdzony: żyła wtedy liczna grupa płazów tarczogłowych zwana kapitozaurami. Z wyglądu przypominały one współczesne krokodyle. Cechowały się płaskimi, wydłużonymi czaszkami. W przeciwieństwie do większości dzisiejszych płazów nie traciły one w dorosłym życiu linii nabocznej, co sugeruje wodne środowisko życia. Prawdopodobnie polowały w nim na ryby i płazy. Wyróżnia się wśród nich 5 rodzin: prymitywne parotozuchidy i erytrozuchidy, cechujące się zamkniętym wcięciem usznym paracyklotozauridy i cyklotozauridy oraz górujące nad pozostałymi rozmiarami mastodonzauridy o dużych oczodołach. Do największych przedstawicieli tej grupy zalicza się mastodonzaur, osiągający 6 m długości. Grupę tę reprezentują też znaleziska z Polski: Capitosaurus silesiacus, Tatrasuchus kulczyckii, parotozuch, Cyclotosaurus intermedius[14].

Powstanie i pokrewieństwo ewolucyjne pomiędzy trzema głównymi grupami płazów współczesnych stanowi przedmiot debaty. Analizy filogenetyczne oparte o sekwencje rybosomalnego DNA wskazują na to, że płazy beznogie i ogoniaste są ze sobą bliżej spokrewnione, niż z bezogonowymi. Wydaje się także, że wszystkie trzy główne grupy zróżnicowały się w paleozoiku, bądź wczesnym mezozoiku (około 250 milionów lat temu), jeszcze przed rozpadem superkontynentu Pangei, niedługo po oddzieleniu się od ryb mięśniopłetwych. Krótkość tego okresu i szybkość, z jaką przebiegała radiacja ewolucyjna, wiążą się ze względną rzadkością znalezisk skamieniałych prymitywnych płazów[15]. Zapis kopalny wykazuje tutaj duże luki, jednak w 2008 opisano odkrycie Gerobatrachus we wczesnopermskich skałach Teksasu w 2009. Gatunek ten stanowi ewolucyjną formę przejściową, jeśli chodzi o wiele cech współczesnych bezogonowych, wydaje się łącznikiem pomiędzy wcześniejszymi płazami paleozoiku a ich młodszymi krewnymi. Ten przedstawiciel temnospondyli dzieli z kladem koronnym ogoniastych połączone dystalne kości stępu (baale commune) i guzek na dźwigaczu nazywany tuberculum interglenoideum. Budowa lemiesza łączy go zarówno z płazami ogoniastymi, jak i bezogonowymi. Z tą ostatnią grupą dzieli on również szeroką czaszkę, ułożenie prętowatego kształtu kości podniebiennych, skrócone kręgi przedkrzyżowe, rozmieszczenie paliczków stóp. Pewnymi cechami zębów przypomina współczesne płazy wszystkich 3 rzędów. Analiza molekularna sugeruje, że rozdzielenie się taksonów ogoniastych i bezogonowych wydarzyło się wcześniej, niż na to wskazują dowody paleontologiczne[16].
Wczesne płazy rozwinęły także inne adaptacje do życia na lądzie, w tym nowe sposoby przemieszczania się. W wodzie poruszały się na sposób rybi, poprzez faliste, z boku na bok, ruchy ciała i ogona. Ale na lądzie potrzebny był zupełnie inny sposób. Ich kręgosłupy, kończyny, obręcze miedniczne i mięśnie musiały być wystarczająco mocne, by unieść ciało nad podłożem. U osobników dorosłych niektórych gatunków nastąpił zanik linii bocznej. Pojawiły się natomiast przystosowania do odbioru bodźców przenoszonych przez powietrze. Płazy na lądzie potrzebowały także nowych mechanizmów regulacji temperatury ciała, by poradzić sobie z fluktuacjami zmiennej temperatury otoczenia. Ponadto w środowisku lądowym wystawiały swą skórę na większe, w porównaniu do środowiska wodnego, dawki szkodliwego promieniowania ultrafioletowego (woda absorbuje promieniowanie UV). W odpowiedzi na to ich skóra zmieniła się. Zwiększyły się jej zdolności ochronne, lepiej zabezpieczała też przed utratą wody[17].
Systematyka[edytuj | edytuj kod]
Naukowy termin „Amphibia” pochodzi ze starożytnej greki od słowa ἀμφίβιος (amphíbios), oznaczającego „dwa rodzaje życia”. Składa się on z ἀμφί „oba, wszystkie rodzaje” i βιος znaczącego „życie”. Termin służył początkowo jako przymiotnik określający zwierzęta zdolne do życia na lądzie i w wodzie, w tym wydry czy foki[18]. Tradycyjnie wyróżnia się gromadę płazów Amphibia obejmującą wszystkie czworonogi niezaliczane do owodniowców. Tak więc płazy w tym najszerszym znaczeniu (sensu lato) podzielono na 3 podgromady, z których 2 wyginęły. Podział ten prezentuje się następująco[19]:
- podgromada Labirynthodontia† (zróżnicowana grupa z paleozoiku i wczesnego mezozoiku)
- podgromada Lepospondyli† (mała grupa paleozoiczna, czasami włączana do labiryntodontów, może w rzeczywistości być bliżej spokrewniona z owodniowcami, niż z Lissamphibia)
- podgromada Lissamphibia (wszystkie współczesne płazy)
- rząd Anura (płazy bezogonowe; np. żaby, ropuchy, obecne co najmniej od jury, obecnie 5602 gatunki w 48 rodzinach)
- rząd Caudata (płazy ogoniaste; np. traszki, salamandry, obecne co najmniej od jury, obecnie 571 gatunków w 10 rodzinach)
- rząd Gymnophiona (płazy beznogie; np. marszczelce, obecne co najmniej od jury, obecnie 190 gatunków w 10 rodzinach).

Rzeczywista liczba gatunków w każdej z grup zależy od przyjętego systemu klasyfikacji taksonomicznej. Dwa najpopularniejsze systemy klasyfikacji płazów to klasyfikacja University of California (Berkeley) zamieszczona na stronie AmphibiaWeb i klasyfikacja herpetologa Darrela Frosta i Amerykańskiego Muzeum Historii Naturalnej, również dostępna w internecie w bazie danych Amphibian Species of the World[20]. Powyżej podane wartości liczby gatunków opierają się na systemie Frosta. Wedle Marthy Crump istnieją obecnie (2009) 174 gatunki płazów beznogich, 571 ogoniastych i 5602 – bezogonowych. Daje to w sumie 6347 gatunków płazów, co stanowi 0,5% wszystkich odkrytych dotąd gatunków zwierząt[21]. W związku z postępem nauki (identyfikacja gatunków kryptycznych) i odkryciami nowych gatunków w naturze w 2008 roku znano już 7044 gatunków płazów[22].
Klasyfikacje filogenetyczne nie wyróżniają labiryntodontów jako osobnego taksonu, uznając go za parafiletyczny bez zdefiniowanych unikatowych cech, synapomorfii, którego jedynymi wspólnymi cechami są plezjomorfie. Klasyfikacje różnią się w zależności od uznawanej przez autora filogenezy, a także od jego upodobań w użyciu dwóch sposobów definiowania kladów (tzw. stem-based i node-based methods). Tradycyjnie płazy jako gromadę definiuje się jako wszystkie czworonogi ze stadium larwalnym. Grupa obejmująca ostatnich wspólnych przodków wszystkich współczesnych płazów i ich potomków nazywa się z kolei Lissamphibia. Filogeneza płazów ery paleozoicznej nie jest pewna. Lissamphibia mogą więc należeć do jednej z wymarłych grup, np. do temnospondyli (tradycyjnie umieszczanych w podgromadzie labiryntodontów) bądź lepospondyli, a wedle niektórych analiz nawet do owodniowców. Przemawia to za usunięciem przez nomenklaturę filogenetyczną licznych bazalnych dewońskich lub karbońskich przypominających płazy grup, a uznawanych za płazy w systemie linneuszowskim. Taksonomia opierająca się o kladystykę umieszcza je gdzie indziej[23]. Jeśli wspólny przodek płazów i owodniowców należy do Amphibia, czyniłoby to grupę parafiletyczną[24].
Wszystkie dzisiejsze płazy należą do podgromady Lissamphibia, zazwyczaj uznawanej za klad, czyli zbiór gatunków pochodzących od wspólnego przodka, obejmujący 3 dzisiejsze rzędy (bezogonowe, ogoniaste i beznogie)[25]. Zasugerowano, że Caudata powstały oddzielnie z przodka przypominającego temnospondyle, a nawet, że beznogie stanowią grupę siostrzaną zaawansowanych Reptiliomorpha, a więc są bliskimi krewnymi owodniowców[16]. Choć znane są szczątki kilku starszych „pra-żab” o prymitywnych cechach, najstarszym znanym właściwym przedstawicielem grupy bezogonowych jest Prosalirus bitis z dolnojurajskiej formacji Kayenta z Arizony. Anatomicznie wykazuje znaczne podobieństwo do współczesnych płazów bezogonowych[26]. Najstarszy znany przedstawiciel rzędu beznogich to inny gatunek wczesnojurajski, Eocaecilia micropodia, także pochodzący z Arizony[27]. Najwcześniejszy znany płaz ogoniasty nosi nazwę Beiyanerpeton jianpingensis z jury późnej, jego szczątki znaleziono na północnym wschodzie Chin[28].
Niektórzy specjaliści toczą spór o to, czy uznać skaczące za nadrząd obejmujący rząd bezogonowych, czy też nadać tym ostatnim rangę podrzędu w obrębie rzędu skaczących. Poza tym, choć Lissamphibia podzielono tradycyjnie na 3 rzędy, wymarła rodzina zwierząt przypominających płazy ogoniaste, Albanerpetontidae, umieszczana jest obecnie w Lissamphibia obok nadrzędu Salientia. Co więcej, Salientia obejmuje wedle niektórych wszystkie 3 współczesne rzędy oraz triasowe triadobatracha[29] i czatkobatracha[30].
Przegląd[edytuj | edytuj kod]
Płazy, w odróżnieniu od pozostałych przedstawicieli nadgromady czworonogów, nie mają błon płodowych[31][32]. Z tego względu płazy wymagają do rozrodu środowiska wodnego. Niektóre gatunki wykształciły różne strategie ochrony czy przenoszenia potomstwa w wodnym stadium larwalnym[17]. Nie zamieszkują też mórz, z wyjątkiem jednego gatunku (żaby krabożernej[33]) zasiedlającego wody słonawe bagien mangrowych[34]. Na lądzie konieczność utrzymania wilgotnej skóry ogranicza ich występowanie do siedlisk wilgotnych[17].

Najmniejszym z płazów i najmniejszym kręgowcem zarazem jest przedstawiciel rodziny wąskopyskowatych, bezogonowy z Nowej Gwinei o nazwie Paedophryne amauensis. Opisano go w 2012. Osiąga średnio 7,7 mm długości. Należy do rodzaju obejmującego 4 z 10 najmniejszych gatunków płazów[35]. Z kolei największy z żyjących obecnie płazów to dorastająca 1,8 m długości salamandra olbrzymia chińska (Andrias davidianus)[36]. Wydaje się jednak mała przy największym płazie wszech czasów, wymarłym dziewięciometrowym prionozuchu, przypominającym krokodyla temnospondylu, zamieszkującym tereny obecnej Brazylii w epoce środkowego permu 270 milionów lat temu[37]. Największym przedstawicielem bezogonowych jest z kolei afrykański goliat płochliwy (Conraua goliath), mierzący 32 cm i ważący 3 kg[36]
Płazy są zmiennocieplne (ektotermiczne) – tzn. nie mają zdolności regulowania ciepłoty swego ciała, tak, jak wyższe kręgowce – ssaki czy ptaki. W związku z tym aktywność ich zależy w dużej mierze od temperatury otoczenia. Ich metabolizm przebiega wolno. Przekłada się to na niewielkie potrzeby energetyczne, a więc i na nieznaczną ilość zjadanego pożywienia. Osobniki dorosłe mają gruczoły łzowe i ruchliwe powieki. Większość gatunków ma uszy (patrz sekcja: „Układ nerwowy i narządy zmysłów”). Odbiera nimi wibracje przenoszone przez powietrze bądź podłoże. Mają umięśniony język. U wielu gatunków może być on wysuwany z jamy ustnej. Kręgi współczesnych płazów z wyrostkami stawowymi są całkowicie skostniałe. Żebra są zwykle krótkie[38] bądź nie ma ich wcale[39], mogą być przyrośnięte do kręgów. Skóra zawiera mało keratyny, nie wytwarza łusek, nie licząc łusek charakterystycznych dla ryb u niektórych Apoda. Jest ona z reguły gładka, rzadziej lekko chropowata i pokryta drobnymi brodawkami. W skórze licznie występują gruczoły śluzowe, zwilżające ją swoją wydzieliną. U niektórych gatunków występują także gruczoły wytwarzające toksyny. Serce składa się z trzech części: dwóch przedsionków i pojedynczej komory. Występuje pęcherz moczowy. Azotowe produkty przemiany materii usuwane są w postaci mocznika[38]. Jaja, zwane u żab skrzekiem, składane są do wody przez większość gatunków płazów. Są one otoczone galaretowatą otoczką pęczniejącą szybko po ich złożeniu, spełniającą rolę ochronną i odżywczą dla zarodków. Nie mają one nigdy twardych, wapiennych skorupek niepotrzebnych im w środowisku wodnym[40]. Wylęgają się z nich larwy, czyli kijanki. Prowadzą one wodny tryb życia. Przechodzą przeobrażenie (metamorfozę), w efekcie którego przybierają kształt dorosłych osobników, które żyją na lądzie[38]. Płazy prowadzą też wymianę gazową przez skórę[17].
Płazy bezogonowe[edytuj | edytuj kod]

Polski termin „płazy bezogonowe” łączono niekiedy z nazwą Salientia[41]. Ich nazwa naukowa Anura wywodzi się z łaciny od an-, czyli „bez”, oraz ze starożytnej greki, gdzie oura oznacza „ogon”. Nie mają ogona. Zwierzęta te mają silne tylne kończyny trzymane w zgięciu, krótsze przednie łapy, palce spięte błoną pławną bez pazurów. Cechują się też dużymi oczami i wilgotną, gruczołowatą skórą[25]. Stosowane niekiedy określenia: „żaba” (ang. frog) – w stosunku do płazów bezogonowych o skórze gładkiej – i „ropucha” (toad) – dla członków rzędu o skórze brodawkowatej – nie mają nic wspólnego z taksonomią i są od nich liczne wyjątki. Prawdziwymi ropuchami (true toad) są jedynie przedstawiciele rodziny ropuchowatych (Bufonidae)[42].
Przedstawiciele Anura różnią się wielkością. Największy ich przedstawiciel to trzydziestocentymetrowy goliat płochliwy (Conraua goliath) zamieszkujący Afrykę Zachodnią[43], najmniejszy to wspominany już mierzący 7,7 mm Paedophryne amauensis, występujący na Nowej Gwinei, najmniejszy znany kręgowiec[44]. Choć większość gatunków jest związana z wodą i siedliskami wilgotnymi, niektóre wyspecjalizowały się w kierunku życia na drzewach albo na pustyniach. Spotyka się je na całym świecie z wyjątkiem obszarów polarnych i mórz[45].
Anura dzielą się na 3 podrzędy, jednak pokrewieństwo pomiędzy nimi pozostaje niejasne[46]. Podrząd Archaeobatrachia zawiera 4 rodziny prymitywnych płazów bezogonowych: Ascaphidae, kumakowate (Bombinatoridae), ropuszkowate (Discoglossidae) i Liopelmowate (Liopelmatidae) (niektórzy autorzy przypuszczają, że podrząd ten jest parafiletyczny)[47]. Większe zaawansowanie ewolucyjne wykazują Mesobatrachia, wśród których umieszcza się 6 rodzin. Zaliczają się doń ryjące w ziemi Megophryidae, grzebiuszkowate (Pelobatidae), nurzańcowate (Pelodytidae), Scaphiopodidae i Rhinophrynidae, a oprócz nich obligatoryjnie wodne grzbietorodowate (Pipidae). Mają pewne cechy pośrednie pomiędzy pozostałymi podrzędami[47]. Pozostałe rodziny płazów należą do najliczniejszego z podrzędów, Neobatrachia. Zaliczają się tu najpospolitsze gatunki. Aż 96% z ponad 5000 współcześnie żyjących gatunków Anura to właśnie Neobatrachia[15].
Płazy ogoniaste[edytuj | edytuj kod]

Rząd płazy ogoniaste nazywany jest naukowo Caudata[48]. Termin wywodzi się z łacińskiego słowa cauda oznaczającego „ogon”[49]. Terminem Urodela określa się takson obejmujący ich wszystkich obecnie żyjących przedstawicieli[50]. To przypominające pokrojem ciała jaszczurki zwierzęta o wydłużonym ciele. Wymieniona cecha należy jednak do symplezjomorfii, a Caudata nie są bliżej spokrewnione z jaszczurkami, niż ze ssakami[51]. Caudata nie mają pazurów ani łusek na skórze, gładkiej bądź pokrytej guzkami. Mają ogon, zazwyczaj spłaszczony bocznie, często wyposażony w płetwę. Największa jest salamandra olbrzymia chińska (Andrias davidianus). Odnotowano osobniki osiągające 1,8 m długości[52]. Najmniejsze rozmiary ma Thorius pennatulus z Meksyku. Rzadko przekracza 20 mm długości[53]. Caudata występują na dużych obszarach Holarktyki na półkuli północnej. Rodzina bezpłucnikowatych (Plethodontidae) spotykana jest również w Ameryce Środkowej i Południowej na północ od Niziny Amazonki[45]. Członkowie kilku rodzin ogoniastych wykazują neotenię. Niekiedy w ogóle nie kończą metamorfozy lub też osobniki dorosłe przejawiają pewne cechy larwalne[54]. Większość przedstawicieli ogoniastych mierzy mniej niż 15 cm długości. Mogą prowadzić lądowy bądź wodny tryb życia, jak również spędzać po części roku w obu tych środowiskach. Na lądzie zazwyczaj spędzają dzień ukryte pod kamieniami czy kłodami drewna lub w gęstej roślinności. Wychodzą wieczorem i nocą, by żerować na dżdżownicach, owadach i innych bezkręgowcach[45].

Podrząd Cryptobranchoidea obejmuje prymitywne Caudata. Ich skamieniałości, do których należą szczątki ponaddwumetrowej długości, znaleziono w Ameryce Północnej, Europie i Azji. Najstarsze z nich, północnoamerykańskie, datuje się na paleocen. Wśród form żyjących obecnie skrytoskrzelnych wymienia się jedynie 3 gatunki: salamandrę olbrzymią chińską (Andrias davidianus), salamandrę olbrzymią japońską (Andrias japonicus) i diabła błotnego (Cryptobranchus alleganiensis) z Ameryki Północnej. Te duże płazy zachowują pewne cechy larwalne w stadium dorosłym. Ich oczu nie okrywają powieki, a szpary skrzelowe nie zanikają. Unikatowe cechy to zdolność do ssania, oraz obniżanie lewej bądź prawej części żuchwy[55]. Samce kopią gniazda i zachęcają samice do złożenia w nich sznurów jaj, których potem pilnują. Oddychając płucami, prowadzą też wymianę gazową przez liczne fałdy ich cienkiej skóry, której naczynia włosowate biegną płytko pod powierzchnią[56]. Ich bliskimi krewnymi są kątozębne (Hynobiidae), 50[57]-60 gatunków zgrupowanych w 8[58]-10[57] rodzajach. Zamieszkują Azję poza jednym gatunkiem żyjącym w europejskiej części Rosji. Osobniki dorosłe mają powieki, nie zachowują szpar skrzelowych[58].
Podrząd Salamandroidea zawiera ewolucyjnie zaawansowane Caudata. Różnią się od poprzednio opisanego zrośniętymi kośćmi prearticular bones w żuchwie, jak również obecnością zapłodnienia wewnętrznego. U salamandrowatych samiec pozostawia pakiet nasienia, spermatofor. Jego wybranka podnosi go i umieszcza w swej kloace, gdzie je przechowuje, zanim złoży jaja (skrzek)[59]. Najliczniejsza rodzina tego podrzędu to bezpłucnikowate (Plethodontidae), nieposiadające płuc. Zalicza się tutaj 60% gatunków płazów ogoniastych. Rodzina salamandrowatych obejmuje właściwe salamandry. W odniesieniu do niektórych jej członków z podrodziny Pleurodelinae stosuje się miano traszki[25].
Trzeci podrząd, Sirenoidea, zawiera tylko 4 gatunki zaliczane do rodziny syrenowatych. Przypominają pokrojem ryby z rzędu węgorzokształtnych. Są to zwierzęta wodne. Ich przednie kończyny uległy znacznej redukcji, a tylne w ogóle nie występują[60]. Wydaje się, że zapłodnienie jest zewnętrzne, bowiem syreny nie mają gruczołów kloakalnych, którymi samce salamandrowatych tworzą spermatofory, samice zaś nie dysponują zbiornikami nasiennymi do przechowywania spermy. Jednakowoż jaja składane są pojedynczo, a behawior nie sprzyja zapłodnieniu zewnętrznemu[59].
Płazy beznogie[edytuj | edytuj kod]

Rząd płazy beznogie nazywa się naukowo Gymnophiona od greckich słów gymnos znaczącego „nagi” i ophis oznaczającego węża bądź Apoda od łacińskiego przedrostka a- znaczącego „bez” i greckiego poda oznaczającego „nogi”. Obejmuje długie, cylindryczne, beznogie stworzenia przypominające z wyglądu węże bądź pierścienice. Osobniki dorosłe osiągają długość od 8 do 75 cm z wyjątkiem Caecilia thompsoni dorastającej do 150 cm. Ich skóra ma dużą liczbę poprzecznych fałdów, a u niektórych gatunków zawiera niewielkie osadzone w niej łuski skórne. Szczątkowe oczy pokrywa skóra. Odbierają one prawdopodobnie jedynie różnice w natężeniu światła. Para krótkich czułków za oczami może się wydłużać. Stanowią one narząd zmysłów czucia i węchu. Większość płazów beznogich żyje pod ziemią, drążąc w wilgotnej glebie, w zgniłym drewnie czy pod ściółką. Niektóre prowadzą wodny tryb życia[61]. Większość gatunków składa jaja pod ziemią. Wylęgające się larwy zmierzają do pobliskich zbiorników wodnych. Inne gatunki wysiadują jaja, a larwy przechodzą metamorfozę, zanim się jeszcze wyklują. Kilka gatunków jest jajożyworodne – podczas pobytu w jajowodach żywią się one wydzieliną gruczołów[62]. Gymnophiona zamieszkują tropikalną Afrykę, Azję, Amerykę Południową i Środkową[63].
Anatomia i fizjologia[edytuj | edytuj kod]
Skóra[edytuj | edytuj kod]

Pokrycie ciała obejmuje pewne elementy typowe dla kręgowców lądowych, jak obecność wysoce zrogowaciałych warstw zewnętrznych, odnawiających się okresowo w procesie linienia kontrolowanym przez przysadkę i tarczycę. Miejscowe zgrubienia, często zwane brodawkami, występują pospolicie, np. u ropuchowatych. Warstwa zewnętrzna podlega okresowemu zrzucaniu w mniejszym bądź większym stopniu w jednym kawałku, w przeciwieństwie do ptaków czy ssaków, zrzucających skórę w płatach. Płazy często zjadają swą starą skórę[45]. Wyjątek stanowią płazy beznogie. Wytwarzają one zbudowane z kolagenu i zmineralizowane[21] łuski skórne osadzone w skórze właściwej, pomiędzy fałdami. Podobieństwo do łusek ryb kostnych jest jednak w znacznej mierze powierzchowne. Jaszczurki i niektóre płazy bezogonowe mają nieco podobne osteodermy tworzące kostne depozyty w skórze właściwej, nie są to jednak cechy homologiczne a analogiczne, powstałe w wyniku konwergencji. Podobne struktury powstały niezależnie w różnych liniach kręgowców[64].

Skóra płazów przepuszcza wodę. Bierze także udział w wymianie gazowej. Pozwala to dorosłym płazom oddychać bez wynurzania się na powierzchnię wody, a nawet trwać w stanie hibernacji na dnie zbiornika[45]. By zabezpieczyć cienką i delikatną skórę przed wysychaniem, Amphibia wytworzyły gruczoły śluzowe, głównie na głowie, grzbiecie i ogonie. Struktury te produkują wydzieliny utrzymujące powłokę ciała wilgotną. Poza tym wiele gatunków ma ziarniste gruczoły tworzące niesmaczne lub toksyczne substancje. Niektóre płazie toksyny mogą nawet spowodować zgon człowieka[65]. Główne gruczoły produkujące toksyny, gruczoły przyuszne, czyli parotydy, wytwarzają neurotoksynę zwaną bufotoksyną. Leżą one za uszami bądź wzdłuż grzbietu przedstawicieli rzędu bezogonowych, za oczami przedstawicieli rzędu ogoniastych lub na górnej powierzchni ciała płazów beznogich[66]. Z uwagi na obecność dużych worków limfatycznych skóra Anura słabo przylega do ciała[41].
Kolor skóry płazów zależy od trzech warstw komórek zawierających pigment, zwanych chromatoforami. Wspomniane 3 warstwy składają się z usytuowanych najgłębiej melanoforów, leżących pośrodku guanoforów, bogatych w ziarnistości i produkujących niebieskozielony barwnik, oraz lipoforów tworzących najbardziej powierzchowną warstwę żółtą[67]. Inny podział mówi o melanoforach, ksantoforach (żółte), erytroforach (czerwone), leukoforach (białe), cyjanoforach (niebieskie) i irydoforach (srebrzyście lśniące kryształtki guaniny)[68]. Osobniki wielu gatunków potrafią zmieniać barwę. Przemianę rozpoczyna hormon wydzielany przez przysadkę. Inaczej, niż u ryb kostnych, układ nerwowy nie kontroluje zmiany koloru bezpośrednio. Zmiana następuje też wolniej, niż u ryb. Jaskrawe ubarwienie oznacza, że zwierzę jest toksyczne, ostrzega przed tym drapieżniki[67]. Często występuje też ubarwienie maskujące, zielone u żab zielonych, brunatne i płowe u żaby moczarowej czy ropuchy paskówki. Niekiedy spotyka się też albinosy, czyli osobniki pozbawione ciemnego barwnika[39]. Jest to u płazów cecha dziedziczona recesywnie, związana z brakiem w skórze czarnego barwnika (melaniny). Występuje na przykład u traszki zwyczajnej, helweckiej, iberyjskiej czy karpackiej[68]. Z drugiej strony nadmiar tego barwnika określa się melanizmem[39]. Stopień melanizmu rośnie wraz z szerokością geograficzną, czego dowiodły badania przeprowadzone na populacjach żaby trawnej. U tego gatunku na barwę ciała duży wpływ wywiera środowisko życia[69]. Osobniki melanistyczne żyją na dużych szerokościach geograficznych, jak też na dużych wysokościach. Poza tym starsze osobniki mają w skórze więcej melaniny, niż młodsze. W przeciwieństwie do innych zwierząt (gady, ptaki, ssaki) poziomu melanizmy nie można wytłumaczyć u tego gatunku sekwencją DNA kodującą melanokortynę 1. Nie wyklucza się jednak, że jest to cecha poligenowa[70].
Szkielet i poruszanie się[edytuj | edytuj kod]
Szkielet płazów jest strukturalnie homologiczny ze szkieletami innych czworonogów, występując w licznych wariacjach. Kości cechują się dużym udziałem przestrzeni pustych i przez to niewielką masą. Układ kostno-mięśniowy jest silny, by wesprzeć głowę i ciało. Kręgi łączą się ze sobą poprzez zachodzące na siebie wyrostki. Dobrze rozwinięta obręcz miednicza wiąże się z kręgosłupem parą żeber krzyżowych. Kość biodrowa opada w kierunku przednim i ciało zwierzęcia znajduje się bliżej podłoża, niż w przypadku ssaków[71].
Szkielet ten wyróżnia się dużą ilością chrząstki. U ropuszkowatych czy grzebiuszkowatych nie dochodzi do kostnienia głów kości długich przez całe życie płaza[39].
Czaszkę określa się jako płaską i szeroką, szczególnie w okolicy potylicznej. Łączy się ona z kręgosłupem, dokładniej z pierwszym kręgiem odcinka szyjnego, dzięki dwóm kłykciom potylicznym. Pozwala to wyłącznie na ruchy głowy w jednej płaszczyźnie. Obrotnik (specjalny drugi kręg szyjny) nie występuje[39]. Kostnienie czaszki przebadano dokładnie u nielicznych gatunków, między innymi u kumaka dalekowschodniego. Zaobserwowano różnice międzyosobnicze pomiędzy kolejnością kostnienia poszczególnych kości. Etapu kostnienia czaszki nie można też wywnioskować ze stadium rozwoju larwy. Zdarza się, że osobnik morfologicznie bardziej rozwinięty ma mniej kości, niż słabiej rozwinięty. Występują też różnice pomiędzy poszczególnymi rodzinami płazów. Różnice sięgają też ilości kości spotykanych u dorosłych płazów. Kumak ma ich 17, podczas gdy żaba czy ropucha mają ich 18. U kumaka nie występują kość podniebienna ani strzemiączko, ma on za to niespotykaną u innych płazów kość interfrontal[72].
Kręgi określa się jako dwuwklęsłe, proceliczne bądź opistoceliczne. Odcinek krzyżowy zazwyczaj obejmuje pojedynczy kręg[73].
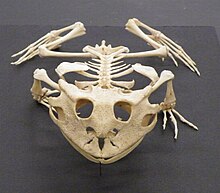
Płazy, z wyjątkiem przedstawicieli rzędu beznogich i kilku gatunków Caudata o zredukowanych kończynach, mają 4 kończyny. U większości płazów dłoń kończy się czterema palcami, a stopa – pięcioma. Nie występują pazury. Niektóre płazy ogoniaste wykazują mniejszą liczbę palców. Amfiumowate to przypominające z wyglądu węgorza zwierzęta o niewielkich, krótkich i grubych łapach. Syrenowate to z kolei wodne Caudata o krótkich i grubych przednich kończynach, niemające tylnych łap. Przedstawiciele płazów beznogich ryją w ziemi, podobnie jak to czynią dżdżownice. Strefy skurczów mięśni przesuwają się wzdłuż ciała. Na powierzchni bądź w wodzie poruszają się poprzez faliste ruchy ciała z boku na bok[74].
U Anura tylne kończyny są większe od przednich; szczególnie widoczne jest to u gatunków, których głównym sposobem poruszania się jest skakanie bądź pływanie. U gatunków poruszających się w sposób kroczący oraz u biegających tylne kończyny nie są aż tak wielkie. Zwierzęta ryjące mają zwykle krótkie łapy i szerokie ciała. Stopy przystosowały się do trybu życia. Wykształciły błonę pławną przydatną przy pływaniu, szerokie przylgi na opuszkach służące wspinaczce lub skeratynizowane guzki na tylnych łapach ułatwiające kopanie. Przedstawiciele grupy bezogonowych bowiem kopią w glebie tyłem[71]. Samce mają na spodniej stronie dłoni modzele godowe, którymi przytrzymują samice. Z kolei modzele piętowe występują u obu płci[48]. U większości Caudata kończyny są krótkie, w większym bądź mniejszym stopniu tej samej długości, wyrastające z tułowia pod właściwym kątem. Lokomocja na lądzie polega na chodzie. Ogon często kołysze się z boku na bok. Służy też jako podpora, zwłaszcza w czasie wspinaczki. W normalnym chodzie tylko jedna noga jednocześnie jest wysuwana do przodu. Ten sposób poruszania się został odziedziczony po przodkach, rybach mięśniopłetwych[71]. Caudata z rodzaju Aneides i niektóre bezpłucnikowate wspinają się na drzewa i cechują się długimi kończynami, dużymi opuszkami palców, jak też chwytnym ogonem[59]. Ogon wodnych przedstawicieli rzędu ogoniastych i kijanek Anura wyposażony jest w płetwy grzbietową i brzuszną. Ciało wprawia się w ruch poprzez boczne skręty, za pomocą których odpycha się od wody. Dorosłe płazy bezogonowe nie mają ogonów, ogony beznogich są bardzo krótkie[74].
Przedstawiciele jednej z rodzin płazów bezogonowych, nogolotkowatych, posiedli również umiejętność lotu ślizgowego. Wykorzystują one błony między palcami kończyn jako płaszczyzny nośne w trakcie lotu ślizgowego. Najsłynniejszemu z należących do niej gatunków, żabie latającej (Rhacoporus reinwardtii) z Jawy, wybitny polski zoolog Michał Siedlecki poświęcił monografię[75].
Ponieważ zwierzęta te są zmiennocieplne, stopień ich aktywności wiąże się z temperaturą otoczenia[40]. W niskiej temperaturze stają się nieaktywne[21].
Układ krwionośny[edytuj | edytuj kod]


Układ krwionośny różni się u postaci larwalnych i dorosłych. Krążenie u kijanek przypomina to spotykane u ryb. Dwujamowe serce pompuje krew przez skrzela, gdzie ulega ona utlenowaniu (pobiera tlen). Następnie zaopatruje weń ciało, po czym wraca do serca. Występuje więc pojedynczy obieg krwi. Dorosłe zwierzę, zwłaszcza reprezentant Anura, traci swe skrzela, rozwijając płuca. Ich serce składa się z trzech jam: dwóch przedsionków i pojedynczej komory. Gdy zaczyna się skurcz komory, odtlenowana (uboga w tlen) krew przepływa tętnicą płucną do płuc. Kontynuując skurcz, mięsień przepycha krew do reszty ciała. Anatomia komory minimalizuje mieszanie się krwi dwóch obiegów (odtlenowanej z utlenowaną)[76], jednak go nie eliminuje[39].
Układ nerwowy i narządy zmysłów[edytuj | edytuj kod]
Ośrodkowy układ nerwowy[edytuj | edytuj kod]
Układ nerwowy płazów zbudowany jest według tego samego ogólnego planu, jak w przypadku innych kręgowców. Mózg płazów pozostaje jednak na niskim poziomie rozwoju. Jest mniej skomplikowany, mniejszy (w stosunku do rozmiarów całego ciała) i występuje w nim mniej struktur, takich jak jądra, niż nie tylko u gadów, ssaków, ptaków, ale też u rekinów czy ryb doskonałokostnych[77]. Obejmuje mózgowie, rdzeń kręgowy i nerwy obwodowe. Morfologicznie i funkcjonalnie przypomina mózg ryby[78], szczególnie przodomózgowie porównuje się z homologiczną strukturą koleniokształtnych, wielopłetwcowatych czy mięśniopłetwych. Najbardziej złożoną budową cechuje się mózg płazów bezogonowych[77]. Obejmuje przodomózgowie, śródmózgowie, móżdżek, rdzeń przedłużony[78].
Przodomózgowie nawet z pominięciem opuszek węchowych u Rana czy Bufo obejmuje 40% masy mózgu, u Caudata nawet więcej – u Ambystoma 56%. Składa się z kresomózgowia i międzymózgowia[79]. Kresomózgowie składa się z dwóch półkul. Półkule te dzieli się na części grzbietową (pallium) i brzuszną (subpallium), a te z kolei na boczne i przyśrodkowe[80]. Pallium podzielono na grzbietowe, boczne i przyśrodkowe. Uznawano, że części te odpowiadają różnym korom występującym u gadów (bocznej, grzbietowej, przyśrodkowej), a u ssaków korom gruszkowatej, hipokampalnej i pozostałych jej częścią. Obecnie powątpiewa się w tę tezę, zwłaszcza w przypadku części grzbietowej. O ile panuje zgoda co do homologii pomiędzy przyśrodkową korą gadów a częścią ssaczego hipokampa, z uwagi na pewne różnice w wypustkach nerwowych u płazów homologia taka nie jest już oczywista[81]. W brzusznej części półkul znajdują się jądra przegrody, w bocznej części subpallium leży prążkowie[80]. W ogonowej części prążkowia leżą komórki homologiczne z częściami ciał migdałowatych u ptaków czy ssaków, oddające włókna zmierzające do podwzgórza i pnia mózgu[81]. Do przodu od bocznego pallium znajdują się opuszki węchowe, podczas gdy układ ciała migdałowatego leży w obrębie kresomózgowia ogonowego. Homologia obecnych w nich struktur z podobnymi występującymi u innych kręgowców stanowi przedmiot debaty[80]. Różne elementy przodomózgowia przetwarzają dane wejściowe. Na przykład płat węchowy bierze udział w obróbce informacji pochodzących z węchu[78] (duża część kresomózgowia zajmuje się obróbką bodźców węchowych[79], w tym pallium przyśrodkowe, choć przyjmuje ono również bodźce innych modalności płynących ze wzgórza, boczna część pallium, posiadająca połączenia z opuszkami węchowymi oraz brzuszna część półkul[80]), a kora wzrokowa – ze wzroku. Kora odpowiada za uczenie się i steruje zachowaniem[78]. Struktury występujące u płazów nie muszą pełnić tych samych funkcji, co odpowiadające im struktury ssaków. Zasadniczą różnicą jest też brak kory nowej, obszarem homologicznym do niej wydaje się grzbietowa część pallium[80]. W obrębie międzymózgowia wyróżnia się epithalamus, gdzie leżą jądra uzdeczki, wzgórze przetwarzające informacje ze zmysłów innych niż węch i podwzgórze, które z kolei łączy się z przysadką i sprawuje kontrolę nad wydzielaniem[82].
Śródmózgowie u Rana czy Bufo zajmuje 21% mózgu, u Ambystoma zaledwie 7%. Składa się z dwóch głównych części. Tectum leży grzbietowo, a tegmentum brzusznie. W tectum występują obszary związane ze zmysłami wzroku i słuchu (torus semicircularis), służące integracji dochodzących sygnałów. Wilczyński zwraca tutaj uwagę na różnice pomiędzy różnymi rzędami płazów. U płazów bezogonowych obszary te są dobrze rozwinięte, mówi się nawet o płatach, w przeciwieństwie do przedstawicieli rzędów beznogich i ogoniastych. W tegmentum znajdują się niektóre jądra nerwów czaszkowych. Śródmózgowie uznaje się niekiedy za największą i „najwyższą” część mózgowia płazów, co spotyka się z krytyką uzasadnioną pomiarami[79].
Pasmowaty móżdżek leży do przodu od rdzenia przedłużonego. Móżdżek u płazów osiąga rozmiary mniejsze, niż u jakichkolwiek innych kręgowców z wyjątkiem bezżuchwowców[79]. Stanowi ośrodek odpowiedzialny za koordynację mięśniową[78].
Rdzeń przedłużony stanowi najniższy region mózgowia, leżący za móżdżkiem. Znajdują się w nim jądra związane z odbiorem wrażeń ze zmysłów słuchu, równowagi i linii bocznej[79]. Kontroluje czynności części narządów, jak akcja serca czy oddychanie[78].
Mózg wysyła sygnały przez rdzeń kręgowy i nerwy obwodowe, regulując aktywność reszty ciała[78]. Z mózgu, głównie z jego pnia, wychodzą pary nerwów czaszkowych. Nerw I (węchowy) i II (wzrokowy) przekazują bodźce odbierane przez odpowiednie zmysły. Nerwy III, IV i VI unerwiają ruchowo gałkę oczną. Nerw V (trójdzielny), pokaźnych rozmiarów, prowadzi zarówno włókna czuciowe, jak i ruchowe, podobnie jak niewielki nerw VII (twarzowy). Nerw VIII (statoakustyczny) znów wiąże się z odpowiednim zmysłem, podobnie jak nerwy umożliwiające działanie linii bocznej. Nerwom IX i X (błędnemu) odpowiadają pewne grupy włókien nerwowych, wychodzące ze środkowo-ogonowej części rdzenia przedłużonego i kierujące się głównie do krtani i języka. W pobliżu początku włókien nerwu X wychodzi też z jądra leżącego w szyjnej części rdzenia kręgowego nerw XI (dodatkowy). Nerw XII (podjęzykowy) wedle części specjalistów nie istnieje, choć obecne jest jego jądro. Odpowiadające mu włókna nerwowe uznaje się niekiedy za pierwszy nerw rdzeniowy[77].
Rdzeń kręgowy leży w grzbietowej części ciała. Wykazuje segmentowanie. Wychodzą z niego parzyste korzenie nerwów rdzeniowych: grzbietowe, czyli czuciowe, i brzuszne – ruchowe. Ich liczba różni się u różnych płazów. U dorosłych Anura występuje ich zwykle 10–11 par. U dorosłych przedstawicieli dwóch pozostałych rzędów współczesnych płazów jest ich więcej, podobnie jak u larw, które tracą ogon, jak i wykształcają kończyny, co wymaga kondensacji i reorganizacji segmentów rdzenia[77].
Szyszynka, u człowieka znana z regulacji rytmu snu i czuwania, u płazów uchodzi za miejsce syntezy hormonów zaangażowanych w hibernację i estywację[78]. Temperatura ciała wpływa na właściwości błony biologicznej, a więc na funkcjonowanie układu nerwowego[83].
Narządy zmysłów[edytuj | edytuj kod]
Kijanki zachowują linię boczną, którą odziedziczyły po swych rybich przodkach, jednakże dorosłe osobniki lądowe większości gatunków jej nie mają. Pewne płazy beznogie posługują się elektrorecepcją. Pozwala im ona lokalizować obiekty wokół nich, gdy przebywają zanurzone w wodzie[71].
Ucho płazów ogoniastych i beznogich ustępuje poziomem rozwoju uszom bezogonowych, gdyż zwierzęta te normalnie nie komunikują się ze sobą poprzez dźwięki[84]. Ich zmysł słuchu określa się jako rozwinięty dobrze, ale słabiej, niż u Anura, u których błona bębenkowa często jest widoczna[41]. Uszy Anura rozwinęły się więc dobrze. Co prawda ucho zewnętrzne nie istnieje, ale duża okrągła błona bębenkowa leży na powierzchni głowy zaraz za okiem. Wibracje czy też dźwięki transmitowane są przez pojedynczą kość, odpowiadającą strzemiączku, do ucha wewnętrznego. Tą drogą usłyszeć można jedynie dźwięki o wysokiej częstotliwości, taką też charakterystykę mają głosy wydawane podczas godów. Dźwięki o niskiej częstotliwości płazy odbierają w inny sposób[71]. Papilla amphibiorum (dosłownie „brodawka płazów”) to również leżąca w uchu wewnętrznym kępka wyspecjalizowanych komórek rzęsatych zdolnych do detekcji niższych dźwięków. Inną cechą, unikatową dla płazów, jest obecność układu kolumienka-wieczko przylegającego do torebki słuchowej, zaangażowanego w transmisję dźwięków drogą powietrzną i drgań podłoża[85].
Pierwszym etapem powstawania oka u larwy jest pierwotny pęcherzyk. W jego wewnętrznej warstwie gromadzi się barwnik. Wyodrębniają się dwie warstwy komórek. Następnie pęcherzyk wydłuża się w kierunku grzbietowym. Ściana przednia, z której rozwija się zewnętrzna część kielicha ocznego, wydaje się cieńsza i bardziej rozciągnięta od tylnej. Na kolejnym etapie pogrubieniu ulega ektoderma pokrywająca pęcherzyk oczny. Tworzy się z niej płytka soczewki. Przednia ściana staje się tymczasem coraz cieńsza. Z kolei ściana tylna ulega spłaszczeniu. Komórki dzielące się ograniczają się do pojedynczej warstwy, wyściełającej pęcherzyk od środka. Przeistoczą się one w zewnętrzną warstwę siatkówki. W końcu ze wspomnianej ektodermy powstaje trójwarstwowa soczewka. Obejmuje ona niepigmentowaną płytkę (lens plate) ulokowaną wewnętrznie, część pośrednią i pigmentowany nabłonek pokrywający ją od zewnątrz. Tworzy się kielich oczny, który dalej wydłuża się. Zmienia się połączenie soczewki z naskórkiem, jak też upakowanie komórek nabłonka barwnikowego w sąsiedztwie siatkówki. Pojawia się zróżnicowanie w ilości barwnika w siatkówce (w centrum jest go mniej niż na obwodzie). W końcu soczewka oddziela się od naskórka. W centrum siatkówki dadzą się dostrzec duże komórki zwojowe. Leżą one na jej warstwie wewnętrznej. Z kolei w warstwie zewnętrznej w centrum zanikają mitozy, utrzymujące się dłużej na obwodzie, która to część siatkówki wzrasta w kierunku soczewki, tworzącej w następnym etapie pęcherzyk. W otoczeniu komórek zwojowych dojrzeć można pewne włókniste struktury. Wytwarzają się warstwy siatkówki, a jej komórki tracą całe zasoby żółtka. Pigment znika z zewnętrznej warstwy rogówki. Wytwarza się równik soczewki. Coraz lepiej widać tęczówkę[86]. Oka kijanki nie okrywa powieka[71]. Do metamorfozy będzie już tylko rosło dzięki podziałom komórkowym[86]. Podczas przeobrażenia rogówka przyjmuje kształt bardziej kopulasty, soczewka ulega spłaszczeniu, rozwijają się powieki i związane z nimi gruczoły[71]. U większości płazów występuje nieruchoma powieka górna, w przeciwieństwie do ruchomej dolnej[87]. Oko to umożliwia widzenie barwne i postrzeganie głębi ostrości[84]. Akomodacja zachodzi poprzez przesuwanie soczewki, umożliwiając widzenie ostre na odległość 2 m[88]. W siatkówce znajdują się zielone pręciki zdolne do odbioru szerokiego zakresu fal[84]. U przedstawicieli rzędu ogoniastych zarówno soczewka, jak i siatkówka podlegają regeneracji. Sądzono, że płazy bezogonowe tracą tę zdolność wraz z metamorfozą. Doniesiono jednak o odtworzeniu się siatkówki i soczewki u dorosłych platan szponiastych. Nowa siatkówka może powstać z komórek nabłonka barwnikowego poprzez odróżnicowanie oraz z komórek macierzystych części rzęskowej[89]. Z siatkówki informacje przekazywane są przez nerwy wzrokowe. Większość włókien ulega skrzyżowaniu, niektóre neurony kończą się wcześniej[90].
Płazy są pierwszą grupą czworonogów, u których pojawił się narząd Jacobsona. Dokładniej przebadano go na przykładzie traszki zwyczajnej. Stanowi on parzyste zagłębienie wyścielone nabłonkiem węchowym. Być może magazynuje on cząsteczki substancji zapachowych, które dostają się doń przez jamę nosową, odbierając bodźce nawet wtedy, gdy zapach już się rozejdzie. U przedstawicieli rzędu bezogonowych, na przykład u ropuchy szarej, chodzi o oddzielne zagłębienie również wysłane nabłonkiem typu węchowego, łączące się z jamą nosową cienkim, mierzącym 18,5 μm średnicy przewodem. Wskazuje to na niewielką ilość substancji zapachowej, która może dostać się do narządu[91].
U płazów żyjących w wodzie (larwy i dorosłe Caudata wodne, także tych powracających do wody po etapie życia na lądzie np. Notopthtalmus, a z Anura u grzbietorodowatych) występuje linia boczna, przebiegająca od głowy wzdłuż ciała. Receptory rozmieszczone są w niewielkich grupkach bądź pojedynczo, jak u Siren[92].
Układ pokarmowy[edytuj | edytuj kod]

Wiele płazów łapie swą zdobycz poprzez wyrzucenie z jamy ustnej wydłużonego języka o lepkim końcu. Następnie język jest wciągany do jamy ustnej, a zdobycz chwytana jest szczęką i żuchwą. Niektóre płazy wykorzystują bezwładność w celu ułatwienia połknięcia zdobyczy: zwierzę wykonuje powtarzające się, ostre szarpnięcia głową do przodu, powodujące ruch pokarmu w tył na skutek bezwładności. Większość płazów połyka swą zdobycz w całości, nie gryząc jej zbytnio. Wiąże się to z dużą objętością żołądka. Krótki przełyk wyściełają rzęski pomagające w transporcie żywności do żołądka. Produkowany przez gruczoły jamy ustnej i gardła śluz ułatwia pasaż. Żołądek produkuje enzym zwany chitynazą, biorący udział w trawieniu chitynowych powłok ciała stawonogów[93].
Płazy mają trzustkę, wątrobę i pęcherzyk żółciowy. Wątroba, zwykle duża, składa się z dwóch płatów. Jej rozmiary determinuje pełniona przez nią funkcja magazynowania glikogenu i tłuszczu. Może się zmieniać z porą roku w związku z magazynowaniem bądź zużywaniem zapasów. Tkanka tłuszczowa stanowi inny ważny rezerwuar energii. Leży w obrębie brzucha, pod skórą, a u niektórych przedstawicieli rzędu ogoniastych, w ogonie[94].
Układ moczowy[edytuj | edytuj kod]
Rodzajem świetnie nadającym się do badań nad rozwojem układu moczowego jest Xenopus. W rozwoju układu moczowego występuje tworzące się z mezodermy pośredniej przednercze. Nefron tworzący ten parzysty narząd jest prosty. Można w nim wyróżnić kłębuszek, prowadzący filtrację dzięki sieci naczyń krwionośnych, powstający z trzewnej części mezodermy pośredniej, kręty kanalik powstający z somatycznej części mezodermy pośredniej, obfitujący w transportery molekularne, i przewód. Trzy urzęsione ujścia kanalika (nephrostomes) prowadzą do celomy. W tym prymitywnym nefronie kłębuszek i kanalik nie są jeszcze połączone. Ultrafiltrat z kłębuszka trafia do wtórnej jamy ciała, z której odbierają go trzy parzyste ujścia kanalika, usuwającego z niej niepotrzebne substancje. W końcu trafiają one do wspólnego przewodu, by opuścić organizm przez kloakę. Z uwagi na wodny tryb życia larwy płazów wydzielają amoniak w dużym rozcieńczeniu, także te ureoteliczne po metamorfozie. Pomimo prostej budowy przednercze spełnia taką samą funkcję, jak nefrony zwierząt o lepiej rozwiniętych układach moczowych[95].
W powstawaniu przednerca uczestniczą między innymi geny kodujące czynnik transkrypcyjny Pax8, białko Xlim-1, anneksynę IV, jak też geny x-WT1, Xpax8/2, Xlim-1enR, GR-Su(H)VP16, GR-Su(H)DBM, GR-notch ICD, XCIRP-1, Xwnt-4, XC3H-3b, Xlmx-1b[95].
Parzysta nerka leży grzbietowo, przy górnej granicy jamy ciała[96]. Spełnia ona wiele różnych, niekoniecznie związanych ze sobą funkcji. Filtruje ona krew z odpadów metabolicznych, zwłaszcza związków azotowych. Prowadzi resorpcję zwrotną niektórych przefiltrowanych substancji, jak glukoza. Bierze udział w regulacji równowagi jonowej i kwasowo-zasadowej organizmu[97].
Larwy i większość dorosłych płazów o wodnym trybie życia wydalają azot w postaci amoniaku rozpuszczonego w dużych ilościach rozcieńczonego moczu[96]. Dobrze nawodniony płaz zdolny jest do produkcji tak dużych ilości moczu z uwagi na znaczny wskaźnik filtracji kłębuszkowej (spadek jego wartości jest jednym z pierwszych skutków odwodnienia płaza) i dużą zdolność kanalików do prowadzenia resorpcji zwrotnej. Natomiast formy lądowe, chociaż wskaźnik filtracji kłębuszkowej jest u nich jeszcze wyższy niż u wodnych[97], zmuszone w większym stopniu do oszczędzania wody, wydalają mniej toksyczny mocznik[96]. Ten paradoks tłumaczy się tym, że – w przeciwieństwie do płazów wodnych – mogą one polegać głównie na nerkach w kwestii wydalania produktów metabolizmu azotu. Formy wodne wykorzystują do tego głównie skórę. Poza tym również kanaliki nerkowe mogą resorbować wodę, za co odpowiada hormon antydiuretyczny[97] (choć w stopniu znacznie mniejszym, niż ssaki). Ciśnienie osmotyczne w kanaliku proksymalnym (gdzie wchłanianiu zwrotnemu ulega 40% wody) nie różni się od osoczowego, resorpcja w kanaliku proksymalnym przebiega więc w sposób izoosmotyczny. Wchłanianiu ulegają w nim m.in. glukoza czy fosforany. U bezogonowych wydziela on także mocznik. Resorpcja zwrotna zachodzi także w kanaliku dalszym, który wytwarza również i wydala amoniak[98]. U żyjących w wodzie przedstawicieli rzędu ogoniastych w sumie odzyskiwane jest 90–96% jonów chlorkowych i sodowych, nieco mniej potasu[99]. Płazy nie wykształciły zdolności wytwarzania moczu hipertonicznego względem osocza (pojawia się ona dopiero u ptaków czy ssaków)[98]. U kilku rodzin wykryto też inne hormony przysadki nerwowej o budowie analogicznej do AVT[100]. Innym hormonem związanym z pracą nerek jest aldosteron. Wpływa on na wymianę kationów potasu i wodoru[101]. Pewne Caudata żyjące na drzewach, mające ograniczony dostęp do wody, wydzielają większość produktów przemiany materii w postaci kwasu moczowego[96].
Wydzielany przez nerkę mocz parzystym moczowodem spływa do pęcherza moczowego, gdzie jest przechowywany, zanim okresowo zwierzę usuwa go na zewnątrz ciała przez otwór kloaki[96]. Pęcherz nie jest jedynie zbiornikiem biernie przechowującym mocz. Zachodzi w nim również transport aktywny jonów. W rodzinie żabowatych zachodzi on bardziej wydajnie wśród gatunków o częściowo wodnym trybie życia, jak żaba jeziorkowa czy żaba jeziorkowa, niż wśród bardziej lądowych, jak żaba trawna[99].
Układ oddechowy[edytuj | edytuj kod]

Płazy wykształciły więcej różnorodnych struktur służących wymianie gazowej (skrzela zewnętrzne, skrzela wewnętrzne, płuca, skóra), niż jakakolwiek inna gromada kręgowców[102].
Stadium larwalne prowadzi zazwyczaj wodny tryb życia, dlatego też do oddychania wykorzystuje skrzela. Leżą one w odpowiedniej komorze/komorach skrzelowych czy wieczkowych lub występują skrzela zewnętrzne. Prowadzą one wymianę gazową poprzez czerpanie tlenu z obmywającej je wody, która dostaje się do organizmu przez jamę ustną lub nozdrza, pompowana ruchami gardła. Tryskawka służy wypuszczaniu wody na zewnątrz[102]. Skrzela występują także u zwierząt, u których pływająca w wodzie larwa nie występuje. Ensatina należąca do salamander bezpłucnych przechodzi rozród bezpośredni, a w jej zarodku występują duże, mięsiste skrzela[103].
Zazwyczaj skrzela zanikają podczas metamorfozy. Wyjątki stanowią odmieńce amerykańskie z rodzaju Necturus. Także wśród gatunków, których przedstawiciele normalnie tracą skrzela, zdarzają się zachowujące je osobniki neoteniczne[102]. Wiele przedstawicieli rzędu ogoniastych wodnych ma skrzela. Niektóre z nich (aksolotl) zachowują je jako żyjące w wodzie dorosłe płazy[93].
U dorosłych płazów występuje pojedyncza tchawica, która prowadzi powietrze od głośni do płuc[104], mówi się też o tchawico-krtani. Jest to krótki odcinek dróg oddechowych. Do przestrzeni martwej zalicza się także praoskrzele[105]. Występując parzyście, płuca często nie są symetryczne, choć może być i tak, jak u Typhlonectes compressicauda, u którego po obu stronach występuje dobrze rozwinięty narząd. Jednak na przykład prawe płuco Ichthyophis orthoplicatus jest czterokrotnie większe od lewego. U Hypogephis rostratus prawe płuco jest dobrze rozwinięte, podczas gdy lewe jest szczątkowe. Jeszcze dalej trend ten posunął się u Boulengerula taitanus, posiadającej tylko jedno płuco. Długie prawe płuco, rozciągające się na od połowy do trzech czwartych długości ciała przy lewym niesięgającym nawet 10%, jest typowe dla gatunków lądowych[106]. U Anura nie odnotowano gatunków niemających płuc[107].
Płuca płazów w porównaniu z płucami owodniowców wydają się prymitywne. Ich powierzchnia wewnętrzna układa się w rozbudowane fałdy. Pomiędzy nimi są komory, czyli pęcherze płucne, gdzie zachodzi wymiana gazów[105]. Nieliczne przegrody międzypęcherzykowe rozdzielają wielkie pęcherzyki płucne[93] (niekiedy w ogóle nie uznaje się ich za pęcherzyki[39]). Worki płucne żaby mierzą 150–600 μm[108]. Wyściela je nabłonek[107] tworzony przez 1 rodzaj komórek (niektórzy autorzy wyróżniają dwa rodzaje komórek)[109], pokryty warstwą surfaktantu[110].

Prócz roli w wymianie gazowej płuco stanowi narząd hydrostatyczny, wpływając na ciężar właściwy i wyporność zwierzęcia w wodzie[106].
W konsekwencji budowy płuc tempo dyfuzji tlenu do krwi jest wolne. Wentylacja następuje w mechanizmie z udziałem policzków (ang. buccal pumping)[93]. Oddychanie u osobników dorosłych następuje na skutek działania pompy: zwierzę najpierw zasysa powietrze do jamy policzkowo-gardłowej przez nozdrza zewnętrzne[38]. Wdychane powietrze wypełnia jamę ustną i gardło, zanim jeszcze porcja z poprzedniego wdechu opuści płuca, dzięki obniżeniu gardła przy zamkniętej głośni. Wtedy dopiero powietrze z płuc opuszcza ciało płaza przez nozdrza. Płaz zwęża lub zamyka nozdrza zewnętrzne. Następuje skurcz mięśni gardła. Powietrze z jamy ustnej i gardła przez otwartą głośnię dostaje się do płuc. Głośnia znowu zamyka się, resztki powietrza opuszczają jamę ustną i gardło. Zmagazynują one kolejną porcję powietrza, nim nastąpi wydech. Mechanizm tego ostatniego wygląda inaczej, niż wdechu: powietrze wypychane jest przez elastyczne płuca i ruchy ściany tułowia. Jednakże te ostatnie zachodzą rzadziej, niż ruchy gardła[111].
Większość płazów potrafi przeprowadzać wymianę gazową przez skórę, zarówno w wodzie, jak i na powietrzu[93]. Oddychanie płucne przez cały rok utrzymywane jest względnie na stałym poziomie, natomiast intensywność oddychania skórnego wyraźnie wzrasta w okresie wiosenno-letnim, a obniża się w okresie zimowym. W wymianie gazowej uczestniczy też błona śluzowa jamy ustnej[107]. By umożliwić wystarczające oddychanie przez skórę, powierzchnia wysoce unaczynionej skóry musi pozostać wilgotna, co pozwala cząsteczkom tlenu dyfundować w wystarczającym tempie[93]. Ponieważ stężenie tlenu w wodzie wzrasta w niskich temperaturach, w takich sytuacjach wodne płazy polegają głównie na wymianie gazowej prowadzonej przez skórę. Przykłady stanowią Telmatobius culeus czy diabeł błotny. Na powietrzu, gdzie stężenie tlenu jest większe, niektóre małe gatunki polegają głównie na wymianie gazowej przez skórę. Najsłynniejsze z nich to bezpłucnikowate. Nie mają one ani płuc, ani skrzeli[93]. Bazują one głównie na swych niewielkich rozmiarach (co oznacza duży stosunek powierzchni ciała do jego objętości), nie cechują się jednak nadmiernie rozwiniętą siecią naczyń włosowatych w skórze. U Batrachoseps jest ona wręcz kiepsko rozwinięta. Kompensuje to duża liczba bezjądrzastych krwinek czerwonych (nieobecność jądra oznacza więcej hemoglobiny przenoszącej tlen). U niektórych gatunków, jak Dicamptodon ensatus, kapilary grzbietowe są dwukrotnie grubsze od brzusznych. Samiec zadziornicy włochatej w sezonie rozrodu rozwija włosowate wypustki skórne, odgrywające niejako funkcję zewnętrznych płuc[112].
Podsumowując, u płazów mówi się o oddychaniu płucnym, skórnym i gębowym[39].
Układ dokrewny[edytuj | edytuj kod]
Przysadka mózgowa płazów jest silnie spłaszczona grzbieto-brzusznie. Przysadka nerwowa składa się z płata nerwowego i wyniosłości przyśrodkowej, rozwiniętej najlepiej u bezogonowych (Anura). Na przysadkę nabłonkową składają się części: dalsza, pośrednia i guzowata. Część dalsza jest owalna i płaska, różniąca się od rybiej brakiem podziału na strefy, połączona z wyniosłością przyśrodkową przez przysadkowe żyły wrotne i tkankę łączną. Część pośrednia, o kształcie zbliżonym do biszkopta, ma wspólne unaczynienie z płatem nerwowym. Część guzowata jest parzysta, granicząca u płazów beznogich i ogoniastych z dalszą, a u większości płazów bezogonowych w formie dwóch zgrupowań komórek w ścianie przedwzgórza[113].
Dużą rolę u płazów odgrywa szyszynka, która wydzielając melatoninę wpływa na skupienie ziaren barwnika w melanoforach i siatkówkach, pobudza wzrost kijanek, wpływa na mięśnie, zwalnia tempo rozwoju i zmniejsza aktywność tarczycy[113].
Tarczyca jest zwarta, parzysta, u bezogonowych (Anura) owalna, a u pozostałych wydłużona. Tarczyce leżą w ścianie dna jamy gębowej i związane są z chrząstkami gnykowymi. Przytarczyce mają u płazów postać małych kulistych ciałek otoczonych torebką łącznotkankową. U ogoniastych (Caudata) leżą po obu stronach łuku aorty, a u Anura związane są z tętnicami szyjnymi. W okresie zimowym ulegają degeneracji[113].
Ciałka pozaskrzelowe u płazów są parzyste i położone po bokach głośni. Ich dojrzewające komórki tracą kontakt z błoną podstawową pęcherzyków i ulegają rozpadowi. Grasica płazów jest parzysta, u Anura mała i zwarta, a u Caudata rozproszona. Trzustka o wysepkach Langerhansa złożonych u płazów ogoniastych prawie wyłącznie z komórek B, a u bezogonowych z A i B[113].
Nadnercza u płazów ogoniastych występują w formie dwóch rzędów niewielkich ciałek w brzusznej ścianie śródnerczy oraz skupisk komórek przy głównych naczyniach żylnych poza śródnerczami. Nadnercza płazów bezogonowych są bardziej skupione: mają formę dwóch taśmowatych ciał przyczepionych do brzusznej stronie śródnerczy. U żab pojawiają się latem w nadnerczach komórki letnie zwane też komórkami Stillinga, charakteryzujące się brakiem lipidów w cytoplazmie[113].
Układ rozrodczy[edytuj | edytuj kod]
Praca płazich gonad znajduje się pod kontrolą przysadki gruczołowej, którą z kolei kontroluje podwzgórze. Te dwa piętra łączą się dzięki naczyniom wrotnym. Przysadka z kolei wpływa na gonady dzięki komórkom kwasochłonnym i zasadochłonnym poprzez wydzielanie gonadotropiny. Zniszczenie przysadki wiąże się z zanikiem narządów płciowych, a u samic także z zanikiem drugorzędowych cech płciowych[114].
Jądra, czyli gonady męskie, prowadzą gametogenezę u samców. Opisuje się jako narządy o prostej budowie, jajowatego kształtu. Dotyczy to płazów bezogonowych i większości przedstawicieli rzędu ogoniastych. Zdarzają się wyjątki: u Desmognathinae i bezpłucnikowatych z krainy neotropikalnej można w nich wyróżnić płaty, podobnie jak u Gymnophiona. U tych ostatnich liczba płatów jąder nie zmienia się w trakcie życia osobnika, podczas gdy u wspomnianych ogoniastych z czasem liczba płatów może rosnąć. Płaty te dzielą się z kolei na płaciki[115].
W jądrach znajdują się dojrzewające komórki rozrodcze na różnych etapach rozwoju[115].
Zazwyczaj samiec nie ma narządu kopulacyjnego[116].
Analogicznie gonady żeńskie – jajniki – prowadzą oogenezę. Przebiega ona podobnie u Anura, Caudata i Gymnophiona, choć zdarzają się odmienności (np. u Ascaphus truei występują oocyty o 8 jądrach komórkowych, wielojądrzaste oocyty występują też u rzekotkowatych). Jajniki zawierają pęcherzyki, w których obrębie znajdują się dojrzewające i przechodzące podział mejotyczny komórki jajowe[115].
Rozmnażanie[edytuj | edytuj kod]

By dokonać rozrodu, większość płazów potrzebuje wody słodkiej. Niektóre składają jednak jaja na lądzie, wykształciły więc różne sposoby utrzymywania wilgoci. Kilkaset gatunków Anura, jak Eleutherodactylus, pacyficzne Ceratobatrachinae, australijsko-papuaskie wąskopyskowate i wiele innych tropikalnych Anura nie potrzebuje wód, by rozmnażać się w środowisku naturalnym. Występuje u nich rozwój prosty. Ta ekologiczna i ewolucyjna adaptacja pozwoliła im na całkowitą niezależność od wód wolnostojących. Prawie wszystkie te płazy żyją w wilgotnych lasach deszczowych. Z ich jaj wylęgają się miniaturowe wersje osobników dorosłych. Stadium kijanki przebyły już bowiem wewnątrz jaja. Sukces reprodukcyjny wielu płazów zależy nie tylko od ilości opadów deszczu, ale też od ich sezonowego występowania[117].
W tropikach wiele płazów rozmnaża się ciągle bądź w dowolnej części roku. W rejonach klimatu umiarkowanego rozród przebiega sezonowo, zazwyczaj na wiosnę. Wywołują go wydłużanie się dnia, podwyższenie temperatur i opady deszczu. Eksperymenty wykazały wagę temperatury, ale czynnikiem spustowym, zwłaszcza na terenach suchych, często jest burza. U przedstawicieli rzędu bezogonowych samce zazwyczaj przybywają na miejsce rozrodu przed płcią przeciwną. Tworzą chór odgłosów, który może stymulować owulację u samic, jak też pobudzać aktywność hormonalną samców, które jeszcze nie są aktywne reprodukcyjnie[118].
U płazów beznogich zachodzi zapłodnienie wewnętrzne. Samiec wyciska swój narząd kopulacyjny o nazwie phallodeum i umieszcza go w kloace samicy. Sparowane gruczoły Müllera wewnątrz kloaki samca wydzielają ciecz przypominającą produkt prostaty ssaków. Może ona transportować i odżywiać nasienie. Zapłodnienie prawdopodobnie zachodzi w jajowodzie[119].
Samce niektórych traszek przybierają szatę godową z grzebieniami i witkowatymi naroślami na ogonie[39]. Mogą odbywać charakterystyczne tańce godowe[48]. Większość przedstawicieli rzędu ogoniastych także cechuje się zapłodnieniem wewnętrznym. U większości z nich samiec pozostawia na podłożu spermatofor, niewielki pakiet nasienia na szczycie żelatynowego stożka. Czyni tak zarówno na lądzie, jak i w wodzie. Samica chwyta pakiet nasienia i podnosi go swymi wargami kloakalnymi, wkładając go sobie do naturalnego otworu ciała. Plemniki zmierzają do zbiornika nasiennego u szczytu steku, gdzie pozostają do czasu owulacji. Może się ona zdarzyć nawet miesiące później. Rytuały zalotów i sposoby przeniesienia spermatoforu różnią się w zależności od gatunku. U niektórych z nich spermatofor może zostać umieszczony bezpośrednio w kloace samicy. U innych zostaje ona doprowadzona do spermatoforu lub przytrzymana w uścisku zwanym ampleksusem. Pewne prymitywne ogoniaste z rodzin syrenowatych, kątozębych i skrytoskrzelnych praktykują zapłodnienie zewnętrzne na sposób podobny do spotykanego u Anura. Samica składa skrzek do wody, a samiec uwalnia nasienie na ich masy[119].
Z kilkoma wyjątkami u Anura zapłodnienie przebiega zewnętrznie. Samiec mocno chwyta samicę. Jego przednie łapy trzymają ją za jej przednimi kończynami lub przed tylnymi, a nawet, jak u Epipedobates tricolor, za szyję. Ampleksus trwa. Ich kloaki leżą blisko siebie, gdy samica składa skrzek, a samiec pokrywa go nasieniem. Pogrubiałe opuszki palców na rękach samca pomagają w utrzymaniu uścisku. Często osobnik męski zbiera i zatrzymuje masy jaj, tworząc rodzaj kosza wokół swych tylnych łap. Wyjątek stanowi Oophaga granulifera, w przypadku której obaj partnerzy zbliżają do siebie swe kloaki, odwróceni od siebie w przeciwne strony, i wtedy jednocześnie wydają z siebie jaja i nasienie. Ascaphus truei rozwinął z kolei zapłodnienie wewnętrzne. Samiec ma strukturę nazywaną „ogonem” (tail). Stanowi ona przedłużenie steku. Zwierzę wykorzystuje ją do unasiennienia swej wybranki. Kręgowiec ten zamieszkuje strumienie o szybkim nurcie. Zapłodnienie wewnętrzne zabezpiecza nasienie przed wypłukaniem, nim nastąpiłoby zapłodnienie zewnętrzne[120]. Sperma może być przechowywana w specjalnych przewodach połączonych z jajowodem aż do następnej wiosny[121].
Większość przedstawicieli taksonu bezogonowych klasyfikuje się jako prolonged lub explosive breeders. Te pierwsze gromadzą się w miejscu rozrodu, samce zazwyczaj zjawiają się szybciej od płci przeciwnej. Nawołują ją i zajmują terytoria. Samce satelitarne pozostają cicho nieopodal, czekając na sposobność do zajęcia własnego terytorium. Samice przybywają sporadycznie, parują się z samcami i składają jaja. W końcu odchodzą, a terytoria zmieniają właścicieli. Pojawia się więcej samic. Sezon rozrodczy zmierza ku końcowi. Explosive breeders tymczasem spotykają się w tymczasowych zbiornikach wodnych, pojawiających się na suchych terenach po opadach deszczu. Tak rozmnażają się płazy zagrzebujące się w ziemi. Wychodzą z niej one po intensywnych deszczach i gromadzą w miejscu rozrodu. Zachęca je odgłos pierwszego samca, który znalazł odpowiednie miejsce, prawdopodobnie stawik tworzący się w tym samym miejscu w każdej porze deszczowej. Zebrane razem, bezogonowe nawołują unisono. Następuje potem nieopanowana aktywność, samce przedzierają się, by współżyć z zazwyczaj mniejszą liczbą samic[120].
Cykl życiowy[edytuj | edytuj kod]

Większość płazów przechodzi przeobrażenie, czyli metamorfozę. Proces ten polega na znacznych zmianach morfologicznych już po wykluciu się. Zazwyczaj skrzek składany jest w wodzie. Wylęgają się zeń larwy (kijanki) zaadaptowane do wodnego trybu życia. Prowadzą one wymianę gazową za pomocą zewnętrznych skrzeli. Przeobrażenie reguluje stężenie tyroksyny we krwi, stymulującej metamorfozę, i prolaktyny, przeciwdziałającej działaniu tyroksyny. Specyficzne tkankowo przemiany zależą od wartości progowych dla konkretnych tkanek[122]. Ponieważ rozwój płodowy zachodzi głównie poza ciałem organizmu rodzicielskiego, musi obejmować liczne przystosowania do warunków środowiskowych. Z tego powodu kijanki zamiast zębów mają rogowe płytki, rozwijają też włosowate wyrostki skórne czy płetwy. Używają też linii bocznej, narządu zmysłu przypominającego ten spotykany u ryb. Po przeobrażeniu narządy te stają się niepotrzebne. Komórki je tworzące ulegają wówczas apoptozie. Różnorodność przystosowań do specyficznych warunków środowiskowych wśród płazów jest szeroka, ciągle dokonuje się nowych odkryć[123].
Jaja[edytuj | edytuj kod]

Jajo płaza zazwyczaj otacza przezroczysta żelatynowa otoczka wydzielana przez jajowody, zawierająca mukoproteiny i mukopolisacharydy. Przepuszcza ona wodę i gazy. Znacznie pęcznieje, absorbując wodę. Komórka jajowa ułożona jest z początku sztywno, ale w zapłodnionych jajach najbardziej wewnętrzne warstwy ulegają upłynnieniu, co pozwala zarodkowi ruszać się swobodnie. Zachodzi to także w przypadku jaj rzędu ogoniastych, nawet jeśli nie uległy zapłodnieniu. Jaja niektórych przedstawicieli rzędów ogoniastych lub bezogonowych zawierają jednokomórkowe zielenice. Penetrują one osłonkę z żelu po złożeniu jaj i mogą zwiększać zasoby tlenu dla zarodka poprzez fotosyntezę. Wydają się zarówno przyśpieszać jego rozwój, jak i zmniejszać umieralność[124]. Większość jaj zawiera barwnik melaninę, który pochłania światło, podnosząc temperaturę. Chroni on też przed promieniowaniem ultrafioletowym. Jaja reprezentantów grup beznogich, pewnych bezpłucnikowatych i pewnych bezogonowych składających je pod ziemią nie zawierają pigmentu. W przypadku żaby leśnej (Rana sylvatica) wnętrze globularnego skupienia jaj może być o 6 °C cieplejsze od otaczającego środowiska. Stanowi to korzyść w jej chłodnym siedlisku na północy[125].
Jaja mogą być składane pojedynczo bądź w niewielkich grupach, jak również tworzyć kuliste masy, tratwy bądź długie sznury. Lądowe płazy beznogie składają swe jaja w kiściach jak winogrona w jamach nieopodal strumieni. Ziemnowodna Ensatina z grupy ogoniastych mocuje swe podobne kiście łodygopodobną strukturą do podwodnych łodyg czy korzeni. Eleutherodactylus planirostris składa jaja w niewielkich grupkach w glebie, gdzie rozwijają się przez około dwa tygodnie bezpośrednio w młodociane żabki, nie przechodząc stadium larwalnego[126]. Samica traszki pirenejskiej (Calotriton asper) składa jaja pod kamieniami[127] i w szczelinach[128]. Physalaemus pustulosus buduje unoszące się gniazdo z piany, chroniące jaja. Gdy skonstruuje tratwę, składa jaja na środku, na końcu pokrywając je kapturkiem z piany. Budulec ten ma właściwości przeciwdrobnoustrojowe. Nie zawiera co prawda detergentów, ale tworzą go wydzielane i ubijane przez matkę białka, w tym lektyny[129][130].
Larwy[edytuj | edytuj kod]

Płazy zazwyczaj składają swe jaja w wodzie. Wylęgają się z nich wolno żyjące larwy (kijanki), które kończą swój rozwój w wodzie, by potem ulec przeobrażeniu w osobniki dorosłe, żyjące w wodzie bądź na lądzie. W przypadku wielu gatunków płazów bezogonowych i u większości bezpłucnikowatych (salamander bezpłucnych) zachodzi rozwój prosty. Larwa rośnie wewnątrz jaja, wylęgając się już jako miniaturowy dorosły. Wiele beznogich i niektóre inne płazy składają swe jaja na lądzie, ale w miejscach, z których wykluwające się kijanki mają łatwy dostęp do wody. Nowo wyklute larwy prześlizgują się lub są przenoszone do zbiorników wodnych. Niektóre Gymnophiona, salamandra czarna (Salamandra atra) i pewne gatunki rodzaju Nectophrynoides osiągnęły żyworodność. Ich larwy żywią się wydzielinami gruczołów i rozwijają w jajowodzie samicy, niekiedy przez długi okres. Inne płazy, jednak nie Gymnophiona, są jajożyworodne. Ich jaja pozostają w ciele matki, ale larwy utrzymuje przy życiu żółtko jaj. Rodzic nie bierze już udziału w ich żywieniu. Larwy wydostają się z ciała osobnika dorosłego w różnych stadiach rozwoju, przed lub po metamorfozie, zależnie od gatunku[131]. U rodzaju ropuchy Nectophrynoides występują – w różnym nasileniu – wszystkie wymienione wzorce rozwoju[21].
Płazy bezogonowe[edytuj | edytuj kod]
Larwy bezogonowych mają zazwyczaj owalne ciała i długi, spłaszczony bocznie ogon zaopatrzony w płetwę. Wolno żyjące kijanki wiodą zazwyczaj w pełni wodny tryb życia. Jednakże niektóre gatunki, jak Nannophrys ceylonensis, żyją częściowo na lądzie, wśród wilgotnych kamieni[132]. Szkielet kijanki tworzy tkanka chrzęstna. Wymianie gazowej służą skrzela, wpierw zewnętrzne, później wewnętrzne. Występuje linia boczna. Długi ogon służy pływaniu[133]. U nowo wyklutych kijanek szybko rozwijają się okrywające skrzela pokrywy. Płuca rozwijają się wcześnie, używane są jako dodatkowe narządy oddechowe. Kijanki podpływają do powierzchni wody, by zaczerpnąć powietrza. Niektóre gatunki kończą swój rozwój w obrębie jaja, a wylęgają się od razu małe żabki. Larwy te nie dysponują skrzelami, zamiast nich mają wyspecjalizowane regiony skóry, przez które wymieniają gazy oddechowe. Kijanka nie ma prawdziwych zębów. Jednak u większości gatunków aparat gębowy tworzy długie, równoległe rowki niewielkich, skeratynizowanych struktur o angielskiej nazwie keradonts, otoczonych rogowym dziobem[134]. W przeciwieństwie do przedstawicieli rzędu ogoniastych tylne łapy tworzą się wcześniej, niż przednie[41]. Przednie kończyny tworzą się poniżej gill sac. Kijanki żywią się zazwyczaj pokarmem roślinnym. Spożywają głównie glony, w tym okrzemki filtrowane z wody za pomocą skrzeli. Należą również do detrytusożerców, wzbijających w górę osad z dna zbiornika i pochłaniających jego jadalne elementy. Mają względnie długie jelito o spiralnym kształcie, pozwalające im na prowadzenie takiej diety[135]. Niektóre gatunki są mięsożerne już w stadium kijanki. Zjadają owady, ryby, a nawet mniejsze kijanki. Młode Osteopilus septentrionalis określanej w języku angielskim mianem „kubańskiej żaby drzewnej” okazjonalnie praktykują kanibalizm. Starsze, lepiej rozwinięte kijanki przechodzące przeobrażenie są atakowane przez młodsze[136]. Kanibalizm występuje też u larw agi, żywiących się zwykle roślinami. Kijanki te wybiórczo pożerają jaja własnego gatunku z pominięciem obcogatunkowych (składanie jaj z zachowaniem długich odstępów czasu chroni przez pożeraniem jaj tej samej samicy). Skrzek dostarcza kijankom substancji odżywczych, kanibalizm zmniejsza też konkurencję. Wśród larw kanibali większy odsetek osobników przechodzi metamorfozę, niż wśród ściśle roślinożernych. Natomiast u rodzimych płazów australijskich larwy spożywają skrzek niezależnie od gatunku[137].
![]() Przeobrażające się kijanki nie muszą być tej samej wielkości, choć większe osobniki mogą szybciej przystępować do metamorfozy. Stan taki występuje np. u żaby trawnej[138]. W trakcie przeobrażania się w życiu zwierzęcia zachodzą szybkie i nieodwracalne zmiany. Spiralne usta o rogowych krawędziach są resorbowane, podobny los czeka spiralne jelito. Zwierzę wykształca duże „szczęki”. Skrzela zanikają. Szybko rosną oczy i kończyny. Tworzy się język. Powiązane zmiany zachodzą w układzie nerwowym, rozwija się widzenie przestrzenne, zanika zaś linia naboczna. Wszystkie te zmiany mogą zajść w ciągu jednego dnia. Kilka dni później płaz pozbywa się ogona. Potrzeba do tego wyższych stężeń tyroksyny[135].
Przeobrażające się kijanki nie muszą być tej samej wielkości, choć większe osobniki mogą szybciej przystępować do metamorfozy. Stan taki występuje np. u żaby trawnej[138]. W trakcie przeobrażania się w życiu zwierzęcia zachodzą szybkie i nieodwracalne zmiany. Spiralne usta o rogowych krawędziach są resorbowane, podobny los czeka spiralne jelito. Zwierzę wykształca duże „szczęki”. Skrzela zanikają. Szybko rosną oczy i kończyny. Tworzy się język. Powiązane zmiany zachodzą w układzie nerwowym, rozwija się widzenie przestrzenne, zanika zaś linia naboczna. Wszystkie te zmiany mogą zajść w ciągu jednego dnia. Kilka dni później płaz pozbywa się ogona. Potrzeba do tego wyższych stężeń tyroksyny[135].
Płazy ogoniaste[edytuj | edytuj kod]


Wylęgająca się typowa larwa Caudata przypomina bardziej niż w przypadku Anura osobnika dorosłego. Pierzaste skrzela zewnętrzne rozpościerają się przytwierdzone do chrzęstnych łuków skrzelowych. Występują szerokie płetwy grzbietowe czy ogonowe[48]. Oczy pozbawione są powiek. Występują zęby w żuchwie i w szczęce, trzy pary pierzastych skrzeli zewnętrznych, ciało nieco spłaszczone bocznie i długi ogon zaopatrzony w płetwy grzbietową i brzuszną. Przednie łapy mogą być częściowo rozwinięte, tylne zaś są szczątkowe u gatunków żyjących w stawach, mogą być nieco lepiej rozwinięte w przypadku gatunków rozradzających się w wodach płynących. Kijanki żyjące w stawach często dysponują parą stabilizatorów, prętowatych struktur po obu stronach głowy ochraniających skrzela przed zawadzaniem o osady. Niektórzy członkowie rodzajów Ambystoma lub Dicamptodon tworzą larwy, które nigdy nie przeobrażają się całkowicie w formy dorosłe, co zależy od gatunku i populacji. Należy tutaj Ambystoma gracile, wykazująca zależność od czynników środowiskowych. Może pozostać na stałe w stanie larwalnym. Zjawisko takie nosi nazwę neotenii. Może też przeobrazić się w dorosłe zwierzę[139]. Obie możliwości pozwalają na rozród[140]. Neotenia pojawia się, kiedy tempo wzrostu jest bardzo niskie, zazwyczaj wiąże się z niekorzystnymi warunkami, jak niska temperatura wody, które mogą zmienić odpowiedź tkanek na hormon tyroksynę[141]. Inne czynniki, które mogą hamować przeobrażenie, obejmują brak pożywienia, brak pierwiastków śladowych i konkurencję wewnątrzgatunkową. Ambystoma tygrysia (Ambystoma tigrinum) także czasami wykazuje neotenię, w tej formie może osiągnąć naprawdę duże rozmiary. Dojrzały osobnik wiedzie lądowy tryb życia, podczas gdy larwa zamieszkuje w wodzie, nabywając zdolność do rozrodu (zachowując stan larwalny). Kiedy warunki na lądzie stają się szczególnie niegościnne, rozmnażanie się larw może zapewnić kontynuację populacji, która w innym przypadku by wymarła. Nauka zna 15 gatunków Caudata, u których neotenia występuje zawsze. Zaliczają się tutaj odmieńcowate z rodzaju Necturus i odmieniec jaskiniowy (Proteus anguinus), a także amfiumy Amphiuma. Podaje się za to wiele przykładów neotenii fakultatywnej (jak u ambystomy tygrysiej), kiedy to rzeczona strategia wykorzystywana jest w przypadku niekorzystnych warunków środowiskowych (nie jest konieczna)[142].
Larwa może być bardzo drapieżna. Kijanki traszki grzebieniastej pożerają drobne skorupiaki: Daphniidae, Chydoridae, widłonogi[143][144], chruściki oraz inne larwy[143] i imago owadów (początkowo w małej ilości), pająki wodne, ślimaki, małże[138], a także małe ryby i kijanki, w tym również larwy własnego gatunku (kanibalizm)[145].
Bezpłucne salamandry z rodziny bezpłucnikowatych żyją na lądzie. Składają niewielką liczbę niepigmentowanych jaj w kłębie wśród wilgotnych liści ściółki. Każde z jaj dysponuje dużym pęcherzykiem żółtkowym. Rozwijająca się larwa korzysta z zapasów w nim zgromadzonych. Wykluwa się już w pełni uformowany osobnik młodociany. Samica często wysiaduje jaja. Obserwowano samice rodzaju Ensatina okręcone wokół nich i przyciskające doń okolice swych gardeł, co skutkuje masażem z wydzieleniem śluzu[146].
Przeobrażenie może nastąpić po około 3 miesiącach[48]. Metamorfoza traszki czy salamandry nie dorównuje gwałtownością przeobrażeniu przedstawicieli rzędu bezogonowych. Dzieje się tak, albowiem kijanka rzędu ogoniastych zawczasu żywi się mięsem i pozostaje drapieżnikiem jako dorosły płaz. Wobec tego w układzie pokarmowym potrzebne są tylko nieliczne zmiany. Płuca osiągają funkcjonalność wcześnie, ale kijanka nie używa ich w takim stopniu, jak larwy przedstawicieli płazów bezogonowych. Skrzeli nigdy nie zasłaniają pokrywy, ulegają one resorpcji tuż przed opuszczeniem wody. Inne zmiany obejmują redukcję wielkości bądź utratę płetwy grzbietowej, zamknięcie się szczelin skrzelowych, pogrubienie skóry, rozwój powiek i pewne zmiany w uzębieniu i budowie języka. Płazy ogoniaste wykazują największą wrażliwość podczas przeobrażenia, bowiem znacząco spada wtedy rozwijana przez nie prędkość pływania, a przeobrażający się ogon stanowi utrudnienie na lądzie[147]. Dorosłe Caudata wracają do wody na wiosnę i lato, na lądzie zaś mieszkają zimą. Adaptacja do wody wymaga hormonu prolaktyny, przystosowanie się do warunków lądowych zależy zaś od tyroksyny. Skrzela zewnętrzne, zresorbowane przed pierwszym wyjściem na ląd, nie są odtwarzane po powrocie do wody[59].
Płazy beznogie[edytuj | edytuj kod]

Większość lądowych Gymnophiona składających jaja czyni to w jamach lub wilgotnych miejscach na lądzie w pobliżu zbiorników wodnych. Dobrze zbadano rozwój młodych zamieszkującego Cejlon Ichthyophis glutinosus. Węgorzowate larwy wylęgają się z jaj i podążają do wody. Mają 3 pary pierzastych, zewnętrznych skrzeli czerwonej barwy, tępo zakończoną głowę o dwóch szczątkowych oczach, linię boczną i krótki ogon z płetwami. Płyną poprzez boczne skręty tułowia. Ich aktywność przypada głównie na porę nocną. Szybko pozbywają się skrzeli i robią wypady na ląd. Przeobrażają się stopniowo. W wieku około dziesięciu miesięcy mają już ostro zakończoną głowę z czuciowymi czułkami w okolicy otworu gębowego i tracą oczy, linię boczna i ogon. Ich skóra grubieje, rozwijają się osadzone w niej łuski. Ciało dzieli się na segmenty. Do tego czasu Gymnophiona mają już sporządzoną jamę i żyją na lądzie[148].
U większości gatunków Gymnophiona występuje jednak żyworodność. Np. u południowoamerykańskiego Typhlonectes compressicauda w jajowodzie może rozwijać się do 9 larw jednocześnie. Są one wydłużone, mają parzyste workowate skrzela, niewielkie oczy i wyspecjalizowane do skrobania zęby. Na początku żywią się żółtkiem zgromadzonym w ich jajach, ale gdy to źródło pokarmu kurczy się, zaczynają skrobać urzęsione komórki nabłonkowe wyścielające jajowody. Stymuluje to sekrecję płynu bogatego w lipidy i mukoproteiny, którym się żywią, skrobiąc ścianę jajowodu. Mogą zwiększyć swą długość sześciokrotnie, osiągając dwie piąte długości matki, nim się urodzą. Przed porodem przechodzą przeobrażenie, tracą oczy i skrzela, rozwijają grubszą skórę i czułki otaczające jamę ustną, tracą zaś zęby. Zęby stałe rosną im niedługo po narodzinach[149][63].
Marszczelec pierścieniowy (Siphonops annulatus) rozwinął unikatowe adaptacje służące rozrodowi. Potomstwo karmi się warstwą skóry specjalnie w tym celu wytwarzaną przez osobnika dorosłego. Zjawisko to nazwano maternal dermatophagy („dermatofagia matczyna”). Miot żywi się porcją przez około 7 minut w odstępach trzydniowych, co daje skórze rodzica możliwość regeneracji. W międzyczasie obserwowano młode pochłaniające płyn wydzielany przez stek matki[150].
Opieka nad potomstwem[edytuj | edytuj kod]

Opieki rodzicielskiej wśród płazów nie poznano zbyt dobrze, jednak stwierdzono, że im więcej złożonych jaj, tym mniejsza jest szansa na jakikolwiek stopień opieki nad nimi. Niemniej szacuje się, że u do 20% gatunków płazów jeden bądź oboje rodziców opiekuje się młodymi[151]. Gatunki rozmnażające się w mniejszych zbiornikach wodnych lub innych specjalnych siedliskach wykazują tendencję do bardziej złożonych wzorców opieki nad potomstwem[152].
Wiele leśnych przedstawicieli kladu ogoniastych składa kłęby jaj pod kłodami drewna lub kamieniami na lądzie. Czyni tak choćby Desmognathus welteri: matka wysiaduje jaja i chroni je przed drapieżnikami, gdy zarodki żywią się żółtkiem swoich jaj. Gdy się w pełni rozwiną, wydostają się z osłonek jaj i rozchodzą się[153]. Samiec diabła błotnego, prymitywnego przedstawiciela Caudata, drąży podwodne gniazdo i zachęca do niego samice. Następnie pilnuje tego miejsca przez 2–3 miesiące, nim wylęgną się larwy. Dzięki falistym skrętom ciała wachluje jaja, zwiększając im dopływ tlenu[56].

Samiec niewielkiego płaza bezogonowego Colostethus subpunctatus ochrania swe jaja ukryte pod kamieniem bądź kłodą. Kiedy wylęgają się larwy, transportuje je na swych plecach, przyczepione śluzową wydzieliną, do tymczasowego zbiornika wodnego. Zanurza się w nim, a kijanki odczepiają się[154]. Samiec pętówki babienicy (Alytes obstetricans) owija sobie sznury jaj wokół ud i nosi je ze sobą przez do 8 tygodni. Utrzymuje je w wilgoci. Gdy są gotowe do wylęgu, odwiedza staw i uwalnia kijanki[155]. Samica Rheobatrachus spp. przechowywała larwy w żołądku po połknięciu jaj bądź niedawno wylęgniętego się potomstwa. Kijanki przebywające w żołądku wydzielały hormon hamujący produkcję soków trawiennych w ciele matki. Nie udało się jednak zaobserwować, czy i w jaki sposób dobiega końca rozwój ontogenetyczny tych kijanek, i nie będzie możliwe dokończenie tych obserwacji, ponieważ wszystkie gatunki z tego rodzaju wymarły[156]. Assa darlingtoni składa jaja na ziemi. Gdy się wylęgają, samiec przenosi kijanki w specjalnych kieszeniach na tylnych łapach[157]. Żyjący w wodzie grzbietoród amerykański (Pipa pipa) nosi swe młode w otworach na grzbiecie, gdzie pozostają do metamorfozy[158]. Oophaga granulifera to typowy nadrzewny Anura należący do rodzin drzewołazowatych. Składaj on jaja na dnie lasu. Po wylęganiu się kijanki jedna po drugiej przenoszone są przez osobnika dorosłego do odpowiedniej, wypełnionej wodą szczeliny, jak miejsce połączenia liścia z łodygą czy rozety ananasowatych. Samica odwiedza żłobek regularnie i składa w nim niezapłodnione jaja. Zjadają je kijanki[159].
Siedliska[edytuj | edytuj kod]
Płazy preferują siedliska wilgotne. W strefie klimatu umiarkowanego zajmują one jednak zróżnicowane środowiska. Niektóre prawie całe swe życie spędzają w wodzie bądź nad brzegiem, jak żaby zielone i kumaki Bombina. Traszki mogą spędzać w wodzie tylko wiosnę, ale mogą też zostać tam do późnego lata, a nawet do końca okresu swej aktywności. Inne płazy prowadzą bardziej lądowy tryb życia. Zamieszkują łąki, zarośla i ogrody jak żaby brunatne. Te ostatnie spotyka się też w rzadkich lasach. W wykrotach, piwnicach, pod kamieniami i zwałami drewna kryją się traszki. Niektóre Caudata wykorzystują nory gryzoni. Skryty tryb życia wiedzie też grzebiuszka[160].
Niektóre płazy przystosowały się do życia w bardzo suchych środowiskach. Przykład stanowi pustynnica katolicka, przez większą część swego życia zagrzebana w glebie, z której wychodzi po obfitych opadach deszczu[161]. Liczne gatunki zamieszkują też tropikalne lasy deszczowe. Spośród drzewołazowatych większość żyje na dnie lasu, ale niektóre bytują na drzewach[162], co z kolei jest normą w przypadku rzekotkowatych[163]. Istnieją też płazy, które przystosowały się do ciemnych, wypełnionych wodą jaskiń, jak odmieniec jaskiniowy[164]. Płazy nie występują w wodach morskich i słonawych. Tylko jeden gatunek, Rana cancrivora, występująca w lasach namorzynowych południowo-wschodniej Azji, jest w stanie przeżyć w wodzie morskiej, jednak preferuje siedliska słodko- i słonawowodne. Również aga (Rhinella marina) i żaba „wodna” (Pelophylax kl. esculentus) wykazują tolerancję na niewielkie zasolenie wody – jak wynika z doniesień, tej ostatniej udało się zasiedlić słonawowodne laguny i estuaria nad Morzem Czarnym[165].
W klimacie umiarkowanym płazy zimują. Sen zimowy często odbywają gromadnie, mogą towarzyszyć im płazy także innych gatunków oraz gady (węże, jaszczurki). Spędzają ten czas w szlamie na dnie zbiorników wodnych, w wykrotach bądź szczelinach skalnych. W Polsce pojawiają się ponownie w marcu, jak żaba trawna[88].
Pożywienie[edytuj | edytuj kod]

Z kilkoma wyjątkami dorosłe płazy są drapieżnikami. Żywią się właściwie wszystkim, co się rusza i co są w stanie połknąć. Ich dieta składa się w największym stopniu z niewielkiej zdobyczy niezdolnej do szybkiego ruchu, jak chrząszcze, gąsienice i pająki. Młynarski wymienia tu owady i ich larwy, a rzadziej pajęczaki, wije, dżdżownice, skorupiaki, ślimaki nagie[88]. Traszki w czasie swego pobytu w zbiornikach wodnych polują na drobne zwierzęta wodne[48]. Syreny (Siren) często połykają wodny materiał roślinny z bezkręgowcami, którymi się żywią[166]. Dieta brazylijskiej Xenohyla truncata obejmuje duże ilości owoców[167]. Rhinophrynus dorsalis ma z kolei specjalny język przystosowany do zbierania mrówek i termitów[168]. Plethodontidae są w stanie wyrzucać koniec języka ze znaczną prędkością na stosunkowo dużą odległość i w ten sposób łapać zdobycz, podobnie niektóre płazy bezogonowe[88].
W klimacie umiarkowanym przedstawiciele rzędu ogoniastych na żer wychodzą w nocy lub podczas opadów ciepłego deszczu[48].
Pożywienie, zasadniczo, lokalizowane jest głównie za pomocą wzroku, nawet przy słabym świetle. Reakcję płaza wywołują ruchy potencjalnej zdobyczy. Anura łapano na haczyki dla ryb wyposażone w przynętę w postaci czerwonej szmatki. Rana clamitans z grupy żab zielonych znajdywano z żołądkami pełnymi nasion wiązów, które ujrzały przepływające obok[169]. Strukturą odpowiedzialną za dostrzeganie zdobyczy jest wzrokowa pokrywa[170]. Przedstawiciele wszystkich trzech współczesnych rzędów używają w celu wykrycia ofiary również węchu. Odpowiedź jest głównie wtórna, bowiem obserwowano Caudata pozostające w bezruchu blisko pachnącej zdobyczy; jadły tylko, gdy się poruszała. Płazy zamieszkujące jaskinie normalnie polują za pomocą węchu. Widywano płazy ogoniaste, które nauczyły się rozpoznawać nieruszającą się zdobycz bez zapachu, nawet w całkowitej ciemności[171].
Płazy zazwyczaj połykają swą zdobycz w całości. Mogą jednak nieznacznie ją gryźć, by sobie z nią poradzić[45]. Zazwyczaj mają małe zęby, przyrośnięte do kości szczękowych i podniebiennych, bez korzeni[39]. Określane są po angielsku mianem pedicellate teeth i są one unikatowe dla płazów. Zarówno koronę, jak i część podstawną buduje zębina, przedzielona nieskalcyfikowanymi warstwami. Zęby te ulegają zastępowaniu. Płazy ogoniaste, beznogie i niektóre bezogonowe mają jeden bądź dwa szeregi zębów w żuchwie i w szczęce, podczas gdy niektóre Anura, jak żaba Rana, nie mają zębów w żuchwie, ropuchy, jak Bufo, w ogóle nie mają zębów. U wielu płazów występują też zęby lemieszowe, czyli przytwierdzone do lemiesza, kości twarzoczaszki położonej u sklepienia jamy ustnej[172]. W połykaniu pomagają gałki oczne, wciągane w głąb głowy specjalnym mięśniem[88].

Większość płazów ogoniastych i bezogonowych poluje z zasadzki, czatując na zdobycz, tak np. jak ambystoma tygrysia (Ambystoma tigrinum). Inne płazy, jak ropuchowate z rodzaju Bufo, aktywnie szukają zdobyczy. Natomiast żaba rogata (Ceratophrys ornata) wabi ciekawską zdobycz, by podeszła bliżej, podnosząc swe stopy ponad grzbiet i wibrując swymi żółtymi palcami[173]. Wśród płazów bezogonowych żyjących w Panamie te aktywnie polujące mają wąskie usta i są smukłe, często jasno ubarwione i toksyczne, podczas gdy te zastawiające zasadzki mają szerokie usta i ciało oraz są kryptycznie ubarwione[174]. Płazy beznogie nie wyrzucają swych języków, ale łapią zdobycz, chwytając ją ustawionymi lekko w tył zębami. Próby wyrwania się zdobyczy i dalsze ruchy drapieżnika popychają zdobycz głębiej. Zdobycz jest zazwyczaj wypuszczana z uchwytu paszczy dopiero w norze i jest tam połykana w całości[175].
Nowo wyklute larwy rzędu bezogonowych żywią się początkowo żółtkiem jaja. Gdy to źródło pokarmu się wyczerpie, przerzucają się na bakterie, fragmenty glonów, detrytus i fragmenty podwodnych roślin. Woda wpływa do ich ust leżących w dolnej części głowy, po czym przepływa przez specjalne filtrujące miejsca między ustami a skrzelami, gdzie śluz skleja cząstki pokarmowe. Inne rozwijają wyspecjalizowany aparat gębowy składający się z rogowych listewek i rzędów rogowych ząbków wargowych. Zdrapują nimi i odgryzają różnorodny pokarm z powierzchni zanurzonych przedmiotów, rośliny wodne, kolonie cyanobakterii, grzebią także w osadach dennych, odfiltrowując większe cząstki detrytusu brodawkami wokół ust. Niektóre, jak Scaphiopodidae, mają silne, zdolne do gryzienia „szczęki”, są mięsożerne, a nawet kanibalistyczne[176].
Kanibalizm wydaje się u płazów szeroko rozpowszechniony. Udokumentowano go u ponad 30 gatunków. Niesie za sobą pewne zagrożenia, jak choćby transmisja pasożytów. Ryzyko jest mniejsze, jeśli zjadane są młode organizmy, w szczególności jaja otoczone osłonką żelową, jak u ropuchy agi. Jej kijanki żywią się jajami własnego gatunku (sposób rozrodu wyklucza, by były złożone przez tę samą samicę), w warunkach naturalnych nie spożywając jaj innych płazów. Kanibalistyczne kijanki mają większą szansę na metamorfozę[137].
Odgłosy[edytuj | edytuj kod]

Dźwięki wydawane przez Caudata czy Anura są ograniczone do okazjonalnych miękkich pisków, chrząknięć i syków. Nie badano ich zbyt obszernie. Klikający odgłos niekiedy wydawany przez Anura może służyć orientacji, jak u nietoperzy, bądź stanowić formę komunikacji. Większość przedstawicieli rzędu ogoniastych uznaje się za nieme. Jednak Dicamptodon ensatus ma struny głosowe i potrafi wydobyć z siebie klekot czy szczekanie. Niektóre gatunki ogoniastych zaatakowane emitują cichy pisk lub skowyt[177].
Anura wydają znacznie więcej dźwięków, zwłaszcza podczas okresu godowego, gdy starają się swymi nawoływaniami przyciągnąć płeć przeciwną. Obecność poszczególnych gatunków na tym samym obszarze można łatwiej rozróżnić na podstawie charakterystyk ich nawoływań, niż dzięki przelotnym spotkaniom z samymi płazami. U większości gatunków dźwięk powstaje dzięki wypuszczaniu powietrza z płuc nad struny głosowe do rezonatorów (powstałych z uchyłków jamy gębowej[48]) pod skórą bądź worków w gardle w kącie ust. Nadymają się one niczym balony i odgrywają rolę pudeł rezonansowych, pomagając dźwiękowi roznieść się po atmosferze bądź w wodzie, jeśli płaz przebywa akurat pod powierzchnią[177]. Wydawanie dźwięków stanowi zwykle głośne nawoływanie samca mające na celu zachęcenie do niego samicy oraz zniechęcenie innych samców do jego terytorium. Głos ten modyfikuje się do cichszego podczas zalotów z nadejściem samicy bądź do agresywniejszej wersji, jeśli nieopodal wtargnie inny samiec. Śpiewy te niosą za sobą ryzyko przyciągnięcia drapieżników. Powodują też zużycie bardzo dużej ilości energii[178]. Inne dźwięki obejmują odpowiedzi samicy na zaproszenie samca bądź na niechciane próby ampleksusu. Gdy płaz jest atakowany, wydaje z siebie odgłos zagrożenia lub strachu. Często przypomina on krzyk[179]. Zazwyczaj nocna rzekotka z Kuby Osteopilus septentrionalis wydaje z siebie specjalny okrzyk, jeśli deszcz pojawia się za dnia[180].
Zachowania terytorialne[edytuj | edytuj kod]
Mało wiadomo o zachowaniach terytorialnych płazów beznogich. Natomiast niektóre płazy ogoniaste czy bezogonowe bronią swych terytoriów. Chodzi zazwyczaj o tereny żerowania, rozrodu czy schronienia. Samce normalnie wykazują takie zachowania, ale w przypadku niektórych gatunków samice, a nawet osobniki młodociane, również je praktykują. Choć u wielu gatunków Anura samice są większe od samców, nie przeszkadza to u większości gatunków, by to samce angażowały się aktywnie w obronę terytorium. U gatunków terytorialnych samce mogą być większe od samic. U niektórych z nich wykształciły się specjalne adaptacje, jak powiększone zęby dla gryzienia czy kolce na tułowiu, rękach czy przedkciukach[181].

U Caudata, wśród których walki w obronie terytorium odnotowano u 19% przedstawicieli[181], obrona terytorium przejawia się przyjmowaniem grożącej postawy i atakowaniem intruza, jeśli zachodzi taka potrzeba. Na atak składają się: kłapanie ustami, gonitwy i czasami ugryzienia, okazjonalnie powodujące nawet utratę ogona. Zachowania terytorialne poznano dokładnie w przypadku Plethodon cinereus. 91% oznaczonych osobników, później schwytanych ponownie, było w odległości metra od ich pierwotnych schronień pod kłodą bądź skałą[182]. Podobną proporcję uzyskano, przenosząc zwierzęta w obrębie eksperymentu na odległość 30 m – kręgowce te wróciły do swych kryjówek[182]. Caudata pozostawiają znaki zapachowe wokół swych terytoriów mierzących średnio 0,16–0,33 m². Czasami zamieszkuje je para złożona z samca i samicy[183]. Stąd powstrzymywanie obcych przed wtargnięciem i wytyczanie granic pomiędzy sąsiadującymi areałami. Większość tych zachowań wydaje się stereotypowa, nie pociąga za sobą żadnych kontaktów pomiędzy osobnikami. Postawa grożąca obejmuje uniesienia ciała na ziemię i grożenie oponentowi, który często ulegle schodzi z drogi. Jeśli intruz pozostaje, następuje wypad do przodu z gryzieniem ogona bądź regionu nosowo-wargowego. Uszkodzenie może pogorszyć stan zdrowia rywala z powodu zapotrzebowania tkanki odpowiedzialnej za regenerację lub upośledzenie zdolności do znajdywania pokarmu[182].
Tylko u 5% Anura samce toczą walki o terytorium[181]. U przedstawicieli tego rzędu zachowania terytorialne samców obserwuje się często na terenach rozrodu. Nawoływania stanowią zarówno zachętę do parowania się, jak i obwieszczenie posiadania terytorium. W ogólności głębszy głos reprezentuje cięższego i silniejszego osobnika. To może wystarczyć do zapobieżenia wtargnięciu przez mniejszego samca. Wydawanie głosów pochłania wiele energii i ma swoją cenę. Jeśli samiec zmęczy się, traci swe terytorium na rzecz innego, zdrowszego. U samców występuje tendencja do tolerowania posiadaczy sąsiednich terytoriów i bardziej agresywnego zachowania wobec nieznanych intruzów. Posiadacze swych areałów odnoszą z tego tytułu korzyści i zazwyczaj wychodzą lepiej w razie starcia dwóch płazów tej samej wielkości. Jeśli grożenie nie wystarcza, nastąpić może bezpośrednie starcie. Metody walki obejmują pchnięcia, parcie, wypychanie powietrza z rezonatorów konkurenta, chwytanie go za głowę, skakanie mu po plecach, gryzienie, gonitwy, chlapanie i zanurzanie przeciwnika pod wodę[184].
Mechanizmy obronne[edytuj | edytuj kod]

Płazy mają miękkie ciała i cienką skórę. Nie dysponują pazurami, ochronnym pancerzem ani kolcami. Zdają się względnie bezbronne. Niemniej wykształciły zróżnicowane mechanizmy obronne pozwalające im uniknąć polujących na nie drapieżników. Pierwszą linię obrony u płazów ogoniastych i bezogonowych stanowi wydzielany przezeń śluz. Powoduje on, że skóra jest stale wilgotna i śliska, niełatwa do chwycenia. Wydzielina jest często lepka i niesmaczna[185]. Obserwowano węże ziewające i rozdziawiające szeroko swe paszcze podczas prób połknięcia platany szponiastej (Xenopus laevis), co dawało ofierze możliwość ucieczki[185][186].
W śluzie niektórych gatunków płazów występują też substancje toksyczne. Kwestię tę w przypadku Gymnophona zbadano pobieżnie, ale Typhlonectes compressicauda produkuje toksyczny śluz, który zabijał ryby drapieżne w doświadczeniu przeprowadzonym w Brazylii[187]. U niektórych Caudata występuje toksyczna skóra. Pacyfotryton szorstki (Taricha granulosa) z Ameryki Północnej i inni członkowie tego rodzaju zawierają neurotoksynę tetrodotoksynę (TTX), najbardziej toksyczną znaną niebiałkową substancję, prawie identyczną z produkowaną przez ryby rozdymkowate. Wzięcie do ręki takiej traszki nie powoduje szkody, ale połknięcie nawet najmniejszych ilości skóry może okazać się śmiertelne. W doświadczeniach, w których karmiono ryby, płazy bezogonowe, gady, ptaki i ssaki pokarmem z dodatkiem skór tych traszek, wszystkie badane organizmy okazały się wrażliwe. Jedynie węże, które zwykły odżywiać się płazami, wykazują mniejszą wrażliwość na toksyny wytwarzane przez płazy – jest to ciekawy przykład koewolucyjnego „wyścigu zbrojeń”[188][189]. Np. węże pończoszniki prążkowane (Thamnophis sirtalis) wykazywały 200 razy mniejszą wrażliwość na TTX niż ssaki czy ptaki[188][190]. Niektóre gatunki płazów bezogonowych (m.in. Dendrobatidae, a także występujące w Polsce ropuchy i kumaki) również produkują substancje toksyczne, głównie bufoteniny. Najważniejsze gruczoły produkujące toksynę leżą po bokach szyi i pod brodawkami grzbietu. Te okolice ciała płaz wystawia atakującemu go zwierzęciu. Ich wydzieliny mogą być obrzydliwe w smaku, wywoływać objawy fizyczne, w tym neurologiczne. W sumie wyizolowano ponad 200 toksyn z ograniczonej liczby gatunków płazów, które dotychczas przebadano[191].



Gatunki niejadalne i trujące cechuje jaskrawe ubarwienie ciała, często z kontrastowymi kombinacjami plam w kolorach czerwonym, żółtym i czarnym, na całości lub na części powierzchni ciała (jak np. u występujących w Polsce kumaków i salamandry). Ostrzega to potencjalnego drapieżnika o toksyczności ofiary: drapieżnik, spróbowawszy raz, o ile przeżyje, nie będzie więcej atakował tak ubarwionej ofiary. Pewne gatunki, jak kumaki Bombina, noszą ochronne ubarwienie na brzusznej stronie ciała. Zaatakowane, przyjmują pozycję obronną, pokazując drapieżcy żywe barwy swego brzucha. Przedstawiciel rzędu bezogonowych Allobates zaparo nie jest toksyczny, ale stosuje mimikrę, upodobniając się do innych, toksycznych gatunków żyjących w tych samych miejscach. Strategia ta służy zmyleniu drapieżnika[193].
Wiele płazów wiedzie nocny tryb życia, ukrywając się za dnia. Unikają w ten sposób dziennych drapieżników polujących przy pomocy wzroku. Inne płazy stosują Ubarwienie kryptyczne, aby zamaskować się w środowisku, w którym przebywają. Niektóre płazy ogoniaste przybierają pozy obronne, gdy czują się bezpośrednio zagrożone przez drapieżnika jak np. przez północnoamerykańską ryjówkę krótkoogoniastą (Blarina brevicauda), wykonują wijące ruchy ciała, unoszą się i smagają ogonem, co sprawia drapieżnikowi trudność w schwytaniu płaza bądź w uniknięciu kontaktu z produkującymi toksyny gruczołami[194]. Podobnie niektóre płazy bezogonowe nadymają się, by wyglądać na większe i groźniejsze. Grzebiuszki z rodzaju Pelobates krzyczą i skaczą w kierunku agresora[45]. Olbrzymie salamandry Andrias, jak też Ceratophryinae i Pyxicephalus mają ostre zęby i są zdolne ranić do krwi, gryząc w swej obronie. Desmognathus quadramaculatus potrafi ugryźć atakującego ją dwu-trzykrotnie większego węża pończosznika prążkowanego (Thamnophis sirtalis) w głowę i dzięki temu często udaje mu się uciec[195].
Kilka gatunków Caudata stosuje autotomię, poświęcając część swego ciała, najczęściej ogon, by umożliwić sobie ucieczkę. U niektórych gatunków należących do bezpłucnikowatych strefa u podstawy ogona jest strukturalnie słaba, co ułatwia odrzucenie ogona w wyniku silnego skurczu mięśni okrężnych u podstawy ogona. Ogon często kurczy się już po odrzuceniu, odwracając uwagę napastnika i pozwalając ogoniastemu uciec. Utracony ogon, a także w niektórych wypadkach kończyny, podlegają częściowej bądź całkowitej regeneracji[196]. U dorosłych Anura kończyny nie odrastają, choć zachodzi to u kijanek[74].
Znaczenie[edytuj | edytuj kod]

Płazy występują na wszystkich kontynentach, z wyjątkiem Antarktydy, i w zdecydowanej większości ekosystemów lądowych na Ziemi. Nie występują jedynie w pełnosłonych morzach (z wyjątkiem jednego gatunku). W niektórych typach ekosystemów (np. w lasach mieszanych strefy umiarkowanej w Nearktyce) są jednymi z najliczniejszych (per capita i pod względem biomasy) kręgowców – ustępując jedynie gryzoniom[197]. Jako drapieżniki, mają znaczny wpływ na kształt sieci troficznych i przepływ energii w ekosystemach: na Środkowym Wschodzie zwiększenie odłowów płazów w celach spożywczych spowodowało spadek liczebności populacji żab i znaczący wzrost liczebności komarów, których liczebność była uprzednio ograniczana przez polujące na nie płazy[198]. Wiele drapieżników z wyższych poziomów troficznych zależy od płazów, jako od podstawowego źródła pożywienia. Wąż Thamnophis elegans w Kalifornii żeruje prawie wyłącznie na dwóch gatunkach płazów bezogonowych, Bufo canorus i Rana muscosa. Ponieważ ich liczebność się zmniejsza, zagraża to populacji tego węża, i innych gatunków (m.in. drapieżnych ptaków)[199]. W drobnych i okresowych zbiornikach wodnych kijanki płazów są jednymi z głównych detrytusożerców i roślinożerców, żywią się nimi rozmaite drapieżne bezkręgowce (larwy i postacie dorosłe chrząszczy, m.in. Dytiscidae, pluskwiaki m.in. Nepidae), ryby, ptaki brodzące[200].
Płazy są zwierzętami pożytecznymi z punktu widzenia człowieka:
- w naturalny sposób kontrolują liczebność zwierząt, które uważane są za szkodniki (owadów, ślimaków)[201].
- niektóre gatunki płazów wykorzystywano na masową skalę do zwalczania szkodników upraw (owadów, gryzoni). M.in. w celu zwalczania szkodników upraw trzciny cukrowej introdukowano na wyspy karaibskie i w Australii ropuchę olbrzymią (Rhinella marina). Na Karaibach akcja ta zakończyła się umiarkowanym sukcesem[202], ale w innych rejonach świata introdukcja agi spowodowała znaczny spadek różnorodności biologicznej – ten żarłoczny płaz żerował nie tylko na szkodnikach, ale również na innych gatunkach i stał się uciążliwym gatunkiem inwazyjnym[203][204][205].
- ze względu na wrażliwość na zmiany warunków siedliskowych i obecność substancji toksycznych (co wynika m.in. z nagiej, przepuszczalnej skóry, złożonego, podatnego na zakłócenia cyklu życiowego) są wykorzystywane jako gatunki wskaźnikowe, świadczące o stanie ekosystemu[206].
- niektóre płazy bezogonowe są jadalne – spożywa się je między innymi we Francji i na Dalekim Wschodzie. Żabami i ropuchami karmi się też zwierzęta futerkowe w hodowlach[88].
- gatunki z rodziny Dendrobatidae (głównie z rodzaju Phyllobates) są wykorzystywane przez Indian środkowo- i południowoamerykańskich do zatruwania strzał, używanych do polowań. Występujące w nich alkaloidy są także przedmiotem badań pod kątem pozyskiwania nowych lekarstw (m.in. środków znieczulających)[207][208].
- różne rodzaje enteogenów (głównie bufoteniny) są pozyskiwane ze skóry i parotydów płazów w wielu częściach świata, m.in. wśród plemion Mezoameryki i na Dalekim Wschodzie[209][210].
- żaba szponiasta (Xenopus laevis) jest ważnym organizmem modelowym, zwłaszcza w badaniach embriogenezy i regulacji transkrypcji (m.in. ze względu na duże, łatwe do manipulowania zarodki i przezroczyste kijanki). Nieocenione usługi oddała w medycynie: ze względu na wrażliwość na gonadotropinę kosmówkową osobniki tego gatunku służyły jako pierwszy w historii medycyny test ciążowy (wystarczyło nastrzyknąć samicę moczem kobiety, obecność gonadotropiny kosmówkowej pobudzała żabę do składania po kilku godzinach jaj). Podobnie wykorzystywany, jako organizm modelowy, jest pokrewny gatunek – Xenopus tropicalis[211][212].
- kumaki, nizinny i górski (Bombina bombina i B. variegata) są wykorzystywane jako organizmy modelowe w badaniach zjawiska hybrydyzacji międzygatunkowej i procesów specjacji[213].
- kijanki wielu gatunków płazów występujących w tropikach i w strefie klimatu umiarkowanego są wykorzystywane do badań nad plastycznością fenotypową i indukcją mechanizmów obrony przed drapieżnictwem oraz mechanizmami kształtującymi różnorodność gatunkową[214][215].
Ochrona[edytuj | edytuj kod]

Drastyczny spadek populacji płazów, obejmujący zanikanie całych populacji i masowe miejscowe wymarcia, obserwuje się od lat 80. XX wieku w wielu miejscach świata. Spadki liczebności płazów uznaje się za jedne z najbardziej krytycznych zagrożeń globalnej bioróżnorodności[216]. W 2006 wyróżniano 4035 gatunków płazów zależnych od wody na pewnym etapie swego rozwoju. 33,6% z nich, czyli 1356 uznano za zagrożone. Liczba ta jest prawdopodobnie niedoszacowana. Nie włączono doń 1427 gatunków, na których temat nie było wystarczających danych, by przypisać im status[217]. Jako przyczyny tego stanu rzeczy wymienia się m.in. zniszczenie środowiska naturalnego, jego modyfikacje, nadmierną eksploatację, zanieczyszczenia, introdukowane gatunki, zmiany klimatyczne, substancje chemiczne zaburzające gospodarkę hormonalną, dziurę ozonową (wykazano, że promieniowanie ultrafioletowe uszkadza szczególnie skórę, oczy i jaja płazów) oraz choroby, jak chytridiomycosis. Jednak przyczyny wielu przypadków spadku liczebności płazów wciąż są niejasne i stanowią temat trwającej dyskusji[218].

Globalna strategia powstrzymania kryzysu opracowana została w 2005 w formie Amphibian Conservation Action Plan (ACAP – „Plan Akcji Ochrony Płazów”). Stworzony przez ponad osiemdziesięciu najważniejszych ekspertów w tej dziedzinie plan działania wyszczególniał, co było potrzebne do ograniczenia spadku liczebności płazów i wyginięć przez kolejnych 5 lat, określając też koszty tych działań. The Amphibian Specialist Group of the World Conservation Union (IUCN) przewodzi wysiłkom ku wdrożeniu wyczerpującej strategii globalnej ochrony płazów[219]. Autorzy ACAP postulują położenie szczególnego nacisku na uzupełnienie wiedzy w zakresie systematyki, ekologii i źródeł zagrożeń płazów, a także na ciągły monitoring stanu środowiska i kondycji populacji płazów w naturze. W planie ACAP najwięcej uwagi poświęcono ochronie siedlisk i tworzeniu sieci ochrony obszarów o znaczeniu kluczowym dla różnorodności biologicznej, gromadzeniu próbek materiału biologicznego płazów, zapobieganiu globalnym zmianom klimatu, ograniczeniu eksploatacji populacji płazów przez człowieka oraz zapobieganiu chorobom, trapiącym populacje płazów[219].
Podstawową formą ochrony płazów pozostaje ochrona gatunkowa gatunków zagrożonych. W Polsce występuje 18 gatunków płazów (zobacz też: Płazy Polski), wszystkie objęte są ochroną gatunkową na terenie kraju[220]. Zapobieganiu nielegalnemu wywozowi i handlowi gatunkami zagrożonymi, w tym płazami, służy konwencja CITES.
Za priorytetową formę ochrony uznaje się ochronę i odtwarzanie siedlisk, ze względu na to, że to właśnie zanik i degradacja siedlisk są głównymi powodami wymierania płazów. W krajach Unii Europejskiej kompleksową formę ochrony siedlisk zapewniają specjalne obszary ochrony siedlisk wchodzące w skład sieci Natura 2000[221], na świecie uzupełniają je obszary wodno-błotne o specjalnym znaczeniu, chronione przez konwencję ramsarską.
Ze względu na to, że w wielu przypadkach nie zostały rozpoznane przyczyny wymierania płazów, a wymieranie to postępuje zbyt szybko, by można było mu przeciwdziałać, ważnymi elementami służącymi ochronie płazów pozostają hodowla in-situ i ex-situ oraz krioprezerwacja materiału genetycznego wymierających gatunków[219]. Amphibian Ark stanowi organizację stworzoną w celu wdrożenia rekomendacji ochrony ex-situ dla tego planu. Współpracuje ona z ogrodami zoologicznymi i akwariami całego świata, zachęcając do tworzenia kolonii stanowiących zabezpieczenie dla zagrożonych gatunków[219]. Panama Amphibian Rescue and Conservation Project („Projekt Ratowania i Ochrony Panamskich Płazów”) zbudowany został dla stworzenia ogólnokrajowej odpowiedzi na zagrożenie chytridiomycosis[222].
(zobacz też: Ochrona płazów)
W kulturze[edytuj | edytuj kod]
Płazy odgrywają pewną rolę w kulturze. Jak zauważa Marian Młynarski, podobnie jak gady, nie należą do zwierząt najlepiej poznanych. Przyczyniło się to do nieprawdziwego ich obrazu. Nie zyskały sobie sympatii społeczeństwa, cieszą się złą opinią. Uważa się je za wstrętne, paskudne stworzenia, wywołujące strach czy odrazę. Ta zupełnie nieuzasadniona opinia przyniosła negatywne skutki: bezmyślne tępienie zwierząt[223].

Zwierzęta te zdążyły obrosnąć w przesądy. Uważa się choćby, że salamandra potrafi przetrwać w ogniu, a nawet preferuje ogień jako swe siedlisko[223]. Odmieńce jaskiniowe z kolei mają stanowić dzieci smoków[224] żyjących w środku ziemi[225]. Rzekotkom przypisywano w przeszłości umiejętność przewidywania pogody, uważano je za pomocne w tworzeniu prognoz. Trzymano je z tego względu w specjalnych, wysokich terrariach[226]. Cały czas hoduje się ją jako zwierzę domowe[227], podobnie jak popularną w hodowli australorzekotkę szmaragdową[228].
W biblijnej Księdze Wyjścia namnożenie się żab stanowi drugą plagę egipską[229]. Zjawiska takie zdarzają się nad Nilem naturalnie[230].
Jan Parandowski nazywa hydrę lernejską, potwora z bagien z mitologii greckiej, „płazem ohydnym”[231]. Z mitologii greckiej pochodzi słowo „tryton”, określające dziś traszki. Stanowiło ono imię boga morskiego, syna Posejdona, oznaczało także całą rasę stworzeń morskich, pół ludzi, pół ryb[232]. W mitologii Korei występuje władca o imieniu Kymwa, czyli „Złota Żaba”[233].
Złą ropuchę z filmu Labirynt fauna wzorowano na postaci z dawnego horroru[234].
Z płazami wiążą się też nazwy miejsc i organizacji. Do salamandry plamistej (zwanej jaszczurem) odwołują się Jaszczurówka, Jaszczurzyce[235] i Polskie Towarzystwo Ochrony Przyrody „Salamandra”[236].
Zadziornica włochata zajęła pierwsze miejsce na liście najdziwniejszych zwierząt świata stworzonej przez serwis internetowy New Scientist[237]. Dzięki swym dziwacznym „pazurom” porównuje się ją do bohaterów komiksów i filmów, jak Wolverine[238].
Nauka[edytuj | edytuj kod]
Nauka o płazach nazywa się batrachologią. Natomiast dyscyplina wiedzy traktująca o płazach i gadach to herpetologia. Wchodzą one w skład szerszej nauki: zoologii, choć rzadko uprawiane są oddzielnie. Badania na tym polu dotyczą zwierzęcej taksonomii, morfologii, etologii, ekologii, fizjologii i biochemii. Wyniki badań podlegają recenzji naukowej i publikacji w czasopismach naukowych. Specjaliści prowadzą prace terenowe, badania na uniwersytetach, kształcą studentów, prowadzą muzea i ogrody zoologiczne, rozmnażają i sprzedają zwierzęta, a także zarządzają dziką przyrodą[239]. Zrzeszają się w towarzystwach naukowych (np. Society for the Study of Amphibians and Reptiles (SSAR)[240] i Societas Europaea Herpetologica (SEH)[241]) i publikują prace w czasopismach naukowych poświęconych herpetologii (np. Amphibia-Reptilia[242]).
Przypisy[edytuj | edytuj kod]
- ↑ AmphibiaWeb. (ang.).
- ↑ Phylogenetic view of Amphibia. AmphibiaWeb, 2012-05-14. [dostęp 2013-09-06]. (ang.).
- ↑ a b Grzegorz Niedźwiedzki, Piotr Szrek, Katarzyna Narkiewicz, Marek Narkiewicz & Per E. Ahlberg. Tetrapod trackways from the early Middle Devonian period of Poland. „Nature”. 463. s. 43–48. DOI: 10.1038/nature08623. (ang.).
- ↑ Laurie J. Vitt, Janalee P. Caldwell: Herpetology: An Introductory Biology of Amphibians and Reptiles. Academic Press, 2013, s. 11.
- ↑ Jing Lu, Min Zhu, John A. Long, Wenjin Zhao, Tim J. Senden, Liantao Jia & Tuo Qiao. The earliest known stem-tetrapod from the Lower Devonian of China. „Nature Communications”. 3, s. 1160, 2012. DOI: 10.1038/ncomms2170. (ang.).
- ↑ a b c Evolution of amphibians. University of Waikato: Plant and animal evolution. [dostęp 2013-10-14].
- ↑ a b c Robert L. Carroll, Hallam, Anthony (Ed.): Patterns of Evolution, as Illustrated by the Fossil Record. Elsevier, 1977, s. 405–420. ISBN 978-0-444-41142-6.
- ↑ a b Clack, Jennifer A: Ichthyostega. [w:] Tree of Life Web Project [on-line]. 2006. [dostęp 2013-10-14].
- ↑ Lombard, R. E.; Bolt, J. R. Evolution of the tetrapod ear: an analysis and reinterpretation. „Biological Journal of the Linnean Society”. 1. 11, s. 19–76, 1979. DOI: 10.1111/j.1095-8312.1979.tb00027.x.
- ↑ a b c J.O.I. Spoczynska: Fossils: A Study in Evolution. Frederick Muller Ltd, 1971, s. 120–125. ISBN 978-0-584-10093-8.
- ↑ D. San Mauro. A multilocus timescale for the origin of extant amphibians. „Molecular Phylogenetics and Evolution”. 2. 56, s. 554–561, 2010. DOI: 10.1016/j.ympev.2010.04.019. PMID: 20399871.
- ↑ Wells 2010 ↓, s. 9.
- ↑ Ralf Werneburga, Ausonio Ronchib & Jörg W. Schneider. The Early Permian Branchiosaurids (Amphibia) of Sardinia (Italy): Systematic Palaeontology, Palaeoecology, Biostratigraphy and Palaeobiogeographic Problems. „Palaeogeography, Palaeoclimatology, Palaeoecology”. 252 (3–4), s. 383–404, 2007-09. Elsevier. (ang.).
- ↑ Tomasz Sulej. Modyfikacja rekonstrukcji czaszki triasowego płaza Tatrasuchus z Tatr na podstawie interpretacji jego pokrewieñstw. „Przegląd Geologiczny”. 57, s. 719–722, 2009.
- ↑ a b San Mauro, Diego; Vences, Miguel; Alcobendas, Marina; Zardoya, Rafael; Meyer, Axel. Initial diversification of living amphibians predated the breakup of Pangaea. „The American Naturalist”. 5. 165, s. 590–599, 2005. DOI: 10.1086/429523. PMID: 15795855.
- ↑ a b Anderson, J.; Reisz, R.; Scott, D.; Fröbisch, N.; Sumida, S. A stem batrachian from the Early Permian of Texas and the origin of frogs and salamanders. „Nature”. 7194. 453, s. 515–518, 2008. DOI: 10.1038/nature06865. PMID: 18497824.
- ↑ a b c d Dorit, Walker i Barnes 1991 ↓, s. 843–859.
- ↑ Walter W. Skeat: A Concise Etymological Dictionary of the English Language. Clarendon Press, 1897, s. 39.
- ↑ Baird, Donald. Paleozoic lepospondyl amphibians. „Integrative and Comparative Biology”. 2. 5, s. 287–294, 1965. DOI: 10.1093/icb/5.2.287.
- ↑ Frost, Darell: American Museum of Natural History: Amphibian Species of the World 5.6, an Online Reference. [w:] Herpetology [on-line]. The American Museum of Natural History, 2011. [dostęp 2013-10-14].
- ↑ a b c d Crump, Martha L. Amphibian diversity and life history. „Amphibian Ecology and Conservation. A Handbook of Techniques”, s. 3–20, 2009.
- ↑ IUCN: Global Amphibian Assessment. [dostęp 2014-05-26]. (ang.).
- ↑ Blackburn, D. C.; Wake, D. B. Class Amphibia Gray, 1825. In: Zhang, Z.-Q. (Ed.) Animal biodiversity: An outline of higher-level classification and survey of taxonomic richness. „Zootaxa”. 3148, s. 39–55, 2011.
- ↑ Speer, B. W.; Waggoner, Ben: Amphibia: Systematics. University of California Museum of Paleontology, 1995. [dostęp 2013-10-14].
- ↑ a b c Stebbins i Cohen 1995 ↓, s. 3.
- ↑ Zbyněk Roček, 14. Mesozoic Amphibians, [w:] Harold Heatwole, Robert L. Carroll (red.), Amphibian Biology: Paleontology: The Evolutionary History of Amphibians, t. 4, Surrey Beatty & Sons, 2000, s. 1295–1331, ISBN 978-0-949324-87-0.
- ↑ Farish A. Jenkins jr., Denis M. Walsh, Robert L Carroll, Anatomy of ''Eocaecilia micropodia'', a limbed caecilian of the Early Jurassic, „Bulletin of the Museum of Comparative Zoology”, 158 (6), 2007, s. 285–365, DOI: 10.3099/0027-4100(2007)158[285:AOEMAL]2.0.CO;2.
- ↑ Gaoa, Ke-Qin; Shubin, Neil H. Late Jurassic salamandroid from western Liaoning, China. „Proceedings of the National Academy of Sciences of the United States of America”. 15. 109, s. 5767–5772, 2012. DOI: 10.1073/pnas.1009828109.
- ↑ Cannatella, David: Salientia. [w:] Tree of Life Web Project [on-line]. 2008. [dostęp 2013-10-14].
- ↑ M. Borsuk-Białynicka, S.E Evans. The scapulocoracoid of an Early Triassic stem-frog from Poland. „Acta Palaeontologica Polonica”. 47. 1, s. 79–96, 2002.
- ↑ Michel Laurin, Terrestrial Vertebrates, [w:] Tree of Life Web Project [online], 2011 [dostęp 2013-10-14].
- ↑ Michel Laurin, Jacques A Gauthier, Amniota, [w:] Tree of Life Web Project [online], 2012 [dostęp 2013-10-14].
- ↑ Yuan Zhigang i inni, Fejervarya cancrivora, [w:] The IUCN Red List of Threatened Species [dostęp 2023-01-10] (ang.).
- ↑ James L. Sumich, Morrissey, John F.: Introduction to the Biology of Marine Life. Jones & Bartlett Learning, 2004, s. 171. ISBN 978-0-7637-3313-1.
- ↑ Eric N. Rittmeyer, Allen Allison, Michael C. Gründler, Derrick K. Thompson i inni. Ecological guild evolution and the discovery of the world’s smallest vertebrate. „PLOS ONE”. 1. 7, s. e29797, 2012. DOI: 10.1371/journal.pone.0029797. PMID: 22253785. PMCID: PMC3256195.
- ↑ a b Brent Nguyen, John Cavagnaro, Amphibian Facts [online], AmphibiaWeb, lipiec 2012 [dostęp 2013-10-14].
- ↑ Price, L. I. Um anfibio Labirinthodonte da formacao Pedra de Fogo, Estado do Maranhao. „Boletim”. 24, s. 7–32, 1948. Ministerio da Agricultura, Departamento Nacional da Producao ineral Divisao de Geologia e Mineralogia.
- ↑ a b c d Stebbins i Cohen 1995 ↓, s. 24–25.
- ↑ a b c d e f g h i j Młynarski 1966 ↓, s. 5.
- ↑ a b Młynarski 1966 ↓, s. 4.
- ↑ a b c d Młynarski 1966 ↓, s. 9.
- ↑ David Cannatella, Anna Graybeal, Bufonidae, True Toads, [w:] Tree of Life Web Project [online], 2008 [dostęp 2013-10-14].
- ↑ Frog fun facts [online], The American Museum of Natural History, 12 stycznia 2010 [dostęp 2013-10-14].
- ↑ David Challenger, World’s smallest frog discovered in Papua New Guinea [online], CNN, 12 stycznia 2012 [dostęp 2013-10-14] [zarchiwizowane z adresu 2012-04-20].
- ↑ a b c d e f g Nicholas Arnold, Denys Ovenden: Reptiles and Amphibians of Britain and Europe. HarperCollins, 2002, s. 13–18. ISBN 978-0-00-219318-4.
- ↑ J. Faivovich i inni, Systematic review of the frog family Hylidae, with special reference to Hylinae: Phylogenetic analysis and revision, „Bulletin of the American Museum of Natural History”, 294, 2005, s. 1–240, DOI: 10.1206/0003-0090(2005)294[0001:SROTFF]2.0.CO;2.
- ↑ a b Linda S. Ford, David C. Cannatella, The major clades of frogs, „Herpetological Monographs”, 7, 1993, s. 94–117, DOI: 10.2307/1466954, JSTOR: 1466954.
- ↑ a b c d e f g h Młynarski 1966 ↓, s. 8.
- ↑ Kumaniecki K. 1975. Słownik łacińsko-polski. PWN Warszawa, s. 546.
- ↑ A. Larson, W. Dimmick. Phylogenetic relationships of the salamander families: an analysis of the congruence among morphological and molecular characters. „Herpetological Monographs”. 7. 7, s. 77–93, 1993. DOI: 10.2307/1466953. JSTOR: 1466953.
- ↑ Baum, David: Trait Evolution on a Phylogenetic Tree: Relatedness, Similarity, and the Myth of Evolutionary Advancement. Nature Education, 2008. [dostęp 2013-10-14].
- ↑ Sparreboom, Max: Andrias davidianus Chinese giant salamander. AmphibiaWeb, 2000-02-07. [dostęp 2013-10-14].
- ↑ Wake, David B: Thorius pennatulus. AmphibiaWeb, 2000-11-08. [dostęp 2013-10-14].
- ↑ Dorit, Walker i Barnes 1991 ↓, s. 852.
- ↑ Heying, Heather: Cryptobranchidae. [w:] Animal Diversity Web [on-line]. University of Michigan, 2003. [dostęp 2013-10-14].
- ↑ a b Mayasich, J.; Grandmaison, D.; Phillips, C: Eastern Hellbender Status Assessment Report. U.S. Fish and Wildlife Service, 2003-06-01. [dostęp 2013-10-14].
- ↑ a b Allan Larson, David Wake & Tom Devitt: Hynobiidae. [w:] Tree of Life web project [on-line]. [dostęp 2013-10-14]. (ang.).
- ↑ a b Hynobiidae. [w:] AmphibiaWeb: Information on amphibian biology and conservation. [on-line]. Berkeley, California: AmphibiaWeb, 2013. [dostęp 2013-10-14]. (ang.).
- ↑ a b c d Caudata, [w:] Encyclopædia Britannica [dostęp 2013-10-14] (ang.).
- ↑ Cogger, H. G.; Zweifel, R. G (Ed.): Encyclopedia of Reptiles and Amphibians. Academic Press, 1998, s. 69–70. ISBN 978-0-12-178560-4.
- ↑ Stebbins i Cohen 1995 ↓, s. 4.
- ↑ Dorit, Walker i Barnes 1991 ↓, s. 858.
- ↑ a b Gymnophiona, [w:] Encyclopædia Britannica [dostęp 2013-10-14] (ang.).
- ↑ Zylberberg, Louise; Wake, Marvalee H. Structure of the scales of Dermophis and Microcaecilia (Amphibia: Gymnophiona), and a comparison to dermal ossifications of other vertebrates. „Journal of Morphology”. 1. 206, s. 25–43, 1990. DOI: 10.1002/jmor.1052060104.
- ↑ Biodiversity Institute of Ontario; Hebert, Paul D. N: Amphibian morphology and reproduction. [w:] Encyclopedia of Earth [on-line]. 2008-10-12. [dostęp 2013-10-14].
- ↑ Stebbins i Cohen 1995 ↓, s. 10–11.
- ↑ a b R.I.C. Spearman: The Integument: A Textbook of Skin Biology. Cambridge University Press, 1973, s. 81. ISBN 978-0-521-20048-6.
- ↑ a b Andrea Modesti, Stefano Aguzzi & Raoul Manenti. A case of complete albinism in Lissotriton vulgaris meridionalis. „Herpetology Notes”. 4, s. 395–396, 2011. [zarchiwizowane z adresu]. (ang.).
- ↑ Jussi S Alho, Gábor Herczeg, Fredrik Söderman, Anssi Laurila, K Ingemar Jönsson & Juha Merilä. Increasing melanism along a latitudinal gradient in a widespread amphibian: local adaptation, ontogenic or environmental plasticity?. „BMC Evolutionary Biology”. 10, s. 317, 2010. (ang.).
- ↑ Gábor Herczeg, Chikako Matsuba & Juha Merilä. Sequence variation in the melanocortin-1 receptor gene (MC1R) does not explain variation in the degree of melanism in a widespread amphibian. „Annales Zoologici Fennici”. 47 (1), s. 37–45, 2010. Finnish Zoological and Botanical Publishing. (ang.).
- ↑ a b c d e f g Dorit, Walker i Barnes 1991 ↓, s. 846.
- ↑ James Hanken& Brian K. Hall. Variation and Timing of the Cranial Ossification Sequence of the Oriental Fire-Bellied Toad, Bombina orientalis (Amphibia, Discoglossidae). „Journal of Morphology”. 182, s. 245–255, 1984. (ang.).
- ↑ Reynolds 1897 ↓, s. 133.
- ↑ a b c Stebbins i Cohen 1995 ↓, s. 26–36.
- ↑ Henryk Szarski, Historia zwierząt kręgowych, Warszawa: PWN, 1990, s. 186–187, ISBN 83-01-09155-X, OCLC 834081005.
- ↑ Dorit, Walker i Barnes 1991 ↓, s. 306.
- ↑ a b c d Wilczynski 1992 ↓, s. 10.
- ↑ a b c d e f g h Stebbins i Cohen 1995 ↓, s. 100.
- ↑ a b c d e Wilczynski 1992 ↓, s. 12.
- ↑ a b c d e Wilczynski 1992 ↓, s. 13.
- ↑ a b LL Bruce, TJ Neary. The limbic system of tetrapods: a comparative analysis of cortical and amygdalar populations. „Brain, Behavior and Evolution”. 46 (4–5), s. 224–234, 1995. (ang.).
- ↑ Wilczynski 1992 ↓, s. 12–13.
- ↑ Wilczynski 1992 ↓, s. 9.
- ↑ a b c amphibian, [w:] Encyclopædia Britannica [dostęp 2013-10-14] (ang.).
- ↑ Stebbins i Cohen 1995 ↓, s. 69.
- ↑ a b A. Glücksmann. Development and differentiation of the tadpole eye. „The British journal of ophthalmology”. 24 (4), s. 153, 1940. (ang.).
- ↑ Khanna i Yadav 2005 ↓, s. 6.
- ↑ a b c d e f Młynarski 1966 ↓, s. 6.
- ↑ Chika Yoshii, Yoko Ueda, Mitumasa Okamoto & Masasuke Araki. Neural retinal regeneration in the anuran amphibian Xenopus laevis post-metamorphosis: Transdifferentiation of retinal pigmented epithelium regenerates the neural retina. „Developmental Biology”. 303, s. 45–56, 2007. Elsevier. (ang.).
- ↑ Wilczynski 1992 ↓, s. 16.
- ↑ V.E. Negus. The organ of Jacobson. „Journal of anatomy”. 90 (Pt4), s. 515, 1956. (ang.).
- ↑ Duellman 1994 ↓, s. 378.
- ↑ a b c d e f g Dorit, Walker i Barnes 1991 ↓, s. 847.
- ↑ Stebbins i Cohen 1995 ↓, s. 66.
- ↑ a b Elizabeth A. Jones. Xenopus: a prince among models for pronephric kidney development.. „Journal of the American Society of Nephrology”. 16 (2), s. 313–321, 2005. (ang.).
- ↑ a b c d e Dorit, Walker i Barnes 1991 ↓, s. 849.
- ↑ a b c Wells 2010 ↓, s. 117.
- ↑ a b Smith 1951 ↓, s. 31.
- ↑ a b Smith 1951 ↓, s. 113.
- ↑ Wells 2010 ↓, s. 108.
- ↑ Oberleithner, H., Weigt, M., Westphale, H. J., & Wang, W. Aldosterone activates Na+/H+ exchange and raises cytoplasmic pH in target cells of the amphibian kidney. „Proceedings of the National Academy of Sciences”. 84 (5), s. 1464–1468, 1987. (ang.).
- ↑ a b c Stebbins i Cohen 1997 ↓, s. 17.
- ↑ Stebbins i Cohen 1997 ↓, s. 18.
- ↑ Khanna i Yadav 2005 ↓, s. 4.
- ↑ a b Walski 1986 ↓, s. 8.
- ↑ a b Stebbins i Cohen 1997 ↓, s. 21.
- ↑ a b c Walski 1986 ↓, s. 5.
- ↑ Walski 1986 ↓, s. 10.
- ↑ Walski 1986 ↓, s. 14.
- ↑ Walski 1986 ↓, s. 9.
- ↑ Stebbins 1997 ↓, s. 25.
- ↑ Stebbins i Cohen 1997 ↓, s. 23.
- ↑ a b c d e Andrzej Jasiński: Gruczoły dokrewne. W: Henryk Szarski: Anatomia porównawcza kręgowców. PWN, 1976, s. 629–695.
- ↑ Duellman 1994 ↓, s. 14–15.
- ↑ a b c Duellman 1994 ↓, s. 14.
- ↑ Khanna i Yadav 2005 ↓, s. 7.
- ↑ Hogan, C. Michael: Abiotic factor. [w:] Encyclopedia of Earth [on-line]. National Council for Science and the Environment, 2010-07-31. [dostęp 2013-10-14].
- ↑ Stebbins i Cohen 1995 ↓, s. 140–141.
- ↑ a b Willia E. Duellman, Linda Trueb: Biology of Amphibians. JHU Press, 1994, s. 77–79. ISBN 978-0-8018-4780-6.
- ↑ a b Stebbins i Cohen 1995 ↓, s. 154–162.
- ↑ Adams, Michael J.; Pearl, Christopher A: Ascaphus truei. AmphibiaWeb, 2005. [dostęp 2013-10-14].
- ↑ Aspects of amphibian metamorphosis: Hormonal control. W: Sakae Kikuyama, Kousuke Kawamura, Shigeyasu Tanaka, Kakutoshi Yamamoto: International Review of Cytology: A Survey of Cell Biology. Academic Press, 1993, s. 105–126. ISBN 978-0-12-364548-7.
- ↑ Newman, Robert A. Adaptive plasticity in amphibian metamorphosis. „BioScience”. 9. 42, s. 671–678, 1992. DOI: 10.2307/1312173. JSTOR: 1312173.
- ↑ Gilbert, Perry W. Observations on the eggs of Ambystoma maculatum with especial reference to the green algae found within the egg envelopes. „Ecology”. 23 (2), s. 215–227, 1942. DOI: 10.2307/1931088. JSTOR: 1931088.
- ↑ Waldman, Bruce; Ryan, Michael J. Thermal advantages of communal egg mass deposition in wood frogs (Rana sylvatica). „Journal of Herpetology”. 1. 17, s. 70–72, 1983. DOI: 10.2307/1563783. JSTOR: 1563783.
- ↑ Meshaka, Walter E. Jr: Eleutherodactylus planirostris. AmphibiaWeb. [dostęp 2013-10-14].
- ↑ J. Bosch i inni, Calotriton asper, [w:] The IUCN Red List of Threatened Species [dostęp 2023-01-10] (ang.).
- ↑ Arie van der Meijden, David B. Wake: Calotriton asper. AmphibiaWeb, 2002-05-25. [dostęp 2013-10-14]. (ang.).
- ↑ Dalgetty, Laura; Kennedy, Malcolm W. Building a home from foam: túngara frog foam nest architecture and three-phase construction process. „Biology Letters”. 6 (3), s. 293–296, 2010. DOI: 10.1098/rsbl.2009.0934. PMID: 20106853. PMCID: PMC2880057.
- ↑ Proteins of frog foam nests. School of Life Sciences, University of Glasgow. [dostęp 2013-10-14].
- ↑ Stebbins i Cohen 1995 ↓, s. 6–9.
- ↑ Janzen, Peter: Nannophrys ceylonensis. AmphibiaWeb, 2005-05-10. [dostęp 2013-10-14].
- ↑ frog and toad, [w:] Encyclopædia Britannica [dostęp 2013-10-14] (ang.).
- ↑ Stebbins i Cohen 1995 ↓, s. 179–181.
- ↑ a b frog and toad, [w:] Encyclopædia Britannica [dostęp 2013-10-14] (ang.).
- ↑ Crump, Martha L. Cannibalism by younger tadpoles: another hazard of metamorphosis. „Copeia”. 4. 4, s. 1007–1009, 1986. DOI: 10.2307/1445301. JSTOR: 1445301.
- ↑ a b Michael R. Crossland, Mark N. Hearnden, Ligia Pizzatto, Ross A. Alford & Richard Shine. Why be a cannibal? The benefits to cane toad, Rhinella marina (=Bufo marinus), tadpoles of consuming conspecific eggs. „Animal Behaviour”. 82, s. 775–782, 201. Elsevier. (ang.).
- ↑ a b Sergius L. Kuzmin, Meredith J. Mahoney, Kellie Whittaker: Rana temporaria Common Frog. AmphibiaWeb, 2010-05-31. [dostęp 2013-10-14]. (ang.).
- ↑ Valentine, Barry D.; Dennis, David M. A comparison of the gill-arch system and fins of three genera of larval salamanders, Rhyacotriton, Gyrinophilus, and Ambystoma. „Copeia”. 1. 1964, s. 196–201, 1964. DOI: 10.2307/1440850. JSTOR: 1440850.
- ↑ Shaffer, H. Bradley: Ambystoma gracile. AmphibiaWeb, 2005. [dostęp 2013-10-14].
- ↑ Kiyonaga, Robin R: Metamorphosis vs. neoteny (paedomorphosis) in salamanders (Caudata). [dostęp 2013-10-14].
- ↑ William E. Duellman, Linda Trueb, Biology of Amphibians, JHU Press, 1994, s. 191–192, ISBN 978-0-8018-4780-6.
- ↑ a b Młynarski 1966 ↓, s. 20–21.
- ↑ Sergius L. Kuzmin Kuzmin, Peera Chantasirivisal: Triturus cristatus Great Crested Newt. AmphibiaWeb, 2006-04-05. [dostęp 2013-10-14]. (ang.).
- ↑ Aleksander Herczek, Jacek Gorczyca: Płazy i gady Polski. Atlas i klucz. Krzeszowice: Kubajak, 1999, s. 24. ISBN 83-87971-11-1.
- ↑ Stebbins i Cohen 1995 ↓, s. 196.
- ↑ Shaffer, H. Bradley; Austin, C. C.; Huey, R. B. The consequences of metamorphosis on salamander (Ambystoma) locomotor performance. „Physiological Zoology”. 64 (1), s. 212–231, 1991. JSTOR: 30158520.
- ↑ Breckenridge, W. R.; Nathanael, S.; Pereira, L. Some aspects of the biology and development of Ichthyophis glutinosus. „Journal of Zoology”. 211, s. 437–449, 1987.
- ↑ Wake, Marvalee H. Fetal maintenance and its evolutionary significance in the Amphibia: Gymnophiona. „Journal of Herpetology”. 4. 11, s. 379–386, 1977. DOI: 10.2307/1562719. JSTOR: 1562719.
- ↑ Wilkinson, Mark; Kupfer, Alexander; Marques-Porto, Rafael; Jeffkins, Hilary; Antoniazzi, Marta M.; Jared, Carlos. One hundred million years of skin feeding? Extended parental care in a Neotropical caecilian (Amphibia: Gymnophiona). „Biology Letters”. 4 (4), s. 358–361, 2008. DOI: 10.1098/rsbl.2008.0217. PMID: 18547909. PMCID: PMC2610157.
- ↑ Martha L. Crump. Parental care among the Amphibia. „Advances in the Study of Behavior”. 25, s. 109–144, 1996. DOI: 10.1016/S0065-3454(08)60331-9.
- ↑ J.L. Brown, V. Morales, K. Summers. A key ecological trait drove the evolution of biparental care and monogamy in an amphibian. „American Naturalist”. 175 (4), s. 436–446, 2010. DOI: 10.1086/650727. PMID: 20180700.
- ↑ Dorit, Walker i Barnes 1991 ↓, s. 853–854.
- ↑ Fandiño, María Claudia; Lüddecke, Horst; Amézquita, Adolfo. Vocalisation and larval transportation of male Colostethus subpunctatus (Anura: Dendrobatidae). „Amphibia-Reptilia”. 18 (1), s. 39–48, 1997. DOI: 10.1163/156853897X00297.
- ↑ van der Meijden, Arie: Alytes obstetricans. AmphibiaWeb, 2010-01-18. [dostęp 2013-10-14].
- ↑ Semeyn, E: Rheobatrachus silus. [w:] Animal Diversity Web [on-line]. University of Michigan Museum of Zoology, 2002. [dostęp 2013-10-14].
- ↑ Jean-Marc Hero, John Clarke, Ed Meyer, Assa darlingtoni, [w:] The IUCN Red List of Threatened Species [dostęp 2013-10-14] (ang.).
- ↑ IUCN SSC Amphibian Specialist Group, Pipa pipa, [w:] The IUCN Red List of Threatened Species [dostęp 2013-10-14] (ang.).
- ↑ van Wijngaarden, René; Bolaños, Federico. Parental care in Dendrobates granuliferus (Anura: Dendrobatidae), with a description of the tadpole. „Journal of Herpetology”. 26 (1), s. 102–105, 1992. DOI: 10.2307/1565037. JSTOR: 1565037.
- ↑ Młynarski 1966 ↓, s. 6–8.
- ↑ Jean-Marc Hero i inni, Notaden bennettii, [w:] The IUCN Red List of Threatened Species [dostęp 2023-01-10] (ang.).
- ↑ David Cannatella, Dendrobatidae, [w:] Tree of Life Web Project [online], 1995 [dostęp 2013-09-09] (ang.).
- ↑ Hylidae, [w:] AmphibiaWeb: Information on amphibian biology and conservation [online], 2013 [dostęp 2013-09-09] (ang.).
- ↑ Jan Willem Arntzen i inni, Proteus anguinus, [w:] The IUCN Red List of Threatened Species [dostęp 2023-01-10] (ang.).
- ↑ Natchev, Nikolay; Tzankov, Nikolay; Geme, Richard. Green frog invasion in the Black Sea: habitat ecology of the Pelophylax esculentus complex (Anura, Amphibia) population in the region of Shablenska Тuzla lagoon in Bulgaria. „Herpetology Notes”. 4, s. 347–351, 2011.
- ↑ Gabbard, Jesse: Siren intermedia: Lesser Siren. [w:] Animal Diversity Web [on-line]. University of Michigan Museum of Zoology, 2000. [dostęp 2013-10-14].
- ↑ Da Silva, H. R.; De Britto-Pereira, M. C. How much fruit do fruit-eating frogs eat? An investigation on the diet of Xenohyla truncata (Lissamphibia: Anura: Hylidae). „Journal of Zoology”. 270 (4), s. 692–698, 2006. DOI: 10.1111/j.1469-7998.2006.00192.x.
- ↑ Trueb, Linda; Gans, Carl. Feeding specializations of the Mexican burrowing toad, Rhinophrynus dorsalis (Anura: Rhinophrynidae). „Journal of Zoology”. 199 (2), s. 189–208, 1983. DOI: 10.1111/j.1469-7998.1983.tb02090.x.
- ↑ Hamilton, W. J. Jr. The food and feeding behavior of the green frog, Rana clamitans Latreille, in New York State. „Copeia”. 1948 (3), s. 203–207, 1948. American Society of Ichthyologists and Herpetologists. DOI: 10.2307/1438455. JSTOR: 1438455.
- ↑ Wilczynski 1992 ↓, s. 17.
- ↑ Stebbins i Cohen 1995 ↓, s. 56.
- ↑ Stebbins i Cohen 1995 ↓, s. 57–8.
- ↑ Radcliffe, Charles W.; Chiszar, David; Estep, Karen; Murphy, James B.; Smith, Hobart M. Observations on pedal luring and pedal movements in Leptodactylid frogs. „Journal of Herpetology”. 20 (3), s. 300–306, 1986. DOI: 10.2307/1564496. JSTOR: 1564496.
- ↑ Toft, Catherine A. Feeding ecology of Panamanian litter anurans: patterns in diet and foraging mode. „Journal of Herpetology”. 15 (2), s. 139–144, 1981. DOI: 10.2307/1563372. JSTOR: 1563372.
- ↑ Bemis, W. E.; Schwenk, K.; Wake, M. H. Morphology and function of the feeding apparatus in Dermophis mexicanus (Amphibia: Gymnophiona). „Zoological Journal of the Linnean Society”. 77 (1), s. 75–96, 1983. DOI: 10.1111/j.1096-3642.1983.tb01722.x.
- ↑ Stebbins i Cohen 1995 ↓, s. 181–185.
- ↑ a b Stebbins i Cohen 1995 ↓, s. 76–77.
- ↑ Sullivan, Brian K. Sexual selection and calling behavior in the American toad (Bufo americanus). „Copeia”. 1992 (1), s. 1–7, 1992. DOI: 10.2307/1446530. JSTOR: 1446530.
- ↑ Capitulo 4. W: Toledo, L. F.; Haddad, C. F. B.: When frogs scream! A review of anuran defensive vocalizations. Instituto de Biociências, São Paulo, 2007.
- ↑ Johnson, Steve A: The Cuban Treefrog (Osteopilus septentrionalis) in Florida. [w:] EDIS [on-line]. University of Florida, 2010. [dostęp 2013-10-14].
- ↑ a b c Shine, Richard. Sexual selection and sexual dimorphism in the Amphibia. „Copeia”. 1979 (2), s. 297–306, 1979. DOI: 10.2307/1443418. JSTOR: 1443418.
- ↑ a b c Gergits, W. F.; Jaeger, R. G. Site attachment by the red-backed salamander, Plethodon cinereus. „Journal of Herpetology”. 1. 24, s. 91–93, 1990. DOI: 10.2307/1564297. JSTOR: 1564297.
- ↑ Casper, Gary S: Plethodon cinereus. AmphibiaWeb. [dostęp 2013-10-14].
- ↑ Wells, K. D. Territoriality and male mating success in the green frog (Rana clamitans). „Ecology”. 58 (4), s. 750–762, 1977. DOI: 10.2307/1936211. JSTOR: 1936211.
- ↑ a b Barthalmus, G. T.; Zielinski W. J. Xenopus skin mucus induces oral dyskinesias that promote escape from snakes. „Pharmacology, Biochemistry and Behavior”. 30 (4), s. 957–959, 1988. DOI: 10.1016/0091-3057(88)90126-8. PMID: 3227042.
- ↑ Crayon, John J: Xenopus laevis. AmphibiaWeb. [dostęp 2013-10-14].
- ↑ Moodie, G. E. E. Observations on the life history of the caecilian Typhlonectes compressicaudus (Dumeril and Bibron) in the Amazon basin. „Canadian Journal of Zoology”. 56 (4), s. 1005–1008, 1978. DOI: 10.1139/z78-141.
- ↑ a b Hanifin, Charles T.; Yotsu-Yamashita, Mari; Yasumoto, Takeshi; Brodie, Edmund D.; Brodie, Edmund D. Jr. Toxicity of dangerous prey: variation of tetrodotoxin levels within and among populations of the newt Taricha granulosa. „Journal of Chemical Ecology”. 25 (9), s. 2161–2175, 1999. DOI: 10.1023/A:1021049125805.
- ↑ Geffeney, Shana L.; Fujimoto, Esther; Brodie, Edmund D.; Brodie, Edmund D. Jr.; Ruben, Peter C. Evolutionary diversification of TTX-resistant sodium channels in a predator–prey interaction. „Nature”. 434 (7034), s. 759–763, 2005. DOI: 10.1038/nature03444. PMID: 15815629.
- ↑ Brodie, Edmund D. Jr. Investigations on the skin toxin of the adult rough-skinned newt, Taricha granulosa. „Copeia”. 1968 (2), s. 307–313, 1968. DOI: 10.2307/1441757. JSTOR: 1441757.
- ↑ Stebbins i Cohen 1995 ↓, s. 110.
- ↑ Jiri Patocka, Kräuff Wulff, MaríaVictoria Palomeque. Dart Poison Frogs and Their Toxins. „ASA Newsletter”. 5 (75), 1999. ISSN 1057-9419. [dostęp 2013-01-29].
- ↑ Darst, Catherine R.; Cummings, Molly E. Predator learning favours mimicry of a less-toxic model in poison frogs. „Nature”. 440 (7081), s. 208–211, 2006. DOI: 10.1038/nature04297. PMID: 16525472.
- ↑ Brodie, Edmund D. Jr.; Nowak, Robert T.; Harvey, William R. Antipredator secretions and behavior of selected salamanders against shrews. „Copeia”. 1979 (2), s. 270–274, 1979. DOI: 10.2307/1443413. JSTOR: 1443413.
- ↑ Brodie, E. D. Jr. Biting and vocalisation as antipredator mechanisms in terrestrial salamanders. „Copeia”. 1978 (1), s. 127–129, 1978. DOI: 10.2307/1443832. JSTOR: 1443832.
- ↑ Beneski, John T. Jr. Adaptive significance of tail autotomy in the salamander, Ensatina. „Journal of Herpetology”. 3. 23, s. 322–324, 1989. DOI: 10.2307/1564465.
- ↑ Burton, T.M., Likens G.E. 1975. Salamander population and biomass in the Hubbart brock experimental forest, New Hampshire. Copeia, 1975:541-546.
- ↑ Sustainability Issues for Resource Managers. W: Henry A. Regier, Gordon, L. Baskerville: Sustainable redevelopment of regional ecosystems degraded by exploitive development. DIANE Publishing, 1996, s. 36–38. ISBN 978-0-7881-4699-2.
- ↑ Jennings, W. Bryan; Bradford, David F.; Johnson, Dale F. Dependence of the garter snake Thamnophis elegans on amphibians in the Sierra Nevada of California. „Journal of Herpetology”. 26 (4), s. 503–505, 1992. DOI: 10.2307/1565132. JSTOR: 1565132.
- ↑ Stebbins i Cohen 1995 ↓, s. 249.
- ↑ Młynarski 1966 ↓, s. 7.
- ↑ H.L. Van Volkenberg. Biological Control of an Insect Pest by a Toad. „Science”. 82 (2125), s. 278–279, Sep 1935. DOI: 10.1126/science.82.2125.278. PMID: 17792964.
- ↑ T. Shanmuganathan i inni, Biological control of the cane toad in Australia: a review, „Animal Conservation”, 13 (Supplement s1), 2010, s. 16–23, DOI: 10.1111/j.1469-1795.2009.00319.x.
- ↑ Smith K. G., Effects of nonindigenous tadpoles on native tadpoles in Florida: evidence of competition, „Biological Conservation”, 123 (4), 2005, s. 433–441, DOI: 10.1016/j.biocon.2005.01.005.
- ↑ Rhinella marina w GISD: Global Invasive Species Database. [dostęp 2014-04-24].
- ↑ James Hardin Waddle: Use of amphibians as ecosystem indicator species. University of Florida, 2006.
- ↑ Dendrobatidae na AmphibiaWeb. [dostęp 2014-04-24].
- ↑ Richard J. Prince, Steven M. Sine, Epibatidine activates muscle acetylcholine receptors with unique site selectivity, „Biophysical Journal”, 75 (4), 2008, s. 1817–1827, DOI: 10.1016/S0006-3495(98)77623-4, PMCID: PMC1299853.
- ↑ Davis W., Weil A. 1992. „Identity of a New World Psychoactive Toad”. Ancient Mesoamerica 3: 51–9.
- ↑ J.R. Brubacher, P.R. Ravikumar, T. Bania, M.B. Heller i inni. Treatment of toad venom poisoning with digoxin-specific Fab fragments. „Chest”. 110 (5), s. 1282–1288, Nov 1996. DOI: 10.1378/chest.110.5.1282. PMID: 8915235.
- ↑ R.M. Harland, R.M. Grainger. Xenopus research: metamorphosed by genetics and genomics. „Trends Genet”. 27 (12), s. 507–515, Dec 2011. DOI: 10.1016/j.tig.2011.08.003. PMID: 21963197.
- ↑ R.M. Grainger. Xenopus tropicalis as a model organism for genetics and genomics: past, present, and future. „Methods Mol Biol”. 917, s. 3–15, 2012. DOI: 10.1007/978-1-61779-992-1_1. PMID: 22956079.
- ↑ Szymura J., Barton G., The genetic structure of the hybrid zone between the fire-bellied toads, Bombina bombina and B. variegata: comparisons between transects and between loci, „Evolution”, 45, 1991, s. 237–261, JSTOR: 2409660.
- ↑ T.J. DeWitt, A. Sih, D.S. Wilson, Costs and limits of phenotypic plasticity, „Trends Ecol. Evol.”, 13, 1998, s. 77–81, DOI: 10.1016/S0169-5347(97)01274-3.
- ↑ David W. Pfennig, Amber M. Rice, Ryan A. Martin, Ecological opportunity and phenotypic plasticity interact to promote character displacement and species coexistence, „Ecology”, 87, 2006, s. 769–779, DOI: 10.1890/05-0787.
- ↑ M.L. McCallum, Amphibian decline or extinction? Current declines dwarf background extinction rate, „Journal of Herpetology”, 41 (3), 2007, s. 483–491, DOI: 10.1670/0022-1511(2007)41[483:ADOECD]2.0.CO;2.
- ↑ Hoekstra, J. M.; Molnar, J. L.; Jennings, M.; Revenga, C.; Spalding, M. D.; Boucher, T. M.; Robertson, J. C.; Heibel, T. J.; Ellison, K: Number of Globally Threatened Amphibian Species by Freshwater Ecoregion. [w:] The Atlas of Global Conservation: Changes, Challenges, and Opportunities to Make a Difference [on-line]. The Nature Conservancy, 2010. [dostęp 2013-10-14].
- ↑ Amphibian Specialist Group. IUCN SSC Amphibian Specialist Group. [dostęp 2013-10-14].
- ↑ a b c d Amphibian Conservation Action Plan. [w:] IUCN [on-line]. [dostęp 2013-10-14]. [zarchiwizowane z tego adresu (2012-04-27)].
- ↑ Rozporządzenie Ministra Środowiska z dnia 12 października 2011 r. w sprawie ochrony gatunkowej zwierząt Dz.U. z 2011 r. nr 237, poz. 1419.
- ↑ Dyrektywa Rady Europy 92/43/EWG z dn. 21 maja 1992. W sprawie ochrony siedlisk przyrodniczych oraz dzikiej fauny i flory. „Dziennik Urzędowy Unii Europejskiej”. L, 22 lipca 1992.
- ↑ Panama Amphibian Rescue and Conservation Project. Amphibian Ark. [dostęp 2013-10-14]. [zarchiwizowane z tego adresu (2010-06-14)].
- ↑ a b Młynarski 1966 ↓, s. 3.
- ↑ Destinacija Postojna [online] [dostęp 2013-10-14].
- ↑ Jaskinia Postojna [online], TravelManiacy.pl [dostęp 2013-10-16].
- ↑ Młynarski 1966 ↓, s. 40–41.
- ↑ Ugur Kaya i inni, Hyla arborea, [w:] The IUCN Red List of Threatened Species [dostęp 2023-01-10] (ang.).
- ↑ Rzekotka australijska (Litoria caerulea) [online], terrarystyka.pl, 3 lipca 2002 [dostęp 2013-10-14] [zarchiwizowane z adresu 2016-03-05].
- ↑ Zenon Kosidowski: Opowieści biblijne. Warszawa: Iskry, 1968, s. 102.
- ↑ Zenon Kosidowski: Opowieści Biblijne. Warszawa: Iskry, 1968, s. 130.
- ↑ Jan Parandowski: Mitologia. Warszawa: czytelnik, 1979, s. 176. ISBN 83-07-00233-8.
- ↑ Pierre Grimal: Słownik mitologii greckiej i rzymskiej. Wrocław: Zakład Narodowy im. Ossolińskich – Wydawnictwo we Wrocławiu, 2008, s. 354. ISBN 978-83-04-04673-3.
- ↑ Halina Ogarek-Czoj: Mitologia Korei. Wydawnictwa Artystyczne i Filmowe, 1988, s. 81, 108–109, seria: Mitologie świata. ISBN 83-221-0404-9.
- ↑ Susan Wloszczyna: Surprises lurk inside Pan’s Labyrinth. USA Today, 2007-03-14. [dostęp 2013-10-14]. (ang.).
- ↑ Salamandra plamista ''Salamandra salamandra'' [online], Poznaj Tatry [dostęp 2013-10-14].
- ↑ Polskie Towarzystwo Ochrony Przyrody Salamandra [online] [dostęp 2013-10-14].
- ↑ Najdziwniejsze zwierzęta 2008 roku [online], Polski Portal Ekologiczny: ochrona przyrody, ochrona środowiska [dostęp 2013-10-14].
- ↑ Helen Meredith, X-Frogs [online], EDGE Evolutionary Distinct & Globally Endangered, 19 czerwca 2008 [dostęp 2013-10-14] (ang.).
- ↑ Careers in Herpetology. American Society of Ichthyologists and Herpetologists. [dostęp 2013-10-14]. [zarchiwizowane z tego adresu (2013-05-28)].
- ↑ Society for the Study of Amphibians and Reptiles. [dostęp 2013-10-06]. (ang.).
- ↑ SEH – Societas Europaea Herpetologica. [dostęp 2013-10-06]. (ang.).
- ↑ Amphibia-Reptilia. Brill. [dostęp 2013-10-06]. (ang.).
Bibliografia[edytuj | edytuj kod]
- R.L. Dorit, W.F. Walker, R.D. Barnes: Zoology. Saunders College Publishing, 1991. ISBN 978-0-03-030504-7.
- Robert C. Stebbins, Nathan W. Cohen: A Natural History of Amphibians. Princeton University Press, 1995. ISBN 978-0-691-03281-8.
- Robert C. Stebbins, Nathan W. Cohen: A Natural History of Amphibians. Princeton University Press, 1997. ISBN 978-0-691-03281-8.
- Marian Młynarski: Płazy i gady Polski. Warszawa: Państwowe Zakłady Wydawnictw Szkolnych, 1966.
- William E. Duellman: Biology of Amphibians. JHU Press, 1994.
- Dev Raj Khanna, P.R. Yadav: Biology of Amphibia. Discovery Publishing House, 2005. [dostęp 2014-04-28].
- Michał Walski: Badania ultrastrukturalne rozwoju bariery krew-powietrze w płucach kręgowców ze szczególnym uwzględnieniem systemu surfaktantu. Warszawa: Dział Wydawnictw Akademii medycznej w Warszawie, 1986. [dostęp 2014-05-02].
- Kentwood D. Wells: The Ecology and Behavior of Amphibians. University of Chicago Press, 2010. [dostęp 2014-05-03].
- Homer William Smith: The Kidney: Structure and Function in Health and Disease. Oxford University Press, 1951.
- Walter Wilczynski: The Nervous System. W: Martin E. Feder, Warren W. Burggren: Environmental Physiology of the Amphibians. University of Chicago Press, 1992. [dostęp 2014-05-16].
- Sidney Hugh Reynolds: The vertebrate skeleton. CUP Archive, 1897, seria: Cambridge Zoological Series. [dostęp 2014-05-18].
