Bupropion
| |||||||||||||||
| |||||||||||||||
| Ogólne informacje | |||||||||||||||
| Wzór sumaryczny |
C13H18ClNO | ||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
239,74 g/mol | ||||||||||||||
| Wygląd | |||||||||||||||
| Identyfikacja | |||||||||||||||
| Numer CAS |
34911-55-2 (wolna amina) | ||||||||||||||
| PubChem | |||||||||||||||
| DrugBank | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| |||||||||||||||
| Podobne związki | |||||||||||||||
| Podobne związki | |||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||
| Klasyfikacja medyczna | |||||||||||||||
| ATC | |||||||||||||||
| |||||||||||||||
| |||||||||||||||
Bupropion – organiczny związek chemiczny z grupy katynonów[6]. Lek powszechnie stosowany jako atypowy lek przeciwdepresyjny zarówno osobno, jak i w kombinacji do wspomagania leków z grup inhibitorów zwrotnego wychwytu serotoniny, jako jedyny lek przeciw depresji sezonowej, a także do redukcji głodu nikotynowego i objawów ADHD, przy czym, jako nieliczny, nie powoduje przyrostu masy ciała ani dysfunkcji seksualnych.
Bupropion (pierwotna nazwa amfebutamon) należy do grupy selektywnych inhibitorów zwrotnego wychwytu (tj. stymulantów) noradrenaliny i dopaminy (NDRI; ang. norepinephrine-dopamine reuptake inhibitor)[a]. W bardzo małym stopniu hamuje wychwyt zwrotny serotoniny[8][9]. Dominuje nad lekami z grupy SSRI ze względu na bardzo dobrą skuteczność, łagodność działania, minimalne skutki uboczne, i wygaśnięcie patentów czyniące go przystępnym.
Został otrzymany przez Narimana Mehtę, opatentował go zaś Burroughs Wellcome[b] w 1969 roku. Pierwotnie określany jako amfebutamone, nazwę bupropion wprowadzono w 2000 roku[10]. Jego nazwa chemiczna to 3-chloro-N-tert-butylo-β-ketoamfetamina. Ma szkielet katynonu (β-ketoamfetaminy), podstawionego grupą tert-butylową przy atomie azotu i atomem chloru w pozycji meta pierścienia benzenowego.
Mechanizm działania[edytuj | edytuj kod]
Bupropion wpływa na liczne neuroprzekaźniki. Jego działanie farmakologiczne opiera się na blokowaniu (inhibicji) wychwytu zwrotnego noradrenaliny i dużo słabiej dopaminy. Ponadto bupropion jest również antagonistą receptorów nikotynowych.
Z chemicznego punktu widzenia bupropion należy do grupy aminoketonów – strukturą swej cząsteczki przypomina katynon i amfepramon – a także do pochodnych fenyloetyloaminy.
W przeciwieństwie do wielu innych leków zwalczających depresję nie powoduje przyrostu masy ciała ani dysfunkcji seksualnych[c]. Najważniejszym jego efektem ubocznym jest wzrost ryzyka drgawek padaczkowych, przez co lek został swego czasu wycofany z rynku na pewien okres, po czym zredukowano zalecaną dawkę dobową leku. Wykazano, że 300 mg dziennie na przeciętną masę ciała nie zwiększa ryzyka nieprowokowanych drgawek[potrzebny przypis].
Zastosowanie[edytuj | edytuj kod]
W Stanach Zjednoczonych i Kanadzie bupropion należy do najczęściej przepisywanych leków przeciw depresji (zależnej od noradrenaliny), jak również – w niższych dawkach – dla utrzymania abstynencji od nikotyny. Jako selektywny inhibitor zwrotnego wychwytu (tj. stymulant) noradrenaliny i dopaminy, jest stosowany również przeciw ADHD[d] (zależnego od noradrenaliny), jak i – jako jedyny skuteczny – przeciw depresji sezonowej[e]. Wykazuje efektywne samodzielne działanie przeciwdepresyjne, ale stosuje się go także często do wspomagania leków z grup inhibitorów zwrotnego wychwytu serotoniny[f].
Zaburzenia depresyjne[edytuj | edytuj kod]
Bupropion należy do najczęściej przepisywanych leków przeciwdepresyjnych zarówno osobno, jak i w kombinacji do wspomagania niekompletnej odpowiedzi na lek pierwszego rzutu z grup inhibitorów zwrotnego wychwytu serotoniny[f]. Jest efektywny w leczeniu depresji[12], ale tylko tych odmian, które reagują na stymulowanie noradrenaliny/dopaminy[g], jako że bupropion jest selektywnym inhibitorem zwrotnego wychwytu noradrenaliny i (w mniejszym stopniu) dopaminy (NDRI; norepinephrine-dopamine reuptake inhibitor)[a] (analogicznie, jak SSRI – serotoniny). Jako NDRI, jest efektywny tam, gdzie podstawą zaburzeń jest nieodpowiedni poziom noradrenaliny/dopaminy, analogicznie jak SSRI czy TLPD[h] w odniesieniu do serotoniny, w tym escitalopram (ASRI), sertralina (SSRI), wenlafaksyna (SNRI), fluoksetyna (SSRI), paroksetyna (SSRI)[13]. Ponieważ bupropion jest jednym z NDRI, tj. bez serotoninergicznej aktywnosci[g] w przeciwieństwie do leków przeciwdepresyjnych oddziałujących na serotoninę, bupropion nie powoduje dysfunkcji seksualnych[c][14]. Terapia nim nie wiąże się również z sennością ani zwiększaniem się masy ciała, powodowanymi przez inne antydepresanty[15] niestymulujące noradrenaliny.
Większość cierpiących na depresję skarży się także na bezsenność, ale są również pacjenci cierpiący na senność i zmęczenie. W tej podgrupie udowodniono większą skuteczność bupropionu nad selektywnymi inhibitorami zwrotnego wychwytu serotoniny (SSRI) w łagodzeniu tych objawów[16]. Wydaje się, że SSRI mają niewielką przewagę nad bupropionem w leczeniu depresji przebiegającej z niepokojem[17], skoro bupropion stymuluje noradrenalinę wydzielaną zwykle razem z adrenaliną – hormonem strachu, walki i ucieczki.
Jak podają przeglądy, dodanie do SSRI stanowi popularną strategię terapii dla ludzi nie odpowiadających na sam SSRI, choć nie ma takiego oficjalnego wskazania[11]. Dodanie bupropionu może skutkować poprawą u niektórych pacjentów z niecałkowitą odpowiedzią na leki przeciwdepresyjne pierwszego rzutu[11].
W niektórych krajach (Wielka Brytania, Australia, Nowa Zelandia) jest to zastosowanie poza wskazaniami rejestracyjnymi[18][19].
Nikotynizm[edytuj | edytuj kod]
Bupropion stosuje się często także w celu wspomagania rzucania palenia. W tym przypadku ma on redukować głód nikotynowy i objawy odstawienne[20]. Typowa terapia bupropionem trwa od 7 do 12 tygodni, przy czym pacjent zaprzestaje używania tytoniu w czasie około 10 dni. Bupropion mniej więcej podwaja szanse na rzucenie palenia po 3 miesiącach. Po roku od leczenia prawdopodobieństwo niepalenia było w grupie stosującej ten specyfik 1,5 raza wyższe niż w grupie używającej placebo[20].
Istnieją jasne dowody na efektywność bupropionu w redukcji głodu nikotynowego. Nie wyjaśniono, czy jest skuteczniejszy od innych sposobów terapii, jako że odbyła się ograniczona ilość badań. Dostępne informacje wskazują, że lek ma porównywalne działanie z nikotynową terapią zastępczą, działając nieco gorzej od warenikliny[20].
W Australii i Wielkiej Brytanii rzucanie palenia stanowi jedyne zarejestrowane wskazanie stosowania bupropionu[18][19].
Depresja sezonowa[edytuj | edytuj kod]
Amerykańska FDA zaakceptowała stosowanie bupropionu w prewencji depresji sezonowej[21] w 2006, który pozostaje jedynym skutecznym lekarstwem przeciw depresji sezonowej[e].
ADHD[edytuj | edytuj kod]
Bupropion został oficjalnie zatwierdzony od 2004 do leczenia ADHD przez FDA i jest skuteczny w leczeniu odmiany ADHD[d][22] bazującej raczej na niedoborze noradrenaliny niż dopaminy, jako selektywny inhibitor zwrotnego wychwytu (tj. stymulant) noradrenaliny i – w mniejszym stopniu – dopaminy (NDRI; (ang.) norepinephrine-dopamine reuptake inhibitor)[a], zarówno u dzieci, jak i dorosłych[23]. W ocenie nauczycieli agresja i nadaktywność dzieci przyjmujących bupropion uległy znacznemu zmniejszeniu w porównaniu z grupą przyjmującą placebo, natomiast w ocenie rodziców i klinicystów nie było różnicy[23]. Wytyczne leczenia ADHD z 2007 wydane przez American Academy of Child and Adolescent Psychiatry radzą klinicystom rekomendować próbę z terapią behawioralną przed przejściem na leki drugiego rzutu[24]. Podobnie wytyczne Texas Department of State Health Services rekomendują rozważenie bupropionu po wypróbowaniu atomoksetyny[25], która również stymuluje noradrenalinę.
Dysfunkcje seksualne[edytuj | edytuj kod]
Bupropion należy do niewielu leków przeciwdepresyjnych niepowodujących dysfunkcji seksualnych[c][26]. Wachlarz badań pokazuje, że środek ten nie tylko wywołuje mniejsze związane ze sferą seksualną działania uboczne, niż inne antydepresanty, ale też pomaga złagodzić dysfunkcje seksualne[27]. W ocenie psychiatrów jest to lek, który należy wybrać w terapii wywołanych przez SSRI dysfunkcji seksualnych, choć takiego wskazania nie zarejestrowała amerykańska FDA. Przeprowadzono także kilka badań sugerujących poprawę funkcji seksualnych pod wpływem bupropionu u kobiet niechorujących na depresję, cierpiących za to na hipolibidemię[28].
Otyłość[edytuj | edytuj kod]
Bupropion, stosowany w terapii otyłości przez okres od 6 do 12 miesięcy, może skutkować spadkiem masy ciała 2,7 kg większym niż placebo[29]. Wynik ten nie przedstawia większych różnic od uzyskiwanego w razie stosowania kilku innych, zarejestrowanych leków, wśród których wymienia się sibutraminę, orlistat i amfepramon[29].
Przebadano też połączenie z naltreksonem[30]. Wątpliwości wiążą się z tym, że bupropion zwiększa ciśnienie krwi i przyśpiesza akcję serca, dlatego też nie został dopuszczony do użycia w tym celu w Stanach Zjednoczonych[30].
Inne zastosowania[edytuj | edytuj kod]
Zaistniała kontrowersja, czy użyteczne jest dodanie antydepresantu takiego jak bupropion do stabilizatora nastroju u pacjentów cierpiących na ChAD. Jednak obecny pogląd uznaje, że bupropion w takiej sytuacji nie wywołuje znacznej szkody i może czasami przynieść znaczne korzyści[31][32].
Bupropion nie wykazuje efektywności w leczeniu uzależnienia od kokainy. Istnieją słabe dowody na jego możliwą użyteczność w leczeniu uzależnienia od metamfetaminy[33].
Na podstawie badań, wedle których bupropion obniża poziom mediującego stan zapalny TNF-α, czyniono sugestie, że może przydać się w leczeniu nieswoistych chorób zapalnych jelit bądź innych chorób autoimmunologicznych, jednak dostępnych jest bardzo mało danych klinicznych[34].
Bupropion, jak inne antydepresanty z wyjątkiem duloksetyny[35], nie łagodzi skutecznie przewlekłego bólu okolicy lędźwiowej[36]. Jednakże daje pewne nadzieje w leczeniu bólu neuropatycznego[37].
Działania niepożądane[edytuj | edytuj kod]
Działania niepożądane bupropionu[18][19][38][39][40][41]:
- Bardzo częste (>10%)
- bezsenność (przejściowa; można jej zazwyczaj uniknąć poprzez unikanie przyjmowania leku przed snem), ból głowy
- Częste (1–10%)
- gorączka, astenia, zawroty głowy, pobudzenie (wskazuje na reakcję nadwrażliwości), lęk, łysienie, drżenia, zaburzenia koncentracji, depresja, suchość w ustach, nudności, wymioty, zaparcia, ból brzucha, wysypka, świąd, poty, pokrzywka, zaburzenia widzenia, zaburzenia smaku
- Niezbyt częste (0,1–1%)
- ból w klatce piersiowej, zaczerwienienie, tachykardia, podwyższone ciśnienie, splątanie, brak apetytu, szum w uszach
- Rzadkie (0,01–0,1%)
- ortostatyczne spadki ciśnienia, wazodylatacja, omdlenie, hipotensja, kołatanie serca, halucynacje, drażliwość, wrogość, drgawki, depersonalizacja, parkinsonism, dystonia, ataksja, zaburzenia koordynacji ruchów, skurcze mięśniowe, niezwykłe sny, zaburzenia pamięci, parestezje, urojenia, ideacja paranoidalna, agresja, zmęczenie, wahania stężenia glukozy w osoczu, artralgia, mialgia, rumień wielopostaciowy, zespół Stevensa-Johnsona, zatrzymanie moczu, częstomocz, podwyższenie poziomu enzymów wątrobowych, żółtaczka, zapalenie wątroby, złe samopoczucie, obrzęk naczyniowy (wskazuje na reakcję nadwrażliwości), duszność (wskazuje na reakcję nadwrażliwości), skurcz oskrzeli (wskazuje na reakcję nadwrażliwości), wstrząs anafilaktyczny (wskazuje na reakcję nadwrażliwości), stan przypominający chorobę osoczową
Najważniejsze działanie niepożądane bupropionu stanowią drgawki padaczkowe. Ich wysoka częstość występowania odpowiada za czasowe wycofanie leku z rynku pomiędzy 1986 i 1989. Ryzyko drgawek wykazuje silną zależność od dawki, choć zależy też od preparatu. Postaci SR (o długotrwałym uwalnianiu) wiążą się z częstością drgawek 0,1% przy dawce dziennej mniejszej od 300 mg, a 0,4% przy 300–400 mg[42]. Postaci o szybkim uwalnianiu wiążą się z częstością występowania drgawek 0,4% przy dawkowaniu poniżej 450 mg; rośnie ona do 5% przy dawce 450–600 mg na dzień[42]. Dla porównania częstość występowania nieprowokowanych drgawek w populacji leży pomiędzy 0,07 i 0,09%, a ich ryzyko w przypadku innych leków przeciwdepresyjnych ogólnie zawiera się pomiędzy 0 a 0,6% przy rekomendowanych dawkach[43]. Kliniczna depresja sama w sobie zwiększa ryzyko drgawek. Zasugerowano nawet, że małe do umiarkowanych dawki antydepresantów mogą nie zwiększać w ogóle tego ryzyka[44]. Jednak to same badanie wykaząło, że bupropion i klomipramina stanowią wyjątek i wiążą się ze zwiększonym ryzykiem drgawek[44].
Zgodnie z ulotką u niektórych pacjentów obserwowano, niekiedy ciężkie, nadciśnienie, zarówno u tych, u którzy chorowali wcześniej na nadciśnienie, jak i u tych, u których go nie obserwowano. Częstość tego działania niepożądanego wynosi poniżej 1% i nie jest znacznie wyższe, niż w przypadku placebo[45]. Przegląd dostępnych danych wydany w 2008 wskazał, że bupropion jest bezpieczny w użyciu u pacjentów z różnymi schorzeniami serca[46].
W UK ponad 7600 doniesień o podejrzewanych efektach ubocznych zebranych zostało w pierwszych dwóch latach po wprowadzeniu bupropionu za zgodą Medicines and Healthcare Products Regulatory Agency jako część Yellow Card Scheme, monitorującego efekty uboczne. Szacunkowo 540 tys. osób leczyło się w tym czasie bupropionem, odstawiając palenie. MHRA otrzymała 60 doniesień o „podejrzeniu (podkreślenie MHRA) reakcji ubocznych na Zyban, które miały zejście śmiertelne”. Organizacja doszła do wniosku, że w większości przypadków stan pacjenta można wyjaśnić w alternatywny sposób[47]. Pozostaje to w zgodzie z wynikami dużego, obejmującego 9300 osób badania bezpieczeństwa, które wykazało, że umieralność palaczy przyjmujących bupropion nie przewyższa naturalnej umieralności palaczy w tym samym wieku[48].
Psychiatryczne[edytuj | edytuj kod]
Myśli i zachowania samobójcze są rzadkie w badaniach klinicznych, jednakże FDA wymaga, by każdy lek przeciwdepresyjny (a więc i bupropion) miał zamieszczone na opakowaniu ostrzeżenie, że antydepresanty mogą zwiększać ryzyko samobójstwa u osób młodszych, niż 25 lat. Ostrzeżenie to opiera się o analizy statystyczne przeprowadzone przez FDA, które znalazły dwukrotny wzrost występowania myśli i zachowań samobójczych u dzieci i młodzieży, natomiast półtorakrotny w grupie wiekowej 18–24 lata[49]. W tej metaanalizie FDA objęła wyniki 295 badań klinicznych 11 antydepresantów, aby uzyskać wyniki istotne statystycznie. Rozważany sam jeden, bupropion nie wykazywał istotnej statystycznie różnicy od placebo[49].
Zachowania samobójcze stanowią mniejsze zagrożenie, jeśli bupropion stosuje się w związku z rzucaniem palenia. Zgodnie z przeglądem Cochrane Database z 2007 dotyczącym stosowania bupropionu z uwagi na rzucanie palenia w Wielkiej Brytanii na milion przepisanych kuracji przypadają 4 samobójstwa, natomiast myśli samobójcze raz na 10000. Przegląd podaje wniosek, że choć odnotowano samobójstwa i zgony podczas terapii bupropionem, brakuje wystarczających dowodów, by sugerować, że to bupropion je spowodował[50]. Z powodu braku wystarczających danych, w 2020 r. nadal nie udało się stwierdzić, czy istnieje związek stosowania bupropionu z próbami samobójczymi[51].
W 2009 FDA wydało ostrzeżenie, że przepisywanie bupropionu z powodu rzucania palenia wiąże się z niezwykłymi zmianami zachowania, pobudzeniem i wrogością. Niektórzy pacjenci, zgodnie z poglądem FDA, wpadli w depresję lub się ona u nich pogorszyła, miewali myśli samobójcze lub o umieraniu, a nawet popełnili próbę samobójczą[52]. Informacja ta bazowała na przeglądzie produktów antytytoniowych, który znalazł 75 „samobójczych skutków ubocznych” stosowania bupropionu na przestrzeni 10 lat[53].
Psychoza wywołana bupropionem może rozwinąć się w wybranych populacjach pacjentów lub pogorszyć się, jeśli już uprzednio występował zespół psychotyczny[54]. Objawy obejmują urojenia, omamy, zespół paranoiczny i splątanie. W większości przypadków objawy te można złagodzić poprzez redukcję dawki, odstawienie leczenia bądź dołączenie leku przeciwpsychotycznego[45][54][55]. Jednak dołączenie do leczenia psychozy benzodiazepiny zamiast leku przeciwpsychotycznego może stać się uznaną alternatywą zgodnie z modelem psychozy indukowanej amfetaminą[56]. Objawy psychotyczne wiążą się z takimi czynnikami, jak wyższe dawki bupropionu, zaburzenia psychotyczne bądź choroba afektywna dwubiegunowa w wywiadzie, równoległe stosowanie innych leków, np. litu bądź benzodiazepin, starszy wiek, uzależnienie od substancji uzależniającej[54][57].
Zgodnie z kilkoma opisami przypadków nagłe odstawienie bupropionu może skutkować zespołem odstawienia. Wyraża się on dystonią, drażliwością, lękiem, manią, bólem głowy i innymi bólami[58]. Informacja zamieszczona na ulotce rekomenduje zmniejszanie dawki po terapii bupropionem depresji sezonowej[45]; nie uważa jej jednak za konieczną, jeśli lek używano w celu zaprzestania palenia[59].
Przeciwwskazania[edytuj | edytuj kod]
GlaxoSmithKline radzi nie stosować bupropionu chorym na padaczkę bądź cierpiącym na inne stany związane z obniżeniem progu drgawkowego, jak anoreksja, bulimia, aktywny guz mózgu, picie alkoholu, używanie benzodiazepin lub odstawianie tych substancji. Bupropionu należy również unikać, gdy przyjmuje się inhibitory monoaminooksydazy. Ważne jest, by odczekać 2 tygodnie pomiędzy zakończeniem terapii MAOI a rozpoczęciem podaży bupropionu[45]. Ulotka zatwierdzona przez FDA rekomenduje ostrożność w terapii pacjentów z uszkodzeniami wątroby, ciężką chorobą nerek, ciężkim nadciśnieniem, jak też u pacjentów pediatrycznych, młodzieży i młodych dorosłych z powodu zwiększonego ryzyka myśli samobójczych[45].
Interakcje[edytuj | edytuj kod]
Bupropion ulega hydroksylacji do hydroksybupropionu przez izoenzym CYP2B6, w związku z czym mogą zajść interakcje z innymi lekami metabolizowanymi przez ten sam izoenzym. Wymienia się wśród nich paroksetynę, sertralinę, fluoksetynę, diazepam, klopidogrel i orfenadrynę. Przewidywanym wynikiem jest zwiększenie stężenia bupropionu, zmniejszenie zaś hydroksybupropionu. Efekt odwrotny (spadek poziomu bupropionu ze zwiększeniem hydroksybupropionu) oczekiwany byłby po przyjęciu induktorów CYP2B6, jak karbamazepina, klotrimazol, ryfampicyna, rytanawir, ziele dziurawca, fenobarbital, fenytoina i inne[60]. Odwrotnie, ponieważ bupropion sam ma właściwości inhibitora CYP2D6 (Ki=21 μM)[38][61], podobnie jak jego aktywny metabolit hydroksybupropion (Ki=13,3 μM), może spowalniać usuwanie innych leków metabolizowanych przez ten enzym[38][39][40][41][60].
Bupropion obniża próg drgawkowy, w związku z czym może potencjalnie oddziaływać z innymi lekami wywołującymi ten efekt, jak teofilina, steroidy i niektóre trójpierścieniowe leki przeciwdepresyjne[45]. Informacja na ulotce rekomenduje ograniczenie spożycia alkoholu, ponieważ w rzadkich przypadkach bupropion zmniejsza tolerancję alkoholu oraz ponieważ nadmierne spożycie alkoholu może obniżać próg drgawkowy[45].
Przedawkowanie[edytuj | edytuj kod]
Bupropion uznaje się za umiarkowanie niebezpieczny przy przedawkowaniu[62][63].
W większości połknięcia przez dzieci w celach poznawczych obejmują jedną albo dwie tabletki. Dzieci takie nie wykazują żadnych zauważalnych objawów[64]. Drgawki częściej obserwuje się u nastolatków bądź dorosłych, ich częstość wzrasta dziesięciokrotnie przy dawkach dobowych 600 mg[65].
Przedawkowanie bupropionu rzadko skutkuje zgonem, ale odnotowano już i takie przypadki. Obawy obejmują omamy i urojenia, wymioty, zachowania agresywne oraz drgawki[66].
Farmakologia[edytuj | edytuj kod]

Jako że bupropion w organizmie szybko ulega przekształceniu do kilku metabolitów o różnej aktywności, jego działania nie można wyjaśnić bez odwołania się do jego metabolizmu. Odsetek miejsc wiążących transporterów dopaminy (DAT) zajmowanych przez bupropion i jego metabolity w mózgu ludzkim oceniono z użyciem pozytonowej tomografii emisyjnej na w niezależnym badaniu na 6–22%[67], natomiast na 12–35% w badaniach GlaxoSmithKline[68]. Opierając się na analogiach z SSRI, dopiero zajęcie ponad 50% DAT byłoby konieczne, aby wpływ na wychwyt zwrotny dopaminy można uznać za główny mechanizm działania leku. Dla porównania, zajęcie około 65% lub więcej miejsc wiążących DAT wywołałoby euforię i niosło ze sobą ryzyko uzależnienia[69]. Jednak obecne badania wskazują, że dopamina jest inaktywowana przez wychwyt zwrotny noradrenaliny w korze czołowej, co może stanowić wyjaśnienie dodatkowych dopaminergicznych efektów leku[70].
Wykazano również działanie bupropionu jako niekompetycyjnego antagonisty receptorów nikotynowych[71].
Poza układem nerwowym sam lek i jego główny metabolit hydrobupropion działają w wątrobie jako silny inhibitor enzymu CYP2D6, metabolizującego też sam bupropion, ale oprócz niego jeszcze wiele innych leków i innych substancji aktywnych biologicznie[61].
Farmakokinetyka[edytuj | edytuj kod]

Bupropion jest przekształcany w wątrobie przez izoenzym cytochromu P450 CYP2B6[42]. Posiada kilka aktywnych metabolitów: R,R-hydroksybupropion, S,S-hydroksybupropion, treo-hydrobupropion i erytro-hydrobupropion, które są w dalszej kolejności metabolizowane do związków nieaktywnych, a w końcu usuwane z ustroju z moczem. Farmakologię bupropionu i jego metabolitów obrazuje poniższa tabela. Bupropion znany jest ze słabego hamowania receptorów α1-adrenergicznych. Oddziałuje z nimi jednakże tylko w 14% tak silnie, jak w przypadku hamowania resorpcji dopaminy. Hamuje też receptory histaminowe H1, osiągając tym razem 9%[72].
| Ekspozycja (stężenie po czasie; przyjęto ekspozycję na bupropion = 100%) i okres półtrwania | |||||
| Bupropion | R,R- Hydroksy bupropion |
S,S- Hydroksy bupropion |
treo- hydro bupropion |
erytro- hydro bupropion | |
|---|---|---|---|---|---|
| Ekspozycja | 100% | 800% | 160% | 310% | 90% |
| Czas półtrwania | 10 h (IR) 17 h (SR) |
21 h | 25 h | 26 h | 26 h |
| Siła hamowania (przyjęto siłę hamowania bupropionu = 100%) | |||||
| wychwyt DA | 100% | brak danych | brak danych | brak danych | brak danych |
| wychwyt noradrenaliny | 27% | brak danych | brak danych | brak danych | brak danych |
| wychwyt serotoniny | 2% | brak danych | brak danych | brak danych | brak danych |
| receptory α3β4 nikotyowe | 53% | 15% | 10% | brak danych | brak danych |
| receptory α4β2 nikotynowe | 8% | 3% | 29% | brak danych | brak danych |
| receptory α1* nikotynowe | 12% | 13% | 13% | brak danych | brak danych |
Biologiczna aktywność bupropionu zależy w znacznym stopniu od jego aktywnych metabolitów, zwłaszcza zaś S,S-hydroksybupropionu. GlaxoSmithKline wprowadziło ten związek jako odrębny lek pod nazwą radafaksyna[77], ale zaniechało tego w 2006 z powodu niesprzyjającego stosunku ryzyka do korzyści[78].
Bupropion jest przekształcany w hydroksybupropion przez CYP2B6, izoenzym cytochromu P450. Alkohol powoduje wzrost aktywności CYP2B6 w wątrobie. Osoby z uzależnieniem od alkoholu w wywiadzie szybciej metabolizują bupropion. Lek jest metabolizowany do treo-hydrobupropionu przez dehydrogenazę 11β-hydroksysteroidową typu 1[79]. Szlak odpowiedzialny za powstawanie erytro-hydrobupropionu nie został rozpoznany.
Metabolizm bupropionu jest bardzo różny. Dawki efektywne otrzymywane przez osoby przyjmujące tą samą ilość leku mogą różnić się od siebie aż 5,5 raza, a czas połowicznego rozpadu wynosi od 3 do 16 godzin, podczas gdy w przypadku hydroksybupropionu aż 7,5 raza z czasem półtrwania od 12 do 38 godzin[80]. W oparciu o te dane niektórzy badacze doradzają monitorowanie poziomu bupropionu i hydroksybupropionu we krwi[81].
Występują znaczne międzygatunkowe różnice w metabolizmie bupropionu. U człowieka przypomina on bardziej obserwowany u świnki morskiej, niż u myszowatych[82]. W rzeczywistości hydroksybupropion, główny metabolit leku u człowieka, w ogóle nie występuje u szczurów[83].
Odnotowano przypadki fałszywie dodatnich testów na obecność amfetaminy w moczu u osób przyjmujących bupropion. Bardziej specyficzne badania potwierdzające wypadały negatywnie[84][85].
Synteza[edytuj | edytuj kod]
Bupropion należy do pochodnych katynonu. Można go otrzymać w dwóch etapach z m-chloropropiofenonu. Proces rozpoczyna bromowanie substratu, zachodzące w pozycji α względem grupy karbonylowej. Reakcję prowadzi się w chlorku metylenu w temp. 0 °C. Powstały α-bromoketon bez oczyszczania poddaje się substytucji nukleofilowej tert-butyloaminą. Optymalnym rozpuszczalnikiem do tego etapu jest N-metylopirolidon, w którym reakcja kończy się w ciągu 10 min (w porównaniu z wieloma godzinami, gdy jako rozpuszczalnik używa się DMF). Dzięki temu unika się degradacji produktu, który jest nietrwały w postaci wolnej aminy. Po przerobie surowy związek uzyskuje się jako roztwór w eterze, który traktuje się stężonym kwasem solnym, w wyniku czego następuje wydzielenie się chlorowodorku bupropionu w postaci białych kryształów. Wydajność całej procedury wynosi ok. 80%, a czas jej trwania w skali laboratoryjnej to ok. 2 h[86][3]:
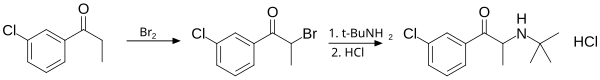
Synteza bupropionu: w pierwszym etapie bromowanie ketonu (3'-chloropropiofenonu) w pozycji α, następnie substytucja nukleofilowa tert-butyloaminą (t-BuNH2) i przekształcenie produktu w chlorowodorek kwasem solnym
W alternatywnej metodzie syntezy substratem jest związek typu acyloiny (α-hydroksyketonu), 1-(m-chlorofenylo)-1-hydroksypropan-2-on, który redukuje się do odpowiedniego diolu i utlenia regioselektywnie za pomocą kwasu jodoksybenzoesowego (IBX) do izomerycznej acyloiny, 1-(m-chlorofenylo)-2-hydroksypropan-1-onu. Następnie grupę hydroksylową aktywuje się za pomocą bezwodnika triflatowego, Tf2O, i wymienia na grupę tert-butyloaminową. Cały proces trwa ok. 45 h, a jego wydajność wynosi ok. 60%[4].
Historia[edytuj | edytuj kod]

Bupropion wynaleziony został przez Narimana Mehtę z Burroughs Wellcome (obecnie GlaxoSmithKline) w 1969, w Stanach Zjednoczonych opatentowano go w 1974[86]. Został zaakceptowany przez amerykańską Agencję Żywności i Leków (FDA) jako lek przeciwdepresyjny 30 grudnia 1985. Wprowadzono go na rynek pod nazwą Wellbutrin[87]. Jednak znaczna częstość występowania napadów drgawkowych po pierwotnie rekomendowanej dawce spowodowała wycofanie leku w 1986. Następnie odkryto, że ryzyko drgawek wykazuje wysoką zależność od dawki i bupropion wrócił na rynek w 1989 z mniejszą maksymalną dawką dzienną[88].
w 1996 FDA zaakceptowała formę o opóźnionym uwalnianiu, o nazwie Wellbutrin SR, przyjmowaną dwukrotnie w ciągu dnia (w porównaniu z dawkowanym trzykrotnie z dzień wcześniejszym preparatem Wellbutrin)[89]. W 2003 FDA zaaprobowała inną postać o opóźnionym uwalnianiu, zwaną Wellbutrin XL, którą wystarczyło przyjmować raz dziennie. Formy SR i XL dostępne są też w postaci generyków w Stanach Zjednoczonych i Kanadzie. W tej ostatniej generyk XR bupropion rozpowszechnia firma Mylan. W 1997 bupropion uzyskał akceptację FDA dla stosowania w rzucaniu palenia pod nazwą Zyban[89]. W 2006 Wellbutrin XL dostał zgodę na stosowanie w depresji sezonowej[90].
W kwietniu 2008 FDA zaakceptowała bromowodorek bupropionu zamiast chlorowodorku, sprzedawany pod nazwą Aplenzin przez Sanofi-Aventis[91].
11 października 2007 dwóch dostawców informacji konsumenckiej dotyczącej produktów odżywczych i suplementów, ConsumerLab.com i The People’s Pharmacy, ujawniło wyniki badań porównawczych różnych preparatów bupropionu[92]. The People’s Pharmacy otrzymała liczne doniesienia o zwiększonej częstości występowania działań niepożądanych i zmniejszonej skuteczności generyku, w związku z czym poprosiła ConsumerLab.com o przetestowanie rzeczonego produktu. Badanie wykazało, że jedna z postaci generycznych leku Wellbutrin XL w dawce 300 mg, sprzedawana pod nazwą Budeprion XL 300 mg, nie działa identycznie, jak markowa tabletka w laboratorium[93]. FDA zainteresowała się ty zgłoszeniem i doszła do wniosku, że Budeprion XL jest równoważny Wellbutrinowi XL w zakresie biodostępności bupropionu oraz jej głównego metabolitu hydroksybupropionu. Stwierdziła też, że najprawdopodobniejszym wyjaśnieniem zauważalnego pogorszenia się depresji po przejściu z Wellbutrinu XL na Budeprion XL są współwystępujące naturalne zmiany nastroju[94]. 3 października 2012 FDA zmieniła zdanie, ogłaszając, że Budeprion XL w dawce 300 mg nie wykazuje równoważności terapeutycznej z preparatem Wellbutrin XL w dawce 300 mg[95]. FDA nie zbadała biorównoważności żadnego innego generyku Wellbutrinu XL w dawce 300 mg, zażądała jednak od czterech wytwórców przesłania danych na ten temat do marca 2013[95]. W październiku 2013 FDA upewniła się, że wyroby pewnych wytwórców nie spełniają wymogu biorównoważności[96].
W 2012 GlaxoSmithKline przyznało się do winy i zgodziło się zapłacić 3 miliardy dolarów kary, po części za promowanie niezaaprobowanego użycia Wellbutrinu w celu redukcji masy ciała oraz na dysfunkcje seksualne[97][98].
We Francji Zyban wpuszczono na rynek 3 sierpnia 2001 z maksymalną dawką dzienną 300 mg[99]. Dostępny jest tam tylko bupropion SR, i to tylko w przypadku rzucania palenia. Bupropion uzyskał pozwolenie na użycie u dorosłych z dużą depresją w Holandii na początku 2007. GlaxoSmithKline spodziewa się kolejnych pozwoleń w innych europejskich krajach[100].
Użycie niemedyczne[edytuj | edytuj kod]
Zgodnie z klasyfikacją leków psychiatrycznych amerykańskiego rządu bupropion nie uzależnia[101]. W badaniach na zwierzętach sajmiri i szczury dały się nakłonić do samodzielnego podawania sobie bupropionu, co często uznaje się za objaw potencjału uzależniającego. Istnieją jednak znaczne różnice międzygatunkowe w metabolizmie bupropionu[61]. Istnieje wiele doniesień anegdotycznych oraz opisów przypadków uzależnienia od bupropionu, jednak ogrom dowodów pokazuje, że efekty subiektywne przyjmowania bupropionu znacznie się różnią od efektów przyjmowania uzależniających stymulantów kokainy lub amfetaminy[102].
Uwagi[edytuj | edytuj kod]
- ↑ a b c (ang.) Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor[7].
- ↑ Później włączony do GlaxoSmithKline.
- ↑ a b c ang. common antidepressant-associated side effects, such as sexual dysfunction, weight gain, and sedation, are not associated with bupropion therapy[7].
- ↑ a b ang. Bupropion has also demonstrated efficacy in the treatment of attention-deficit/hyperactivity disorder (ADHD)[7].
- ↑ a b ang. Bupropion... is the only antidepressant to have demonstrated efficacy in reducing the risk of seasonal depressive relapse when taken prophylactically for seasonal affective disorder (SAD)[7].
- ↑ a b ang. Use of bupropion in combination with serotonin reuptake inhibitors[11].
- ↑ a b ang. because bupropion is a selective norepinephrine and dopamine reuptake inhibitor with no serotonergic activity[7].
- ↑ ang. the efficacy of bupropion is comparable to that of other antidepressants, including the SSRIs and TCAs[7].
Przypisy[edytuj | edytuj kod]
- ↑ Chlorowodorek bupropionu, [w:] Encyklopedia leków i suplementów – lekopedia [online], www.doz.pl [dostęp 2016-12-02].
- ↑ Bupropion, [w:] PubChem, United States National Library of Medicine, CID: 444 (ang.).
- ↑ a b Daniel M. Perrine i inni, A Short, One-Pot Synthesis of Bupropion (Zyban, Wellbutrin), „Journal of Chemical Education”, 77 (11), 2000, s. 1479, DOI: 10.1021/ed077p1479 [dostęp 2022-10-24] (ang.).
- ↑ a b Giovanni W. Amarante, Mayra Cavallaro, Fernando Coelho, Hyphenating the curtius rearrangement with Morita-Baylis-Hillman adducts: synthesis of biologically active acyloins and vicinal aminoalcohols, „Journal of the Brazilian Chemical Society”, 22 (8), 2011, s. 1568–1584, DOI: 10.1590/S0103-50532011000800022 [dostęp 2022-10-24] (ang.).
- ↑ Bupropion, chlorowodorek, karta charakterystyki produktu Sigma-Aldrich, Merck, 22 września 2019, numer katalogowy: B102 [dostęp 2022-06-16]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Charles W. Schindler i inni, Comparison of the effects of methamphetamine, bupropion and methylphenidate on the self-administration of methamphetamine by rhesus monkeys, „Experimental and Clinical Psychopharmacology”, 19 (1), 2011, s. 1–10, DOI: 10.1037/a0022432, PMID: 21341918, PMCID: PMC3392967.
- ↑ a b c d e f Stahl i in. 2004 ↓.
- ↑ Wellbutrin XR tabletki powlekane o zmodyfikowanym uwalnianiu [online], Medycyna Praktyczna [dostęp 2022-07-15].
- ↑ Rozdział 3.3.3. → Bupropion, [w:] Grażyna Rajtar-Cynke, Farmakologia, wyd. 3, Warszawa: Wydawnictwo Lekarskie PZWL, 2015, ISBN 978-83-200-4869-8, OCLC 903361942.
- ↑ World Health Organization, International Nonproprietary Names for Pharmaceutical Substances (INN). Proposed INN: List 83, „WHO Drug Information”, 2, 14, 2000 [dostęp 2016-12-01] [zarchiwizowane 2009-03-18].
- ↑ a b c Zisook i in. 2006 ↓.
- ↑ R. Moreira, The efficacy and tolerability of bupropion in the treatment of major depressive disorder, „Clin Drug Investig”, 31, 2011, s. 5–17, DOI: 10.2165/1159616-S0-000000000-00000, PMID: 22015858 (ang.).
- ↑ Andrea Cipriani i inni, Comparative efficacy and acceptability of 12 new-generation antidepressants: a multiple-treatments meta-analysis, „The Lancet”, 373 (9665), 2009, s. 746–758, DOI: 10.1016/S0140-6736(09)60046-5, PMID: 19185342 [dostęp 2022-10-24] (ang.).
- ↑ Agnes Higgins, Antidepressant-associated sexual dysfunction: impact, effects, and treatment, „Drug, Healthcare and Patient Safety”, 2010, s. 141, DOI: 10.2147/DHPS.S7634, PMID: 21701626, PMCID: PMC3108697 [dostęp 2022-10-24] (ang.).
- ↑ Sohita Dhillon, Lily P.H. Yang, Monique P. Curran, Bupropion: a review of its use in the management of major depressive disorder, „Drugs”, 68 (5), 2008, s. 653–689, DOI: 10.2165/00003495-200868050-00011, PMID: 18370448 [dostęp 2022-10-24] (ang.).
- ↑ David S. Baldwin, George I. Papakostas, Symptoms of fatigue and sleepiness in major depressive disorder, „The Journal of Clinical Psychiatry”, 67 (suppl. 6), 2006, s. 9–15, PMID: 16848671 [dostęp 2022-10-24] (ang.).
- ↑ George I. Papakostas i inni, Efficacy of bupropion and the selective serotonin reuptake inhibitors in the treatment of major depressive disorder with high levels of anxiety (anxious depression): a pooled analysis of 10 studies, „The Journal of Clinical Psychiatry”, 69 (8), 2008, s. 1287–1292, DOI: 10.4088/jcp.v69n0812, PMID: 18605812 [dostęp 2022-10-24] (ang.).
- ↑ a b c Rossi, S: Australian Medicines Handbook. Wyd. 2013. Adelaide: The Australian Medicines Handbook Unit Trust, 2013. ISBN 978-0-9805790-9-3.
- ↑ a b c Joint Formulary Committee: British National Formulary (BNF). Wyd. 65. London, UK: Pharmaceutical Press, 2013. ISBN 978-0-85711-084-8.
- ↑ a b c Ping Wu i inni, Effectiveness of smoking cessation therapies: a systematic review and meta-analysis, „BMC Public Health”, 6 (1), 2006, s. 300, DOI: 10.1186/1471-2458-6-300, PMID: 17156479, PMCID: PMC1764891 [dostęp 2022-10-24] (ang.).
- ↑ First drug for seasonal depression, „FDA consumer”, 40 (5), 2006, s. 7, PMID: 17328102 [dostęp 2022-10-24] (ang.).
- ↑ Rachel Kornfield i inni, Effects of FDA Advisories on the Pharmacologic Treatment of ADHD, 2004–2008, „Psychiatric Services”, 64 (4), 2013, s. 339–346, DOI: 10.1176/appi.ps.201200147, PMID: 23318985, PMCID: PMC4023684 [dostęp 2022-10-24] (ang.).
- ↑ a b D.P. Cantwell, ADHD through the life span: the role of bupropion in treatment, „The Journal of Clinical Psychiatry”, 59 (suppl. 4), 1998, s. 92–94, PMID: 9554326 [dostęp 2022-10-24] (ang.).
- ↑ Steven Pliszka, AACAP Work Group on Quality Issues, Practice parameter for the assessment and treatment of children and adolescents with attention-deficit/hyperactivity disorder, „Journal of the American Academy of Child and Adolescent Psychiatry”, 46 (7), 2007, s. 894–921, DOI: 10.1097/chi.0b013e318054e724, PMID: 17581453 [dostęp 2022-10-24] (ang.).
- ↑ Steven R. Pliszka i inni, The Texas Children's Medication Algorithm Project: revision of the algorithm for pharmacotherapy of attention-deficit/hyperactivity disorder, „Journal of the American Academy of Child and Adolescent Psychiatry”, 45 (6), 2006, s. 642–657, DOI: 10.1097/01.chi.0000215326.51175.eb, PMID: 16721314 [dostęp 2022-10-24] (ang.).
- ↑ Alessandro Serretti, Alberto Chiesa, Treatment-emergent sexual dysfunction related to antidepressants: a meta-analysis, „Journal of Clinical Psychopharmacology”, 29 (3), 2009, s. 259–266, DOI: 10.1097/JCP.0b013e3181a5233f, PMID: 19440080 [dostęp 2022-10-24] (ang.).
- ↑ Stephen M. Stahl i inni, A Review of the Neuropharmacology of Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor, „The Primary Care Companion to The Journal of Clinical Psychiatry”, 06 (04), 2004, s. 159–166, DOI: 10.4088/PCC.v06n0403, PMID: 15361919, PMCID: PMC514842 [dostęp 2022-10-24].
- ↑ Kevin F. Foley, Kevin P. DeSanty, Richard E. Kast, Bupropion: pharmacology and therapeutic applications, „Expert Review of Neurotherapeutics”, 6 (9), 2006, s. 1249–1265, DOI: 10.1586/14737175.6.9.1249, PMID: 17009913 [dostęp 2022-10-24] (ang.).
- ↑ a b Zhaoping Li i inni, Meta-analysis: pharmacologic treatment of obesity, „Annals of Internal Medicine”, 142 (7), 2005, s. 532–546, DOI: 10.7326/0003-4819-142-7-200504050-00012, PMID: 15809465 [dostęp 2022-10-24] (ang.).
- ↑ a b Donna H. Ryan, George A. Bray, Pharmacologic treatment options for obesity: what is old is new again, „Current Hypertension Reports”, 15 (3), 2013, s. 182–189, DOI: 10.1007/s11906-013-0343-6, PMID: 23625271 [dostęp 2022-10-24] (ang.).
- ↑ Harm J. Gijsman i inni, Antidepressants for bipolar depression: a systematic review of randomized, controlled trials, „The American Journal of Psychiatry”, 161 (9), 2004, s. 1537–1547, DOI: 10.1176/appi.ajp.161.9.1537, PMID: 15337640 [dostęp 2022-10-24] (ang.).
- ↑ Lakshmi N. Yatham i inni, Canadian Network for Mood and Anxiety Treatments (CANMAT) guidelines for the management of patients with bipolar disorder: update 2007, „Bipolar Disorders”, 8 (6), 2006, s. 721–739, DOI: 10.1111/j.1399-5618.2006.00432.x, PMID: 17156158 [dostęp 2022-10-24] (ang.).
- ↑ Kyle Kampman, The Search for Medications to Treat Stimulant Dependence, „Addiction Science & Clinical Practice”, 4 (2), 2008, s. 28–35, DOI: 10.1151/ascp084228, PMID: 18497715, PMCID: PMC2797110 [dostęp 2022-10-24] (ang.).
- ↑ Antonina A Mikocka-Walus i inni, Antidepressants and inflammatory bowel disease: a systematic review, „Clinical Practice and Epidemiology in Mental Health”, 2 (1), 2006, s. 24, DOI: 10.1186/1745-0179-2-24 [dostęp 2022-10-24] (ang.).
- ↑ FDA clears Cymbalta to treat chronic musculoskeletal pain. [w:] FDA Press Announcements [on-line]. Food and Drug Administration, 2010-11-04. [dostęp 2013-08-19]. Cytat: The U.S. Food and Drug Administration ... approved Cymbalta (duloxetine hydrochloride) to treat chronic musculoskeletal pain, including discomfort from osteoarthritis and chronic lower back pain.
- ↑ D.M. Urquhart i inni, Antidepressants for non-specific low back pain, „Cochrane Database of Systematic Reviews” (1), 2008, CD001703, DOI: 10.1002/14651858.CD001703.pub3, PMID: 18253994, PMCID: PMC7025781 [dostęp 2022-10-24] (ang.).
- ↑ Tanmay H. Shah, Abdolali Moradimehr, Bupropion for the treatment of neuropathic pain, „The American Journal of Hospice & Palliative Care”, 27 (5), 2010, s. 333–336, DOI: 10.1177/1049909110361229, PMID: 20185402 [dostęp 2022-10-24] (ang.).
- ↑ a b c Zyban 150 mg prolonged release film-coated tablets – Summary of Product Characteristics (SPC). [w:] electronic Medicines Compendium [on-line]. GlaxoSmithKline UK, 2013-08-01. [dostęp 2013-10-22].
- ↑ a b Prexaton Bupropion hydrochloride. Product information. [w:] TGA eBusiness Services [on-line]. Ascent Pharma Pty Ltd, 2 października 2012. [dostęp 2013-10-22].
- ↑ a b Bupropion hydrochloride tablet, film coated [Sandoz Inc]. [w:] DailyMed [on-line]. Sandoz, Inc, kwiecień 2013. [dostęp 2013-10-22].
- ↑ a b Product information. Zyban® sustained release tablets. [w:] TGA eBusiness Services [on-line]. Aspen Pharmacare Australia Pty Ltd, 2013-04-19. [dostęp 2013-10-22].
- ↑ a b c Hales E, Yudofsky JA: The American Psychiatric Press Textbook of Psychiatry. Washington, DC: American Psychiatric Publishing, Inc., 2003.
- ↑ Francesco Pisani i inni, Effects of psychotropic drugs on seizure threshold, „Drug Safety”, 25 (2), 2002, s. 91–110, DOI: 10.2165/00002018-200225020-00004, PMID: 11888352 (ang.).
- ↑ a b Kenneth Alper i inni, Seizure incidence in psychopharmacological clinical trials: an analysis of Food and Drug Administration (FDA) summary basis of approval reports, „Biological Psychiatry”, 62 (4), 2007, s. 345–354, DOI: 10.1016/j.biopsych.2006.09.023, PMID: 17223086 (ang.).
- ↑ a b c d e f g Wellbutrin XL Prescribing Information. GlaxoSmithKline, 2008. [dostęp 2010-01-16]. [zarchiwizowane z tego adresu (2012-06-21)].
- ↑ D. Taylor, Antidepressant drugs and cardiovascular pathology: a clinical overview of effectiveness and safety, „Acta Psychiatrica Scandinavica”, 118 (6), 2008, s. 434–442, DOI: 10.1111/j.1600-0447.2008.01260.x, PMID: 18785947 (ang.).
- ↑ Zyban (bupropion hydrochloride) – safety update, Medicines and Healthcare products Regulatory Agency, 24 lipca 2002 [zarchiwizowane z adresu 2007-09-28].
- ↑ R. Hubbard i inni, Bupropion and the risk of sudden death: a self-controlled case-series analysis using The Health Improvement Network, „Thorax”, 60 (10), 2005, s. 848–850, DOI: 10.1136/thx.2005.041798, PMID: 16055620, PMCID: PMC1747199.
- ↑ a b Levenson M, Holland C: Antidepressants and suicidality in adults: statistical evaluation. (Presentation at Psychopharmacologic Drugs Advisory Committee; 13 grudnia 2006). Agencja Żywności i Leków. [dostęp 2007-05-13].
- ↑ J.R. Hughes, L.F. Stead, T. Lancaster, Antidepressants for smoking cessation, „The Cochrane Database of Systematic Reviews” (1), 2007, art. nr CD000031, DOI: 10.1002/14651858.CD000031.pub3, PMID: 17253443 (ang.).
- ↑ Seth Howes i inni, Antidepressants for smoking cessation, „Cochrane Database of Systematic Reviews”, 2021 (5), 2020, DOI: 10.1002/14651858.CD000031.pub5, PMID: 32319681, PMCID: PMC7175455 [dostęp 2022-10-24] (ang.).
- ↑ Public Health Advisory: FDA requires new boxed warnings for the smoking cessation drugs Chantix and Zyban, Agencja Żywności i Leków, 1 lipca 2009 [zarchiwizowane z adresu 2014-09-02].
- ↑
 The smoking cessation aids varenicline (marketed as Chantix) and bupropion (marketed as Zyban and generics) suicidal ideation and behavior, „Drug Safety Newsletter”, 2 (1), 2009, s. 1–4.
The smoking cessation aids varenicline (marketed as Chantix) and bupropion (marketed as Zyban and generics) suicidal ideation and behavior, „Drug Safety Newsletter”, 2 (1), 2009, s. 1–4.
- ↑ a b c Sanjeev Kumar i inni, Bupropion-induced psychosis: folklore or a fact? A systematic review of the literature, „General Hospital Psychiatry”, 33 (6), 2011, s. 612–617, DOI: 10.1016/j.genhosppsych.2011.07.001, PMID: 21872337 (ang.).
- ↑ W.T. Howard, J.K. Warnock, Bupropion-induced psychosis, „The American Journal of Psychiatry”, 156 (12), 1999, s. 2017–2018, DOI: 10.1176/ajp.156.12.2017-a, PMID: 10588428 (ang.).
- ↑ T. Javelot i inni, Troubles psychotiques aigus liés au bupropion: revue de la littérature, „L’Encephale”, 36 (6), 2010, s. 461–471, DOI: 10.1016/j.encep.2010.01.005, PMID: 21130229 (fr.).
- ↑ Nemeroff CB, Schatzberg AF: Essentials of clinical psychopharmacology. Washington, D.C: American Psychiatric Publishing, 2006, s. 146. ISBN 1-58562-243-5.
- ↑ Timothy R. Berigan, Bupropion-Associated Withdrawal Symptoms Revisited: A Case Report, „Primary Care Companion to the Journal of Clinical Psychiatry”, 4 (2), 2002, s. 78–79, DOI: 10.4088/PCC.v04n0208a, PMID: 15014751, PMCID: PMC181231.
- ↑ Prescribing information – Zyban (bupropion hydrochloride) sustained-release tablets [online], Glaxo Smith-Kline [dostęp 2010-01-06].
- ↑ a b James W. Jefferson, James F. Pradko, Keith T. Muir, Bupropion for major depressive disorder: Pharmacokinetic and formulation considerations, „Clinical Therapeutics”, 27 (11), 2005, s. 1685–1695, DOI: 10.1016/j.clinthera.2005.11.011, PMID: 16368442 (ang.).
- ↑ a b c Linda P. Dwoskin i inni, Review of the pharmacology and clinical profile of bupropion, an antidepressant and tobacco use cessation agent, „CNS drug reviews”, 12 (3-4), 2006, s. 178–207, DOI: 10.1111/j.1527-3458.2006.00178.x, PMID: 17227286, PMCID: PMC6506196 [dostęp 2022-10-24] (ang.).
- ↑ D Taylor, P Carol, K Shitij: The Maudsley prescribing guidelines in psychiatry. West Sussex: Wiley-Blackwell, 2012. ISBN 978-0-470-97969-3.
- ↑ Nicole White, Toby Litovitz, Cathleen Clancy, Suicidal antidepressant overdoses: a comparative analysis by antidepressant type, „Journal of Medical Toxicology”, 4 (4), 2008, s. 238–250, DOI: 10.1007/BF03161207, PMID: 19031375, PMCID: PMC3550116.
- ↑ Michael C. Beuhler, Henry A. Spiller, Howell C. Sasser, The outcome of unintentional pediatric bupropion ingestions: a NPDS database review, „Journal of Medical Toxicology”, 6 (1), 2010, s. 4–8, DOI: 10.1007/s13181-010-0027-4, PMID: 20213217, PMCID: PMC3550434.
- ↑ J.A. Johnston i inni, A 102-center prospective study of seizure in association with bupropion, „The Journal of Clinical Psychiatry”, 52 (11), 1991, s. 450–456, PMID: 1744061 (ang.).
- ↑ Henry A. Spiller, Edward Bottei, Linda Kalin, Fatal bupropion overdose with post mortem blood concentrations, „Forensic Science, Medicine, and Pathology”, 4 (1), 2008, s. 47–50, DOI: 10.1007/s12024-007-0030-5, PMID: 19291469.
- ↑ Jeffrey H. Meyer i inni, Bupropion occupancy of the dopamine transporter is low during clinical treatment, „Psychopharmacology”, 163 (1), 2002, s. 102–105, DOI: 10.1007/s00213-002-1166-3, PMID: 12185406 [dostęp 2022-10-24] (ang.).
- ↑ Susan M. Learned-Coughlin i inni, In vivo activity of bupropion at the human dopamine transporter as measured by positron emission tomography, „Biological Psychiatry”, 54 (8), 2003, s. 800–805, DOI: 10.1016/s0006-3223(02)01834-6, PMID: 14550679 [dostęp 2022-10-24] (ang.).
- ↑ L.L. Howell, K.M. Wilcox, The dopamine transporter and cocaine medication development: drug self-administration in nonhuman primates, „The Journal of Pharmacology and Experimental Therapeutics”, 298 (1), 2001, s. 1–6, PMID: 11408518 [dostęp 2022-10-24] (ang.).
- ↑ Bupropion. Stahlonline.cambridge.org: Cambridge University Press. [dostęp 2010-04-27].
- ↑ Hugo R. Arias, Is the inhibition of nicotinic acetylcholine receptors by bupropion involved in its clinical actions?, „The International Journal of Biochemistry & Cell Biology”, 41 (11), 2009, s. 2098–2108, DOI: 10.1016/j.biocel.2009.05.015, PMID: 19497387 [dostęp 2022-10-24] (ang.).
- ↑ a b W.D. Horst, S.H. Preskorn, Mechanisms of action and clinical characteristics of three atypical antidepressants: venlafaxine, nefazodone, bupropion, „Journal of Affective Disorders”, 51 (3), 1998, s. 237–254, DOI: 10.1016/s0165-0327(98)00222-5, PMID: 10333980 [dostęp 2022-10-24] (ang.).
- ↑ Andrew J. Johnston i inni, Pharmacokinetic optimisation of sustained-release bupropion for smoking cessation, „Drugs”, 62 Suppl 2, 2002, s. 11–24, DOI: 10.2165/00003495-200262002-00002, PMID: 12109932 [dostęp 2022-10-24] (ang.).
- ↑ Hongmei Xu i inni, Stereoselective analysis of hydroxybupropion and application to drug interaction studies, „Chirality”, 19 (3), 2007, s. 163–170, DOI: 10.1002/chir.20356, PMID: 17167747 [dostęp 2022-10-24] (ang.).
- ↑ Mikhail L. Bondarev i inni, Behavioral and biochemical investigations of bupropion metabolites, „European Journal of Pharmacology”, 474 (1), 2003, s. 85–93, DOI: 10.1016/s0014-2999(03)02010-7, PMID: 12909199 [dostęp 2022-10-24] (ang.).
- ↑ M. Imad Damaj i inni, Enantioselective effects of hydroxy metabolites of bupropion on behavior and on function of monoamine transporters and nicotinic receptors, „Molecular Pharmacology”, 66 (3), 2004, s. 675–682, DOI: 10.1124/mol.104.001313, PMID: 15322260 [dostęp 2022-10-24] (ang.).
- ↑ GlaxoSmithKline (GSK) Reviews Novel Therapeutics For CNS Disorders And Confirms Strong Pipeline Momentum. PRNewswire, 2004-11-23. [dostęp 2007-08-18]. [zarchiwizowane z tego adresu (2017-03-20)].
- ↑ GlaxoSmithKline: Pipeline Update. 2006-07-26. [dostęp 2007-08-18]. [zarchiwizowane z tego adresu (2012-07-15)].
- ↑ Arne Meyer i inni, Formation of threohydrobupropion from bupropion is dependent on 11β-hydroxysteroid dehydrogenase 1, „Drug Metabolism and Disposition: The Biological Fate of Chemicals”, 41 (9), 2013, s. 1671–1678, DOI: 10.1124/dmd.113.052936, PMID: 23804523, PMCID: PMC3876805 [dostęp 2022-10-24] (ang.).
- ↑ Leah M. Hesse i inni, Pharmacogenetic determinants of interindividual variability in bupropion hydroxylation by cytochrome P450 2B6 in human liver microsomes, „Pharmacogenetics”, 14 (4), 2004, s. 225–238, DOI: 10.1097/00008571-200404000-00002, PMID: 15083067 [dostęp 2022-10-24] (ang.).
- ↑ S.H. Preskorn, Should bupropion dosage be adjusted based upon therapeutic drug monitoring?, „Psychopharmacology Bulletin”, 27 (4), 1991, s. 637–643, PMID: 1813908 [dostęp 2022-10-24] (ang.).
- ↑ R.F. Suckow i inni, Pharmacokinetics of bupropion and metabolites in plasma and brain of rats, mice, and guinea pigs, „Drug Metabolism and Disposition: The Biological Fate of Chemicals”, 14 (6), 1986, s. 692–697, PMID: 2877828 [dostęp 2022-10-24] (ang.).
- ↑ R.M. Welch, A.A. Lai, D.H. Schroeder, Pharmacological significance of the species differences in bupropion metabolism, „Xenobiotica; the Fate of Foreign Compounds in Biological Systems”, 17 (3), 1987, s. 287–298, DOI: 10.3109/00498258709043939, PMID: 3107223 [dostęp 2022-10-24] (ang.).
- ↑ D. Weintraub, M.W. Linder, Amphetamine positive toxicology screen secondary to bupropion, „Depression and Anxiety”, 12 (1), 2000, s. 53–54, DOI: 10.1002/1520-6394(2000)12:1<53::AID-DA8>3.0.CO;2-4, PMID: 10999247 [dostęp 2022-10-24] (ang.).
- ↑ A.L. Nixon i inni, Bupropion metabolites produce false-positive urine amphetamine results, „Clinical Chemistry”, 41 (6 Pt 1), 1995, s. 955–956, DOI: 10.1093/clinchem/41.6.955, PMID: 7768026 [dostęp 2022-10-24] (ang.).
- ↑ a b Mehta NB: United States Patent 3,819,706: Meta-chloro substituted α-butylamino-propiophenones. USPTO, 1974-06-25. [dostęp 2008-06-02].
- ↑ Wellbutrin label and approval history.. U.S. Food and Drug Administration Center for Drug Evaluation and Research. [dostęp 2007-08-18].
- ↑ Bupropion (Wellbutrin). eMedExpert.com, 2008-03-31. [dostęp 2013-08-20].
- ↑ a b L. Whitten, Bupropion helps people with schizophrenia quit smoking, „National Institute on Drug Abuse Research Findings”, 20 (5), 2006 [zarchiwizowane z adresu 2007-08-05].
- ↑ Seasonal affective disorder drug Wellbutrin XL wins approval. CNN, 2006-06-14. [dostęp 2007-08-19]. [zarchiwizowane z tego adresu (2012-11-04)].
- ↑ Waknine, Yael: FDA Approvals: Advair, Relistor, Aplenzin. Medscape, 2008-05-08. [dostęp 2008-05-09].
- ↑ Generic drug equality questioned. [dostęp 2007-10-13]. [zarchiwizowane z tego adresu (3 października 2012)].
- ↑ Jacqueline Stenson: Report questions generic antidepressant. msnbc.com, 12 października 2007. [dostęp 2007-10-13].
- ↑ Review of therapeutic equivalence: generic bupropion XL 300 mg and Wellbutrin XL 300 mg. [dostęp 2008-04-19]. [zarchiwizowane z tego adresu (2011-06-06)].
- ↑ a b Budeprion XL 300 mg not therapeutically equivalent to Wellbutrin XL 300 mg. FDA, 3 października 2012. [dostęp 2013-03-23].
- ↑ FDA Update from Oct 2013.
- ↑ „Największe oszustwo w historii służby zdrowia”. Gigant farmaceutyczny zapłaci 3 mld dolarów. gazeta.pl, 2012-07-03. [dostęp 2014-11-04].
- ↑ K. Thomas, M.S. Schmidt, Glaxo agrees to pay $3 billion in fraud settlement, „The New York Times”, 2 lipca 2012 (ang.).
- ↑ Zyban: sevrage tabagique et sécurité d’emploi. [w:] Zyban: smoking cessation and job security [on-line]. Agence française de sécurité sanitaire des produits de santé, 2002-01-18. [dostęp 2011-01-25]. [zarchiwizowane z tego adresu (2011-07-23)]. (fr.).
- ↑ GlaxoSmithKline receives first European approval for Wellbutrin XR, GlaxoSmithKline, 16 stycznia 2007 [dostęp 2014-11-04].
- ↑
 Figure 3-4. Abuse potential of common psychiatric medications. W: Substance abuse treatment for persons with HIV/AIDS. Rockville: U.S. Department of Health and Human Services. Substance Abuse and Mental Health Services Administration. Center for Substance Abuse Treatment, s. 83–84, seria: Treatment Improvement Protocol.
Figure 3-4. Abuse potential of common psychiatric medications. W: Substance abuse treatment for persons with HIV/AIDS. Rockville: U.S. Department of Health and Human Services. Substance Abuse and Mental Health Services Administration. Center for Substance Abuse Treatment, s. 83–84, seria: Treatment Improvement Protocol.
- ↑ Joshua A. Lile, Michael A. Nader, The Abuse Liability and Therapeutic Potential of Drugs Evaluated for Cocaine Addiction as Predicted by Animal Models, „Current Neuropharmacology”, 1 (1), s. 21–46, DOI: 10.2174/1570159033360566 [dostęp 2022-10-24] (ang.).
Bibliografia[edytuj | edytuj kod]
- Stephen M. Stahl i inni, A Review of the Neuropharmacology of Bupropion, a Dual Norepinephrine and Dopamine Reuptake Inhibitor, „The Primary Care Companion to The Journal of Clinical Psychiatry”, 06 (04), 2004, s. 159–166, DOI: 10.4088/PCC.v06n0403, PMID: 15361919, PMCID: PMC514842 [dostęp 2022-10-23].
- Sidney Zisook i inni, Use of bupropion in combination with serotonin reuptake inhibitors, „Biological Psychiatry”, 59 (3), 2006, s. 203–210, DOI: 10.1016/j.biopsych.2005.06.027, PMID: 16165100 [dostęp 2022-10-23] (ang.).


