Choroby genetyczne człowieka: Różnice pomiędzy wersjami
| [wersja przejrzana] | [wersja przejrzana] |
m →Częstość występowania chorób genetycznych człowieka: drobne techniczne |
uściślenie podziału chorób genetycznych, uzupełnienie merytoryczne, źródłowe, w linki zewnętrzne, uwagi, tabelka, int., lit., drobne redakcyjne, drobne techniczne, WP:SK |
||
| Linia 1: | Linia 1: | ||
'''Choroby genetyczne człowieka''' – grupa [[choroby genetyczne|chorób uwarunkowanych genetycznie]] występujących u człowieka; upośledzające sprawność życiową odchylenia od stanu prawidłowego (statystycznej normy), które mogą być przekazywane jako cecha dziedziczna z pokolenia na pokolenie lub powstawać ''[[de novo]]'' na skutek zmian i zaburzeń w mechanizmach przekazywania cech dziedzicznych. Powstałe ''de novo'' zmiany mogą być przekazywane potomstwu jako cecha (choroba) dziedziczna{{odn|Boczkowski|1990|s=15}}. Mogą być spowodowane [[Aberracje chromosomowe|aberracjami strukturalnymi chromosomów]], zmianami liczbowymi oraz [[mutacja|mutacjami genowymi]]{{odn|Mizerski|2013|s=314}}. |
'''Choroby genetyczne człowieka''' – grupa [[choroby genetyczne|chorób uwarunkowanych genetycznie]] występujących u człowieka; upośledzające sprawność życiową odchylenia od stanu prawidłowego (statystycznej normy), które mogą być przekazywane jako cecha dziedziczna z pokolenia na pokolenie lub powstawać ''[[de novo]]'' na skutek zmian i zaburzeń w mechanizmach przekazywania cech dziedzicznych. Powstałe ''de novo'' zmiany mogą być przekazywane potomstwu jako cecha (choroba) dziedziczna{{odn|Boczkowski|1990|s=15}}. Mogą być spowodowane [[Aberracje chromosomowe|aberracjami strukturalnymi chromosomów]], zmianami liczbowymi oraz [[mutacja|mutacjami genowymi]]{{odn|Mizerski|2013|s=314}}. |
||
Podział chorób genetycznych jest oparty tradycyjnie na podstawowych prawach dziedziczenia. Wyróżnia się choroby '''jednogenowe'''<ref>[http://www.teachersdomain.org/resources/tdc02/sci/life/gen/lp_disorder/index.html WGBH Educational Foundation]</ref>, które są dziedziczone zgodnie z [[Prawa Mendla|prawami]] [[Grzegorz Mendel|Mendla]] i uwarunkowane treścią informacyjną jednego genu, tj. w obrębie pary alleli, występujących w określonym ''[[locus]]'' genowym. Wśród nich wyróżnia się autosomalne recesywne, autosomalne dominujące i sprzężone z chromosomem płciowym żeńskim X, zwykle określane jako sprzężone z płcią. Kolejną grupę stanowią choroby '''wielogenowe''', warunkowane współdziałaniem wielu genów umiejscowionych w różnych ''loci''{{odn|Boczkowski|1990|s=49}}. Często objawy tych chorób występują na skutek interakcji z czynnikami środowiskowymi i ujawniają się dopiero wówczas, gdy nasilenie działania tych czynników osiągnie |
Podział chorób genetycznych jest oparty tradycyjnie na podstawowych prawach dziedziczenia. Wyróżnia się choroby '''jednogenowe'''<ref>[http://www.teachersdomain.org/resources/tdc02/sci/life/gen/lp_disorder/index.html WGBH Educational Foundation]</ref>, które są dziedziczone zgodnie z [[Prawa Mendla|prawami]] [[Grzegorz Mendel|Mendla]] i uwarunkowane treścią informacyjną jednego genu, tj. w obrębie pary alleli, występujących w określonym ''[[locus]]'' genowym. Wśród nich wyróżnia się autosomalne recesywne, autosomalne dominujące i sprzężone z chromosomem płciowym żeńskim X, zwykle określane jako sprzężone z płcią. Kolejną grupę stanowią choroby '''wielogenowe''', warunkowane współdziałaniem wielu genów umiejscowionych w różnych ''loci''{{odn|Boczkowski|1990|s=49}}. Często objawy tych chorób występują na skutek interakcji z czynnikami środowiskowymi i ujawniają się dopiero wówczas, gdy nasilenie działania tych czynników osiągnie pewną wartość progową, dlatego też mówi się o chorobach '''wieloczynnikowych'''. Pojęcia ''choroby wieloczynnikowe'' i ''choroby wielogenowe'' w wielu pracach naukowych, podręcznikach są stosowane zamiennie i granica pomiędzy nimi jest płynna{{odn|Boczkowski|1990|s=16}}. Ostatnią ważną grupę stanowią choroby występujące w związku z nieprawidłowościami liczby (aberracje liczbowe) lub struktury chromosomów (aberracje strukturalne), czyli '''choroby chromosomalne''' lub '''aberracje chromosomalne'''{{odn|Boczkowski|1990|s=16}}{{odn|Mizerski|2013|s=314}}. |
||
== Genetyczne obciążenie populacji == |
== Genetyczne obciążenie populacji == |
||
| Linia 73: | Linia 73: | ||
! Choroby!! Częstość występowania |
! Choroby!! Częstość występowania |
||
|- |
|- |
||
| |
!colspan=2| Autosomalne |
||
|- |
|- |
||
| Mukowiscydoza|| 0,4 |
| Mukowiscydoza|| 0,4 |
||
| Linia 89: | Linia 89: | ||
| Glikogenozy|| 0,02 |
| Glikogenozy|| 0,02 |
||
|- |
|- |
||
| |
!colspan=2| Sprzężone z chromosomem X |
||
|- |
|- |
||
| Dystrofia mięśniowa Duchenne'a|| 0,14 |
| Dystrofia mięśniowa Duchenne'a|| 0,14 |
||
|- |
|- |
||
| Hemofilia A|| 0,01 |
| Hemofilia A|| 0,01 |
||
|} |
|||
{| class="wikitable" |
|||
|+ Częstość mutacji u człowieka{{odn|Boczkowski|1990|s=184}} |
|||
! Cecha!! Liczba mutantów na 10<sup>6</sup> gamet |
|||
|- |
|||
!colspan=2 | Choroby autosomalne dominujące |
|||
|- |
|||
| Achondroplazja|| 6 - 13 |
|||
|- |
|||
| [[Aniridia]]|| 5 |
|||
|- |
|||
| Dystrofia miotoniczna|| 8 - 11 |
|||
|- |
|||
| Siatkówczak zarodkowy|| 6 - 12 |
|||
|- |
|||
| Akrocefalosyndaktylia|| 4 |
|||
|- |
|||
| [[Stwardnienie guzowate]]|| 5 - 15 |
|||
|- |
|||
| [[Neurofibromatoza]]|| 44 - 100 |
|||
|- |
|||
| Torbielowatość nerek|| 65 - 120 |
|||
|- |
|||
!colspan=2 | Cechy recesywne autosomalne |
|||
|- |
|||
| [[Mikrocefalia]]|| 25 - 49 |
|||
|- |
|||
| Rybia łuska wrodzona|| 11 |
|||
|- |
|||
| [[Cereidolipofuscynoza]] - postać młodzieńcza|| 38 |
|||
|- |
|||
| Ślepota na barwy całkowita|| 28 |
|||
|- |
|||
| Fenyloketonuria|| 25 |
|||
|- |
|||
!colspan=2 | Cechy sprzeżone z chromosomem X |
|||
|- |
|||
| Hemofilia A|| 32 - 57 |
|||
|- |
|||
| Hemofilia B|| 2 - 3 |
|||
|- |
|||
| Dystrofia mięśniowa Duchenne'a|| 46 - 105 |
|||
|- |
|||
| Zespół Blocha i Sulzbergera|| 6 - 20 |
|||
|} |
|} |
||
| Linia 132: | Linia 177: | ||
== Aberracje strukturalne == |
== Aberracje strukturalne == |
||
Poza mutacjami liczbowymi chromosomów ciężkie choroby genetyczne wywołują również aberracje strukturalne. Polegają one na nieprawidłowej budowie chromosomu. Największe prawdopodobieństwo ich wystąpienia istnieje w okresie podziału komórki, gdy chromosomy potomne przechodzą do nowo powstających komórek. Najczęściej spotykane choroby związane z aberracjami strukturalnymi, które zostaną poniżej krótko omówione, powstają przeważnie w wyniku przerwania ciągłości chromosomu, a więc odłamania się jego odcinka. Taki odłamany odcinek może połączyć się ponownie z tym samym lub innym chromosomem, co powoduje powstanie [[Inwersja chromosomowa|inwersji]], [[Translokacja|translokacji]], [[Duplikacja|duplikacji]] lub [[Deficjencja|deficjencji]] (w wielu źródłach [[Delecja|delecji]]), gdy utracona zostaje część chromosomu (np. ramię){{odn|Boczkowski|1990|s=49}}. Wybrane choroby związane z uszkodzeniami chromosomów: |
Poza mutacjami liczbowymi chromosomów ciężkie choroby genetyczne wywołują również aberracje strukturalne. Polegają one na nieprawidłowej budowie chromosomu. Największe prawdopodobieństwo ich wystąpienia istnieje w okresie podziału komórki, gdy chromosomy potomne przechodzą do nowo powstających komórek. Najczęściej spotykane choroby związane z aberracjami strukturalnymi, które zostaną poniżej krótko omówione, powstają przeważnie w wyniku przerwania ciągłości chromosomu, a więc odłamania się jego odcinka. Taki odłamany odcinek może połączyć się ponownie z tym samym lub innym chromosomem, co powoduje powstanie [[Inwersja chromosomowa|inwersji]], [[Translokacja|translokacji]], [[Duplikacja|duplikacji]] lub [[Deficjencja|deficjencji]] (w wielu źródłach [[Delecja|delecji]]), gdy utracona zostaje część chromosomu (np. ramię){{odn|Boczkowski|1990|s=49}}. Wybrane choroby związane z uszkodzeniami chromosomów: |
||
=== Zespół ustno-twarzowo-palcowy === |
=== Zespół ustno-twarzowo-palcowy === |
||
{{Osobny artykuł|Zespół ustno-twarzowo-palcowy}} |
{{Osobny artykuł|Zespół ustno-twarzowo-palcowy}} |
||
Zespoły ustno-twarzowo-palcowe stanowią grupę około dziesięciu chorób. Częstą przyczyną jest translokacja części [[Chromosom 6|chromosomu 6]] do [[Chromosom 1|1]]. Objawia się m.in. wadą górnej wargi, podniebienia i jamy ustnej oraz grubymi palcami o krótkich paznokciach<ref>{{Cytuj pismo | autor=GORLIN RJ, ANDERSON VE, SCOTT CR | tytuł=Hypertrophied frenuli, oligophrenia, famflial trembling and anomalies of the hand. Report of four casesin one family and a forme fruste in another | rok=1961 | czasopismo=N Engl J Med | doi= | wolumin= | oznaczenie=264 | pmid= 13707262 | strony=486-9}}</ref><ref>{{Cytuj pismo | autor=Towfighi J, Berlin CM, Ladda RL, Frauenhoffer EE, Lehman RA | tytuł=Neuropathology of oral-facial-digital syndromes| rok=1985 | czasopismo=Arch Pathol Lab Med | doi= | wolumin=7 | oznaczenie=109 | pmid= 3839363 | strony=642-6}}</ref><ref name=":2" />. Jedną z odmian jest zespół Papillona-League-Psaume, ({{ang.|orofaciodigital syndrome type I, OFD1}}), którego podłoże molekularne stanowi mutacja genu ''[[OFD1]]'' sprzężonego z chromosomem X (region Xp22.2.), dziedziczącego się dominująco lub genu ''CXORF5''<ref>{{Cytuj pismo | autor=Ferrante MI, Giorgio G, Feather SA, Bulfone A, Wright V, Ghiani M, Selicorni A, Gammaro L, Scolari F, Woolf AS, Sylvie O, Bernard L, Malcolm S, Winter R, Ballabio A, Franco B | tytuł=Identification of the gene for oral-facial-digital type I syndrome | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179005 | strony=569-76}}</ref><ref>{{Cytuj|autor=Shilpa Chetty-John, Katie Piwnica-Worms, Joy Bryant, Isa Bernardini, Roxanne E. Fischer|tytuł=Fibrocystic disease of liver and pancreas; under-recognized features of the X-linked ciliopathy oral-facial-digital syndrome type 1 (OFD I)|czasopismo=American Journal of Medical Genetics Part A|data=2010-10-01|data dostępu=2017-01-03|issn=1552-4833|wydanie=10|s=2640–2645|doi=10.1002/ajmg.a.33666|pmid=20818665|pmc=2963649|url=http://onlinelibrary.wiley.com/doi/10.1002/ajmg.a.33666/abstract|język=en}}</ref>. Do głównych objawów patomorfologicznych należą<ref>{{Cytuj|autor=Fiorella Gurrieri, Brunella Franco, Helga Toriello, Giovanni Neri|tytuł=Oral–facial–digital syndromes: Review and diagnostic guidelines|czasopismo=American Journal of Medical Genetics Part A|data=2007-12-15|data dostępu=2017-01-03|issn=1552-4833|wydanie=24|s=3314–3323|doi=10.1002/ajmg.a.32032|url=http://onlinelibrary.wiley.com/doi/10.1002/ajmg.a.32032/abstract|język=en}}</ref>: [[malforacja|malforacje]] twarzy i jamy ustnej: rozszczep podniebienia, pogrubienie wału dziąseł, nisko osadzone uszy, próchnica zębów, nieobecne boczne zęby sieczne, szeroki grzbiet nosa. Występują także wady ośrodkowego układu nerwowego (40%): brak [[ciało modzelowate|ciała modzelowatego]], [[heterotopia]] [[istota szara|istoty szarej]], [[przepuklina oponowo-rdzeniowa]] (rzadko), wodogłowie, torbiele pajęczynówki, nieprawidłowości móżdżku, porencefalia. Występuje często razem z [[wielotorbielowatość nerek|wielotorbielowatością nereki]]<ref>{{Cytuj|autor=D. Donnai, L. Kerzin-Storrar, R. Harris|tytuł=Familial orofaciodigital syndrome type I presenting as adult polycystic kidney disease.|czasopismo=Journal of Medical Genetics|data=1987-02-01|data dostępu=2017-01-03|issn=1468-6244|wydanie=2|s=84–87|doi=10.1136/jmg.24.2.84|pmid=3560172|url=http://jmg.bmj.com/content/24/2/84|język=en}}</ref><ref>{{Cytuj pismo | autor=Harrod MJ, Stokes J, Peede LF, Goldstein JL | tytuł=Polycystic kidney disease in a patient with the oral-facial-digital syndrome - type I | rok=1976 | czasopismo=Clin Genet | doi= | wolumin=2 | oznaczenie=9 | pmid= 1248177 | strony=183-6}}</ref>. Zespół występuje u kobiet, u mężczyzn jest [[mutacja letalna|letalny]]<ref>{{OMIM|id=311200|nazwa=OROFACIODIGITAL SYNDROME I; OFD1}}</ref>. |
Zespoły ustno-twarzowo-palcowe stanowią grupę około dziesięciu chorób. Częstą przyczyną jest translokacja części [[Chromosom 6|chromosomu 6]] do [[Chromosom 1|1]]. Objawia się m.in. wadą górnej wargi, podniebienia i jamy ustnej oraz grubymi palcami o krótkich paznokciach<ref>{{Cytuj pismo | autor=GORLIN RJ, ANDERSON VE, SCOTT CR | tytuł=Hypertrophied frenuli, oligophrenia, famflial trembling and anomalies of the hand. Report of four casesin one family and a forme fruste in another | rok=1961 | czasopismo=N Engl J Med | doi= | wolumin= | oznaczenie=264 | pmid= 13707262 | strony=486-9}}</ref><ref>{{Cytuj pismo | autor=Towfighi J, Berlin CM, Ladda RL, Frauenhoffer EE, Lehman RA | tytuł=Neuropathology of oral-facial-digital syndromes| rok=1985 | czasopismo=Arch Pathol Lab Med | doi= | wolumin=7 | oznaczenie=109 | pmid= 3839363 | strony=642-6}}</ref><ref name=":2" />. Jedną z odmian jest zespół Papillona-League-Psaume, ({{ang.|orofaciodigital syndrome type I, OFD1}}), którego podłoże molekularne stanowi mutacja genu ''[[OFD1]]'' sprzężonego z chromosomem X (region Xp22.2.), dziedziczącego się dominująco lub genu ''CXORF5''<ref>{{Cytuj pismo | autor=Ferrante MI, Giorgio G, Feather SA, Bulfone A, Wright V, Ghiani M, Selicorni A, Gammaro L, Scolari F, Woolf AS, Sylvie O, Bernard L, Malcolm S, Winter R, Ballabio A, Franco B | tytuł=Identification of the gene for oral-facial-digital type I syndrome | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179005 | strony=569-76}}</ref><ref>{{Cytuj|autor=Shilpa Chetty-John, Katie Piwnica-Worms, Joy Bryant, Isa Bernardini, Roxanne E. Fischer|tytuł=Fibrocystic disease of liver and pancreas; under-recognized features of the X-linked ciliopathy oral-facial-digital syndrome type 1 (OFD I)|czasopismo=American Journal of Medical Genetics Part A|data=2010-10-01|data dostępu=2017-01-03|issn=1552-4833|wydanie=10|s=2640–2645|doi=10.1002/ajmg.a.33666|pmid=20818665|pmc=2963649|url=http://onlinelibrary.wiley.com/doi/10.1002/ajmg.a.33666/abstract|język=en}}</ref>. Do głównych objawów patomorfologicznych należą<ref>{{Cytuj|autor=Fiorella Gurrieri, Brunella Franco, Helga Toriello, Giovanni Neri|tytuł=Oral–facial–digital syndromes: Review and diagnostic guidelines|czasopismo=American Journal of Medical Genetics Part A|data=2007-12-15|data dostępu=2017-01-03|issn=1552-4833|wydanie=24|s=3314–3323|doi=10.1002/ajmg.a.32032|url=http://onlinelibrary.wiley.com/doi/10.1002/ajmg.a.32032/abstract|język=en}}</ref>: [[malforacja|malforacje]] twarzy i jamy ustnej: rozszczep podniebienia, pogrubienie wału dziąseł, nisko osadzone uszy, próchnica zębów, nieobecne boczne zęby sieczne, szeroki grzbiet nosa. Występują także wady ośrodkowego układu nerwowego (40%): brak [[ciało modzelowate|ciała modzelowatego]], [[heterotopia]] [[istota szara|istoty szarej]], [[przepuklina oponowo-rdzeniowa]] (rzadko), wodogłowie, torbiele pajęczynówki, nieprawidłowości móżdżku, porencefalia. Występuje często razem z [[wielotorbielowatość nerek|wielotorbielowatością nereki]]<ref>{{Cytuj|autor=D. Donnai, L. Kerzin-Storrar, R. Harris|tytuł=Familial orofaciodigital syndrome type I presenting as adult polycystic kidney disease.|czasopismo=Journal of Medical Genetics|data=1987-02-01|data dostępu=2017-01-03|issn=1468-6244|wydanie=2|s=84–87|doi=10.1136/jmg.24.2.84|pmid=3560172|url=http://jmg.bmj.com/content/24/2/84|język=en}}</ref><ref>{{Cytuj pismo | autor=Harrod MJ, Stokes J, Peede LF, Goldstein JL | tytuł=Polycystic kidney disease in a patient with the oral-facial-digital syndrome - type I | rok=1976 | czasopismo=Clin Genet | doi= | wolumin=2 | oznaczenie=9 | pmid= 1248177 | strony=183-6}}</ref>. Zespół występuje u kobiet, u mężczyzn jest [[mutacja letalna|letalny]]<ref>{{OMIM|id=311200|nazwa=OROFACIODIGITAL SYNDROME I; OFD1}}</ref>. |
||
=== Zespół kociego krzyku === |
=== Zespół kociego krzyku === |
||
| Linia 213: | Linia 258: | ||
To choroba genetyczna występująca u kobiet. Kobiety z tą chorobą mają kariotyp typowy dla mężczyzny (XY), jednak część chromosomu Y kluczowa dla rozwoju płci została utracona lub jest nieczynna wskutek mutacji. Do objawów klinicznych zalicza się bezpłodność: gonady obecne w jamie brzusznej nie funkcjonują. Drugorzędowe żeńskie cechy płciowe nie rozwijają się z powodu braku hormonów ([[Estrogeny|estrogenów]]). Inteligencja niezaburzona{{odn|Mizerski|2013|s=314}}<ref>{{cytuj książkę|tytuł=Położnictwo i ginekologia, tom 2|strony=692|inni=Grzegorz H. Bręborowicz (red.)|id=83-200-3082-X|wydawca=[[Wydawnictwo Lekarskie PZWL]]}}</ref>. |
To choroba genetyczna występująca u kobiet. Kobiety z tą chorobą mają kariotyp typowy dla mężczyzny (XY), jednak część chromosomu Y kluczowa dla rozwoju płci została utracona lub jest nieczynna wskutek mutacji. Do objawów klinicznych zalicza się bezpłodność: gonady obecne w jamie brzusznej nie funkcjonują. Drugorzędowe żeńskie cechy płciowe nie rozwijają się z powodu braku hormonów ([[Estrogeny|estrogenów]]). Inteligencja niezaburzona{{odn|Mizerski|2013|s=314}}<ref>{{cytuj książkę|tytuł=Położnictwo i ginekologia, tom 2|strony=692|inni=Grzegorz H. Bręborowicz (red.)|id=83-200-3082-X|wydawca=[[Wydawnictwo Lekarskie PZWL]]}}</ref>. |
||
== |
== Choroby jednogenowe == |
||
Choroby z tej grupy dziedziczą się zwykle zgodnie z prawami Mendla, a mutacje je powodujące znajdują się w pojedynczych genach{{odn|Boczkowski|1990|s=114}}. Ponadto są one głównie związane z wystąpieniem mutacji w genach zlokalizowanych w DNA jądrowym. W zależności od tego, w jakim chromosomie zaszła mutacja (autosomie czy heterosomie) wyróżnia się '''choroby autosomalne''' i '''sprzężone z płcią'''<ref name="pmid15758612">{{Cytuj pismo|autor=Kuliev A|autor2=Verlinsky Y |tytuł=Preimplantation diagnosis: A realistic option for assisted reproduction and genetic practice |pismo=Curr. Opin. Obstet. Gynecol. |wolumin=17 |wydanie=2 |strony=179–83 |data=2005 |pmid=15758612 |doi= 10.1097/01.gco.0000162189.76349.c5|url=http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=1040-872X&volume=17&issue=2&spage=179 |data dostępu=2009-04-01}}</ref><ref name="Dubert">{{Cytuj|autor=Franciszek Dubert, Marek Jurgowiak, Maria Marko-Worłowska, Władysław Zamachowski|rozdział=Mechanizmy dziedziczenia|tytuł=Biologia na czasie 3. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony.|data=2016|isbn=978-83-267-1711-6|wydanie=Wydanie III|miejsce=Warszawa|wydawca=Nowa Era|s=s.93-96}}</ref>. Ze względu na charakter dziedziczonej cechy, choroby genetyczne jednogenowe dzieli się na dziedziczone dominująco i recesywnie<ref name="Williams">{{Cytuj pismo|autor = Williams T. N.|autor2 = Obaro S. K. |data = 2011|tytuł = Sickle cell disease and malaria morbidity: a tale with two tails |pismo = Trends in Parasitology |wolumin = 27 |wydanie = 7|strony = 315–320}}</ref>. Wyjątek stanowią choroby mitochondrialne, które dziedziczą się pozajądrowo, gdyż ich etiopatogeneza związana jest z mutacjami w DNA mitochondrialnym, niezależnym od DNA jądrowego. Ponad 4000 chorób człowieka jest spowodowanych przez mutacje pojedynczych genów (prawdopodobnie wiele recesywnych jeszcze nie zostało poznanych)<ref>{{Cytuj stronę|url=https://www.healthxchange.com.sg/News/Pages/Genetic-link-to-4000-diseases.aspx|tytuł=Genetic link to 4,000 diseases}}</ref>. |
|||
=== Achondroplazja === |
|||
=== Autosomalne dominujące === |
|||
Tylko jedna zmutowana wersja genu jest potrzebna do ujawnienia się cechy (choroby). Zwykle osoba dotknięta chorobą ma jednego chorego rodzica<ref>{{Cytuj książkę|nazwisko=Griffiths|imię=Anthony J.F.|tytuł=Introduction to Genetic Analysis|data=2012|publisher=W.H. Freeman and Company|miejsce=New York|isbn=978-1-4292-2943-2|strona=57|wydanie=10|autor2=Wessler, Susan R. |autor3=Carroll, Sean B. |autor4=Doebley, John |rozdział=2: Single-Gene Inheritance}}</ref>. Dziedziczenie tych chorób charakteryzuje się występowaniem osób o nieprawidłowym fenotypie „pionowo” w rodowodzie, czyli w kilku kolejnych pokoleniach. Niekiedy w poszczególnych rodzinach stwierdza się zjawisko antycypacji, tj. występowania w kolejnych pokoleniach bardziej nasilonych objawów choroby, albo też ich wystąpienie we wcześniejszym wieku. Wielu naukowców uważa jednak, że atycypacja jest zjawiskiem jedynie statystycznym{{odn|Boczkowski|1990|s=173}}. W większości przypadków choroby dominujące są letalne w stanie homozygotycznym, toteż prawdopodobieństwo urodzenia się zdrowego dziecka rodziców heterozygotycznych wynosi 2:1, zaś gdy tylko jeden z rodziców jest chory, szansa ta wynosić będzie 50%{{odn|Boczkowski|1990|s=173}}. Charakterystyczne cechy, po których należy podejrzewać autosomalny dominujący typ dziedziczenia{{odn|Boczkowski|1990|s=174}}: |
|||
* choroba występuje we wszystkich pokoleniach, |
|||
* choroba występuje z równą częstością u obu płci i przez osoby obu płci jest przekazywana, |
|||
* dotknięta osoba przekazuje cechę połowie swego potomstwa, |
|||
* członkowie rodziny nie mający fenotypowych cech choroby mają zdrowe dzieci, |
|||
* dwie osoby z podobnymi miernymi nieprawidłowościami fenotypu mają dzieci z dużymi wadami (25%, przy założeniu, że układ homozygotyczny nie jest letalny), podobne do rodziców (50%) i prawidłowe (25%), to można podejrzewać, że rodzice są heterozygotami mającymi cechę dominującą.<br /> |
|||
Przy dziedziczeniu autosomalnym dominującym zdarza się, że gen ma ograniczoną penetrację, to znaczy, że choć potrzebna jest tylko jedna zmutowana kopia, to nie wszystkie osoby, które ją dziedziczą, będą miały pełny obraz kliniczny lub czy w ogóle będą chore<ref name="Griffiths">{{Cytuj książkę|nazwisko=Griffiths|imię=Anthony J.F.|tytuł=Introduction to Genetic Analysis|data=2012|wydawnictwo=W.H. Freeman and Company|miejsce=New York|isbn=978-1-4292-2943-2|strona=58|wydanie=10|autor2=Wessler, Susan R. |autor3=Carroll, Sean B. |autor4=Doebley, John}}</ref>. Tego typu choroby są spowodowane najczęściej powtórzeniami trinukleotydów<ref group=uwaga>Na tej stronie (w tym artykule) zostały one omówione osobno, gdyż stanowią szczególną grupę, w której znajdują się również niektóre choroby sprzężone z płcią.</ref><ref name="Sobczak">Sobczak K, de Mezer M, Michlewski G, Krol J, Krzyzosiak WJ. (2003) RNA structure of trinucleotide repeats associated with human neurological diseases. Nucleic Acids Research. Oct 1;31(19):5469-82 [http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=14500809&ordinalpos=5&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum PMID 14500809]</ref>. |
|||
==== Achondroplazja ==== |
|||
{{Osobny artykuł|Achondroplazja}} |
{{Osobny artykuł|Achondroplazja}} |
||
Inna nazwa: '''chondrodystrofia'''.<br /> |
|||
Inna nazwa: '''chondrodystrofia'''.<br />To choroba dziedziczona autosomalnie dominująco, prowadząca do nieprawidłowego kostnienia śródchrzęstnego, co powoduje zaburzenie rozwoju pewnych kości w organizmie i [[Niedobór wzrostu|karłowatość]]<ref name="Wynn-2007">{{Cytuj pismo | nazwisko = Wynn | imię = J. | nazwisko2 = King | imię2 = TM. | nazwisko3 = Gambello | imię3 = MJ. | nazwisko4 = Waller | imię4 = DK. | nazwisko5 = Hecht | imię5 = JT. | tytuł = Mortality in achondroplasia study: a 42-year follow-up. | czasopismo = Am J Med Genet A | wolumin = 143A | numer = 21 | strony = 2502–11 | miesiąc = Nov | rok = 2007 | doi = 10.1002/ajmg.a.31919 | pmid = 17879967}}</ref>. Przyczyną schorzenia jest mutacja genu zlokalizowanego na krótkim ramieniu chromosomu 4 (4p16.3). W postaci homozygotycznej [[mutacja letalna|letalna]] na poziomie zarodkowym – upośledzenie w życiu płodowym. W ponad 99% przypadków tej choroby dochodzi do różnego typu mutacji receptora dla czynnika wzrostu fibroblastów (''fibroblast growth factor receptor 3'', ''FGFR3''). Jest to zwykle mutacja punktowa, polegająca na substytucji Gly380Arg<ref>{{Cytuj|tytuł=Achondroplazja - badania genetyczne|data dostępu=2016-12-26|język=pl|opublikowany=www.genomed.pl|url=http://www.genomed.pl/index.php/pl/badania-genetyczne/lista-badan/achondroplazja}}</ref>. Częstość występowania w populacji wynosi 1:25000<ref name="Wynn-2007"/>. Choroba ta w 80% przypadków powstaje ''de novo''. Częstość występowania tej mutacji wzrasta w przypadku ojca w wieku powyżej 35 lat{{r|Dakouane Giudicelli-2008}}. Do objawów należą: karłowatość, skrócenie długości kończyn, szczególnie części proksymalnych, prawidłowa długość tułowia, nadmierna lordoza odcinka lędźwiowego kręgosłupa zwężenie kanału kręgowego w odcinku lędźwiowym, małe sześcienne trzony kręgów, szpotawe kolana, dłoń kształtu trójzębnego, wydatne czoło, zapadnięta nasada nosa, [[mikromelia]] (małe dłonie)<ref>{{Cytuj|tytuł=Achondroplazja|czasopismo=Healthline|data dostępu=2016-12-26|url=http://pl.healthline.com/health/achondroplazja#Przyczyny2}}</ref><ref>{{Cytuj|tytuł=Achondroplazja - czyli wrodzona choroba kości - O genetyce bez tajemnic|czasopismo=O genetyce bez tajemnic|data=2015-05-05|data dostępu=2016-12-26|url=http://www.genetyczne.pl/choroby-genetyczne/achondroplazja-czyli-wrodzona-choroba-kosci/http://www.genetyczne.pl/choroby-genetyczne/achondroplazja-czyli-wrodzona-choroba-kosci/|język=pl-PL}}</ref>. |
|||
To choroba dziedziczona autosomalnie dominująco, prowadząca do nieprawidłowego kostnienia śródchrzęstnego, co powoduje zaburzenie rozwoju pewnych kości w organizmie i [[Niedobór wzrostu|karłowatość]]<ref name="Wynn-2007">{{Cytuj pismo | nazwisko = Wynn | imię = J. | nazwisko2 = King | imię2 = TM. | nazwisko3 = Gambello | imię3 = MJ. | nazwisko4 = Waller | imię4 = DK. | nazwisko5 = Hecht | imię5 = JT. | tytuł = Mortality in achondroplasia study: a 42-year follow-up. | czasopismo = Am J Med Genet A | wolumin = 143A | numer = 21 | strony = 2502–11 | miesiąc = Nov | rok = 2007 | doi = 10.1002/ajmg.a.31919 | pmid = 17879967}}</ref>. Przyczyną schorzenia jest mutacja genu zlokalizowanego na krótkim ramieniu chromosomu 4 (4p16.3). W postaci homozygotycznej [[mutacja letalna|letalna]] na poziomie zarodkowym – upośledzenie w życiu płodowym. W ponad 99% przypadków tej choroby dochodzi do różnego typu mutacji receptora dla czynnika wzrostu fibroblastów (''fibroblast growth factor receptor 3'', ''FGFR3''). Jest to zwykle mutacja punktowa, polegająca na substytucji Gly380Arg<ref>{{Cytuj|tytuł=Achondroplazja - badania genetyczne|data dostępu=2016-12-26|język=pl|opublikowany=www.genomed.pl|url=http://www.genomed.pl/index.php/pl/badania-genetyczne/lista-badan/achondroplazja}}</ref>. Częstość występowania w populacji wynosi 1:25000<ref name="Wynn-2007"/>. Choroba ta w 80% przypadków powstaje ''de novo''. Częstość występowania tej mutacji wzrasta w przypadku ojca w wieku powyżej 35 lat{{r|Dakouane Giudicelli-2008}}. Do objawów należą: karłowatość, skrócenie długości kończyn, szczególnie części proksymalnych, prawidłowa długość tułowia, nadmierna lordoza odcinka lędźwiowego kręgosłupa zwężenie kanału kręgowego w odcinku lędźwiowym, małe sześcienne trzony kręgów, szpotawe kolana, dłoń kształtu trójzębnego, wydatne czoło, zapadnięta nasada nosa, [[mikromelia]] (małe dłonie)<ref>{{Cytuj|tytuł=Achondroplazja|czasopismo=Healthline|data dostępu=2016-12-26|url=http://pl.healthline.com/health/achondroplazja#Przyczyny2}}</ref><ref>{{Cytuj|tytuł=Achondroplazja - czyli wrodzona choroba kości - O genetyce bez tajemnic|czasopismo=O genetyce bez tajemnic|data=2015-05-05|data dostępu=2016-12-26|url=http://www.genetyczne.pl/choroby-genetyczne/achondroplazja-czyli-wrodzona-choroba-kosci/http://www.genetyczne.pl/choroby-genetyczne/achondroplazja-czyli-wrodzona-choroba-kosci/|język=pl-PL}}</ref>. |
|||
=== |
==== Choroba Brugadów ==== |
||
[[Plik:Brugada.jpg|Obraz EKG w odprowadzeniach znad prawej komory w trzech typach zespołu|thumb|200px]] |
|||
{{osobny artykuł|Choroba Brugadów}} |
|||
Dziedziczona autosomalnie dominująco, charakteryzuje się skłonnością do występowania napadowych zaburzeń rytmu o typie [[częstoskurcz komorowy|częstoskurczu komorowego]], który może ustąpić samoistnie lub przekształcić się w [[migotanie komór]] i doprowadzić do [[nagłe zatrzymanie krążenia|nagłego zatrzymania krążenia]] i [[śmierć|śmierci]]. Podłoże molekularne stanowi mutacja w [[gen]]ie ''[[SCN5A]]'' kodującym [[kanał sodowy]]<ref>Plewka M, Kasprzak J. ''[http://web.archive.org/web/*/http://www.almamedia.com.pl/pliki/PPK/2001/1/PPK_2001_1_65.pdf Zespół Brugadów.]'' Polski Przegląd Kardiologiczny 3, 1, 65-67 (2001) {{ISSN|1507-5540}}</ref><ref>B.Dąbrowska: ''[http://www.mp.pl/artykuly/index.php?aid=9996&_tc=6CA90EAE131C4A4AB763A91060DBD9D4 Zespół Brugadów.]'' Medycyna Praktyczna 6 (2001)</ref>. Wskutek tego dochodzi do skrócenia czasu trwania [[potencjał czynnościowy|potencjału czynnościowego]], zwłaszcza fazy 2, co powoduje zmiany repolaryzacji i wystąpienia zjawiska ''[[Pobudzenie nawrotne|reentry]]''<ref>{{Cytuj pismo | autor=Napolitano C, Priori SG | tytuł=Brugada syndrome | rok=2006 | czasopismo=Orphanet J Rare Dis | doi=10.1186/1750-1172-1-35 | wolumin= | oznaczenie=1 | pmid= 16972995 | strony=35}}</ref><ref>{{OMIM|id=601144|nazwa=BRUGADA SYNDROME 1}}</ref>. |
|||
==== Miotonia wrodzona Thomsena ==== |
|||
{{osobny artykuł|Choroba Thomsena}} |
|||
To choroba [[mięsień poprzecznie prążkowany|mięśni szkieletowych]] o podłożu leżą mutacyjnym w genie ''[[CLCN1]]'' znajdującym się na chromosomie 7q35, charakteryzujące się utrudnieniem wykonywania ruchu po dłuższym odpoczynku. Poprawa następuje po wykonaniu pierwszych kilku ruchów (''warm up''). Najczęściej zajęte schorzeniem są mięśnie dłoni, kończyn dolnych, żwaczy i powiek. Diagnostyka miotonii Thomsena opiera się na analizie rodowodu chorego i [[elektromiografia|badaniu EMG]], w którym obecność ciągów miotonicznych potwierdza chorobę<ref>{{Cytuj książkę | nazwisko= Podemski | imię=Ryszard Józef | autor link=Ryszard Józef Podemski | inni= | tytuł= Kompendium neurologii | data=2008 | wydawca=Via Medica | miejsce=Gdańsk | isbn=978-83-7555-054-2 | strony=504}}</ref>. |
|||
==== Pęcherzowe oddzielanie się naskórka ==== |
|||
{{Osobny artykuł|Pęcherzowe oddzielanie się naskórka}} |
|||
Grupa [[genodermatozy|genodermatoz]], których wspólną cechą jest występowanie [[pęcherz]]y wskutek urazów mechanicznych. Wyróżnia się trzy główne grupy, w zależności od miejsca tworzenia się pęcherza: w obrębie [[naskórek|naskórka]] (''EB simplex''), w obrębie [[błona podstawna|błony podstawnej]] (''EB junctionalis''), poniżej błony podstawnej, w [[skóra właściwa|skórze właściwej]] (''EB epidermolytica''). |
|||
===== Grupa ''epidermolysis bullosa simplex'' ===== |
|||
====== EB Webera-Cockayne'a ====== |
|||
Dziedziczona autosomalnie dominująco<ref>{{Cytuj|autor=Kana Yasukawa, Daisuke Sawamura, James R. McMillan, Hideki Nakamura, Hiroshi Shimizu|tytuł=Dominant and Recessive Compound Heterozygous Mutations in Epidermolysis Bullosa Simplex Demonstrate the Role of the Stutter Region in Keratin Intermediate Filament Assembly|czasopismo=Journal of Biological Chemistry|data=2002-06-28|data dostępu=2017-01-03|issn=0021-9258|wydanie=26|s=23670–23674|doi=10.1074/jbc.M200974200|pmid=11973334|url=http://www.jbc.org/content/277/26/23670|język=en}}</ref>. Etiopatogeneza: mutacja genu ''KRT14'' kodującego [[keratyna|keratynę]] 5 i 14 oraz defektem enzymów proteolitycznych<ref name="Fine">Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. ''The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB''. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations] http://www.jaad.org/article/S0190-9622(08)00208-9/abstract</ref>. Obraz kliniczny: zmiany występują najczęściej na stopach, rzadziej na dłoniach, pęcherze zwykle pojawiają się u dzieci w wieku około 18 miesięcy, gdy wykazują dużą aktywność ruchową. Zmiany mogą się ujawnić w późniejszym wieku, w późnym dzieciństwie albo u młodych dorosłych. Czynniki nasilające tworzenie pęcherzy to duża wilgotność, wzmożone pocenie się. [[Błona śluzowa|Błony śluzowe]] i płytki paznokciowe nie są zajęte<ref>Pfendner, E. G., Sadowski, S. G., Uitto, J. ''Epidermolysis bullosa simplex: recurrent and de novo mutations in the KRT5 and KRT14 genes, phenotype/genotype correlations, and implications for genetic counseling and prenatal diagnosis''. J. Invest. Derm. 125: 239-243, 2005. [PubMed: 16098032, related citations]</ref>. |
|||
====== EB Dowlinga-Meary (EB herpetiformis) ====== |
|||
Od innych chorób z grupy ''epidermolysis bullosa simplex'' różni się ciężkim przebiegiem i charakterystycznym obrazem w [[mikroskop elektronowy|mikroskopie elektronowym]] ([[cytoplazma]]tyczne "kępki" tonofilamentów). Tak jak typ Koebnera i typ Webera-Cockayne'a, typ Dowlinga-Meary EBS wiąże się z mutacjami w genach ''KRT5'' (region 12q13.13) i ''KRT14'' (region 17q21.2)<ref>Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. ''The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB''. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations]</ref>. Objawy<ref>{{OMIM|id=131900|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX, GENERALIZED}}</ref><ref>Hacham-Zadeh, S., Rappersberger, K., Livshin, R., Konrad, K. ''Epidermolysis bullosa herpetiformis Dowling-Meara in a large family''. J. Am. Acad. Derm. 18: 702-706, 1988. [PubMed: 3372762, related citations]</ref>: uogólnione tworzenie pęcherzy o opryszczkowatym (zgrupowanym) układzie (stąd inna nazwa schorzenia, ''epidermolysis bullosa simplex herpetiformis''), surowicze i krwotoczne pęcherze tworzą się w każdej lokalizacji, przede wszystkim jednak na stopach i podeszwach, dookoła ust, na karku i szyi. Czynnikami zaostrzającymi przebieg choroby są: [[gorączka]], pora roku (miesiące letnie), a także wiek (zmiany nasilają się z wiekiem). |
|||
====== EB wariant Koebnera ====== |
|||
Etiopatogeneza: mutacje w genach [[keratyna|keratyny]] 5 i 14 (''KRT4'', ''KRT15'')<ref name="Fine"/>. Ponieważ mutacje w tych samych genach odpowiadają za wystąpienie cech fenotypowych EBS typu Webera-Cockayne'a i typu Dowlinga-Meary, często cechy tych trzech chorób nakładają się na siebie. Zdarza się, że w obrębie jednej rodziny diagnozowano przypadki dwóch różnych typów EBS. Objawy: zmiany są hiperkeratotyczne, pęcherzowe, czasem pęcherze są krwotoczne, niekiedy tworzą się [[prosak]]i, mogą wystąpić zaburzenia pigmentacji (hipo- lub hiperpigmentacja) tak jak w odmianie Dowlinga-Meary, czasem zajęte są paznokcie i błony śluzowe<ref>{{OMIM|id=131960|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX WITH MOTTLED PIGMENTATION; EBSMP}}</ref>. |
|||
===== Grupa ''epidermolysis bullosa junctionalis'' ===== |
|||
====== EB Herlitza ====== |
|||
Postać śmiertelna, rzadka, dziedziczona autosomalnie recesywnie, spowodowana mutacją w jednym z genów kodujących trzy polipeptydy [[laminina|lamininy]] 5: α-3 (gen ''LAMA3''), β-3 (gen ''LAMB3''), albo γ-2 (gen ''LAMC2'')<ref>{{Cytuj|autor=F. J. D. Smith, R. a. J. Eady, I. M. Leigh, J. R. McMillan, E. L. Rugg|tytuł=Plectin deficiency results in muscular dystrophy with epidermolysis bullosa|czasopismo=Nature Genetics|data=1996-08-01|data dostępu=2017-01-03|wydanie=4|s=450–457|doi=10.1038/ng0896-450|url=http://www.nature.com/ng/journal/v13/n4/abs/ng0896-450.html|język=en}}</ref>. Obraz kliniczny: występowanie licznych pęcherzy, które łatwo pękają, pozostawiając rozległe [[nadżerka|nadżerki]] w obrębie całej skóry i błon śluzowych, również [[drogi oddechowe|dróg oddechowych]] (już wewnątrzmacicznie następuje tworzenie pęcherzy i nadżerek, tak że dziecko rodzi się z rozległymi ubytkami naskórka). Ręce i stopy są zwykle relatywnie najmniej dotknięte przez proces chorobowy. Nigdy nie występuje [[blizna|bliznowacenie]], [[syndaktylia]], nie tworzą się [[prosaki]]. W wieku około 6 miesięcy wokół ust bądź nosa tworzy się patognomoniczny, niegojący się [[strup]]<ref>Skoczylas M., Kordek A., Łoniewska B., Maleszka R., Rudnicki J., Problemy kliniczne u chorych na odmianę Herlitza pęcherzowego oddzielania się naskórka. Postępy Neonatologii 2011;2(17):54-56</ref><ref>{{OMIM|id= 226670|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX WITH MUSCULAR DYSTROPHY; EBSMD}}</ref>. |
|||
====== EB z atrezją odźwiernika ====== |
|||
Bardzo rzadka choroba, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genach ''ITGB4'' i ''ITGA6'', która skutkuje obniżoną ekspresją kodowanych przez te geny α6 i (lub) β4 integryny<ref>{{Cytuj|autor=S. Chavanas, Y. Gache, J. Vailly, J. Kanitakis, L. Pulkkinen|tytuł=Splicing Modulation of Integrin (β4 Pre-mRNA Carrying a Branch Point Mutation Underlies Epidermolysis Bullosa with Pyloric Atresia Undergoing Spontaneous Amelioration With Ageing|czasopismo=Human Molecular Genetics|data=1999-10-01|data dostępu=2017-01-03|issn=0964-6906|wydanie=11|s=2097–2105|doi=10.1093/hmg/8.11.2097|pmid=10484780|url=http://hmg.oxfordjournals.org/content/8/11/2097|język=en}}</ref><ref>{{Cytuj|autor=Frédérique Vidal, Daniel Aberdam, Corinne Miquel, Angela M. Christiano, Leena Pulkkinen|tytuł=Integrin β4 mutations associated with junctional epidermolysis bullosa with pyloric atresia|czasopismo=Nature Genetics|data=1995-06-01|data dostępu=2017-01-03|wydanie=2|s=229–234|doi=10.1038/ng0695-229|url=http://www.nature.com/ng/journal/v10/n2/abs/ng0695-229.html|język=en}}</ref>. Objawy: zmianom skórnym z reguły towarzyszy wrodzona [[atrezja]] [[odźwiernik]]a (rzadziej [[atrezja przełyku]] lub [[dwunastnica|dwunastnicy]]), dystrofia paznokci i anomalie w zakresie uzębienia, takie jak [[hipoplazja]] [[Szkliwo (anatomia)|szkliwa]]. Tworzenie pęcherzy jest uogólnione, rokowanie bardzo złe, mimo chirurgicznej interwencji; mutacja często jest letalna<ref>{{Cytuj|autor=L Ruzzi, L Gagnoux-Palacios, M Pinola, S Belli, G Meneguzzi|tytuł=A homozygous mutation in the integrin alpha6 gene in junctional epidermolysis bullosa with pyloric atresia.|czasopismo=The Journal of Clinical Investigation|data=1997-06-15|data dostępu=2017-01-03|issn=0021-9738|wydanie=12|doi=10.1172/JCI119474|pmid=9185503|pmc=508131|url=http://www.jci.org/articles/view/119474|język=en}}</ref><ref>{{OMIM|id= 226730 |nazwa=EPIDERMOLYSIS BULLOSA JUNCTIONALIS WITH PYLORIC ATRESIA}}</ref>. |
|||
===== Grupa ''epidermolysis bullosa dystrophica'' ===== |
|||
====== EB dystroficzna, postać Pasiniego ====== |
|||
Dziedziczona jest w sposób autosomalny dominujący. Obraz kliniczny: pęcherze ustępują z pozostawieniem drobnych, białawych wykwitów [[grudka|grudkowych]], umiejscowionych głównie na tułowiu w okolicy krzyżowej, zajęte są śluzówka jamy ustnej i zęby, paznokcie mogą być [[dystrofia|dystroficzne]]. W starszym wieku choroba może złagodzić swój przebieg<ref name="Fine"/><ref>{{OMIM|id=131750|nazwa=EPIDERMOLYSIS BULLOSA DYSTROPHICA, AUTOSOMAL DOMINANT; DDEB}}</ref>. |
|||
====== EB dystroficzna, postać Cockayne'a-Toureine'a ====== |
|||
Dziedziczona jest w sposób autosomalny dominujący. Wykwity głównie na kończynach, śluzówka i zęby zajęte w minimalnym stopniu<ref>{{Cytuj|autor=C. A. Oakley, D. J. Gawkrodger, J. A. Ross, J. A. Hunter|tytuł=The Cockayne-Touraine type of dominant dystrophic epidermolysis bullosa--ultrastructural similarities to the Pasini variant|czasopismo=Acta Dermato-Venereologica|data=1984-01-01|data dostępu=2017-01-03|issn=0001-5555|wydanie=3|s=253–256|pmid=6204490|url=https://www.ncbi.nlm.nih.gov/pubmed/6204490}}</ref>. |
|||
====== EB Hallopeau-Siemensa ====== |
|||
Podłoże molekularne: mutacja w genie kodującym [[kolagen]] typu VII (''COL7A1''). Objawy: charakterystyczne jest uogólnione tworzenie pęcherzy w momencie urodzenia lub we wczesnym niemowlęctwie, rozległe bliznowacenie, zmiany w obrębie skóry kończyn, [[pseudosyndaktylia]] dłoni i stóp, niekiedy są zajęte paznokcie i zęby, śluzówka przełyku (czego skutkiem jest [[zwężenie przełyku]]), stenoza cewki moczowej, odbytu, [[stulejka]], bliznowacenie rogówki lub spojówki. W EB Hallopeau-Siemensa wyraźnie zwiększone jest ryzyko wystąpienia [[rak kolczystokomórkowy skóry|raka kolczystokomórkowego skóry]]; nowotwór rozwija się na podłożu blizn<ref>{{Cytuj|autor=J. Diedrichson, D. Talanow, A. Safi|tytuł=[Epidermolysis bullosa dystrophica (Hallopeau-Siemens syndrome) of the hand -- surgical strategy and results]|czasopismo=Handchirurgie, Mikrochirurgie, Plastische Chirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Handchirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Mikrochirurgie Der Peripheren Nerven Und Gefasse: Organ Der V...|data=2005-10-01|data dostępu=2017-01-03|issn=0722-1819|wydanie=5|s=316–322|doi=10.1055/s-2005-872849|pmid=16287016|url=https://www.ncbi.nlm.nih.gov/pubmed/16287016}}</ref>. |
|||
==== Rodzinna polipowatość gruczolakowata ==== |
|||
[[Plik:Familial adenomatous polyposis as seen on sigmoidoscopy.jpg|130px|Endoskopowy obraz zmian w [[esica|esicy]] u pacjenta z FAP|thumb]] |
|||
{{Osobny artykuł|Rodzinna polipowatość gruczolakowata}} |
|||
Inne nazwy: {{ang.|''familial adenomatous polyposis'', '''''FAP'''''}}.<br /> |
|||
Choroba ta charakteryzująca się licznymi [[polip (medycyna)|polipami gruczolakowatymi]] [[jelito grube|jelita grubego]], powstającymi w 2. dekadzie życia. U nieleczonych chorych niemal we wszystkich przypadkach rozwija się [[rak jelita grubego]]. Etiopatogenezę na poziomie molekularnym stanowi mutacja [[antyonkogen]]u ''[[APC (gen)|APC]]'' (''adenomatous poliposis coli gene'') w ''[[locus]]'' [[chromosom 5|5q]]21-22. Mutacje te prowadzą do powstania nieprawidłowych, skróconych, [[Białka|białek]]<ref>Bisgaard ML, Fenger K, Bülow S, Niebuhr E, Mohr J: Familial adenomatous polyposis (FAP): frequency, penetrance, and mutation rate. Hum Mutat 1994, 3:121–125.</ref><ref>Rozen P, Samuel Z, Rabau M, Goldman G, Shomrat R, Legum C, Orr-Urtreger A : Familial adenomatous polyposis at the Tel Aviv Medical Center: demographic and clinical features. Fam Cancer 2001, 1:75–82.</ref>. W patomorfologii charakterystyczne są polipy gruczolakowate, zarówno cewkowe, kosmkowe jak i mieszane, makroskopowo przypominające powiększone [[grudki chłonne]] [[Okrężnica (anatomia)|okrężnicy]], co może być przyczyną nierozpoznania choroby w badaniu [[kolonoskopia|kolonoskopowym]]. W przebiegu choroby występują setki [[polip (medycyna)|polipów gruczolakowatych]] różnej wielkości w [[Okrężnica (anatomia)|okrężnicy]] i [[odbytnica|odbytnicy]]. U połowy pacjentów z FAP polipy są obecne w wieku 15 lat, a w wieku 35 lat u 95%<ref name="pmid25931827"/>. Oprócz tego może współistnieć [[polipowatość dna żołądka]] (ang. ''fundic gland polyps'', FGP), polipy dwunastnicy i gruczolaki jelita cienkiego, na ich podłożu mogą rozwijać się nowotwory złośliwe, z których najczęściej występującym w zespole polipowatości gruczolakowatej jest rak jelita grubego, którego ryzyko wynosi niemal 100%<ref name="pmid26265988">{{Cytuj pismo | nazwisko = Campos | imię = FG. | nazwisko2 = Sulbaran | imię2 = M. | nazwisko3 = Safatle-Ribeiro | imię3 = AV. | nazwisko4 = Martinez | imię4 = CA. | tytuł = Duodenal adenoma surveillance in patients with familial adenomatous polyposis | czasopismo = World J Gastrointest Endosc | wolumin = 7 | numer = 10 | strony = 950-9 | miesiąc = Aug | rok = 2015 | doi = 10.4253/wjge.v7.i10.950 | pmid = 26265988}}</ref>. U nieleczonych chorych rak jelita grubego powstaje przeciętnie w wieku 35 lat, a rzadko przed 20. rokiem życia<ref name="pmid25931827">{{Cytuj pismo | nazwisko = Leoz | imię = ML. | nazwisko2 = Carballal | imię2 = S. | nazwisko3 = Moreira | imię3 = L. | nazwisko4 = Ocaña | imię4 = T. | nazwisko5 = Balaguer | imię5 = F. | tytuł = The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management | czasopismo = Appl Clin Genet | wolumin = 8 | numer = | strony = 95-107 | miesiąc = | rok = 2015 | doi = 10.2147/TACG.S51484 | pmid = 25931827}}</ref>. Do innych nowotworów często występujących w przebiegu choroby należą: [[Nowotwory tarczycy|rak tarczycy]]<ref name="Jasperson"/><ref name="pmid22425061">{{Cytuj pismo | nazwisko = Steinhagen | imię = E. | nazwisko2 = Guillem | imię2 = JG. | nazwisko3 = Chang | imię3 = G. | nazwisko4 = Salo-Mullen | imię4 = EE. | nazwisko5 = Shia | imię5 = J. | tytuł = The prevalence of thyroid cancer and benign thyroid disease in patients with familial adenomatous polyposis may be higher than previously recognized | czasopismo = Clin Colorectal Cancer | wolumin = 11 | numer = 4 | strony = 304-8 | miesiąc = Dec | rok = 2012 | doi = 10.1016/j.clcc.2012.01.006 | pmid = 22425061}}</ref>, [[gruczolakorak jelita cienkiego]]<ref name="pmid11355321">{{Cytuj pismo | nazwisko = Kadmon | imię = M. | nazwisko2 = Tandara | imię2 = A. | nazwisko3 = Herfarth | imię3 = C. | tytuł = Duodenal adenomatosis in familial adenomatous polyposis coli. A review of the literature and results from the Heidelberg Polyposis Register. | czasopismo = Int J Colorectal Dis | wolumin = 16 | numer = 2 | strony = 63-75 | miesiąc = Apr | rok = 2001 | doi = | pmid = 11355321}}</ref><ref name="pmid19626156">{{Cytuj pismo | nazwisko = Dasari | imię = BV. | nazwisko2 = Gardiner | imię2 = KR. | tytuł = Management of adenocarcinoma of the small intestine. | czasopismo = Gastrointest Cancer Res | wolumin = 3 | numer = 3 | strony = 121-2 | miesiąc = May | rok = 2009 | doi = | pmid = 19626156}}</ref>, [[Wątrobiak zarodkowy|hepatoblastoma]]<ref name="pmid16317745">{{Cytuj pismo | nazwisko = Aretz | imię = S. | nazwisko2 = Koch | imię2 = A. | nazwisko3 = Uhlhaas | imię3 = S. | nazwisko4 = Friedl | imię4 = W. | nazwisko5 = Propping | imię5 = P. | tytuł = Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations? | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 811-8 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20698 | pmid = 16317745}}</ref><ref name="pmid18612695"/><ref name="pmid1329510">{{Cytuj pismo | nazwisko = Hughes | imię = LJ. | nazwisko2 = Michels | imię2 = VV. | tytuł = Risk of hepatoblastoma in familial adenomatous polyposis. | czasopismo = Am J Med Genet | wolumin = 43 | numer = 6 | strony = 1023-5 | miesiąc = Aug | rok = 1992 | doi = 10.1002/ajmg.1320430621 | pmid = 1329510}}</ref><ref name="pmid18612695"/><ref name="pmid16317745">{{Cytuj pismo | nazwisko = Aretz | imię = S. | nazwisko2 = Koch | imię2 = A. | nazwisko3 = Uhlhaas | imię3 = S. | nazwisko4 = Friedl | imię4 = W. | nazwisko5 = Propping | imię5 = P. | tytuł = Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations? | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 811-8 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20698 | pmid = 16317745}}</ref><ref name="pmid16106429">{{Cytuj pismo | nazwisko = Sanders | imię = RP. | nazwisko2 = Furman | imię2 = WL. | tytuł = Familial adenomatous polyposis in two brothers with hepatoblastoma: implications for diagnosis and screening | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 851-4 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20556 | pmid = 16106429}}</ref>, [[rak trzustki]]<ref name="Jasperson">{{Cytuj | autor= Kory W. Jasperson, Randall W. Burt | tytuł= [http://www.ncbi.nlm.nih.gov/books/NBK1345/ APC-Associated Polyposis Conditions]| data= 1998}}</ref><ref name="pmid8244108">{{Cytuj pismo | nazwisko = Giardiello | imię = FM. | nazwisko2 = Offerhaus | imię2 = GJ. | nazwisko3 = Lee | imię3 = DH. | nazwisko4 = Krush | imię4 = AJ. | nazwisko5 = Tersmette | imię5 = AC. | tytuł = Increased risk of thyroid and pancreatic carcinoma in familial adenomatous polyposis | czasopismo = Gut | wolumin = 34 | numer = 10 | strony = 1394-6 | miesiąc = Oct | rok = 1993 | doi = | pmid = 8244108}}</ref><ref name="pmid18612695"/><ref name="pmid12171972">{{Cytuj pismo | nazwisko = Maire | imię = F. | nazwisko2 = Hammel | imię2 = P. | nazwisko3 = Terris | imię3 = B. | nazwisko4 = Olschwang | imię4 = S. | nazwisko5 = O'Toole | imię5 = D. | tytuł = Intraductal papillary and mucinous pancreatic tumour: a new extracolonic tumour in familial adenomatous polyposis. | czasopismo = Gut | wolumin = 51 | numer = 3 | strony = 446-9 | miesiąc = Sep | rok = 2002 | doi = | pmid = 12171972}}</ref>, [[rak żołądka]]<ref name="Jasperson"/><ref name="pmid10370594">{{Cytuj pismo | nazwisko = Offerhaus | imię = GJ. | nazwisko2 = Entius | imię2 = MM. | nazwisko3 = Giardiello | imię3 = FM. | tytuł = Upper gastrointestinal polyps in familial adenomatous polyposis | czasopismo = Hepatogastroenterology | wolumin = 46 | numer = 26 | strony = 667-9 | miesiąc = | rok = | doi = | pmid = 10370594}}</ref><ref name="pmid18274437">{{Cytuj pismo | nazwisko = Garrean | imię = S. | nazwisko2 = Hering | imię2 = J. | nazwisko3 = Saied | imię3 = A. | nazwisko4 = Jani | imię4 = J. | nazwisko5 = Espat | imię5 = NJ. | tytuł = Gastric adenocarcinoma arising from fundic gland polyps in a patient with familial adenomatous polyposis syndrome. | czasopismo = Am Surg | wolumin = 74 | numer = 1 | strony = 79-83 | miesiąc = Jan | rok = 2008 | doi = | pmid = 18274437}}</ref>, [[Rak nadnercza|rak nadnerczy]]<ref name="pmid18612695"/>, [[Nowotwory ośrodkowego układu nerwowego|guzy mózgu]] – najczęstszym guzem [[Ośrodkowy układ nerwowy|OUN]] związany z FAP jest [[rdzeniak]], stanowi około 80% guzów związanych z zespołem FAP, ryzyko zachorowania w ciągu życia wynosi około 1%<ref name="Jasperson"/><ref name="pmid18612695"/>. W obrazie klinicznym mogą być widoczne zróżnicowane objawy pozajelitowe, takie jak<ref name="pmid18612695">{{Cytuj pismo | nazwisko = Groen | imię = EJ. | nazwisko2 = Roos | imię2 = A. | nazwisko3 = Muntinghe | imię3 = FL. | nazwisko4 = Enting | imię4 = RH. | nazwisko5 = de Vries | imię5 = J. | tytuł = Extra-intestinal manifestations of familial adenomatous polyposis | czasopismo = Ann Surg Oncol | wolumin = 15 | numer = 9 | strony = 2439-50 | miesiąc = Sep | rok = 2008 | doi = 10.1245/s10434-008-9981-3 | pmid = 18612695}}</ref>: [[kostniak]]i – występują u 20% chorych, zwykle w obrębie żuchwy i czaszki; nieprawidłowości uzębienia – występują u 17% chorych, nieprawidłowości obejmują [[Ząb nadliczbowy|zęby nadliczbowe]], wrodzone braki zębów, torbiele zębowe, [[odontoma|zębiaki]]; [[Guz desmoidalny|guzy desmoidalne]] – [[Nowotwór miejscowo złośliwy|miejscowo złośliwy guz]] najczęściej zlokalizowany w jamie brzusznej, tylko 10% z nich znajduje się poza jamą brzuszną. Często rosną do ogromnych rozmiarów, stanowią duże zagrożenie dla sąsiednich struktur; [[torbiel epidermoidalna|torbiele epidermoidalne]] – nie wykazują potencjału złośliwego, stanowią problem kosmetyczny<ref name="Jasperson"/>; [[wrodzona hipertrofia barwnikowa siatkówki]]. Odmiany FAP: '''[[Zespół Gardnera (gastrologia)|zespół Gardnera]]''' - w przebiegu choroby występują setki, a nawet tysiące polipów jelita grubego, którym towarzyszy powstawanie guzów mezodermalnych o typie [[kostniak]]ów, [[Guz desmoidalny|guzów desmoidalnych]], torbieli naskórkowych oraz przerostu nabłonka barwnikowego siatkówki (CHRPE, ang. ''Congenital Hypertrophy of the Retinal Pigment Epithelium''); '''[[zespół Turcota]]''' - współwystępują guzy mózgu i polipy okrężnicy; '''poronna postać FAP''' - mniej agresywny wariant FAP, w jego przebiegu powstaje mniej polipów (10-100) i rozwijają się one w późniejszym wieku<ref name=ojrd>{{Cytuj pismo | nazwisko = Half | imię = E. | nazwisko2 = Bercovich | imię2 = D. | nazwisko3 = Rozen | imię3 = P. | tytuł = Familial adenomatous polyposis | czasopismo = Orphanet J Rare Dis | wolumin = 4 | numer = 1 | strony = 22 | miesiąc = Oct | rok = 2009 | doi = 10.1186/1750-1172-4-22 | pmid = 19822006}}</ref>. Ryzyko nowotworu złośliwego jest mniejsze i nie przekracza 70%<ref name="pmid25931827"/>. |
|||
==== Zespół Costello ==== |
|||
[[Plik:Costello syndrome facial manifestation 17-year-old female.png|thumb|140px|Costello syndrome facial manifestation 17-year-old female|17-letnia kobieta ze zdiagnozowanym zespołem Costello (grube rysy twarzy, rzadkie włosy, duże usta, grube wargi, luźna skóra){{r|Sriboonnark}}]] |
|||
{{Osobny artykuł|Zespół Costello}} |
|||
Inne nazwy: {{łac.|syndroma Costello}}, {{ang.|Costello syndrome, faciocutaneoskeletal syndrome, FCS syndrome}}.<br />To choroba genetyczna i zespół wad wrodzonych, dziedzicząca się autosomalnie dominująco, która spowodowana jest uszkodzeniem genu HRAS zlokalizowanego na ramieniu krótkim [[chromosom 11|chromosomu 11]], w regionie p15{{r|OMIM5}}. GTP-aza kodowana przez gen HRAS bierze udział w szlaku Ras–[[Kinazy aktywowane mitogenami|MAPK]]{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=24}}. Zespół Costello jest zespołem genetycznym dziedziczonym autosomalnie dominująco, z pełną [[penetracja (genetyka)|penetracją]] genu{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=20}}{{r|Orphanet2}}{{r|Pelc}}. Częstość występowania: 1 na 24 000 000 żywych urodzeń{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=20}}. Charakterystyczne cechy fenotypowe osoby chorej: [[niedobór wzrostu]], opóźniony rozwój psychoruchowy, nadmierna wiotkość małych [[staw (anatomia)|stawów]], hiperpigmentacja skóry, charakterystyczny wygląd twarzy oraz niepełnosprawność intelektualna{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=22}}. Wśród objawów występują liczne zaburzenia kardiologiczne (np. [[zwężenie drogi odpływu prawej komory]]), [[gastroenterologia|gastroenterologiczne]] (np. [[przerostowe zwężenie odźwiernika]]), ortopedyczne (np. deformacja [[klatka piersiowa|klatki piersiowej]]) i neurologiczne (np. [[napad padaczkowy|napady padaczkowe]]){{r|Orphanet2}}. |
|||
==== Zespół Crouzona ==== |
|||
{{osobny artykuł|Zespół Crouzona}} |
|||
Zespół Crouzona, inaczej dysostoza czaszkowo-twarzowa ([[Łacina|łac.]] ''dysostosis craniofacialis'') to choroba genetyczna o najprawdopodobniej [[Dziedziczenie autosomalne dominujące|autosomalnym dominującym]] typie dziedziczenia{{odn|Boczkowski|1990|s=284}}. Spowodowana jest mutacją w genie ''FGFR2'' kodującym receptor czynnika wzrostu fibroblastów (ang. fibroblast growth factor receptor-2) w ''locus'' [[Chromosom 10|10q]]26<ref>{{OMIM|id=176943|nazwa=FIBROBLAST GROWTH FACTOR RECEPTOR 2; FGFR2}}</ref>. Objawia się licznymi deformacjami twarzy, m.in.: „gotyckim” podniebieniem, nisko osadzonymi uszami, hiperteloryzmem, wytrzeszczem [[Oko|gałek ocznych]] (łac. ''proptosis'') prowadzącym do zaniku [[Nerw wzrokowy|nerwu wzrokowego]], [[Hipoplazja|hipoplazją]] [[Szczęka|szczęki]] (pozorny [[prognatyzm]]) i nieprawidłowym uzębieniem. |
|||
==== Zespół Lyncha ==== |
|||
{{osobny artykuł|Zespół Lyncha}} |
|||
To dziedziczny rak jelita grubego niezwiązany z polipowatością<ref>{{cytuj stronę|url=http://www.puo.pl/pdf/rak_jelita_grubego.pdf|tytuł=Rak jelita grubego|autor=Marek P. Nowacki (red.)|archiwum=http://web.archive.org/web/20130923173744/http://www.puo.pl/pdf/rak_jelita_grubego.pdf|zarchiwizowano=2013-09-23}}</ref> ({{ang.|hereditary non-polyposis colorectal cancer, HNPCC}}), stanowiący około 1-3% wszystkich [[rak jelita grubego|raków jelita grubego]]<ref name="pmid19375789">{{Cytuj pismo | nazwisko = Resnick | imię = KE. | nazwisko2 = Hampel | imię2 = H. | nazwisko3 = Fishel | imię3 = R. | nazwisko4 = Cohn | imię4 = DE. | tytuł = Current and emerging trends in Lynch syndrome identification in women with endometrial cancer. | czasopismo = Gynecol Oncol | wolumin = 114 | numer = 1 | strony = 128-34 | miesiąc = Jul | rok = 2009 | doi = 10.1016/j.ygyno.2009.03.003 | pmid = 19375789}}</ref><ref name="pmid16136383">{{Cytuj pismo | nazwisko = de la Chapelle | imię = A. | tytuł = The incidence of Lynch syndrome. | czasopismo = Fam Cancer | wolumin = 4 | numer = 3 | strony = 233-7 | miesiąc = | rok = 2005 | doi = 10.1007/s10689-004-5811-3 | pmid = 16136383}}</ref>. Średni wiek wystąpienia [[nowotwór złośliwy|nowotworu złośliwego]] [[jelito grube|jelita grubego]] wynosi około 44 lata<ref name="pmid24533633">{{Cytuj pismo | nazwisko = Baiocchi | imię = GL. | nazwisko2 = Portolani | imię2 = N. | nazwisko3 = Vermi | imię3 = W. | nazwisko4 = Baronchelli | imię4 = C. | nazwisko5 = Gheza | imię5 = F. | tytuł = Lynch syndrome from a surgeon perspective: retrospective study of clinical impact of mismatch repair protein expression analysis in colorectal cancer patients less than 50 years old. | czasopismo = BMC Surg | wolumin = 14 | numer = | strony = 9 | miesiąc = | rok = 2014 | doi = 10.1186/1471-2482-14-9 | pmid = 24533633}}</ref>. Zespół wiąże się z 80% ryzykiem zachorowania na raka jelita grubego<ref name="pmid12667026">{{Cytuj pismo | nazwisko = Chung | imię = DC. | nazwisko2 = Rustgi | imię2 = AK. | tytuł = The hereditary nonpolyposis colorectal cancer syndrome: genetics and clinical implications. | czasopismo = Ann Intern Med | wolumin = 138 | numer = 7 | strony = 560-70 | miesiąc = Apr | rok = 2003 | doi = | pmid = 12667026}}</ref>. Najczęściej stwierdza się mutacje genów ''hMSH2''((human mutS homolog 2) w ''locus'' [[chromosom 2|2p]]21-22) i ''hMLH1'' ((human mutL homolog 1) w ''locus'' [[chromosom 3|3p]]21.3-23)<ref>{{cytuj książkę|autor=M. Nowacki (red.)|tytuł=Nowotwory jelita grubego|wydawca=Wydawnictwo Wiedza i Życie|miejsce=Warszawa|data=1996|isbn=83-86805-86-2}}</ref>. Dziedziczenie zespołu jest [[dziedziczenie autosomalne dominujące|autosomalne dominujące]]. W przeważającej części (około 70% przypadków) rak występuje w prawej połowie [[Okrężnica (anatomia)|okrężnicy]]<ref name="pmid12621137">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = de la Chapelle | imię2 = A. | tytuł = Hereditary colorectal cancer. | url = http://www.nejm.org/doi/full/10.1056/NEJMra012242 | czasopismo = N Engl J Med | wolumin = 348 | numer = 10 | strony = 919-32 | miesiąc = Mar | rok = 2003 | doi = 10.1056/NEJMra012242 | pmid = 12621137}}</ref><ref name="pmid19654196">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = Lynch | imię2 = JF. | nazwisko3 = Attard | imię3 = TA. | tytuł = Diagnosis and management of hereditary colorectal cancer syndromes: Lynch syndrome as a model. | czasopismo = CMAJ | wolumin = 181 | numer = 5 | strony = 273-80 | miesiąc = Sep | rok = 2009 | doi = 10.1503/cmaj.071574 | pmid = 19654196}}</ref>. Występują dwie różniące się od siebie postacie choroby: zespół Lyncha I – rak dotyczy tylko [[jelito grube|jelita grubego]]; zespół Lyncha II – z rakiem jelita grubego współistnieją [[nowotwór złośliwy|nowotwory złośliwe]] [[rak trzonu macicy|trzonu macicy]], [[rak jajnika|jajnika]], [[rak żołądka człowieka|żołądka]], [[Gruczolakorak jelita cienkiego|jelita cienkiego]], [[rak nerki|nerek]], [[rak moczowodu|moczowodu]], a rzadziej [[rak podstawnokomórkowy skóry|skóry]], [[Rak dróg żółciowych|dróg żółciowych]] i [[Nowotwory ośrodkowego układu nerwowego|guzy centralnego układu nerwowego]]<ref name="pmid2804907">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = Smyrk | imię2 = TC. | nazwisko3 = Lynch | imię3 = PM. | nazwisko4 = Lanspa | imię4 = SJ. | nazwisko5 = Boman | imię5 = BM. | tytuł = Adenocarcinoma of the small bowel in lynch syndrome II. | czasopismo = Cancer | wolumin = 64 | numer = 10 | strony = 2178-83 | miesiąc = Nov | rok = 1989 | doi = | pmid = 2804907}}</ref><ref name="pmid8612988">{{Cytuj pismo | nazwisko = Vasen | imię = HF. | nazwisko2 = Wijnen | imię2 = JT. | nazwisko3 = Menko | imię3 = FH. | nazwisko4 = Kleibeuker | imię4 = JH. | nazwisko5 = Taal | imię5 = BG. | tytuł = Cancer risk in families with hereditary nonpolyposis colorectal cancer diagnosed by mutation analysis. | czasopismo = Gastroenterology | wolumin = 110 | numer = 4 | strony = 1020-7 | miesiąc = Apr | rok = 1996 | doi = | pmid = 8612988}}</ref><ref name="pmid10188721">{{Cytuj pismo | nazwisko = Aarnio | imię = M. | nazwisko2 = Sankila | imię2 = R. | nazwisko3 = Pukkala | imię3 = E. | nazwisko4 = Salovaara | imię4 = R. | nazwisko5 = Aaltonen | imię5 = LA. | tytuł = Cancer risk in mutation carriers of DNA-mismatch-repair genes. | czasopismo = Int J Cancer | wolumin = 81 | numer = 2 | strony = 214-8 | miesiąc = Apr | rok = 1999 | doi = | pmid = 10188721}}</ref><ref name="pmid12624141">{{Cytuj pismo | nazwisko = Parc | imię = Y. | nazwisko2 = Boisson | imię2 = C. | nazwisko3 = Thomas | imię3 = G. | nazwisko4 = Olschwang | imię4 = S. | tytuł = Cancer risk in 348 French MSH2 or MLH1 gene carriers. | czasopismo = J Med Genet | wolumin = 40 | numer = 3 | strony = 208-13 | miesiąc = Mar | rok = 2003 | doi = | pmid = 12624141}}</ref>. |
|||
==== Zespół Morgagniego-Stewarta-Morela ==== |
|||
{{Osobny artykuł|Zespół Morgagniego-Stewarta-Morela}} |
|||
Inne nazwy: {{ang.|Morgagni-Stewart-Morel syndrome, Morgagni's trias}}<ref>Henschen F: Morgagni’s syndrome. Jena, 1937.</ref>, [[Łacina|łac.]] ''hyperostosis frontalis interna''.<br />Jest to rzadka choroba genetyczna o nie do końca poznanej etiologii i etiopatogenezie, dziedziczona autosomalnie dominująco<ref>{{Cytuj pismo | autor=Koller MF, Papassotiropoulos A, Henke K, Behrends B, Noda S, Kratzer A, Hock C, Hofmann M | tytuł=Evidence of a genetic basis of Morgagni-Stewart-Morel syndrome. A case report of identical twins| rok=2005 | czasopismo=Neuro-degenerative diseases | doi=10.1159/000089284 | wydanie=2 | wolumin=2 | miesiąc= | pmid= 16909048 | strony=56–60}} |
|||
</ref><ref>Knies PT, Le Fever HE. Metabolic craniopathy: hyperostosis frontalis interna. ''Ann Intern Med'' 14: 1858-1892 (1941)</ref>, związana z przerostem i nadreaktywnością kory [[nadnercze|nadnerczy]] wskutek nadmiernego wydzielania [[hormon adrenokortykotropowy|ACTH]]. Sugerowano również związek objawów z podwyższonymi poziomami [[prolaktyna|prolaktyny]], ponieważ w populacji kobiet z [[mlekotok]]iem na tym tle ''hyperostosis frontalis'' występowała w 43% przypadków<ref>{{Cytuj pismo | autor=Pawlikowski M, Komorowski J | tytuł=Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome| rok=1983 | czasopismo=Lancet | doi= | wydanie=1 | wolumin=8322 | miesiąc=luty | pmid= 6131191 | strony=474}}</ref>. Na obraz kliniczny składają się objawy, takie jak: [[otyłość]], przerost wewnętrznej powierzchni [[kość czołowa|kości czołowej]] (''hyperostosis frontalis interna'')<ref>Stewart RM: ''Localized cranial hyperostosis in insane.'' Journal of Neurology and Psychopathology 8, 321 (1928).</ref>, [[Maskulinizacja|wirylizm]] i [[hirsutyzm]]<ref>Morgagni GB: ''Adversaria anatomica. VI. Animadversio 74.'' Padwa, 1719.</ref><ref>Morgagni GB: ''De sedibus et causis morborum.Liv II.'' Wenecja, 1761.</ref>, [[brak miesiączki]]<ref>Morel F: ''L'hyperostose frontale interne. Syndrome de l'hyperostose frontale interne avec adipose et troubles cérébraux.'' Paryż, 1930.</ref>, zaburzenia tolerancji glukozy, [[cukrzyca]], [[hiperfagia|polifagia]], [[polidypsja]], [[wielomocz|poliuria]]<ref>{{WhoNamedIt|synd|1746|Morgagni-Stewart-Morel syndrome}}</ref><ref>Pawlikowski, M., Komorowski, J. Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome. (Letter) Lancet 321: 474 only, 1983. Note: Originally Volume I..</ref>. Objawy podmiotowe stanowią: [[zmęczenie]], [[somnolencja|senność]], zaburzenia widzenia, [[zawroty głowy|zawroty]] i [[ból głowy|bóle głowy]], [[Szumy uszne|dzwonienie w uszach]], zaburzenia węchu. Mogą występować zaburzenia psychiczne, spowodowane przerostem kości czołowych i rozpoznawane jako [[zespół czołowy]]<ref>Psychiatria. Podręcznik dla studentów medycyny. Bilikiewicz A (red.). Wydanie III Wydawnictwo Lekarskie PZWL, Warszawa 2006 s. 150 {{ISBN|83-200-3388-8}}</ref>. |
|||
==== Zespół Nagera ==== |
|||
{{osobny artykuł|Zespół Nagera}} |
|||
[[Dziedziczenie autosomalne dominujące|Dziedziczona autosomalnie dominująco]] choroba z grupy [[dyzostozy kończynowo-twarzowe|dyzostoz kończynowo-twarzowych]]{{r|Fakim}}, wynik zaburzeń kształtowania się drugiej i trzeciej [[kieszonki skrzelowe]]j oraz [[zawiązek|zawiązków]] kończyn podczas rozwoju embrionalnego{{r|Fakim}}. Spowodowana jest uszkodzeniem [[gen]]u SF3B4 znajdującego się na długim ramieniu [[chromosom 1|chromosomu 1]], w regionie q21{{r|Smigiel}}. Gen SF3B4 koduje nukleoproteinę U2 [[splicesom]]u{{r|Smigiel}}, który bierze udział w regulacji genów wczesnej [[embriogeneza|embriogenezy]] poprzez [[splicing|wycinanie sekwencji niekodujących (splicing)]] z [[pre-mRNA|prekursorowego mRNA]] oraz w specjalizacji tkanek{{r|Smigiel}}. Obraz kliniczny stanowią objawy, takie jak: zaburzenia rozwoju [[czaszka|twarzoczaszki]] (hipoplazja [[łuk jarzmowy|łuków jarzmowych]], [[mikrognacja]], małe i obrócone ku tyłowi [[małżowina uszna|małżowiny uszne]]) oraz brak [[kciuk]]ów, niedorozwój [[krtań|krtani]], [[głuchota]], niedorozwój [[przewód słuchowy zewnętrzny|przewodów słuchowych zewnętrznych]], bez objawów [[niepełnosprawność intelektualna|niepełnosprawności intelektualnej]]{{r|Smigiel}}. |
|||
==== Zespół Tourette'a ==== |
|||
{{osobny artykuł|Zespół Tourette'a}} |
|||
Jest to choroba dziedziczona w sposób autosomalny dominujący. Skutkiem mutacji są zmiany w niezidentyfikowanych genach. Część przypadków można wyjaśnić zaburzeniami w syntezie [[Histamina|histaminy]]<ref>Sonya Collins: Treating Tourette's: Histamine Gene May Be Behind Some Tic Disorders. Scientific American, 2011-05-17. [dostęp 2015-10-08].</ref><ref>Sonya Collins. ''Terapia zespołu Tourette'a''. „Świat Nauki”. nr 7 (239), s. 8, lipiec 2011. Prószyński Media. ISSN 0867-6380.</ref>. Objawami klinicznymi są [[tiki]] (w tym wokalne) i zachowania obsesyjne, pojawia się zjawisko [[Echolalia (psychopatologia)|echolalii]]. Występuje w nim szereg neurologiczno-psychicznych objawów o niewyjaśnionym podłożu<ref>Adam Bilikiewicz, Stanisław Pużyński, Jacek Wciórka, Janusz Rybakowski: ''Psychiatria''. T. 2. Wrocław: Urban & Parner, 2003. {{ISBN|83-87944-72-6}}. </ref>. Choroba pojawia się przed 18 rokiem życia i nasila z wiekiem. Nasilenie objawów bywa bardzo różne (wiele nie wymaga leczenia). |
|||
=== Autosomalne recesywne === |
|||
Większość z opisanych dotychczas chorób jest dziedziczona autosomalnie recesywnie<ref name="Dubert" />, choć jeszcze wiele z nich prawdopodobnie nie zostało poznanych{{odn|Boczkowski|1990|s=114}}. Wiąże się to z tym, że aby cecha warunkowana przez allel recesywny się ujawniła, obie wersje genu muszą być wadliwe (zmutowane). Dotknięci chorobą mają zwykle zdrowych rodziców, którzy posiadają po jednym zmutowanym allelu (i są określani jako nosiciele)<ref>{{Cytuj książkę|url=http://link.springer.com/10.1007/978-3-319-17819-6|tytuł=http://link.springer.com/10.1007/978-3-319-17819-6|nazwisko=Khan Mohammad Beigi|imię=Pooya|nazwisko2=Maverakis|imie22=Emanual|doi=10.1007/978-3-319-17819-6}}</ref>. Jeśli jest dwoje zdrowych rodziców, z których każdy ma jedną kopię zmutowanego genu, to ryzyko posiadania dzieci dotkniętych zaburzeniem wynosi 25% z każdej ciążym<ref name=Wade>{{Cytuj pismo|autor= Wade, Nicholas|tytuł=Japanese Scientists Identify Ear Wax Gene| pismo=New York Times|data= January 29, 2006}}</ref><ref name=Yoshiura>{{Cytuj pismo|autor=Yoshiura K|autor2=Kinoshita A|autor3=Ishida T|tytuł=A SNP in the ABCC11 gene is the determinant of human earwax type |pismo=Nat. Genet. |wolumin=38 |wydanie=3 |strony=324–30 |data=March 2006 |pmid=16444273 |doi=10.1038/ng1733}}</ref>. |
|||
==== Alfa-mannozydoza ==== |
|||
{{Osobny artykuł|Alfa-mannozydoza}} |
{{Osobny artykuł|Alfa-mannozydoza}} |
||
| Linia 225: | Linia 367: | ||
</ref>. Do objawów klinicznych należą: [[Pierwotne niedobory odporności|pierwotny niedobór odporności]], nieprawidłowości szkieletu (np. [[stopa końsko-szpotawa]]) i [[Wady wrodzone#Cechy dysmorficzne|cechami dysmorficznymi]] twarzy, upośledzenie słuchu, [[makroglosja]] i opóźnienie umysłowe. Chorobę opisał Ockerman w 1967 roku<ref>Ockerman PA. A generalized storage disorder resembling Hurler's syndrome. Lancet 2: 239–241, 1967.</ref><ref>{{Cytuj pismo | autor=Malm D, Nilssen O | tytuł=Alpha-mannosidosis | rok=2008 | czasopismo=Orphanet J Rare Dis | doi=10.1186/1750-1172-3-21 | wolumin=1 | oznaczenie=3 | pmid= 18651971 | strony=21}}</ref>. |
</ref>. Do objawów klinicznych należą: [[Pierwotne niedobory odporności|pierwotny niedobór odporności]], nieprawidłowości szkieletu (np. [[stopa końsko-szpotawa]]) i [[Wady wrodzone#Cechy dysmorficzne|cechami dysmorficznymi]] twarzy, upośledzenie słuchu, [[makroglosja]] i opóźnienie umysłowe. Chorobę opisał Ockerman w 1967 roku<ref>Ockerman PA. A generalized storage disorder resembling Hurler's syndrome. Lancet 2: 239–241, 1967.</ref><ref>{{Cytuj pismo | autor=Malm D, Nilssen O | tytuł=Alpha-mannosidosis | rok=2008 | czasopismo=Orphanet J Rare Dis | doi=10.1186/1750-1172-3-21 | wolumin=1 | oznaczenie=3 | pmid= 18651971 | strony=21}}</ref>. |
||
=== Alkaptonuria === |
==== Alkaptonuria ==== |
||
{{osobny artykuł|Alkaptonuria}} |
{{osobny artykuł|Alkaptonuria}} |
||
Rzadka, genetycznie uwarunkowana choroba polegająca na enzymatycznym defekcie metabolicznym w szlaku przemian [[aminokwasy|aminokwasów]] aromatycznych: [[tyrozyna|tyrozyny]] i [[fenyloalanina|fenyloalaniny]]<ref>{{Cytuj|tytuł=Alkaptonuria|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/choroby-od-a-do-z/choroby-genetyczne,alkaptonuria,artykul,1696108.html}}</ref>. Alkaptonuria jest dziedziczona w sposób autosomalny recesywny i charakteryzuje się wydalaniem z [[mocz]]em dużych ilości [[Kwas homogentyzynowy|kwasu homogentyzynowego]] (ciemniejącego na powietrzu<ref>{{Cytuj|autor=K. Ziaja|tytuł=Choroby rzadkie: Alkaptonuria - choroba czarnego moczu|data dostępu=2016-12-17|opublikowany=Choroby rzadkie|url=http://chorobyrzadkie.blogspot.com/2015/02/alkaptonuria-choroba-czarnego-moczu.html}}</ref>), niebieskawo-czarnym zabarwieniem [[Tkanka łączna|tkanki łącznej]] (ochronoza)<ref>{{Cytuj|tytuł=Obraz kliniczny alkaptonurii i ochronozy|czasopismo=Reumatologia/Rheumatology|data dostępu=2016-12-17|issn=0034-6233|url=http://www.termedia.pl/Obraz-kliniczny-alkaptonurii-i-ochronozy,18,19227,0,0.html}}</ref> oraz zmianami zwyrodnieniowymi stawów i [[Kręgosłup człowieka|kręgosłupa]]. [[Mutacja|Mutacje]] dotyczą genu [[oksydaza kwasu homogentyzynowego|oksydazy kwasu homogentyzynowego]] (HGD), zlokalizowanego na [[Chromosom 3|chromosomie 3]] (3q13.33)<ref name="omim">{{cytuj stronę | url = http://omim.org/entry/607474 | tytuł = Online Mendelian Inheritance in Man (OMIM)| data dostępu = 2013-01-25 | autor = | opublikowany = | praca = | data = | język = en}}</ref><ref>{{Cytuj książkę | nazwisko = Kucharz | imię = Eugeniusz | tytuł = Reumatologia ( w ''Wielka Interna'') | data = 2011 | wydawca = Medical Tribune Polska | miejsce = Warszawa | isbn = 978-83-62597-06-2 | strony = 375-377}}</ref>. |
Rzadka, genetycznie uwarunkowana choroba polegająca na enzymatycznym defekcie metabolicznym w szlaku przemian [[aminokwasy|aminokwasów]] aromatycznych: [[tyrozyna|tyrozyny]] i [[fenyloalanina|fenyloalaniny]]<ref>{{Cytuj|tytuł=Alkaptonuria|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/choroby-od-a-do-z/choroby-genetyczne,alkaptonuria,artykul,1696108.html}}</ref>. Alkaptonuria jest dziedziczona w sposób autosomalny recesywny i charakteryzuje się wydalaniem z [[mocz]]em dużych ilości [[Kwas homogentyzynowy|kwasu homogentyzynowego]] (ciemniejącego na powietrzu<ref>{{Cytuj|autor=K. Ziaja|tytuł=Choroby rzadkie: Alkaptonuria - choroba czarnego moczu|data dostępu=2016-12-17|opublikowany=Choroby rzadkie|url=http://chorobyrzadkie.blogspot.com/2015/02/alkaptonuria-choroba-czarnego-moczu.html}}</ref>), niebieskawo-czarnym zabarwieniem [[Tkanka łączna|tkanki łącznej]] (ochronoza)<ref>{{Cytuj|tytuł=Obraz kliniczny alkaptonurii i ochronozy|czasopismo=Reumatologia/Rheumatology|data dostępu=2016-12-17|issn=0034-6233|url=http://www.termedia.pl/Obraz-kliniczny-alkaptonurii-i-ochronozy,18,19227,0,0.html}}</ref> oraz zmianami zwyrodnieniowymi stawów i [[Kręgosłup człowieka|kręgosłupa]]. [[Mutacja|Mutacje]] dotyczą genu [[oksydaza kwasu homogentyzynowego|oksydazy kwasu homogentyzynowego]] (HGD), zlokalizowanego na [[Chromosom 3|chromosomie 3]] (3q13.33)<ref name="omim">{{cytuj stronę | url = http://omim.org/entry/607474 | tytuł = Online Mendelian Inheritance in Man (OMIM)| data dostępu = 2013-01-25 | autor = | opublikowany = | praca = | data = | język = en}}</ref><ref>{{Cytuj książkę | nazwisko = Kucharz | imię = Eugeniusz | tytuł = Reumatologia ( w ''Wielka Interna'') | data = 2011 | wydawca = Medical Tribune Polska | miejsce = Warszawa | isbn = 978-83-62597-06-2 | strony = 375-377}}</ref>. |
||
=== Analgezja wrodzona === |
==== Analgezja wrodzona ==== |
||
{{osobny artykuł|Analgezja wrodzona}} |
{{osobny artykuł|Analgezja wrodzona}} |
||
Rzadka choroba spowodowana mutacją w genie ''[[SCN9A]]'' w locus [[chromosom 2|2q]]24<ref name="pmid18060017">{{Cytuj pismo | autor=Drenth JP, Waxman SG | tytuł=Mutations in sodium-channel gene SCN9A cause a spectrum of human genetic pain disorders | rok=2007 | czasopismo=The Journal of clinical investigation | doi=10.1172/JCI33297 | wydanie=117 | wolumin=12 | miesiąc=grudzień | pmid= 18060017 | strony=3603–9}}</ref>, który odpowiada za przekazywanie pomiędzy [[neuron|komórkami nerwowymi]] impulsów bólowych do [[Kresomózgowie|mózgu]]. Dziedziczona jest autosomalnie recesywnie<ref>{{Cytuj|autor=Yp Goldberg, Sn Pimstone, R Namdari, N Price, C Cohen|tytuł=Human Mendelian pain disorders: a key to discovery and validation of novel analgesics|czasopismo=Clinical Genetics|data=2012-10-01|data dostępu=2016-12-30|issn=1399-0004|wydanie=4|s=367–373|doi=10.1111/j.1399-0004.2012.01942.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2012.01942.x/abstract|język=en}}</ref>. Chorzy są zdolni do odbioru bodźców pozabólowych: dotyku, ciepła, zimna, łaskotania. Nie odczuwają jednak żadnych czynników bólowych, co może stwarzać zagrożenie życia<ref>{{OMIM|id=243000|nazwa=INDIFFERENCE TO PAIN, CONGENITAL, AUTOSOMAL RECESSIVE}}</ref>. Dzieci dotknięte chorobą mogą osiągnąć wiek dojrzały, ale ich przewidywana długość życia jest dużo krótsza od reszty populacji z uwagi na brak reakcji na stany zagrażające zdrowiu i życiu, np.: oparzenie, skaleczenie, złamanie nogi. |
Rzadka choroba spowodowana mutacją w genie ''[[SCN9A]]'' w locus [[chromosom 2|2q]]24<ref name="pmid18060017">{{Cytuj pismo | autor=Drenth JP, Waxman SG | tytuł=Mutations in sodium-channel gene SCN9A cause a spectrum of human genetic pain disorders | rok=2007 | czasopismo=The Journal of clinical investigation | doi=10.1172/JCI33297 | wydanie=117 | wolumin=12 | miesiąc=grudzień | pmid= 18060017 | strony=3603–9}}</ref>, który odpowiada za przekazywanie pomiędzy [[neuron|komórkami nerwowymi]] impulsów bólowych do [[Kresomózgowie|mózgu]]. Dziedziczona jest autosomalnie recesywnie<ref>{{Cytuj|autor=Yp Goldberg, Sn Pimstone, R Namdari, N Price, C Cohen|tytuł=Human Mendelian pain disorders: a key to discovery and validation of novel analgesics|czasopismo=Clinical Genetics|data=2012-10-01|data dostępu=2016-12-30|issn=1399-0004|wydanie=4|s=367–373|doi=10.1111/j.1399-0004.2012.01942.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2012.01942.x/abstract|język=en}}</ref>. Chorzy są zdolni do odbioru bodźców pozabólowych: dotyku, ciepła, zimna, łaskotania. Nie odczuwają jednak żadnych czynników bólowych, co może stwarzać zagrożenie życia<ref>{{OMIM|id=243000|nazwa=INDIFFERENCE TO PAIN, CONGENITAL, AUTOSOMAL RECESSIVE}}</ref>. Dzieci dotknięte chorobą mogą osiągnąć wiek dojrzały, ale ich przewidywana długość życia jest dużo krótsza od reszty populacji z uwagi na brak reakcji na stany zagrażające zdrowiu i życiu, np.: oparzenie, skaleczenie, złamanie nogi. |
||
=== Anemia sierpowata === |
==== Anemia sierpowata ==== |
||
{{osobny artykuł|Anemia sierpowata}} |
{{osobny artykuł|Anemia sierpowata}} |
||
Anemia sierpowata to rodzaj wrodzonej anemii (niedokrwistości) polegającej na wadzie budowy hemoglobiny<ref>{{Cytuj|tytuł=Anemia Sierpowata - przyczyny, objawy, leczenie, diagnoza anemii|czasopismo=ZdrowyPortal.org - Portal o Zdrowiu|data=2015-03-25|data dostępu=2016-12-17|url=http://www.zdrowyportal.org/136/anemia-sierpowata/|język=pl-PL}}</ref>. Mutacja punktowa w genie β-globiny powoduje zmianę pojedynczego aminokwasu w sekwencji białka (z [[Kwas glutaminowy|kwasu glutaminowego]] na [[Walina|walinę]]). Hemoglobinę z taką mutacją określa się jako hemoglobinę S (HbS) w przeciwieństwie do normalnej hemoglobiny A (HbA) u dorosłych. Choroba dziedziczy się w sposób autosomalny (nie jest sprzężona z płcią) i częściowo recesywny – nosiciele tylko jednej kopii wadliwego genu (heterozygoty) zwykle nie mają objawów klinicznych, choć ich erytrocyty zawierają ok. 40% HbS<ref>{{Cytuj|tytuł=Anemia sierpowata: dziedziczna, nieuleczalna, śmiertelna|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/zdrowie/zdrowie-dla-kazdego,anemia-sierpowata---przyczyny--objawy--leczenie,artykul,1715931.html}}</ref>. [[Heterozygota|Heterozygoty]] są również w dużym stopniu odporne na malarię. Zjawisko takie nazywa się przewagą heterozygot lub [[naddominacja|naddominacją]]. Naddominacja powoduje, że na terenach występowania malarii mutacja powodująca anemię sierpowatą utrzymuje się w populacji{{odn|Mizerski|2013|s=314}}<ref>{{cytuj książkę|inni=[[Andrzej Szczeklik]] (red.)|tytuł=Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom II|wydawca=Wydawnictwo Medycyna Praktyczna|rok=2005|isbn = 83-7430-031-0|strony=1456–1457}}</ref>. |
Anemia sierpowata to rodzaj wrodzonej anemii (niedokrwistości) polegającej na wadzie budowy hemoglobiny<ref>{{Cytuj|tytuł=Anemia Sierpowata - przyczyny, objawy, leczenie, diagnoza anemii|czasopismo=ZdrowyPortal.org - Portal o Zdrowiu|data=2015-03-25|data dostępu=2016-12-17|url=http://www.zdrowyportal.org/136/anemia-sierpowata/|język=pl-PL}}</ref>. Mutacja punktowa w genie β-globiny powoduje zmianę pojedynczego aminokwasu w sekwencji białka (z [[Kwas glutaminowy|kwasu glutaminowego]] na [[Walina|walinę]]). Hemoglobinę z taką mutacją określa się jako hemoglobinę S (HbS) w przeciwieństwie do normalnej hemoglobiny A (HbA) u dorosłych. Choroba dziedziczy się w sposób autosomalny (nie jest sprzężona z płcią) i częściowo recesywny – nosiciele tylko jednej kopii wadliwego genu (heterozygoty) zwykle nie mają objawów klinicznych, choć ich erytrocyty zawierają ok. 40% HbS<ref>{{Cytuj|tytuł=Anemia sierpowata: dziedziczna, nieuleczalna, śmiertelna|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/zdrowie/zdrowie-dla-kazdego,anemia-sierpowata---przyczyny--objawy--leczenie,artykul,1715931.html}}</ref>. [[Heterozygota|Heterozygoty]] są również w dużym stopniu odporne na malarię. Zjawisko takie nazywa się przewagą heterozygot lub [[naddominacja|naddominacją]]. Naddominacja powoduje, że na terenach występowania malarii mutacja powodująca anemię sierpowatą utrzymuje się w populacji{{odn|Mizerski|2013|s=314}}<ref>{{cytuj książkę|inni=[[Andrzej Szczeklik]] (red.)|tytuł=Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom II|wydawca=Wydawnictwo Medycyna Praktyczna|rok=2005|isbn = 83-7430-031-0|strony=1456–1457}}</ref>. |
||
=== Choroba Andersen === |
==== Choroba Andersen ==== |
||
{{osobny artykuł|Choroba Andersen}} |
{{osobny artykuł|Choroba Andersen}} |
||
Rzadka, śmiertelna (zgon następuje przeważnie w wieku 3-5 lat z powodu [[Niewydolność wątroby|niewydolności wątroby]]) choroba genetyczna, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genie ''[[GBE1]]'', znajdującym się na chromosomie 3p12, która skutkuje defektem [[Enzym rozgałęziający glikogen|enzymu rozgałęziającego glikogen]]. Powstaje glikogen o nienormalnie długich łańcuchach podobnych do tych jakie znajdują się w [[Amylopektyna|amylopektynie]]. Efektem tego jest nagromadzenie nieprawidłowego strukturalnie glikogenu w narządach, głównie w wątrobie i mięśniach (mimo na ogół prawidłowej jego zawartości w wątrobie). Do objawów należą: [[hepatomegalia]] i [[splenomegalia]], [[marskość wątroby]], niewydolność wątroby, hipotonia mięśniowa, upośledzenie wzrostu, [[niewydolność serca]]<ref>[http://www.whonamedit.com/synd.cfm/78.html Artykuł o chorobie Andersen w Who named it?] {{lang|en}}</ref><ref>[http://omim.org/entry/232500 Choroba Andersen] w bazie [http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=OMIM Online Mendelian Inheritance In Man] {{lang|en}}</ref>. |
Rzadka, śmiertelna (zgon następuje przeważnie w wieku 3-5 lat z powodu [[Niewydolność wątroby|niewydolności wątroby]]) choroba genetyczna, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genie ''[[GBE1]]'', znajdującym się na chromosomie 3p12, która skutkuje defektem [[Enzym rozgałęziający glikogen|enzymu rozgałęziającego glikogen]]. Powstaje glikogen o nienormalnie długich łańcuchach podobnych do tych jakie znajdują się w [[Amylopektyna|amylopektynie]]. Efektem tego jest nagromadzenie nieprawidłowego strukturalnie glikogenu w narządach, głównie w wątrobie i mięśniach (mimo na ogół prawidłowej jego zawartości w wątrobie). Do objawów należą: [[hepatomegalia]] i [[splenomegalia]], [[marskość wątroby]], niewydolność wątroby, hipotonia mięśniowa, upośledzenie wzrostu, [[niewydolność serca]]<ref>[http://www.whonamedit.com/synd.cfm/78.html Artykuł o chorobie Andersen w Who named it?] {{lang|en}}</ref><ref>[http://omim.org/entry/232500 Choroba Andersen] w bazie [http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=OMIM Online Mendelian Inheritance In Man] {{lang|en}}</ref>. |
||
=== Choroba |
==== Choroba Canavan ==== |
||
[[Plik:Brugada.jpg|Obraz EKG w odprowadzeniach znad prawej komory w trzech typach zespołu|thumb|200px]] |
|||
{{osobny artykuł|Choroba Brugadów}} |
|||
Dziedziczona autosomalnie dominująco, charakteryzuje się skłonnością do występowania napadowych zaburzeń rytmu o typie [[częstoskurcz komorowy|częstoskurczu komorowego]], który może ustąpić samoistnie lub przekształcić się w [[migotanie komór]] i doprowadzić do [[nagłe zatrzymanie krążenia|nagłego zatrzymania krążenia]] i [[śmierć|śmierci]]. Podłoże molekularne stanowi mutacja w [[gen]]ie ''[[SCN5A]]'' kodującym [[kanał sodowy]]<ref>Plewka M, Kasprzak J. ''[http://web.archive.org/web/*/http://www.almamedia.com.pl/pliki/PPK/2001/1/PPK_2001_1_65.pdf Zespół Brugadów.]'' Polski Przegląd Kardiologiczny 3, 1, 65-67 (2001) {{ISSN|1507-5540}}</ref><ref>B.Dąbrowska: ''[http://www.mp.pl/artykuly/index.php?aid=9996&_tc=6CA90EAE131C4A4AB763A91060DBD9D4 Zespół Brugadów.]'' Medycyna Praktyczna 6 (2001)</ref>. Wskutek tego dochodzi do skrócenia czasu trwania [[potencjał czynnościowy|potencjału czynnościowego]], zwłaszcza fazy 2, co powoduje zmiany repolaryzacji i wystąpienia zjawiska ''[[Pobudzenie nawrotne|reentry]]''<ref>{{Cytuj pismo | autor=Napolitano C, Priori SG | tytuł=Brugada syndrome | rok=2006 | czasopismo=Orphanet J Rare Dis | doi=10.1186/1750-1172-1-35 | wolumin= | oznaczenie=1 | pmid= 16972995 | strony=35}}</ref><ref>{{OMIM|id=601144|nazwa=BRUGADA SYNDROME 1}}</ref>. |
|||
=== Choroba Canavan === |
|||
{{osobny artykuł|Choroba Canavan}} |
{{osobny artykuł|Choroba Canavan}} |
||
Leukodystrofia gąbczasta (inna nazwa) jest dziedziczoną w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]], zwyrodnieniową chorobą układu nerwowego z początkiem w okresie prenatalnym. Istotą choroby jest zwyrodnienie [[Substancja biała|istoty białej]] i [[Substancja szara|szarej]] mózgu jako skutek niedoboru ''N''-acetyloaspartazy, spowodowanego mutacją (najczęstsza mutacją jest [[Tranzycja (biologia)|tranzycja]] <tt>A>C</tt>, skutkująca zamianą [[kwas glutaminowy|kwasu glutaminowego]] przez [[alanina|alaninę]] w pozycji 285 białka enzymu. Ponieważ zmiana dotyczy centrum aktywnego dochodzi do całkowitego zablokowania aktywności enzymu) w kodującym ten enzym genie ''[[ASPA (gen)|ASPA]]'' w ''locus'' [[chromosom 17|17pter]]-p13<ref>Kaul R, Gao G.P, Aloya M et al. "Canavan disease; mutations among Jewish and non-Jewish patients", Am J Hum.Genet, 1994;55:34-41</ref>. Zwyrodnienie gąbczaste wyodrębniono jako osobną jednostkę chorobową w [[1949]] roku, a pierwszy opis choroby pozostawiła [[Myrtelle Canavan]] w 1931<ref>{{Cytuj pismo|autor=Canavan MM|rok=1931|tytuł=Schilder's encephalitis periaxialis diffusa. Report of a case in a child aged sixteen and one-half months|czasopismo=Archives of Neurology and Psychiatry|oznaczenie=25|strony=299-308}}</ref>. W zależności od postaci choroby wyróżnia się następujące objawy: '''postać wrodzona i dziecięca''' – [[makrocefalia|wielkogłowie]], zespół wiotkiego dziecka, opóźnienie rozwoju motorycznego i umysłowego, napady padaczkowe. W dalszym etapie dochodzi do niedowładu spastycznego i [[Porażenie opuszkowe|zespołu opuszkowego]] co prowadzi do śmierci w ciągu kilku lat; '''postać młodzieńcza i dorosłych''' – [[otępienie]], objawy móżdżkowe, zwyrodnienie barwnikowe siatkówki, obraz choroby jest mniej charakterystyczny. Mikroskopowo obserwuje się m.in.: zmiany w [[Komórki Purkiniego|komórkach Purkiniego]] [[móżdżek|móżdżku]] i w [[jądro zębate|jądrze zębatym]], [[demielinizacja]] w obrębie zmian gąbczastych i poza nimi, aksony zazwyczaj zachowane, brak produktów rozpadu mieliny, w [[kora mózgu|korze mózgu]] następuje [[rozrost|rozplem]] [[astrocyt|astrogleju]]<ref>Kozubski Wojciech: "Zaburzenia metaboliczne i genetyczne układu nerwowego". W: Choroby układu nerwowego. Wydawnictwo Lekarskie PZWL, Warszawa, 2004, 287. {{ISBN|83-200-2636-9}}</ref>. Dla [[patomorfologia|patomorfologii]] charakterystyczny jest obraz makroskopowy: odpowiednio do klinicznie widocznego [[makrocefalia|wielkogłowia]] mózg jest duży i ciężki (czasem nawet o 80% normy), jednak wraz z czasem trwania choroby ulega on zmniejszeniu<ref>{{Cytuj książkę |nazwisko=Mossakowski |imię=Mirosław |autor link= |tytuł=Podstawy neuropatologii|url= |data= |rok=1981 |miesiąc= |wydawca=Państwowy Zakład Wydawnictw Lekarskich |miejsce=Warszawa |id= |rozdział=Choroby metaboliczne układu nerwowego|adres rozdziału= |cytat =}}</ref><ref>{{WhoNamedIt|synd|421|Canavan's disease}}</ref><ref>{{OMIM|id=271900|nazwa=CANAVAN DISEASE}}</ref>. |
Leukodystrofia gąbczasta (inna nazwa) jest dziedziczoną w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]], zwyrodnieniową chorobą układu nerwowego z początkiem w okresie prenatalnym. Istotą choroby jest zwyrodnienie [[Substancja biała|istoty białej]] i [[Substancja szara|szarej]] mózgu jako skutek niedoboru ''N''-acetyloaspartazy, spowodowanego mutacją (najczęstsza mutacją jest [[Tranzycja (biologia)|tranzycja]] <tt>A>C</tt>, skutkująca zamianą [[kwas glutaminowy|kwasu glutaminowego]] przez [[alanina|alaninę]] w pozycji 285 białka enzymu. Ponieważ zmiana dotyczy centrum aktywnego dochodzi do całkowitego zablokowania aktywności enzymu) w kodującym ten enzym genie ''[[ASPA (gen)|ASPA]]'' w ''locus'' [[chromosom 17|17pter]]-p13<ref>Kaul R, Gao G.P, Aloya M et al. "Canavan disease; mutations among Jewish and non-Jewish patients", Am J Hum.Genet, 1994;55:34-41</ref>. Zwyrodnienie gąbczaste wyodrębniono jako osobną jednostkę chorobową w [[1949]] roku, a pierwszy opis choroby pozostawiła [[Myrtelle Canavan]] w 1931<ref>{{Cytuj pismo|autor=Canavan MM|rok=1931|tytuł=Schilder's encephalitis periaxialis diffusa. Report of a case in a child aged sixteen and one-half months|czasopismo=Archives of Neurology and Psychiatry|oznaczenie=25|strony=299-308}}</ref>. W zależności od postaci choroby wyróżnia się następujące objawy: '''postać wrodzona i dziecięca''' – [[makrocefalia|wielkogłowie]], zespół wiotkiego dziecka, opóźnienie rozwoju motorycznego i umysłowego, napady padaczkowe. W dalszym etapie dochodzi do niedowładu spastycznego i [[Porażenie opuszkowe|zespołu opuszkowego]] co prowadzi do śmierci w ciągu kilku lat; '''postać młodzieńcza i dorosłych''' – [[otępienie]], objawy móżdżkowe, zwyrodnienie barwnikowe siatkówki, obraz choroby jest mniej charakterystyczny. Mikroskopowo obserwuje się m.in.: zmiany w [[Komórki Purkiniego|komórkach Purkiniego]] [[móżdżek|móżdżku]] i w [[jądro zębate|jądrze zębatym]], [[demielinizacja]] w obrębie zmian gąbczastych i poza nimi, aksony zazwyczaj zachowane, brak produktów rozpadu mieliny, w [[kora mózgu|korze mózgu]] następuje [[rozrost|rozplem]] [[astrocyt|astrogleju]]<ref>Kozubski Wojciech: "Zaburzenia metaboliczne i genetyczne układu nerwowego". W: Choroby układu nerwowego. Wydawnictwo Lekarskie PZWL, Warszawa, 2004, 287. {{ISBN|83-200-2636-9}}</ref>. Dla [[patomorfologia|patomorfologii]] charakterystyczny jest obraz makroskopowy: odpowiednio do klinicznie widocznego [[makrocefalia|wielkogłowia]] mózg jest duży i ciężki (czasem nawet o 80% normy), jednak wraz z czasem trwania choroby ulega on zmniejszeniu<ref>{{Cytuj książkę |nazwisko=Mossakowski |imię=Mirosław |autor link= |tytuł=Podstawy neuropatologii|url= |data= |rok=1981 |miesiąc= |wydawca=Państwowy Zakład Wydawnictw Lekarskich |miejsce=Warszawa |id= |rozdział=Choroby metaboliczne układu nerwowego|adres rozdziału= |cytat =}}</ref><ref>{{WhoNamedIt|synd|421|Canavan's disease}}</ref><ref>{{OMIM|id=271900|nazwa=CANAVAN DISEASE}}</ref>. |
||
=== Choroba Coriego === |
==== Choroba Coriego ==== |
||
{{osobny artykuł|Choroba Coriego}} |
{{osobny artykuł|Choroba Coriego}} |
||
To choroba metaboliczna, dziedziczona w sposób autosomalny recesywny, spowodowana niedoborem amylo-1,6-glukozydazy (jednej części układu enzymatycznego glikogenu rozkładającej łańcuchy boczne)<ref>{{OMIM|id=232400|nazwa=GLYCOGEN STORAGE DISEASE III; GSD3}}</ref><ref>{{Cytuj|tytuł=Glycogenosis type 3 information Diseases Database|data=2016-12-22|data dostępu=2016-12-24|opublikowany=www.diseasesdatabase.com|url=http://www.diseasesdatabase.com/ddb5302.htm|język=en}}</ref>. Przebieg kliniczny tej choroby jest podobny do glikogenozy typu I, ale łagodniejszy. Do objawów należy hepatomegalia, która jest obecna jest u małych dzieci z tą chorobą i czasami zmniejsza się, znika z wiekiem. Niedobór ten prowadzi do nadmiernego odkładania nieprawidłowego [[glikogen]]u w [[mięsień|mięśniach]], [[wątroba|wątrobie]] a także w [[budowa serca człowieka|sercu]]. Zostało zidentyfikowanych sześć podgrup, z których podgrupy typu IIIa i IIIb są najczęstsze<ref>{{Cytuj|tytuł=Glycogen Storage Disease Type III|data dostępu=2016-12-24|opublikowany=www.nlm.nih.gov|język=en|url=https://www.nlm.nih.gov/cgi/mesh/2010/MB_cgi?field=uid&term=D006010}}</ref>. Szacuje się, ze w Stanach Zjednoczonych choroba występuje z częstością 1/100 000 żywych urodzeń<ref name="eMedicine">{{cytuj stronę|url=http://emedicine.medscape.com/article/942618-overview|tytuł=Glycogen-Storage Disease Type III|opublikowany=eMedicine|język=en|data dostępu=2010-06-11}}</ref>. |
To choroba metaboliczna, dziedziczona w sposób autosomalny recesywny, spowodowana niedoborem amylo-1,6-glukozydazy (jednej części układu enzymatycznego glikogenu rozkładającej łańcuchy boczne)<ref>{{OMIM|id=232400|nazwa=GLYCOGEN STORAGE DISEASE III; GSD3}}</ref><ref>{{Cytuj|tytuł=Glycogenosis type 3 information Diseases Database|data=2016-12-22|data dostępu=2016-12-24|opublikowany=www.diseasesdatabase.com|url=http://www.diseasesdatabase.com/ddb5302.htm|język=en}}</ref>. Przebieg kliniczny tej choroby jest podobny do glikogenozy typu I, ale łagodniejszy. Do objawów należy hepatomegalia, która jest obecna jest u małych dzieci z tą chorobą i czasami zmniejsza się, znika z wiekiem. Niedobór ten prowadzi do nadmiernego odkładania nieprawidłowego [[glikogen]]u w [[mięsień|mięśniach]], [[wątroba|wątrobie]] a także w [[budowa serca człowieka|sercu]]. Zostało zidentyfikowanych sześć podgrup, z których podgrupy typu IIIa i IIIb są najczęstsze<ref>{{Cytuj|tytuł=Glycogen Storage Disease Type III|data dostępu=2016-12-24|opublikowany=www.nlm.nih.gov|język=en|url=https://www.nlm.nih.gov/cgi/mesh/2010/MB_cgi?field=uid&term=D006010}}</ref>. Szacuje się, ze w Stanach Zjednoczonych choroba występuje z częstością 1/100 000 żywych urodzeń<ref name="eMedicine">{{cytuj stronę|url=http://emedicine.medscape.com/article/942618-overview|tytuł=Glycogen-Storage Disease Type III|opublikowany=eMedicine|język=en|data dostępu=2010-06-11}}</ref>. |
||
=== Choroba Gauchera === |
==== Choroba Gauchera ==== |
||
{{osobny artykuł|Choroba Gauchera}} |
{{osobny artykuł|Choroba Gauchera}} |
||
[[Lizosomalne choroby spichrzeniowe|Lizosomalna choroba spichrzeniowa]], dziedzicząca się w sposób autosomalny recesywny, spowodowana [[mutacja|mutacją]] w genie ''GBA'' kodującym białko enzymu [[glukocerebrozydaza|glukocerebrozydazy]]<ref>Gaucher PCE. ''De l'epithelioma primitif de la rate, hypertrophie idiopathique de la rate sans leucemie''. Academic thesis, Paris, France, 1882.</ref>. Wyróżnia się kilka postaci klinicznych choroby: typ 1 nieneuronopatyczny o przewlekłym przebiegu (szacunkowo 1 przypadek na 50.000 urodzeń)<ref>{{OMIM|id=230800|nazwa=GAUCHER DISEASE, TYPE I}}</ref>, typ 2 ostry neuronopatyczny niemowlęcy (szacunkowo 1 przypadek na 100.000 urodzeń)<ref>{{OMIM|id=230900|nazwa=GAUCHER DISEASE, TYPE II}}</ref>, typ 3 podostry neuronopatyczny (szacunkowo 1 przypadek na 100.000 urodzeń)<ref>{{OMIM|id=231000|nazwa=GAUCHER DISEASE, TYPE III}}</ref>. |
[[Lizosomalne choroby spichrzeniowe|Lizosomalna choroba spichrzeniowa]], dziedzicząca się w sposób autosomalny recesywny, spowodowana [[mutacja|mutacją]] w genie ''GBA'' kodującym białko enzymu [[glukocerebrozydaza|glukocerebrozydazy]]<ref>Gaucher PCE. ''De l'epithelioma primitif de la rate, hypertrophie idiopathique de la rate sans leucemie''. Academic thesis, Paris, France, 1882.</ref>. Wyróżnia się kilka postaci klinicznych choroby: typ 1 nieneuronopatyczny o przewlekłym przebiegu (szacunkowo 1 przypadek na 50.000 urodzeń)<ref>{{OMIM|id=230800|nazwa=GAUCHER DISEASE, TYPE I}}</ref>, typ 2 ostry neuronopatyczny niemowlęcy (szacunkowo 1 przypadek na 100.000 urodzeń)<ref>{{OMIM|id=230900|nazwa=GAUCHER DISEASE, TYPE II}}</ref>, typ 3 podostry neuronopatyczny (szacunkowo 1 przypadek na 100.000 urodzeń)<ref>{{OMIM|id=231000|nazwa=GAUCHER DISEASE, TYPE III}}</ref>. |
||
=== Choroba Hersa === |
==== Choroba Hersa ==== |
||
{{osobny artykuł|Choroba Hersa}} |
{{osobny artykuł|Choroba Hersa}} |
||
Podobnie jak większość chorób jednogenowych dziedziczona w sposób autosomalny recesywny. Spowodowana jest mutacją w genie ''[[PYGL]]'' znajdującym się na chromosomie 14. Aberracja skutkuje brakiem [[Fosforylaza glikogenu|fosforylazy glikogenowej]] (wątrobowej). Niedobór ten prowadzi do nadmiernego odkładania [[glikogen]]u w [[Wątroba|wątrobie]] (przy prawidłowej strukturze narządu). Objawami, które najczęściej występują są: [[hepatomegalia]], [[hipoglikemia]], [[hiperlipidemia]]<ref>{{OMIM|id=232700|nazwa=GLYCOGEN STORAGE DISEASE VI}}</ref>. |
Podobnie jak większość chorób jednogenowych dziedziczona w sposób autosomalny recesywny. Spowodowana jest mutacją w genie ''[[PYGL]]'' znajdującym się na chromosomie 14. Aberracja skutkuje brakiem [[Fosforylaza glikogenu|fosforylazy glikogenowej]] (wątrobowej). Niedobór ten prowadzi do nadmiernego odkładania [[glikogen]]u w [[Wątroba|wątrobie]] (przy prawidłowej strukturze narządu). Objawami, które najczęściej występują są: [[hepatomegalia]], [[hipoglikemia]], [[hiperlipidemia]]<ref>{{OMIM|id=232700|nazwa=GLYCOGEN STORAGE DISEASE VI}}</ref>. |
||
=== Choroba |
==== Choroba McArdle'a ==== |
||
[[Plik:CD serpiginous ulcer.jpg|thumb|100px|Wrzód pełzający okrężnicy w obrazie ednoskopowym, klasycznie występującego w chorobie Crohna]] |
|||
{{osobny artykuł|Choroba Crohna}} |
|||
Jest to nieuleczalna zapalna choroba jelita o niewyjaśnionej [[Etiologia|etiologii]], zaliczana do grupy [[Nieswoiste zapalenia jelit|nieswoistych zapaleń jelit]] (IBD), przewlekły, nieswoisty [[zapalenie|proces zapalny]] ściany [[przewód pokarmowy|przewodu pokarmowego]]; może dotyczyć każdego jego odcinka, lecz najczęściej lokalizuje się w końcowej części [[jelito cienkie|jelita cienkiego]] oraz początkowej [[jelito grube|jelita grubego]] (z tego względu dawniejsza nazwa to ''ileitis terminalis'')<ref>{{Cytuj pismo|autor=Gary R. Lichtenstein, Stephen B. Hanauer, William J. Sandborn, and The Practice Parameters Committee of the American College of Gastroenterology |
|||
|czasopismo=The American Journal of GASTROENTEROLOGY|tytuł=Management of Crohn’s Disease in Adults|wolumin=104|strony=465–483|rok=2009|url=http://www.gi.org/physicians/guidelines/CrohnsDiseaseinAdults2009.pdf|doi=10.1038/ajg.2008.168|język=en}}</ref><ref>{{Cytuj pismo|autor= E F Stange|autor2= S P L Travis|autor3= S Vermeire|autor4= C Beglinger|autor5= L Kupcinkas|autor6= K Geboes|autor7= A Barakauskiene|autor8= V Villanacci|autor9= A Von Herbay|autor10= B F Warren|autor11= C Gasche|autor12= H Tilg|autor13= Stefan W Schreiber|autor14= J Schölmerich|autor15= W Reinisch|czasopismo=GUT. An International Journal of Gastroenterology and Hepatology|tytuł=European evidence based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis|rok=2006|wolumin=55(suppl 1)|strony=i1-i15|doi =10.1136/gut.2005.081950a|język=en|url=http://gut.bmj.com/content/55/suppl_1/i1.full.html}}</ref>. Opisana została po raz pierwszy przez polskiego lekarza [[Antoni Leśniowski|Antoniego Leśniowskiego]] w 1904<ref name="leśniowski">{{Cytuj pismo|autor=Leśniowski, A|tytuł=Przyczynek do chirurgii kiszek|czasopismo=Medycyna (Warszawa)|rok=1903|wolumin=31|strony=460-464, 483–489, 514-518}}</ref>, a dokładniejszego opisu dostarczył [[Burrill Bernard Crohn]] ze współpracownikami w 1932<ref name="crohn">{{Cytuj pismo|autor=Crohn, BB, Ginzburg, L, Oppenheimer, GD|tytuł=Regional ileitis; a pathologic and clinical entity|czasopismo=Journal of the American Medical Association (Chicago)|rok=1932|wolumin=99|strony=1323-1329}}</ref>. Etiopatogeneza choroby może być związana z [[mutacja|mutacją]] genu ''[[NOD2]]'' oraz defektem immunologicznym [[monocyt]]ów, jednak dokładne jej podłoże nie jest znane<ref> {{Cytuj pismo| autor= Vermeire S |tytuł=NOD2/CARD15: relevance in clinical practice |czasopismo= Best Pract Res Clin Gastroenterol |wolumin =18|strony=569-75 |rok=2004 |pmid= 15157828}} </ref><ref> {{Cytuj pismo| autor= Hugot J P et al. |tytuł=Prevalence of CARD15/NOD2 mutations in Caucasian healthy people|czasopismo= Am J Gastroenterol |wolumin =102|strony=1259-1267 |rok=2007 |pmid= 17319929 |doi= 10.1111/j.1572-0241.2007.01149.x}}</ref>. Jej występowanie jest uwarunkowane geograficznie (największa zachorowalność w krajach Europy Zachodniej i Ameryki Północnej)<ref>{{cytuj książkę|autor=Grażyna Rydzewska, Ewa Małecka-Panas (red)|tytuł=Choroba Leśniowskiego-Crohna – 100 lat diagnostyki i terapii|autor r= Agata Witanowska, Grażyna Rydzewska|rozdział=Epidemiologia i przebieg kliniczny choroby Leśniowskiego-Crohna|wydawca=Termedia Wydawnictwa Medyczne|miejsce=Poznań|data=2008|strony=23–36|isbn=978-83-89825-53-7}}</ref>. Charakterystyczne dla przebiegu choroby jest zajęcie całej grubości ściany narządu oraz możliwość występowania w całym przewodzie pokarmowym, podczas gdy we [[wrzodziejące zapalenie jelita grubego|wrzodziejącym zapaleniu jelita grubego]] zajęte są tylko błona śluzowa i podśluzowa jelita grubego). Zmiany mają charakter ogniskowy. Główne objawy dotyczące [[przewód pokarmowy|przewodu pokarmowego]] to: przewlekła biegunka (zwykle bez krwi), czasem nocna. W poważnych przypadkach może istnieć potrzeba oddania ponad 20 stolców na dzień<ref name=Hanauer/><ref name=Podolsky>{{Cytuj pismo | autor=Mueller MH., Kreis ME., Gross ML., Becker HD., Zittel TT., Jehle EC | tytuł=Anorectal functional disorders in the absence of anorectal inflammation in patients with Crohn's disease. | rok=2002 | czasopismo=Br J Surg | doi=10.1046/j.1365-2168.2002.02173.x | wolumin=8 | oznaczenie= Aug;89 | pmid= 12153630 | strony=1027-31}}</ref>, bóle brzucha (często prawe podbrzusze), [[niedrożność jelit]], guzowaty opór w jamie brzusznej, zmiany okołoodbytniczne ([[Rozpadlina (medycyna)|szczelina]], [[przetoka]], [[ropień]]). Do rzadziej występujących objawów pozajelitowych należą<ref name=Hanauer>{{Cytuj pismo | autor=Hanauer SB | tytuł=Inflammatory bowel disease | rok=1996 | czasopismo=N Engl J Med | doi= | wolumin=13 | oznaczenie=334 | pmid= 8596552 | strony=841-8}}</ref>: skórne – [[rumień guzowaty]] (łac. ''erythema nodosum''), [[piodermia zgorzelinowa]]; stawowe; oczne – ''episcleritis'' lub ''keratoconjunctivitis'', ''uveitis''<ref>{{Cytuj pismo|autor=Hampe, J, Grebe, J, Nikolaus, S, Solberg, C, Croucher, PJ, Mascheretti, S, Jahnsen, J, Moum, B, Klump, B, Krawczak, M, Mirza, MM, Foelsch, UR, Vatn, M, Schreiber, S|czasopismo=Lancet|tytuł=Association of ''NOD2'' (CARD 15) with clinical course of Crohn's disease: a cohort study|pmid=12020527|rok=2002|oznaczenie=359|wolumin=9318|strony=1661-1665}}</ref><ref>{{Cytuj pismo|autor=Wu, S, Lim, KC, Huang, J, Saidi, RF, Sears, CL|tytuł=''Bacteroides fragilis'' enterotoxin cleaves the zonula adherens protein, E-cadherin|czasopismo=Proc Natl Acad Sci U S A|url=http://www.pnas.org/cgi/content/full/95/25/14979|oznaczenie=95|wolumin=25|strony=14979-14984|rok=1998|pmid=9844001}}</ref>. |
|||
=== Choroba Menkesa === |
|||
{{osobny artykuł|Choroba Menkesa}} |
|||
Inne nazwy to: ''choroba kręconych włosów'', ''zespół Menkesa'', [[Język angielski|ang.]] ''Menkes disease'', ''Menkes syndrome'', ''kinky hair disease'' i ''steely hair syndrome''. |
|||
Jest chorobą neurodegeneracyjną, związaną z zaburzeniem metabolizmu [[miedź|miedzi]]. Przyczyną choroby Menkesa jest [[mutacja]] w genie ''ATP7A''<ref>{{Cytuj pismo | autor=Voskoboinik I., Camakaris J | tytuł=Menkes copper-translocating P-type ATPase (ATP7A): biochemical and cell biology properties, and role in Menkes disease. | rok=2002 | czasopismo=Journal of bioenergetics and biomembranes | doi= | wydanie=34 | wolumin=5 | miesiąc=październik | pmid= 12539963 | strony=363–71}}</ref> w ''locus'' [[chromosom X|Xq]]12-q13. |
|||
Zmiany strukturalne występują w mózgu, wątrobie, naczyniach krwionośnych i w tkance kostnej – co powoduje zaburzenia neurologiczne, kostne i osteoporozę. Chorzy wykazują również nietypową budowę włosa – włosy są sztywne i bardzo łamliwe, lub przeciwnie, bardzo wiotkie. |
|||
=== Choroba McArdle'a === |
|||
{{osobny artykuł|Choroba McArdle'a}} |
{{osobny artykuł|Choroba McArdle'a}} |
||
Najczęstszą mutacją będącą podłożem molekularnym tej rzadkiej choroby jest występująca w [[Biała odmiana człowieka|populacji białej]] (ang. ''Caucasian population'') tranzycja [[cytozyna|cytozyny]] w [[tymina|tyminę]] (p.R50X) powodująca przedwczesną terminację translacji<ref>{{Cytuj|autor = Gisela Nogales-Gadea, Tomàs Pinós, Alejandro Lucia, Joaquín Arenas, Yolanda Camara|tytuł = Knock-in mice for the R50X mutation in the PYGM gene present with McArdle disease|czasopismo = Brain: A Journal of Neurology|data = 2012-07-01|data dostępu = 2016-02-27|issn = 1460-2156|wydanie = Pt 7|s = 2048–2057|doi = 10.1093/brain/aws141|pmid = 22730558|url = http://www.ncbi.nlm.nih.gov/pubmed/22730558}}</ref>. Drugą, pod względem częstości występowania, jest mutacja p.G205S skutkująca wytworzeniem nieaktywnego enzymu<ref>{{Cytuj|autor = A. L. Andreu, G. Nogales-Gadea, D. Cassandrini, J. Arenas, C. Bruno|tytuł = McArdle disease: molecular genetic update|czasopismo = Acta Myologica: Myopathies and Cardiomyopathies: Official Journal of the Mediterranean Society of Myology / Edited by the Gaetano Conte Academy for the Study of Striated Muscle Diseases|data = 2007-07-01|data dostępu = 2016-02-27|issn = 1128-2460|wydanie = 1|s = 53–57|pmid = 17915571|pmc = 2949323|url = http://www.ncbi.nlm.nih.gov/pubmed/17915571}}</ref><ref>{{Cytuj|autor = A. Martinuzzi, G. Schievano, A. Nascimbeni, M. Fanin|tytuł = McArdle's disease. The unsolved mystery of the reappearing enzyme|czasopismo = The American Journal of Pathology|data = 1999-06-01|data dostępu = 2016-02-27|issn = 0002-9440|wydanie = 6|s = 1893–1897|doi = 10.1016/S0002-9440(10)65447-8|pmid = 10362816|pmc = 1866615|url = http://www.ncbi.nlm.nih.gov/pubmed/10362816}}</ref>. Dziedziczona jest w sposób autosomalny recesywny. Mutacja skutkuje niedoborem [[Enzymy|enzymu]] – [[mięsień|mięśniowej]] [[Fosforylaza glikogenu|fosforylazy glikogenowej]], który powoduje nadmierne gromadzenie się [[glikogen]]u w mięśniach<ref>{{Cytuj|autor = Renata Siciliani Scalco, Sherryl Chatfield, Richard Godfrey, Jatin Pattni, Charlotte Ellerton|tytuł = From exercise intolerance to functional improvement: the second wind phenomenon in the identification of McArdle disease|czasopismo = Arquivos De Neuro-Psiquiatria|data = 2014-07-01|data dostępu = 2016-02-27|issn = 1678-4227|wydanie = 7|s = 538–541|pmid = 25054987|url = http://www.ncbi.nlm.nih.gov/pubmed/25054987}}</ref><ref>{{Cytuj|autor = R. Quinlivan, J. Buckley, M. James, A. Twist, S. Ball|tytuł = McArdle disease: a clinical review|czasopismo = Journal of Neurology, Neurosurgery, and Psychiatry|data = 2010-11-01|data dostępu = 2016-02-27|issn = 1468-330X|wydanie = 11|s = 1182–1188|doi = 10.1136/jnnp.2009.195040|pmid = 20861058|url = http://www.ncbi.nlm.nih.gov/pubmed/20861058}}</ref><ref>{{Cytuj|autor = MIGOCKA-PATRZAŁEK M., KOSIERADZKA A., LEWANDOWSKI D., POSYNIAK E., DUBIŃSKA-MAGIERA M., DACZEWSKA M.|tytuł = Choroba McArdle’a: patogeneza i perspektywy terapii|czasopismo = POSTEPY BIOLOGII KOMORKI|data = 12-05-2015|wydanie = 42 (3)|s = 431-433|url = http://www.pbkom.eu/sites/default/files/artykulydo2012/Choroba-McArdlea-patogeneza-i-perspektywy-terapii.pdf}}</ref>. Do objawów należą: bóle mięśniowe, [[mioglobinuria]], podwyższenie poziomu enzymów mięśniowych we krwi po wysiłku<ref>[http://www.emedicine.com/med/topic911.htm Artykuł o chorobie McArdle'a w eMedicine (en)]</ref>. |
Najczęstszą mutacją będącą podłożem molekularnym tej rzadkiej choroby jest występująca w [[Biała odmiana człowieka|populacji białej]] (ang. ''Caucasian population'') tranzycja [[cytozyna|cytozyny]] w [[tymina|tyminę]] (p.R50X) powodująca przedwczesną terminację translacji<ref>{{Cytuj|autor = Gisela Nogales-Gadea, Tomàs Pinós, Alejandro Lucia, Joaquín Arenas, Yolanda Camara|tytuł = Knock-in mice for the R50X mutation in the PYGM gene present with McArdle disease|czasopismo = Brain: A Journal of Neurology|data = 2012-07-01|data dostępu = 2016-02-27|issn = 1460-2156|wydanie = Pt 7|s = 2048–2057|doi = 10.1093/brain/aws141|pmid = 22730558|url = http://www.ncbi.nlm.nih.gov/pubmed/22730558}}</ref>. Drugą, pod względem częstości występowania, jest mutacja p.G205S skutkująca wytworzeniem nieaktywnego enzymu<ref>{{Cytuj|autor = A. L. Andreu, G. Nogales-Gadea, D. Cassandrini, J. Arenas, C. Bruno|tytuł = McArdle disease: molecular genetic update|czasopismo = Acta Myologica: Myopathies and Cardiomyopathies: Official Journal of the Mediterranean Society of Myology / Edited by the Gaetano Conte Academy for the Study of Striated Muscle Diseases|data = 2007-07-01|data dostępu = 2016-02-27|issn = 1128-2460|wydanie = 1|s = 53–57|pmid = 17915571|pmc = 2949323|url = http://www.ncbi.nlm.nih.gov/pubmed/17915571}}</ref><ref>{{Cytuj|autor = A. Martinuzzi, G. Schievano, A. Nascimbeni, M. Fanin|tytuł = McArdle's disease. The unsolved mystery of the reappearing enzyme|czasopismo = The American Journal of Pathology|data = 1999-06-01|data dostępu = 2016-02-27|issn = 0002-9440|wydanie = 6|s = 1893–1897|doi = 10.1016/S0002-9440(10)65447-8|pmid = 10362816|pmc = 1866615|url = http://www.ncbi.nlm.nih.gov/pubmed/10362816}}</ref>. Dziedziczona jest w sposób autosomalny recesywny. Mutacja skutkuje niedoborem [[Enzymy|enzymu]] – [[mięsień|mięśniowej]] [[Fosforylaza glikogenu|fosforylazy glikogenowej]], który powoduje nadmierne gromadzenie się [[glikogen]]u w mięśniach<ref>{{Cytuj|autor = Renata Siciliani Scalco, Sherryl Chatfield, Richard Godfrey, Jatin Pattni, Charlotte Ellerton|tytuł = From exercise intolerance to functional improvement: the second wind phenomenon in the identification of McArdle disease|czasopismo = Arquivos De Neuro-Psiquiatria|data = 2014-07-01|data dostępu = 2016-02-27|issn = 1678-4227|wydanie = 7|s = 538–541|pmid = 25054987|url = http://www.ncbi.nlm.nih.gov/pubmed/25054987}}</ref><ref>{{Cytuj|autor = R. Quinlivan, J. Buckley, M. James, A. Twist, S. Ball|tytuł = McArdle disease: a clinical review|czasopismo = Journal of Neurology, Neurosurgery, and Psychiatry|data = 2010-11-01|data dostępu = 2016-02-27|issn = 1468-330X|wydanie = 11|s = 1182–1188|doi = 10.1136/jnnp.2009.195040|pmid = 20861058|url = http://www.ncbi.nlm.nih.gov/pubmed/20861058}}</ref><ref>{{Cytuj|autor = MIGOCKA-PATRZAŁEK M., KOSIERADZKA A., LEWANDOWSKI D., POSYNIAK E., DUBIŃSKA-MAGIERA M., DACZEWSKA M.|tytuł = Choroba McArdle’a: patogeneza i perspektywy terapii|czasopismo = POSTEPY BIOLOGII KOMORKI|data = 12-05-2015|wydanie = 42 (3)|s = 431-433|url = http://www.pbkom.eu/sites/default/files/artykulydo2012/Choroba-McArdlea-patogeneza-i-perspektywy-terapii.pdf}}</ref>. Do objawów należą: bóle mięśniowe, [[mioglobinuria]], podwyższenie poziomu enzymów mięśniowych we krwi po wysiłku<ref>[http://www.emedicine.com/med/topic911.htm Artykuł o chorobie McArdle'a w eMedicine (en)]</ref>. |
||
=== Choroba Niemanna-Picka === |
==== Choroba Niemanna-Picka ==== |
||
{{osobny artykuł|Choroba Niemanna-Picka}} |
{{osobny artykuł|Choroba Niemanna-Picka}} |
||
[[Lizosomalne choroby spichrzeniowe|Lizosomalna choroba spichrzeniowa]] heterogenna pod względem etiologicznym i klinicznym . Wyróżnia się kilka typów schorzenia<ref>{{OMIM|id=257200|nazwa=NIEMANN-PICK DISEASE, TYPE A}}</ref><ref>{{OMIM|id=607616|nazwa=NIEMANN-PICK DISEASE, TYPE B}}</ref><ref>{{OMIM|id=257220|nazwa=NIEMANN-PICK DISEASE, TYPE C1; NPC1}}</ref><ref>{{OMIM|id=607625|nazwa=NIEMANN-PICK DISEASE, TYPE C2}}</ref>, łączy je obecność tzw. komórek Niemanna-Picka (komórek piankowatych), spotykanych w miejscach gdzie typowo spotyka się [[makrofagi]], czyli we wszystkich narządach [[Układ fagocytarny|układu siateczkowo-śródbłonkowego]]<ref>{{Cytuj książkę | nazwisko= Liberski | imię=Paweł P | nazwisko2= Papierz | imię2=Wielisław | nazwisko3= Kozubski | imię3=Wojciech | nazwisko4= Kłoszewska | imię4=Iwona | nazwisko5= Mossakowski | imię5=Mirosław Jan | inni= | tytuł= Neuropatologia Mossakowskiego | data=2005 | wydawca=Wydawnictwo Czelej | miejsce=Lublin | isbn=83-89309-63-7 | strony=77-78}}</ref>. Materiałem spichrzanym jest [[sfingomielina]]. Jako pierwszy jednostkę chorobową opisał [[Albert Niemann (pediatra)|Albert Niemann]] w 1914 roku<ref>{{cytuj pismo|autor=Niemann A|tytuł=Ein unbekanntes Krankheitsbild|czasopismo=Jahrbuch für Kinderheilkunde|rok=1914|wolumin=79|strony=1-10}}</ref>. |
[[Lizosomalne choroby spichrzeniowe|Lizosomalna choroba spichrzeniowa]] heterogenna pod względem etiologicznym i klinicznym . Wyróżnia się kilka typów schorzenia<ref>{{OMIM|id=257200|nazwa=NIEMANN-PICK DISEASE, TYPE A}}</ref><ref>{{OMIM|id=607616|nazwa=NIEMANN-PICK DISEASE, TYPE B}}</ref><ref>{{OMIM|id=257220|nazwa=NIEMANN-PICK DISEASE, TYPE C1; NPC1}}</ref><ref>{{OMIM|id=607625|nazwa=NIEMANN-PICK DISEASE, TYPE C2}}</ref>, łączy je obecność tzw. komórek Niemanna-Picka (komórek piankowatych), spotykanych w miejscach gdzie typowo spotyka się [[makrofagi]], czyli we wszystkich narządach [[Układ fagocytarny|układu siateczkowo-śródbłonkowego]]<ref>{{Cytuj książkę | nazwisko= Liberski | imię=Paweł P | nazwisko2= Papierz | imię2=Wielisław | nazwisko3= Kozubski | imię3=Wojciech | nazwisko4= Kłoszewska | imię4=Iwona | nazwisko5= Mossakowski | imię5=Mirosław Jan | inni= | tytuł= Neuropatologia Mossakowskiego | data=2005 | wydawca=Wydawnictwo Czelej | miejsce=Lublin | isbn=83-89309-63-7 | strony=77-78}}</ref>. Materiałem spichrzanym jest [[sfingomielina]]. Jako pierwszy jednostkę chorobową opisał [[Albert Niemann (pediatra)|Albert Niemann]] w 1914 roku<ref>{{cytuj pismo|autor=Niemann A|tytuł=Ein unbekanntes Krankheitsbild|czasopismo=Jahrbuch für Kinderheilkunde|rok=1914|wolumin=79|strony=1-10}}</ref>. |
||
=== Choroba Pompego === |
==== Choroba Pompego ==== |
||
{{osobny artykuł|Choroba Pompego}} |
{{osobny artykuł|Choroba Pompego}} |
||
Jedyna z glikogenoz należąca do grupy lizosomalnych chorób spichrzeniowych. Podłoże molekularne stanowi mutacja w genie ''[[GAA]]'' w części chromosomu 17q25<ref>{{OMIM|id=232300|nazwa=GLYCOGEN STORAGE DISEASE II}}</ref>. Skutkuje to brakiem enzymu – [[Glukozydazy|α-glukozydazy]] (kwaśnej maltazy). Efektem tego jest zaburzenie spichrzania [[glikogen]]u w organizmie, przy czym nie występują znaczące zaburzenia metabolizmu [[węglowodany|węglowodanów]] i epizody [[hipoglikemia|hipoglikemii]]. Niedobór ten powoduje zwiększone odkładanie glikogenu w [[wątroba|wątrobie]], [[mięsień|mięśniach]], [[budowa serca człowieka|sercu]], [[Komórki glejowe|komórkach glejowych]], jądrach ruchowych [[pień mózgu|pnia mózgu]] i rogach przednich [[Rdzeń kręgowy|rdzenia kręgowego]]. Występują trzy postacie choroby. Wspólnymi dla nich objawami są hipotonia i słabość mięśniowa, niewydolność serca i oddechowa<ref>[http://chorobapompego.pl/ Choroba Pompego]</ref><ref>[http://chorobapompego.pl Polska strona poświęcona chorobie Pompego]</ref><ref>[http://www.unitedpompe.com/ United Pompe Foundation] {{lang|en}}</ref><ref>[http://www.pompe.org.uk/ choroba Pompego w Association for Glycogen Storage Disease (UK)] {{lang|en}}</ref><ref>[http://www.pompe.com strona firmy Genzyme o chorobie Pompego] {{lang|en}}</ref>. |
Jedyna z glikogenoz należąca do grupy lizosomalnych chorób spichrzeniowych. Podłoże molekularne stanowi mutacja w genie ''[[GAA]]'' w części chromosomu 17q25<ref>{{OMIM|id=232300|nazwa=GLYCOGEN STORAGE DISEASE II}}</ref>. Skutkuje to brakiem enzymu – [[Glukozydazy|α-glukozydazy]] (kwaśnej maltazy). Efektem tego jest zaburzenie spichrzania [[glikogen]]u w organizmie, przy czym nie występują znaczące zaburzenia metabolizmu [[węglowodany|węglowodanów]] i epizody [[hipoglikemia|hipoglikemii]]. Niedobór ten powoduje zwiększone odkładanie glikogenu w [[wątroba|wątrobie]], [[mięsień|mięśniach]], [[budowa serca człowieka|sercu]], [[Komórki glejowe|komórkach glejowych]], jądrach ruchowych [[pień mózgu|pnia mózgu]] i rogach przednich [[Rdzeń kręgowy|rdzenia kręgowego]]. Występują trzy postacie choroby. Wspólnymi dla nich objawami są hipotonia i słabość mięśniowa, niewydolność serca i oddechowa<ref>[http://chorobapompego.pl/ Choroba Pompego]</ref><ref>[http://chorobapompego.pl Polska strona poświęcona chorobie Pompego]</ref><ref>[http://www.unitedpompe.com/ United Pompe Foundation] {{lang|en}}</ref><ref>[http://www.pompe.org.uk/ choroba Pompego w Association for Glycogen Storage Disease (UK)] {{lang|en}}</ref><ref>[http://www.pompe.com strona firmy Genzyme o chorobie Pompego] {{lang|en}}</ref>. |
||
=== Choroba Stargardta === |
==== Choroba Stargardta ==== |
||
{{Osobny artykuł|Choroba Stargardta}} |
{{Osobny artykuł|Choroba Stargardta}} |
||
Inne, często spotykane nazwy: '''dno żółto-plamiste''' {{ang.|Stargardt's disease, STGD}}, [[Łacina|łac.]] ''fundus flavimaculatus''.<br />Choroba Stargardta jest najczęstszą postacią dziedzicznego zwyrodnienia plamki nieletnich, dziedziczona autosomalnie recesywnie, to ciężka forma MD, która rozpoczyna się w późnym dzieciństwie i prowadzi do całkowitej ślepoty. Schorzenie to objawowo podobne do związanego z wiekiem zwyrodnienia plamki żółtej, i występuje w przybliżeniu u 10000 dzieci<ref name=mdsupport>[http://www.mdsupport.org/library/stargrdt.html Stargardt's Disease]</ref><ref>{{OMIM|id=248200|nazwa=STARGARDT DISEASE 1; STGD1}}</ref>. Podłoże molekularne stanowi mutacja w genie ''ABCA4'', rzadziej ''CNGB3'' albo ''ELOVL4''. W wyniku ekspresji ABCA4 wytwarzane jest białko zaangażowane w transportu energii do i z komórek fotoreceptorów w siatkówce. Mutacje w genie ABCA4 powodują wytwarzanie dysfunkcyjnego białka, które nie może wykonywać swojej funkcji transportowej. W wyniku degeneracji komórek fotoreceptorów następuje utrata wzroku. Niefunkcjonalnego białka ABCA4 prowadzi do akumulacji żółtej substancji tłuszczowej – [[lipofuscyna|lipofuscyny]] do gromadzenia się w [[Siatkówka (anatomia)|siatkówce]], materiał ten powoduje plamki, a ostatecznie utratę wzroku<ref name=mdsupport/><ref>{{Cytuj książkę|tytuł=Okulistyka. Podstawy kliniczne|inni=[[Maria Hanna Niżankowska]] (red.)|miejsce=Warszawa|wydawca=Wydawnictwo Lekarskie PZWL|rok=2007|isbn=9788320032246|strony=399-401}}</ref>. Chorobę jako pierwszy opisał berliński okulista [[Karl Stargardt]] w 1909 roku<ref>{{WhoNamedIt|synd|2306|Stargardt's disease}}</ref><ref>{{Cytuj pismo|autor=K. B. Stargardt|tytuł=Über familiäre, progressive Degeneration in der Makulagegend des Auges|czasopismo=Albrecht von Graefes Archiv für Ophthalmologie|rok=1909|wolumin=71|strony=534-50}}</ref>. |
Inne, często spotykane nazwy: '''dno żółto-plamiste''' {{ang.|Stargardt's disease, STGD}}, [[Łacina|łac.]] ''fundus flavimaculatus''.<br />Choroba Stargardta jest najczęstszą postacią dziedzicznego zwyrodnienia plamki nieletnich, dziedziczona autosomalnie recesywnie, to ciężka forma MD, która rozpoczyna się w późnym dzieciństwie i prowadzi do całkowitej ślepoty. Schorzenie to objawowo podobne do związanego z wiekiem zwyrodnienia plamki żółtej, i występuje w przybliżeniu u 10000 dzieci<ref name=mdsupport>[http://www.mdsupport.org/library/stargrdt.html Stargardt's Disease]</ref><ref>{{OMIM|id=248200|nazwa=STARGARDT DISEASE 1; STGD1}}</ref>. Podłoże molekularne stanowi mutacja w genie ''ABCA4'', rzadziej ''CNGB3'' albo ''ELOVL4''. W wyniku ekspresji ABCA4 wytwarzane jest białko zaangażowane w transportu energii do i z komórek fotoreceptorów w siatkówce. Mutacje w genie ABCA4 powodują wytwarzanie dysfunkcyjnego białka, które nie może wykonywać swojej funkcji transportowej. W wyniku degeneracji komórek fotoreceptorów następuje utrata wzroku. Niefunkcjonalnego białka ABCA4 prowadzi do akumulacji żółtej substancji tłuszczowej – [[lipofuscyna|lipofuscyny]] do gromadzenia się w [[Siatkówka (anatomia)|siatkówce]], materiał ten powoduje plamki, a ostatecznie utratę wzroku<ref name=mdsupport/><ref>{{Cytuj książkę|tytuł=Okulistyka. Podstawy kliniczne|inni=[[Maria Hanna Niżankowska]] (red.)|miejsce=Warszawa|wydawca=Wydawnictwo Lekarskie PZWL|rok=2007|isbn=9788320032246|strony=399-401}}</ref>. Chorobę jako pierwszy opisał berliński okulista [[Karl Stargardt]] w 1909 roku<ref>{{WhoNamedIt|synd|2306|Stargardt's disease}}</ref><ref>{{Cytuj pismo|autor=K. B. Stargardt|tytuł=Über familiäre, progressive Degeneration in der Makulagegend des Auges|czasopismo=Albrecht von Graefes Archiv für Ophthalmologie|rok=1909|wolumin=71|strony=534-50}}</ref>. |
||
=== Choroba tangierska === |
==== Choroba tangierska ==== |
||
{{Osobny artykuł|Choroba tangierska}} |
{{Osobny artykuł|Choroba tangierska}} |
||
Inne nazwy: choroba wyspy Tangier, rodzinny niedobór HDL, {{ang.|Analphalipoproteinemia, TGD}}<ref name="OMIM3">{{OMIM|id=205400|nazwa=Tangier disease; TGD}}</ref>.<br />Choroba Tanger jest dziedziczona autosomalnie recesywnie, charakteryzuje się znacznie obniżonym poziomem w osoczu lipoprotein wysokiej gęstości (HDL), co powoduje nagromadzenie w tkankach estrów cholesterolu. Przyczynę stanowi mutacja w genie ABCA1 (''ATP-binding cassette-1'', 600046) na chromosomie [[chromosom 9|9q]]31<ref name="OMIM3"/><ref>{{cytuj stronę|url=http://ghr.nlm.nih.gov/condition=tangierdisease?wf=1|tytuł=Genetics Home Reference}}</ref>.<br />Obraz kliniczny obejmuje bardzo wiele różnych objawów, należą do nich m.in.: żółto-pomarańczowy kolor [[Migdałek podniebienny|migdałków]], powiększenie wątroby, [[śledziona|śledziony]] i [[Węzeł chłonny|węzłów chłonnych]], [[hipertrójglicerydemia]] i nienormalne resztki [[chylomikron]]u, [[Kępki żółte|żółtaki]], [[splenomegalia]], zmętnienie [[rogówka|rogówki]]<ref name="OMIM3"/>. Ten zespół chorobowy został odkryty na [[Tangier (wyspa)|wyspie Tangier]] w pobliżu wybrzeży [[Wirginia|Wirginii]]. |
Inne nazwy: choroba wyspy Tangier, rodzinny niedobór HDL, {{ang.|Analphalipoproteinemia, TGD}}<ref name="OMIM3">{{OMIM|id=205400|nazwa=Tangier disease; TGD}}</ref>.<br />Choroba Tanger jest dziedziczona autosomalnie recesywnie, charakteryzuje się znacznie obniżonym poziomem w osoczu lipoprotein wysokiej gęstości (HDL), co powoduje nagromadzenie w tkankach estrów cholesterolu. Przyczynę stanowi mutacja w genie ABCA1 (''ATP-binding cassette-1'', 600046) na chromosomie [[chromosom 9|9q]]31<ref name="OMIM3"/><ref>{{cytuj stronę|url=http://ghr.nlm.nih.gov/condition=tangierdisease?wf=1|tytuł=Genetics Home Reference}}</ref>.<br />Obraz kliniczny obejmuje bardzo wiele różnych objawów, należą do nich m.in.: żółto-pomarańczowy kolor [[Migdałek podniebienny|migdałków]], powiększenie wątroby, [[śledziona|śledziony]] i [[Węzeł chłonny|węzłów chłonnych]], [[hipertrójglicerydemia]] i nienormalne resztki [[chylomikron]]u, [[Kępki żółte|żółtaki]], [[splenomegalia]], zmętnienie [[rogówka|rogówki]]<ref name="OMIM3"/>. Ten zespół chorobowy został odkryty na [[Tangier (wyspa)|wyspie Tangier]] w pobliżu wybrzeży [[Wirginia|Wirginii]]. |
||
=== Choroba Taruiego === |
==== Choroba Taruiego ==== |
||
{{osobny artykuł|Choroba Taruiego}} |
{{osobny artykuł|Choroba Taruiego}} |
||
Jest to bardzo rzadka choroba spichrzeniowa, której podłożem są mutacje w obrębie [[chromosom]]u 12p13, dziedziczona autosomalnie recesywnie. Bezpośrednią przyczyną choroby jest niedobór [[fosfofruktokinaza|fosfofruktokinazy]] (w [[mięsień|mięśniach]] prawie całkowity; w [[erytrocyt]]ach około 50% aktywności). [[Fosfofruktokinaza]] jest [[Enzymy|enzymem]], który katalizuje konwersję fruktozo-6-fosforanu do fruktozo-1,6-difosforanu podczas [[glikoliza|glikolizy]], toteż niedobór tego enzymu powoduje nadmierne nagromadzenie [[glikogen]]u w tkankach, w których występuje deficyt PFK. Objawy są podobne do tych jakie występują w [[choroba McArdle'a|chorobie McArdle’a]] (są to głównie bóle i skurcze mięśni, podwyższone stężenie enzymów mięśniowych po wysiłku, [[mioglobinuria]]). Występują trzy warianty choroby: wyjątkiem ''wariantu niemowlęcego'', który szybko prowadzi do zgonu, pozostałe typy schorzenia przebiegają jedynie z niewielkim upośledzeniem komfortu życia<ref>[[Włodzimierz Januszewicz|W.Januszewicz]], [[Franciszek Kokot|F.Kokot]] (red.), ''Interna'', Warszawa, Wydawnictwo Lekarskie PZWL, tom III, s. 1141-1142, {{ISBN|83-200-2873-6}}</ref><ref>{{WhoNamedIt|synd|3022|Tarui’s disease}}</ref><ref>[http://www.emedicine.com/ped/topic2209.htm Artykuł w eMedicine]</ref>. |
Jest to bardzo rzadka choroba spichrzeniowa, której podłożem są mutacje w obrębie [[chromosom]]u 12p13, dziedziczona autosomalnie recesywnie. Bezpośrednią przyczyną choroby jest niedobór [[fosfofruktokinaza|fosfofruktokinazy]] (w [[mięsień|mięśniach]] prawie całkowity; w [[erytrocyt]]ach około 50% aktywności). [[Fosfofruktokinaza]] jest [[Enzymy|enzymem]], który katalizuje konwersję fruktozo-6-fosforanu do fruktozo-1,6-difosforanu podczas [[glikoliza|glikolizy]], toteż niedobór tego enzymu powoduje nadmierne nagromadzenie [[glikogen]]u w tkankach, w których występuje deficyt PFK. Objawy są podobne do tych jakie występują w [[choroba McArdle'a|chorobie McArdle’a]] (są to głównie bóle i skurcze mięśni, podwyższone stężenie enzymów mięśniowych po wysiłku, [[mioglobinuria]]). Występują trzy warianty choroby: wyjątkiem ''wariantu niemowlęcego'', który szybko prowadzi do zgonu, pozostałe typy schorzenia przebiegają jedynie z niewielkim upośledzeniem komfortu życia<ref>[[Włodzimierz Januszewicz|W.Januszewicz]], [[Franciszek Kokot|F.Kokot]] (red.), ''Interna'', Warszawa, Wydawnictwo Lekarskie PZWL, tom III, s. 1141-1142, {{ISBN|83-200-2873-6}}</ref><ref>{{WhoNamedIt|synd|3022|Tarui’s disease}}</ref><ref>[http://www.emedicine.com/ped/topic2209.htm Artykuł w eMedicine]</ref>. |
||
=== Choroba Taya-Sachsa === |
==== Choroba Taya-Sachsa ==== |
||
[[Plik:Tay-sachsUMich.jpg|thumb|100px|Tay-sachsUMich|Obraz dna oka w chorobie Taya-Sachsa („objaw wisienki”)]] |
[[Plik:Tay-sachsUMich.jpg|thumb|100px|Tay-sachsUMich|Obraz dna oka w chorobie Taya-Sachsa („objaw wisienki”)]] |
||
{{osobny artykuł|Choroba Taya-Sachsa}} |
{{osobny artykuł|Choroba Taya-Sachsa}} |
||
| Linia 321: | Linia 442: | ||
To recesywna choroba z grupy [[Lizosomalne choroby spichrzeniowe|chorób spichrzeniowych]]<ref>{{OMIM|id=272800|nazwa=TAY-SACHS DISEASE; TSD}}</ref>, spowodowana mutacją punktową (najczęstszy typ mutacji to [[insercja]] czterech par zasad w [[ekson]]ie 11 lub [[mutacja miejsca splicingowego]] w [[intron]]ie 12), która powoduje brak w [[lizosom]]ach [[Neuron|komórek nerwowych]] enzymu heksozaminidazy A rozkładającego [[gangliozyd]]y, przez co odkładają się one w lizosomach. W związku z tym, niemowlę stopniowo traci nabyte umiejętności ruchowe, przestaje reagować na bodźce z otoczenia i ślepnie<ref name="connor">{{cytuj książkę|autor=Connor M, Ferguson-Smith M|tytuł=Podstawy genetyki medycznej|edycja=wyd. II|wydawca=Wydawnictwo Lekarskie PZWL|miejsce=Warszawa|rok=1997|isbn = 83-200-2250-9}}</ref>. Najczęściej śmierć następuje ok. 2-5 roku życia na skutek wzrostu masy mózgu o ok. 50%. Jest to jednak jedna z najrzadszych chorób – występuje głównie we wschodnioeuropejskiej populacji [[Żydzi aszkenazyjscy|Żydów aszkenazyjskich]]<ref>P. J. Vinken. ''Leucodystrophies and poliodystrophies''. North-Holland, 1970 s. 212</ref>. |
To recesywna choroba z grupy [[Lizosomalne choroby spichrzeniowe|chorób spichrzeniowych]]<ref>{{OMIM|id=272800|nazwa=TAY-SACHS DISEASE; TSD}}</ref>, spowodowana mutacją punktową (najczęstszy typ mutacji to [[insercja]] czterech par zasad w [[ekson]]ie 11 lub [[mutacja miejsca splicingowego]] w [[intron]]ie 12), która powoduje brak w [[lizosom]]ach [[Neuron|komórek nerwowych]] enzymu heksozaminidazy A rozkładającego [[gangliozyd]]y, przez co odkładają się one w lizosomach. W związku z tym, niemowlę stopniowo traci nabyte umiejętności ruchowe, przestaje reagować na bodźce z otoczenia i ślepnie<ref name="connor">{{cytuj książkę|autor=Connor M, Ferguson-Smith M|tytuł=Podstawy genetyki medycznej|edycja=wyd. II|wydawca=Wydawnictwo Lekarskie PZWL|miejsce=Warszawa|rok=1997|isbn = 83-200-2250-9}}</ref>. Najczęściej śmierć następuje ok. 2-5 roku życia na skutek wzrostu masy mózgu o ok. 50%. Jest to jednak jedna z najrzadszych chorób – występuje głównie we wschodnioeuropejskiej populacji [[Żydzi aszkenazyjscy|Żydów aszkenazyjskich]]<ref>P. J. Vinken. ''Leucodystrophies and poliodystrophies''. North-Holland, 1970 s. 212</ref>. |
||
=== Choroba Urbacha-Wiethego === |
==== Choroba Urbacha-Wiethego ==== |
||
{{osobny artykuł|Choroba Urbacha-Wiethego}} |
{{osobny artykuł|Choroba Urbacha-Wiethego}} |
||
Przyczyną jest mutacja z utratą funkcji w genie ''[[ECM1]]'', kodującym białko [[macierz pozakomórkowa|macierzy pozakomórkowej]]<ref>{{Cytuj pismo | nazwisko = Hamada | imię = T. | nazwisko2 = McLean | imię2 = W.H. | nazwisko3 = Ramsay | imię3 = M. | nazwisko4 = Ashton | imię4 = G.H. | nazwisko5 = Nanda | imię5 = A. | tytuł = Lipoid proteinosis maps to 1q21 and is caused by mutations in the extracellular matrix protein 1 gene (ECM1) | czasopismo = Human Molecular Genetics | wolumin = 11 | numer = 7 | strony = 833-840 | rok = 2002 | doi = 10.1093/hmg/11.7.833| pmid = 11929856}}</ref>, prowadzi ona do nieprawidłowości w budowie skóry i błon śluzowych, a także zwapnień w [[płat skroniowy|płatach skroniowych]] (w tym w [[ciało migdałowate|ciałach migdałowatych]])<ref>{{Cytuj pismo | nazwisko = Siebert | imię = M. | nazwisko2 = Markowitsch | imię2 = H.J. | nazwisko3 = Bartel | imię3 = P. | tytuł = Amygdala, affect and cognition: evidence from 10 patients with Urbach-Wiethe disease | czasopismo = Brain | wolumin = 126 | numer = Pt 12 | strony = 2627-2637 | rok = 2003 | doi = 10.1093/brain/awg271 | pmid = 12937075}}</ref>. Na obraz kliniczny choroby składają się objawy: bliznowacenie skóry, [[grudka|grudki]] powiek, [[chrypka]], [[padaczka]], zaburzenia psychiczne. Opisano około 300 przypadków, z czego około 25% wśród potomków Holendrów i Niemców w Afryce Południowej<ref>{{Cytuj pismo | nazwisko = Di Giandomenico | imię = S. | nazwisko2 = Masi | imię2 = R. | nazwisko3 = Cassandrini | imię3 = D. | nazwisko4 = El-Hachem | imię4 = M. | nazwisko5 = De Vito | imię5 = R. | tytuł = Lipoid proteinosis: case report and review of the literature | czasopismo = Acta Otorhinolaryngologica Italica| wolumin = 26 | numer = 3 | strony = 162-167 | rok = 2006 | doi = | pmid = 17063986}}</ref><ref>{{OMIM|id=247100|nazwa=LIPOID PROTEINOSIS OF URBACH AND WIETHE}}</ref>. |
Przyczyną jest mutacja z utratą funkcji w genie ''[[ECM1]]'', kodującym białko [[macierz pozakomórkowa|macierzy pozakomórkowej]]<ref>{{Cytuj pismo | nazwisko = Hamada | imię = T. | nazwisko2 = McLean | imię2 = W.H. | nazwisko3 = Ramsay | imię3 = M. | nazwisko4 = Ashton | imię4 = G.H. | nazwisko5 = Nanda | imię5 = A. | tytuł = Lipoid proteinosis maps to 1q21 and is caused by mutations in the extracellular matrix protein 1 gene (ECM1) | czasopismo = Human Molecular Genetics | wolumin = 11 | numer = 7 | strony = 833-840 | rok = 2002 | doi = 10.1093/hmg/11.7.833| pmid = 11929856}}</ref>, prowadzi ona do nieprawidłowości w budowie skóry i błon śluzowych, a także zwapnień w [[płat skroniowy|płatach skroniowych]] (w tym w [[ciało migdałowate|ciałach migdałowatych]])<ref>{{Cytuj pismo | nazwisko = Siebert | imię = M. | nazwisko2 = Markowitsch | imię2 = H.J. | nazwisko3 = Bartel | imię3 = P. | tytuł = Amygdala, affect and cognition: evidence from 10 patients with Urbach-Wiethe disease | czasopismo = Brain | wolumin = 126 | numer = Pt 12 | strony = 2627-2637 | rok = 2003 | doi = 10.1093/brain/awg271 | pmid = 12937075}}</ref>. Na obraz kliniczny choroby składają się objawy: bliznowacenie skóry, [[grudka|grudki]] powiek, [[chrypka]], [[padaczka]], zaburzenia psychiczne. Opisano około 300 przypadków, z czego około 25% wśród potomków Holendrów i Niemców w Afryce Południowej<ref>{{Cytuj pismo | nazwisko = Di Giandomenico | imię = S. | nazwisko2 = Masi | imię2 = R. | nazwisko3 = Cassandrini | imię3 = D. | nazwisko4 = El-Hachem | imię4 = M. | nazwisko5 = De Vito | imię5 = R. | tytuł = Lipoid proteinosis: case report and review of the literature | czasopismo = Acta Otorhinolaryngologica Italica| wolumin = 26 | numer = 3 | strony = 162-167 | rok = 2006 | doi = | pmid = 17063986}}</ref><ref>{{OMIM|id=247100|nazwa=LIPOID PROTEINOSIS OF URBACH AND WIETHE}}</ref>. |
||
=== Choroba Wilsona === |
==== Choroba Wilsona ==== |
||
{{osobny artykuł|Choroba Wilsona}} |
{{osobny artykuł|Choroba Wilsona}} |
||
Jest to choroba wywołana dziedziczoną [[dziedziczenie autosomalne recesywne|autosomalnie recesywnie]] [[mutacja|mutacją]] [[gen]]u ''ATP7B'' na [[chromosom 13|chromosomie 13]] (13q14.3), kodującego białko [[ATP-aza ATP7B|ATPazę ATP7B]]<ref name=bull>{{Cytuj pismo | nazwisko = Bull | imię = PC. | nazwisko2 = Thomas | imię2 = GR. | nazwisko3 = Rommens | imię3 = JM. | nazwisko4 = Forbes | imię4 = JR. | nazwisko5 = Cox | imię5 = DW. | tytuł = The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene | czasopismo = Nat Genet | wolumin = 5 | numer = 4 | strony = 327-37 | rok = 1993 | doi = 10.1038/ng1293-327 | pmid = 8298639}}</ref>. |
Jest to choroba wywołana dziedziczoną [[dziedziczenie autosomalne recesywne|autosomalnie recesywnie]] [[mutacja|mutacją]] [[gen]]u ''ATP7B'' na [[chromosom 13|chromosomie 13]] (13q14.3), kodującego białko [[ATP-aza ATP7B|ATPazę ATP7B]]<ref name=bull>{{Cytuj pismo | nazwisko = Bull | imię = PC. | nazwisko2 = Thomas | imię2 = GR. | nazwisko3 = Rommens | imię3 = JM. | nazwisko4 = Forbes | imię4 = JR. | nazwisko5 = Cox | imię5 = DW. | tytuł = The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene | czasopismo = Nat Genet | wolumin = 5 | numer = 4 | strony = 327-37 | rok = 1993 | doi = 10.1038/ng1293-327 | pmid = 8298639}}</ref>. |
||
| Linia 332: | Linia 453: | ||
Choroba Wilsona jest chorobą metabolizmu [[miedź|miedzi]], która powoduje objawy uszkodzenia narządów wewnętrznych związane ze odkładaniem się tego pierwiastka w: wątrobie, mózgu, rogówce oka i nerkach. Największe znaczenie kliniczne ma uszkodzenie wątroby prowadzące do [[marskość wątroby|marskości tego narządu]] i różnego typu zaburzenia neuro-psychiatryczne<ref name="epstein">{{cytuj książkę|autor=Richard J. Epstein|tytuł=Biologia molekularna człowieka. Molekularne podłoże zjawisk w stanie zdrowia i w przebiegu chorób|wydawca=Czelej|miejsce=Lublin|rok=2005|isbn = 83-89309-64-5|strony=589-590}}</ref>. |
Choroba Wilsona jest chorobą metabolizmu [[miedź|miedzi]], która powoduje objawy uszkodzenia narządów wewnętrznych związane ze odkładaniem się tego pierwiastka w: wątrobie, mózgu, rogówce oka i nerkach. Największe znaczenie kliniczne ma uszkodzenie wątroby prowadzące do [[marskość wątroby|marskości tego narządu]] i różnego typu zaburzenia neuro-psychiatryczne<ref name="epstein">{{cytuj książkę|autor=Richard J. Epstein|tytuł=Biologia molekularna człowieka. Molekularne podłoże zjawisk w stanie zdrowia i w przebiegu chorób|wydawca=Czelej|miejsce=Lublin|rok=2005|isbn = 83-89309-64-5|strony=589-590}}</ref>. |
||
=== Choroba van Buchema === |
==== Choroba van Buchema ==== |
||
{{Osobny artykuł|Choroba van Buchema}} |
{{Osobny artykuł|Choroba van Buchema}} |
||
| Linia 340: | Linia 461: | ||
Do charakterystycznych objawów należą: zwiększenie grubości kości, często rozszerzona szczęka, ale także powiększenie czaszki, żeber, trzonu kości długich, jak i rurowych kości dłoni i stóp, powodując [[hiperostoza korowa|hiperostozę korową]] zwiększenie gęstości kości korowej czaszki. Kliniczne konsekwencje zwiększonej grubości czaszki to porażenie nerwu twarzowego, powodujące utratę słuchu, zaburzeń widzenia, ból neurologiczny, a także bardzo rzadko ślepotę wynikającą z [[atrofia|atrofią]] i zanikiem nerwu wzrokowego oraz osteoskleroza, hiperfosfatemia. Anomalie kostne pojawiają się w pierwszej dekadzie życia i postępują z wiekiem<ref name="OMIM2"/><ref>http://omim.org/entry/239100#14</ref>. |
Do charakterystycznych objawów należą: zwiększenie grubości kości, często rozszerzona szczęka, ale także powiększenie czaszki, żeber, trzonu kości długich, jak i rurowych kości dłoni i stóp, powodując [[hiperostoza korowa|hiperostozę korową]] zwiększenie gęstości kości korowej czaszki. Kliniczne konsekwencje zwiększonej grubości czaszki to porażenie nerwu twarzowego, powodujące utratę słuchu, zaburzeń widzenia, ból neurologiczny, a także bardzo rzadko ślepotę wynikającą z [[atrofia|atrofią]] i zanikiem nerwu wzrokowego oraz osteoskleroza, hiperfosfatemia. Anomalie kostne pojawiają się w pierwszej dekadzie życia i postępują z wiekiem<ref name="OMIM2"/><ref>http://omim.org/entry/239100#14</ref>. |
||
=== Choroba von Gierkego === |
==== Choroba von Gierkego ==== |
||
{{osobny artykuł|Choroba von Gierkego}} |
{{osobny artykuł|Choroba von Gierkego}} |
||
Jest to najczęstsza z [[choroby spichrzeniowe glikogenu|glikogenoz]], stosunkowo rzadka choroba genetyczna, dziedziczona w sposób autosomalny recesywny. Polega na braku [[glukozo-6-fosfataza|glukozo-6-fosfatazy]], [[Enzymy|enzymu]] niezbędnego w procesie [[glukoneogeneza|glukoneogenezy]] (w '''GSD Ia''', czyli jej właściwej postaci). Wśród objawów klinicznych dominuje [[hepatomegalia]], [[hipoglikemia]], [[ketonuria]], okresowa [[neutropenia]] oraz [[kwasica mleczanowa]]<ref>Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Vicor W. Rodwell, ''Biochemia Harpera'', Warszawa, Wydawnictwo Lekarskie PZWL, str. 225, [[1995]], {{ISBN|83-200-1798-X}}</ref>. Odmiana '''GSD Ib''' jest spowodowana brakiem [[translokaza glukozo-6-fosforanu|translokazy glukozo-6-fosforanu]]. W wyniku tego niedoboru [[glukozo-6-fosforan]] nie może przedostać się do [[mikrosom]]ów (w błonie mikrosomalnej znajduje się glukozo-6-fosfataza)<ref>W. Januszewicz, [[Franciszek Kokot|F. Kokot]] (red.), ''Interna'', Warszawa, Wydawnictwo Lekarskie PZWL, tom III, ss. 1141-1142, {{ISBN|83-200-2873-6}}</ref><ref>http://www.emedicine.com/ped/topic2416.htm</ref><ref>{{OMIM|id=232200|nazwa=GLYCOGEN STORAGE DISEASE I}}</ref>. |
Jest to najczęstsza z [[choroby spichrzeniowe glikogenu|glikogenoz]], stosunkowo rzadka choroba genetyczna, dziedziczona w sposób autosomalny recesywny. Polega na braku [[glukozo-6-fosfataza|glukozo-6-fosfatazy]], [[Enzymy|enzymu]] niezbędnego w procesie [[glukoneogeneza|glukoneogenezy]] (w '''GSD Ia''', czyli jej właściwej postaci). Wśród objawów klinicznych dominuje [[hepatomegalia]], [[hipoglikemia]], [[ketonuria]], okresowa [[neutropenia]] oraz [[kwasica mleczanowa]]<ref>Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Vicor W. Rodwell, ''Biochemia Harpera'', Warszawa, Wydawnictwo Lekarskie PZWL, str. 225, [[1995]], {{ISBN|83-200-1798-X}}</ref>. Odmiana '''GSD Ib''' jest spowodowana brakiem [[translokaza glukozo-6-fosforanu|translokazy glukozo-6-fosforanu]]. W wyniku tego niedoboru [[glukozo-6-fosforan]] nie może przedostać się do [[mikrosom]]ów (w błonie mikrosomalnej znajduje się glukozo-6-fosfataza)<ref>W. Januszewicz, [[Franciszek Kokot|F. Kokot]] (red.), ''Interna'', Warszawa, Wydawnictwo Lekarskie PZWL, tom III, ss. 1141-1142, {{ISBN|83-200-2873-6}}</ref><ref>http://www.emedicine.com/ped/topic2416.htm</ref><ref>{{OMIM|id=232200|nazwa=GLYCOGEN STORAGE DISEASE I}}</ref>. |
||
=== Cystynoza === |
==== Cystynoza ==== |
||
[[Plik:Cystinosis.png|120px|Kryształki cystyny w rogówce 4,5-letniego pacjenta z cystynozą|thumb]] |
[[Plik:Cystinosis.png|120px|Kryształki cystyny w rogówce 4,5-letniego pacjenta z cystynozą|thumb]] |
||
{{Osobny artykuł|Cystynoza}} |
{{Osobny artykuł|Cystynoza}} |
||
| Linia 351: | Linia 472: | ||
Inne nazwy: {{ang.|Cystinosis, late-onset juvenile or adolescent nephropathic}}<ref name="OMIM4">{{OMIM|id=219900|nazwa=CYSTINOSIS, LATE-ONSET JUVENILE OR ADOLESCENT NEPHROPATHIC TYPE}}</ref>.<br />Cystynoza to choroba metaboliczna zaliczana do lizosomalnych chorób spichrzeniowych, w której przebiegu w lizosomach gromadzi się aminokwas [[cystyna]]. Dziedziczona jest w sposób autosomalny recesywny. Nefropatyczna cystynoza jest spowodowana mutacją w obrębie genu kodującego cystynę (606272), który znajduje się na chromosomie 17p13<ref name="Attard">{{Cytuj|autor=Marlene Attard, Geneviève Jean, Lionel Forestier, Stèphanie Cherqui, William van't Hoff|tytuł=Severity of phenotype in cystinosis varies with mutations in the CTNS gene: predicted effect on the model of cystinosin|czasopismo=Human Molecular Genetics|data=1999-12-01|data dostępu=2016-12-25|issn=0964-6906|wydanie=13|s=2507–2514|doi=10.1093/hmg/8.13.2507|pmid=10556299|url=http://hmg.oxfordjournals.org/content/8/13/2507|język=en}}</ref>.<br />Wyróżnia się trzy typy choroby: niemowlęcy nefropatyczny ([OMIM#219800]<ref>{{OMIM|id=219800|nazwa=CYSTINOSIS, NEPHROPATHIC; CTNS}}</ref>); dziecięcy lub młodzieńczy nefropatyczny ([OMIM#219900]<ref name="OMIM4"/>); nienefropatyczny dorosłych ([OMIM#219750]<ref>{{OMIM|id=219750|nazwa=CYSTINOSIS, ADULT NONNEPHROPATHIC}}</ref>). Objawy obejmują: niedobór wzrostu w pierwszym roku życia, [[niechęć do ssania]] w wieku niemowlęcym, wydatne czoło, nieprawidłowości oczne: [[światłowstręt]], [[retinopatia]], obniżona ostrość wzroku, kryształki w rogówce, [[różaniec krzywiczy]], [[hepatomegalia]], [[splenomegalia]], niewydolność trzustki, [[zespół Fanconiego]], niewydolność nerek, [[kamica nerkowa]] (moczanowa i szczawianowa), opóźniony [[wiek kostny]], [[kolana koślawe]], jasne włosy i skóra, męczliwość mięśni, miopatia, [[dysfagia|trudności w połykaniu]], prawidłowa inteligencja, atrofia mózgu, nawracające epizody kwasicy i odwodnień, [[Wielomocz|poliuria]] i [[polidypsja]]<ref>{{Cytuj|autor=H. Goldman, C. R. Scriver, K. Aaron, E. Delvin, Z. Canlas|tytuł=Adolescent Cystinosis: Comparisons with Infantile and Adult Forms|czasopismo=Pediatrics|data=1971-06-01|data dostępu=2016-12-25|issn=0031-4005|wydanie=6|s=979–988|pmid=5141767|url=http://pediatrics.aappublications.org/content/47/6/979|język=en}}</ref><ref name="Attard"/><ref>{{Cytuj|autor=J Macías-Vidal, M Rodés, Jm Hernández-Pérez, Ma Vilaseca, Mj Coll|tytuł=Analysis of the CTNS gene in 32 cystinosis patients from Spain|czasopismo=Clinical Genetics|data=2009-11-01|data dostępu=2016-12-25|issn=1399-0004|wydanie=5|s=486–489|doi=10.1111/j.1399-0004.2009.01222.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2009.01222.x/abstract|język=en}}</ref>. Do nieprawidłowości biochemicznych należą: [[białkomocz]], [[cukromocz|glukozuria]] przy normoglikemii, [[hiponatremia]], [[hipokaliemia]], niedobór karnityny, [[hipofosfatemia]], [[krwinkomocz]], [[aminoaciduria|aminoacyduria]]<ref name="OMIM4"/><ref>{{Cytuj|autor=Geraldine A. McDowell, William A. Gahl, Leah A. Stephenson, Jerry A. Schneider, Jean Weissenbach|tytuł=Linkage of the gene for cystinosis to markers on the short arm of chromosome 17|czasopismo=Nature Genetics|data=1995-06-01|data dostępu=2016-12-25|wydanie=2|s=246–248|doi=10.1038/ng0695-246|url=http://www.nature.com/ng/journal/v10/n2/abs/ng0695-246.html|język=en}}</ref><ref name="Attard"/>. |
Inne nazwy: {{ang.|Cystinosis, late-onset juvenile or adolescent nephropathic}}<ref name="OMIM4">{{OMIM|id=219900|nazwa=CYSTINOSIS, LATE-ONSET JUVENILE OR ADOLESCENT NEPHROPATHIC TYPE}}</ref>.<br />Cystynoza to choroba metaboliczna zaliczana do lizosomalnych chorób spichrzeniowych, w której przebiegu w lizosomach gromadzi się aminokwas [[cystyna]]. Dziedziczona jest w sposób autosomalny recesywny. Nefropatyczna cystynoza jest spowodowana mutacją w obrębie genu kodującego cystynę (606272), który znajduje się na chromosomie 17p13<ref name="Attard">{{Cytuj|autor=Marlene Attard, Geneviève Jean, Lionel Forestier, Stèphanie Cherqui, William van't Hoff|tytuł=Severity of phenotype in cystinosis varies with mutations in the CTNS gene: predicted effect on the model of cystinosin|czasopismo=Human Molecular Genetics|data=1999-12-01|data dostępu=2016-12-25|issn=0964-6906|wydanie=13|s=2507–2514|doi=10.1093/hmg/8.13.2507|pmid=10556299|url=http://hmg.oxfordjournals.org/content/8/13/2507|język=en}}</ref>.<br />Wyróżnia się trzy typy choroby: niemowlęcy nefropatyczny ([OMIM#219800]<ref>{{OMIM|id=219800|nazwa=CYSTINOSIS, NEPHROPATHIC; CTNS}}</ref>); dziecięcy lub młodzieńczy nefropatyczny ([OMIM#219900]<ref name="OMIM4"/>); nienefropatyczny dorosłych ([OMIM#219750]<ref>{{OMIM|id=219750|nazwa=CYSTINOSIS, ADULT NONNEPHROPATHIC}}</ref>). Objawy obejmują: niedobór wzrostu w pierwszym roku życia, [[niechęć do ssania]] w wieku niemowlęcym, wydatne czoło, nieprawidłowości oczne: [[światłowstręt]], [[retinopatia]], obniżona ostrość wzroku, kryształki w rogówce, [[różaniec krzywiczy]], [[hepatomegalia]], [[splenomegalia]], niewydolność trzustki, [[zespół Fanconiego]], niewydolność nerek, [[kamica nerkowa]] (moczanowa i szczawianowa), opóźniony [[wiek kostny]], [[kolana koślawe]], jasne włosy i skóra, męczliwość mięśni, miopatia, [[dysfagia|trudności w połykaniu]], prawidłowa inteligencja, atrofia mózgu, nawracające epizody kwasicy i odwodnień, [[Wielomocz|poliuria]] i [[polidypsja]]<ref>{{Cytuj|autor=H. Goldman, C. R. Scriver, K. Aaron, E. Delvin, Z. Canlas|tytuł=Adolescent Cystinosis: Comparisons with Infantile and Adult Forms|czasopismo=Pediatrics|data=1971-06-01|data dostępu=2016-12-25|issn=0031-4005|wydanie=6|s=979–988|pmid=5141767|url=http://pediatrics.aappublications.org/content/47/6/979|język=en}}</ref><ref name="Attard"/><ref>{{Cytuj|autor=J Macías-Vidal, M Rodés, Jm Hernández-Pérez, Ma Vilaseca, Mj Coll|tytuł=Analysis of the CTNS gene in 32 cystinosis patients from Spain|czasopismo=Clinical Genetics|data=2009-11-01|data dostępu=2016-12-25|issn=1399-0004|wydanie=5|s=486–489|doi=10.1111/j.1399-0004.2009.01222.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2009.01222.x/abstract|język=en}}</ref>. Do nieprawidłowości biochemicznych należą: [[białkomocz]], [[cukromocz|glukozuria]] przy normoglikemii, [[hiponatremia]], [[hipokaliemia]], niedobór karnityny, [[hipofosfatemia]], [[krwinkomocz]], [[aminoaciduria|aminoacyduria]]<ref name="OMIM4"/><ref>{{Cytuj|autor=Geraldine A. McDowell, William A. Gahl, Leah A. Stephenson, Jerry A. Schneider, Jean Weissenbach|tytuł=Linkage of the gene for cystinosis to markers on the short arm of chromosome 17|czasopismo=Nature Genetics|data=1995-06-01|data dostępu=2016-12-25|wydanie=2|s=246–248|doi=10.1038/ng0695-246|url=http://www.nature.com/ng/journal/v10/n2/abs/ng0695-246.html|język=en}}</ref><ref name="Attard"/>. |
||
==== Dysplazja Lewandowsky'ego-Lutza ==== |
|||
=== Daltonizm === |
|||
{{osobny artykuł|Daltonizm}} |
|||
Podobnie jak hemofilia jest to choroba recesywna sprzężona z płcią, co oznacza, że allel warunkujący zapadanie na tą chorobę nie ujawnia się, jeśli obok niego występuje allel dominujący odpowiadający za prawidłowe widzenie barw (inna nazwa tej choroby to ''ślepota barw'' i zdradza częściowo jej objawy). W związku z tym, że wadliwy gen znajduje się jedynie na chromosomie X, u mężczyzn wystarczy odziedziczenie go po matce, by ujawnił się pełen zespół objawów, nawet jeśli ojciec jest zdrowy. To powoduje, że mężczyźni zapadają na tą chorobę znacznie częściej niż kobiety, które w tym wypadku muszą być [[Homozygota recesywna|homozygotą recesywną]] żeby być daltonistkami (znacznie mniejsze prawdopodobieństwo)<ref>Sharpe, L.T.; Stockman, A.; Jägle, H.; Nathans, J. (1999). ''Opsin genes, cone photopigments, color vision and color blindness'', rozdział w: Gegenfurtner, K. R.; Sharpe, L. T. ''Color Vision: From Genes to Perception''. Cambridge University Press. {{ISBN|978-0-521-00439-8}}</ref>. Do głównych skutków mutacji jednogenowej należy brak lub zmniejszona ilość barwników wzrokowych (np. [[Jodopsyna|jodopsyny]]) odpowiedzialnych za rozróżnianie barw. Objawy kliniczne to najczęściej niezdolność do odróżniania barwy zielonej lub czerwonej lub obu. Występuje w różnym nasileniu{{odn|Mizerski|2013|s=314}}. Inna nazwa tej choroby, to: deuteranopia<ref>{{Cytuj stronę|url = http://encyklopedia.pwn.pl/haslo/daltonizm;3890431.html|tytuł = Internetowa encyklopedia PWN|autor = |data dostępu = 2014-11-02|opublikowany = |język =}}</ref>. |
|||
=== Dysplazja Lewandowsky'ego-Lutza === |
|||
{{osobny artykuł|Epidermodysplasia verruciformis}} |
{{osobny artykuł|Epidermodysplasia verruciformis}} |
||
Autosomalnie recesywnie dziedziczona rzadka choroba skóry, której molekularną przyczyną są mutacje w obrębie jednego z dwóch sąsiadujących genów na [[chromosom 17|chromosomie 17]]: ''[[EVER1]]'' albo ''[[EVER2]]'', które powstają w wyniku zainfekowania wirusem [[wirus brodawczaka ludzkiego|HPV]] (typy 5, 8 i 14) u osób o określonej predyspozycji genetycznej<ref>{{OMIM|id=226400|nazwa=EPIDERMODYSPLASIA VERRUCIFORMIS; EV}}</ref>. Na obraz kliniczny składają się objawy: wykwity w EV o charakterze płaskich [[grudka|grudek]], [[plama (dermatologia)|plam]] rumieniowych lub przebarwień, występujące zwykle w dzieciństwie, utrzymujące i nasilające się całe życie; dotyczą najczęściej czoła, grzbietów rąk, przedramion i podudzi, stopniowo się uogólniają; włosy, błony śluzowe i paznokcie pozostają nie zajęte<ref>[http://www.dermis.net/dermisroot/en/14286/diagnose.htm Epidermodysplasia verruciformis] na stronie [http://web.archive.org/web/*/http://www.dermis.net/index_e.html DermIS.net] {{lang|en}}</ref>. Zmiany skórne w EV stanowią punkt wyjścia [[nowotwór złośliwy skóry|raków skóry]]<ref>Stefania Jabłońska, Sławomir Majewski ''Choroby skóry i choroby przenoszone drogą płciową'' PZWL 2005, {{ISBN|83-200-3367-5}}</ref>. |
Autosomalnie recesywnie dziedziczona rzadka choroba skóry, której molekularną przyczyną są mutacje w obrębie jednego z dwóch sąsiadujących genów na [[chromosom 17|chromosomie 17]]: ''[[EVER1]]'' albo ''[[EVER2]]'', które powstają w wyniku zainfekowania wirusem [[wirus brodawczaka ludzkiego|HPV]] (typy 5, 8 i 14) u osób o określonej predyspozycji genetycznej<ref>{{OMIM|id=226400|nazwa=EPIDERMODYSPLASIA VERRUCIFORMIS; EV}}</ref>. Na obraz kliniczny składają się objawy: wykwity w EV o charakterze płaskich [[grudka|grudek]], [[plama (dermatologia)|plam]] rumieniowych lub przebarwień, występujące zwykle w dzieciństwie, utrzymujące i nasilające się całe życie; dotyczą najczęściej czoła, grzbietów rąk, przedramion i podudzi, stopniowo się uogólniają; włosy, błony śluzowe i paznokcie pozostają nie zajęte<ref>[http://www.dermis.net/dermisroot/en/14286/diagnose.htm Epidermodysplasia verruciformis] na stronie [http://web.archive.org/web/*/http://www.dermis.net/index_e.html DermIS.net] {{lang|en}}</ref>. Zmiany skórne w EV stanowią punkt wyjścia [[nowotwór złośliwy skóry|raków skóry]]<ref>Stefania Jabłońska, Sławomir Majewski ''Choroby skóry i choroby przenoszone drogą płciową'' PZWL 2005, {{ISBN|83-200-3367-5}}</ref>. |
||
==== Dziedziczny rak piersi i jajnika ==== |
|||
=== Dystrofia mięśniowa === |
|||
{{osobny artykuł|Dystrofia mięśniowa Duchenne’a}} |
|||
Mutacje w pojedynczym genie zlokalizowanym na chromosomie X ([[locus|prążek]] Xp21) są przyczyną [[Dystrofie mięśniowe|dystrofii mięśniowych]] typu [[Dystrofia mięśniowa Duchenne’a|Duchenne’a]] (DMD) i Beckera (BMD)<ref>{{OMIM|id=310200|nazwa=MUSCULAR DYSTROPHY, DUCHENNE TYPE; DMD}}</ref>. Szacuje się, że DMD występuje u 1 na 3500 chłopców, ujawniając się w 2-3 roku życia postępującym zanikiem mięśni. BMD ma przebieg łagodniejszy<ref name=":2" />. To najczęstsza prowadząca do śmierci dziedziczona recesywnie [[Choroby sprzężone z płcią|choroba sprzężona z płcią]]<ref>{{Cytuj pismo | nazwisko = Mendell | imię = JR | nazwisko2 = Sahenk | imię2 = Z | nazwisko3 = Prior | imię3 = TW | tytuł = The childhood muscular dystrophies: diseases sharing a common pathogenesis of membrane instability | czasopismo = J Child Neurol | wolumin = 10 | numer = 2 | strony = 150–159 | rok = 1995 | doi = 10.1177/088307389501000219 | pmid = 7782608}}</ref>. Choroba ma charakter postępujący, początkowo zajmuje [[Mięsień poprzecznie prążkowany|mięśnie szkieletowe]], potem także [[mięsień sercowy]] – prowadząc do [[Kardiomiopatie|kardiomiopatii]]. Pierwsze objawy występują w wieku 3–8 lat. Obejmują opóźniony rozwój ruchowy, kaczkowaty chód i kłopoty z bieganiem oraz chodzeniem po schodach. Chorzy przy wstawaniu pomagają sobie rękami ([[objaw Gowersa]])<ref>{{otwarty dostęp}} {{Cytuj pismo | nazwisko = Ferrier | imię = P. | nazwisko2 = Bamatter | imię2 = F. | nazwisko3 = Klein | imię3 = D. | tytuł = Muscular Dystrophy (Duchenne) in a Girl with Turner's Syndrome | czasopismo = J Med Genet | wolumin = 2 | numer = 1 | strony = 38-46 | rok = 1965 | doi = 10.1136/jmg.2.1.38 | pmid = 14296923 | pmc = 1012803| url = http://jmg.bmj.com/content/2/1/38.full.pdf}}</ref>. |
|||
=== Dziedziczny rak piersi i jajnika === |
|||
{{osobny artykuł|Dziedziczny rak piersi i jajnika}} |
{{osobny artykuł|Dziedziczny rak piersi i jajnika}} |
||
Do najczęstszych przyczyn dziedzicznych raków tych narządów należą [[mutacja|mutacje]] w genach ''[[BRCA1]]'' i ''[[BRCA2]]''. Dziedziczny rak piersi i jajnika jest heterogenną etiologicznie i klinicznie grupą zespołów predyspozycji do nowotworów sutka i (lub) jajnika<ref>{{cytuj książkę|autor=Jacek Gronwald, Tomasz Byrski, Tomasz Huzarski, Oleg Oszurek, Janusz Menkiszak, Izabella Rzepka–Górska, Jan Lubiński|tytuł=Nowotwory dziedziczne 2002. Profilaktyka, diagnostyka, leczenie|rozdział=[http://genetyka.pam.szczecin.pl/download/3.pdf Dziedziczny rak piersi i jajnika]|strony=35-49|[[Jan Lubiński]] (red.)|wydawca=Termedia Wydawnictwa Medyczne|rok=2002|miejsce=Poznań|isbn = 83-916594-1-0}}</ref><ref>{{Cytuj pismo|autor=Fiona Lalloo, D Gareth R Evans|tytuł=The pathology of familial breast cancer: Clinical and genetic counselling implications of breast cancer pathology|czasopismo=Breast Cancer Res|rok=1999|oznaczenie=1|strony=48-51}} {{doi|10.1186/bcr13}}</ref>. [[Diagnostyka preimplantacyjna|Diagnostyce]] poddaje się [[komórka jajowa|komórki jajowe]] lub komórki [[zarodek|zarodka]] przed podaniem do jamy macicy ([[implantacja (fizjologia)|implantacją]]). Jest to badanie genetyczne związane z [[zapłodnienie pozaustrojowe|technikami wspomaganego rozrodu]]. Z diagnostyki preimplantacyjnej korzystają przede wszystkim pary poddające się zapłodnieniu In vitro. Badanie to pozwala na wyeliminowanie zarodków obciążonych wadami genetycznymi przed implantacją do jamy macicy<ref>{{cytuj stronę|url=http://www.eshre.eu/binarydata.aspx?type=doc&sessionId=sbz4itbhfjfw1e4503hfzu45/Guidelines_for_FISH-based_PGD.pdf|tytuł=Guidelines for FISH-based PGD|autor=ESHRE}}</ref>. |
Do najczęstszych przyczyn dziedzicznych raków tych narządów należą [[mutacja|mutacje]] w genach ''[[BRCA1]]'' i ''[[BRCA2]]''. Dziedziczny rak piersi i jajnika jest heterogenną etiologicznie i klinicznie grupą zespołów predyspozycji do nowotworów sutka i (lub) jajnika<ref>{{cytuj książkę|autor=Jacek Gronwald, Tomasz Byrski, Tomasz Huzarski, Oleg Oszurek, Janusz Menkiszak, Izabella Rzepka–Górska, Jan Lubiński|tytuł=Nowotwory dziedziczne 2002. Profilaktyka, diagnostyka, leczenie|rozdział=[http://genetyka.pam.szczecin.pl/download/3.pdf Dziedziczny rak piersi i jajnika]|strony=35-49|[[Jan Lubiński]] (red.)|wydawca=Termedia Wydawnictwa Medyczne|rok=2002|miejsce=Poznań|isbn = 83-916594-1-0}}</ref><ref>{{Cytuj pismo|autor=Fiona Lalloo, D Gareth R Evans|tytuł=The pathology of familial breast cancer: Clinical and genetic counselling implications of breast cancer pathology|czasopismo=Breast Cancer Res|rok=1999|oznaczenie=1|strony=48-51}} {{doi|10.1186/bcr13}}</ref>. [[Diagnostyka preimplantacyjna|Diagnostyce]] poddaje się [[komórka jajowa|komórki jajowe]] lub komórki [[zarodek|zarodka]] przed podaniem do jamy macicy ([[implantacja (fizjologia)|implantacją]]). Jest to badanie genetyczne związane z [[zapłodnienie pozaustrojowe|technikami wspomaganego rozrodu]]. Z diagnostyki preimplantacyjnej korzystają przede wszystkim pary poddające się zapłodnieniu In vitro. Badanie to pozwala na wyeliminowanie zarodków obciążonych wadami genetycznymi przed implantacją do jamy macicy<ref>{{cytuj stronę|url=http://www.eshre.eu/binarydata.aspx?type=doc&sessionId=sbz4itbhfjfw1e4503hfzu45/Guidelines_for_FISH-based_PGD.pdf|tytuł=Guidelines for FISH-based PGD|autor=ESHRE}}</ref>. |
||
=== Fenyloketonuria === |
==== Fenyloketonuria ==== |
||
{{osobny artykuł|Fenyloketonuria}} |
{{osobny artykuł|Fenyloketonuria}} |
||
Skutkiem mutacji jest niedobór lub brak enzymu hydroksylazy fenyloalaninowej w [[Wątroba|wątrobie]], co uniemożliwia przekształcenie fenyloalaniny w tyrozynę. Objawy kliniczne to: nieprawidłowy rozwój umysłowy dziecka niedowłady, drgawki, niedobór melaniny (powstającej z tyrozyny) – jasny kolor skóry, włosów, oczu, „mysi” zapach potu i moczu, uszkodzenie układu nerwowego{{odn|Mizerski|2013|s=316}}. |
Skutkiem mutacji jest niedobór lub brak enzymu hydroksylazy fenyloalaninowej w [[Wątroba|wątrobie]], co uniemożliwia przekształcenie fenyloalaniny w tyrozynę. Objawy kliniczne to: nieprawidłowy rozwój umysłowy dziecka niedowłady, drgawki, niedobór melaniny (powstającej z tyrozyny) – jasny kolor skóry, włosów, oczu, „mysi” zapach potu i moczu, uszkodzenie układu nerwowego{{odn|Mizerski|2013|s=316}}. |
||
=== Galaktozemia === |
==== Galaktozemia ==== |
||
{{osobny artykuł|Galaktozemia}} |
{{osobny artykuł|Galaktozemia}} |
||
W wyniku mutacji powstaje defekt enzymu przekształcającego [[Galaktoza|galaktozę]] (zawartą w mleku) w glukozę; gromadzi się galaktozo-1-fosforan. Z tego powodu u chorych dzieci karmionych [[Mleko|mlekiem]] występują zmiany w układzie nerwowym, uszkodzenia [[Nerka|nerek]] i wątroby. Częstym objawem są również zaburzenia funkcji [[jajnik]]ów{{odn|Mizerski|2013|s=316}}. |
W wyniku mutacji powstaje defekt enzymu przekształcającego [[Galaktoza|galaktozę]] (zawartą w mleku) w glukozę; gromadzi się galaktozo-1-fosforan. Z tego powodu u chorych dzieci karmionych [[Mleko|mlekiem]] występują zmiany w układzie nerwowym, uszkodzenia [[Nerka|nerek]] i wątroby. Częstym objawem są również zaburzenia funkcji [[jajnik]]ów{{odn|Mizerski|2013|s=316}}. |
||
=== Hemochromatoza pierwotna === |
==== Hemochromatoza pierwotna ==== |
||
[[Plik:Hemosiderosis high mag.jpg|thumb|100px|Hemosiderosis high mag|hemochromatoza widoczna w biopsji wątroby]] |
[[Plik:Hemosiderosis high mag.jpg|thumb|100px|Hemosiderosis high mag|hemochromatoza widoczna w biopsji wątroby]] |
||
{{osobny artykuł|Hemochromatoza pierwotna}} |
{{osobny artykuł|Hemochromatoza pierwotna}} |
||
| Linia 386: | Linia 498: | ||
Hemochromatoza pierwotna jest dziedziczną [[Wrodzone błędy metabolizmu|chorobą metaboliczną]] spowodowaną mutacją genu ''HFE'', który znajduje się w chromosomie 6. i odpowiada za kontrolę wchłaniania żelaza w komórkach nabłonka jelit. Efektem mutacji jest recesywny allel genu ''HFE'', kodujący łańcuch polipeptydowy enzymu, w którym tyrozyna została zastąpiona przez [[cysteina|cysteinę]]<ref name=":0">Mutacje założycielskie – Dennis Drayna, Świat Nauki Nr 11 (171), listopad 2005; s. 35-41</ref><ref>Robbins Patologia - Kumar, Cotran, Robbins, wyd I polskie pod redakcją Włodzimierza T. Olszewskiego, Wydawnictwo Medyczne Urban&Partner Wrocław 2005 {{ISBN|978-83-89581-92-1}} str. 707</ref>. Skutkuje to zwiększonym pobieraniem [[żelazo|żelaza]] z pokarmu i jego stopniowym gromadzeniem się w niektórych narządach (szczególnie w [[wątroba|wątrobie]]), co może po dłuższym czasie wywołać uszkodzenia tych narządów. Choroba ujawnia się przeważnie dopiero pomiędzy 40. i 60. rokiem życia (częściej i we wcześniejszym okresie życia jest diagnozowana u mężczyzn)<ref>CKE, ''Informator o egzaminie maturalnym z biologii od roku szkolnego 2014/2015'', Warszawa 2013, zad. 16.</ref>. Do objawów należ: ciągłe uczucie zmęczenia, bóle [[Staw (anatomia)|stawów]], dolegliwości żołądkowo-jelitowe, powiększenie wątroby (która ulega [[Marskość wątroby|marskości drobnoguzkowej]]) oraz [[zaburzenia rytmu serca]], obniżone [[libido]]<ref>[http://www.wrongdiagnosis.com/symptoms/libido_symptoms/common.htm Common causes of Libido symptoms - WrongDiagnosis.com<!-- Tytuł wygenerowany przez bota -->]</ref>, szarobrązowe zabarwienie [[Skóra|skóry]] spowodowane uszkodzeniem [[Kora nadnercza|kory nadnerczy]] złogami [[Hemosyderyna|hemosyderyny]], co wywołuje zmniejszenie wydzielania [[Hormony zwierzęce|hormonów]] nadnerczowych, co z kolei powoduje nadmierne wydzielanie [[Proopiomelanokortyna|proopiomelanokortyny]] z [[Przysadka mózgowa|przysadki]], z której na drodze enzymatycznej powstają: [[Hormon adrenokortykotropowy|ACTH]], [[beta-endorfina]], [[Hormon lipotropowy|LPH]] i [[Melanotropina|MSH]] (hormon melanotropowy). MSH stymuluje [[melanocyty]] do wytwarzania melaniny, co przyczynia się do zmiany zabarwienia skóry<ref>{{Cytuj książkę | nazwisko= Stachura | imię=Jerzy | nazwisko2= Domagała | imię2=Wenancjusz | nazwisko3= | imię3= | inni= | tytuł= Patologia : znaczy słowo o chorobie. T. 2, Patologia narządowa. Cz. 1 | data=2005 | wydawca=PAU | miejsce=Kraków | id={{ISBN|83-88857-92-4}} (t.2, cz.1) | strony=}}</ref>. Inne nazwy to: '''hemochromatoza wrodzona''', ''cukrzyca brunatna'' i ''cukrzyca brązowa'' (''diabetes bronze'')<ref>{{Cytuj|autor=HCV|tytuł=HCV Prometeusze|data dostępu=2016-12-17|język=en|opublikowany=www.prometeusze.pl|url=http://www.prometeusze.pl/hemochromatoza.php}}</ref>. |
Hemochromatoza pierwotna jest dziedziczną [[Wrodzone błędy metabolizmu|chorobą metaboliczną]] spowodowaną mutacją genu ''HFE'', który znajduje się w chromosomie 6. i odpowiada za kontrolę wchłaniania żelaza w komórkach nabłonka jelit. Efektem mutacji jest recesywny allel genu ''HFE'', kodujący łańcuch polipeptydowy enzymu, w którym tyrozyna została zastąpiona przez [[cysteina|cysteinę]]<ref name=":0">Mutacje założycielskie – Dennis Drayna, Świat Nauki Nr 11 (171), listopad 2005; s. 35-41</ref><ref>Robbins Patologia - Kumar, Cotran, Robbins, wyd I polskie pod redakcją Włodzimierza T. Olszewskiego, Wydawnictwo Medyczne Urban&Partner Wrocław 2005 {{ISBN|978-83-89581-92-1}} str. 707</ref>. Skutkuje to zwiększonym pobieraniem [[żelazo|żelaza]] z pokarmu i jego stopniowym gromadzeniem się w niektórych narządach (szczególnie w [[wątroba|wątrobie]]), co może po dłuższym czasie wywołać uszkodzenia tych narządów. Choroba ujawnia się przeważnie dopiero pomiędzy 40. i 60. rokiem życia (częściej i we wcześniejszym okresie życia jest diagnozowana u mężczyzn)<ref>CKE, ''Informator o egzaminie maturalnym z biologii od roku szkolnego 2014/2015'', Warszawa 2013, zad. 16.</ref>. Do objawów należ: ciągłe uczucie zmęczenia, bóle [[Staw (anatomia)|stawów]], dolegliwości żołądkowo-jelitowe, powiększenie wątroby (która ulega [[Marskość wątroby|marskości drobnoguzkowej]]) oraz [[zaburzenia rytmu serca]], obniżone [[libido]]<ref>[http://www.wrongdiagnosis.com/symptoms/libido_symptoms/common.htm Common causes of Libido symptoms - WrongDiagnosis.com<!-- Tytuł wygenerowany przez bota -->]</ref>, szarobrązowe zabarwienie [[Skóra|skóry]] spowodowane uszkodzeniem [[Kora nadnercza|kory nadnerczy]] złogami [[Hemosyderyna|hemosyderyny]], co wywołuje zmniejszenie wydzielania [[Hormony zwierzęce|hormonów]] nadnerczowych, co z kolei powoduje nadmierne wydzielanie [[Proopiomelanokortyna|proopiomelanokortyny]] z [[Przysadka mózgowa|przysadki]], z której na drodze enzymatycznej powstają: [[Hormon adrenokortykotropowy|ACTH]], [[beta-endorfina]], [[Hormon lipotropowy|LPH]] i [[Melanotropina|MSH]] (hormon melanotropowy). MSH stymuluje [[melanocyty]] do wytwarzania melaniny, co przyczynia się do zmiany zabarwienia skóry<ref>{{Cytuj książkę | nazwisko= Stachura | imię=Jerzy | nazwisko2= Domagała | imię2=Wenancjusz | nazwisko3= | imię3= | inni= | tytuł= Patologia : znaczy słowo o chorobie. T. 2, Patologia narządowa. Cz. 1 | data=2005 | wydawca=PAU | miejsce=Kraków | id={{ISBN|83-88857-92-4}} (t.2, cz.1) | strony=}}</ref>. Inne nazwy to: '''hemochromatoza wrodzona''', ''cukrzyca brunatna'' i ''cukrzyca brązowa'' (''diabetes bronze'')<ref>{{Cytuj|autor=HCV|tytuł=HCV Prometeusze|data dostępu=2016-12-17|język=en|opublikowany=www.prometeusze.pl|url=http://www.prometeusze.pl/hemochromatoza.php}}</ref>. |
||
=== |
==== Ksantynuria ==== |
||
{{osobny artykuł|Hemofilia}} |
|||
Jest to choroba recesywna jednogenowa sprzężona z płcią powodująca poważne zaburzenia [[krzepnięcie krwi|krzepliwości krwi]]<ref>[http://wayback.archive.org/web/*/http://www.idn.org.pl/hemofilia/biuletyn7.rtf Biuletyn informacyjny Polskiego Stowarzyszenia Chorych na Hemofilię]</ref>, zwana też ''krwawiączką'' albo ''chorobą królów''. Wadliwy gen znajduje się na chromosomie X, dlatego też u mężczyzn nie ma możliwości zdominowania go przez gen z homologicznego chromosomu (mają genotyp XY). Z tego powodu wystarczy, by jedno z rodziców przekazało ten gen dziecku, aby zachorował mężczyzna, lecz w przypadku kobiet oboje rodzice muszą posiadać wadliwy gen{{odn|Mizerski|2013|s=314}}. Wyróżnia się cztery typy hemofilii. Klasyczną postacią jest '''hemofilia A''' spowodowana mutacją w ''locus'' Xq28 powodującą niedobór VIII czynnika krzepnięcia krwi (czynnika antyhemolitycznego), zaś jedną z najrzadszych jest '''nabyta hemofilia''', której bezpośrednią przyczyną są [[autoprzeciwciała]] skierowane przeciwko czynnikowi VIII<ref name="Buczma-">{{Cytuj pismo | nazwisko = Buczma | imię = A. | nazwisko2 = Windyga | imię2 = J. | tytuł = Acquired haemophilia | czasopismo = Pol Arch Med Wewn | wolumin = 117 | numer = 5-6 | strony = 241-5 | miesiąc = | rok = 2007 | doi = | pmid = 18030874 |url=http://tip.org.pl/pamw/files/articlepdf/54/en.html}} (wersja polska: [http://tip.org.pl/pamw/files/articlepdf/54/pl.html Hemofilia nabyta])</ref>. Pozostałe typy to: '''hemofilia B''' (mutacja w ''locus'' Xq27.1-q27.2, niedobór IX czynnika krzepnięcia krwi – czynnika Christmasa), '''hemofilia C''' (mutacja w ''locus'' [[chromosom 4|4q]]35, niedobór XI czynnika krzepnięcia krwi (czynnika Rosenthala), najczęściej w [[genetyka populacyjna|populacji]] Żydów Aszkenazyjskich, dziedziczenie autosomalne recesywne). Do objawów należą: krwawienia wewnętrzne (krwawienia podskórne – tzw. siniaki,krwawienia do stawów szczególnie kolanowych, skokowych i łokciowych, krwawienia do mięśni np. mięśnia biodrowo-lędźwiowego, łydki, [[hematuria|krwiomocz]]); krwawienia zewnętrzne (krwawienia z błony śluzowej jamy ustnej i [[krwawienie z nosa|nosa]]0 oraz krwawienia które mogą zagrażać życiu (krwawienie [[przestrzeń zaotrzewnowa|pozaotrzewnowe]], krwawienie do ośrodkowego układu nerwowego, krwawienie w okolicach szyi)<ref>{{cytuj książkę|tytuł=Podstawy hematologii|inni=Anna Dmoszyńska, Tadeusz Robak|miejsce=Lublin|rok=2003|wydawca=Wydawnictwo Czelej|strony=374-382|isbn = 83-88063-94-4}}</ref>. |
|||
=== Krzywica witamino-D-oporna (hipofosfatemia) === |
|||
Rzadka choroba spowodowana uszkodzeniem genu ''PHEX'' kodującego białko enzymatyczne - [[Endopeptydazy|endopeptydazę]], występujące głównie w komórkach kości i [[zęby|zębów]], odpowiedzialnego za [[Inaktywator|inaktywację]] innego białka – czynnika fosfaturycznego, który – dla odróżnienia od parathormonu – nazwano [[fosfatonina|fosfatoniną]], pełniącego funkcję regulacyjną przy [[resorpcja w nerkach|wchłanianiu zwrotnym]] [[fosforany|fosforanów]] w [[nerka]]ch. Cechuje się brakiem reakcji na witaminę D w dawkach stosowanych w leczeniu [[krzywica|krzywicy niedoborowej]]. Choroby te spowodowane są zaburzeniami metabolizmu i działania witaminy D i/lub zaburzeniami gospodarki fosforowej. Najczęstszą postacią krzywicy opornej na witaminę D jest krzywica hipofosfatemiczna rodzinna – sprzężona z chromosomem X. Do innych postaci należą: osteomalacja onkogeniczna, autosomalna dominująca krzywica hipofosfatemiczna, krzywica hipofosfatemiczna rodzinna z [[Hiperkalciuria|hiperkalciurią]] i krzywice pseudoniedoborowe. Nadmierna aktywność białka regulującego wpływa na wzmożone wydalanie fosforanów w moczu i niską ich zawartość we krwi. Skutkiem choroby jest deformacja szkieletu oraz brak szkliwa na zębach. Choroba ta częściej dotyka kobiet niż mężczyzn, ale efekt fenotypowy jest u obu płci taki sam<ref>{{Cytuj|autor=Katarzyna Grzanka, Eugeniusz Józef Kucharz|tytuł=KRZYWICA OPORNA NA WITAMINĘ D|czasopismo=ResearchGate|data dostępu=2016-12-22|url=https://www.researchgate.net/publication/242695537_KRZYWICA_OPORNA_NA_WITAMINE_D}}</ref><ref name="pmid19169476">{{OMIM|id=131222|nazwa=THYMIDINE PHOSPHORYLASE: TYMP}}</ref><ref name="pmid17451081">{{OMIM|id=174763|nazwa=POLYMERASE, DNA, GAMMA; POLG}}</ref><ref name="Macedo">{{Cytuj pismo | autor=Macedo LC., Soardi FC., Ananias N., Belangero VM., Rigatto SZ., De-Mello MP., D'Souza-Li L | tytuł=Mutations in the vitamin D receptor gene in four patients with hereditary 1,25-dihydroxyvitamin D-resistant rickets. | rok=2008 | czasopismo=Arquivos brasileiros de endocrinologia e metabologia | doi= | wydanie=52 | wolumin=8 | miesiąc=listopad | pmid= 19169476 | strony=1244–51}}</ref><ref name="Nicolaidou"/>. |
|||
=== Ksantynuria === |
|||
{{Osobny artykuł|Ksantynuria}} |
{{Osobny artykuł|Ksantynuria}} |
||
| Linia 400: | Linia 504: | ||
hipourykemii i kamicy nerkowej|data dostępu=2016-12-25|opublikowany=www.urologiapolska.pl|język=pl|url=http://www.urologiapolska.pl/artykul.php?3288}}</ref>, enzymów niezbędnych do przekształcania [[Ksantyna|ksantyny]] do [[Kwas moczowy|kwasu moczowego]]. Podłoże molekularne stanowi mutacja genu oksyreduktazy ksantynowej zlokalizowany jest na chromosomie [[chromosom 2|2p]]22-p23 [7-9]<ref name="Urologia"/>. W konsekwencji występują objawy: niezwykle wysokie stężenie ksantyny i [[Hipoksantyna|hipoksantyny]] we krwi i moczu, co może prowadzić do powikłań, takich jak [[niewydolność nerek]] i powstanie ksantynowych [[Kamica nerkowa|kamieni nerkowych]] (złogi niecieniujące), jednego z najrzadszych rodzajów kamieni nerkowych; w surowicy i moczu kwas moczowy występuje w niskim stężeniu; na pieluszkach chorego dziecka może wystąpić ceglasty osad<ref>{{Cytuj pismo|autor=Kojima T, Nishina T, Kitamura M, Hosoya T, Nishioka K|tytuł=Biochemical studies on the purine metabolism of four cases with hereditary xanthinuria|data=1984-02-28|czasopismo=Clin Chim Acta|oznaczenie=137 (2)|pmid=6423323|strony=189-98}}</ref><ref>{{Cytuj pismo|autor=Ichida K, Amaya Y, Kamatani N, Nishino T, Hosoya T, Sakai O|tytuł=Identification of two mutations in human xanthine dehydrogenase gene responsible for classical type I xanthinuria|data=1997-05-15|czasopismo=J Clin Invest|doi=10.1172/JCI119421|oznaczenie=99 (10)|pmid=9153281|strony=2391-7}}</ref><ref>{{Cytuj pismo|autor=Dent CE, Philpot GR|tytuł=Xanthinuria, an inborn error (or deviation) of metabolism|czasopismo=The Lancet|data=1954-01-23|oznaczenie=266 (6804)|strony=182–5|doi=10.1016/S0140-6736(54)91257-X|pmid=13118765}}</ref><ref>{{Cytuj pismo|autor=Hille R|tytuł=Structure and Function of Xanthine Oxidoreductase|czasopismo=European journal of Inorganic Chemistry|rok=2006|oznaczenie=10|strony=1913–1926|doi=10.1002/ejic.200600087}}</ref>. |
hipourykemii i kamicy nerkowej|data dostępu=2016-12-25|opublikowany=www.urologiapolska.pl|język=pl|url=http://www.urologiapolska.pl/artykul.php?3288}}</ref>, enzymów niezbędnych do przekształcania [[Ksantyna|ksantyny]] do [[Kwas moczowy|kwasu moczowego]]. Podłoże molekularne stanowi mutacja genu oksyreduktazy ksantynowej zlokalizowany jest na chromosomie [[chromosom 2|2p]]22-p23 [7-9]<ref name="Urologia"/>. W konsekwencji występują objawy: niezwykle wysokie stężenie ksantyny i [[Hipoksantyna|hipoksantyny]] we krwi i moczu, co może prowadzić do powikłań, takich jak [[niewydolność nerek]] i powstanie ksantynowych [[Kamica nerkowa|kamieni nerkowych]] (złogi niecieniujące), jednego z najrzadszych rodzajów kamieni nerkowych; w surowicy i moczu kwas moczowy występuje w niskim stężeniu; na pieluszkach chorego dziecka może wystąpić ceglasty osad<ref>{{Cytuj pismo|autor=Kojima T, Nishina T, Kitamura M, Hosoya T, Nishioka K|tytuł=Biochemical studies on the purine metabolism of four cases with hereditary xanthinuria|data=1984-02-28|czasopismo=Clin Chim Acta|oznaczenie=137 (2)|pmid=6423323|strony=189-98}}</ref><ref>{{Cytuj pismo|autor=Ichida K, Amaya Y, Kamatani N, Nishino T, Hosoya T, Sakai O|tytuł=Identification of two mutations in human xanthine dehydrogenase gene responsible for classical type I xanthinuria|data=1997-05-15|czasopismo=J Clin Invest|doi=10.1172/JCI119421|oznaczenie=99 (10)|pmid=9153281|strony=2391-7}}</ref><ref>{{Cytuj pismo|autor=Dent CE, Philpot GR|tytuł=Xanthinuria, an inborn error (or deviation) of metabolism|czasopismo=The Lancet|data=1954-01-23|oznaczenie=266 (6804)|strony=182–5|doi=10.1016/S0140-6736(54)91257-X|pmid=13118765}}</ref><ref>{{Cytuj pismo|autor=Hille R|tytuł=Structure and Function of Xanthine Oxidoreductase|czasopismo=European journal of Inorganic Chemistry|rok=2006|oznaczenie=10|strony=1913–1926|doi=10.1002/ejic.200600087}}</ref>. |
||
=== |
==== Mukowiscydoza ==== |
||
{{osobny artykuł|Choroba Thomsena}} |
|||
To choroba [[mięsień poprzecznie prążkowany|mięśni szkieletowych]] o podłożu leżą mutacyjnym w genie ''[[CLCN1]]'' znajdującym się na chromosomie 7q35, charakteryzujące się utrudnieniem wykonywania ruchu po dłuższym odpoczynku. Poprawa następuje po wykonaniu pierwszych kilku ruchów (''warm up''). Najczęściej zajęte schorzeniem są mięśnie dłoni, kończyn dolnych, żwaczy i powiek. Diagnostyka miotonii Thomsena opiera się na analizie rodowodu chorego i [[elektromiografia|badaniu EMG]], w którym obecność ciągów miotonicznych potwierdza chorobę<ref>{{Cytuj książkę | nazwisko= Podemski | imię=Ryszard Józef | autor link=Ryszard Józef Podemski | inni= | tytuł= Kompendium neurologii | data=2008 | wydawca=Via Medica | miejsce=Gdańsk | isbn=978-83-7555-054-2 | strony=504}}</ref>. |
|||
=== Mukowiscydoza === |
|||
{{osobny artykuł|Mukowiscydoza}} |
{{osobny artykuł|Mukowiscydoza}} |
||
| Linia 411: | Linia 510: | ||
Jedną z częściej występujących chorób genetycznych jest [[mukowiscydoza]], której podłoże molekularne stanowi mutacja (najczęściej <tt>ΔF508</tt> lub F508del<ref name="ŚN241">{{cytuj pismo | nazwisko = Rowe | imię = Steven M. | nazwisko2 = Clancy | imię2 = J.P. | nazwisko3 = Sorscher | imię3 = Eric J. | tytuł = Głęboki oddech | czasopismo = [[Świat Nauki]] | wydawca = Prószyński Media | wolumin = nr. 9 (241) | issn = 0867-6380 | data = wrzesień 2011 | strony = 51-53}}</ref>) genu odpowiedzialnego za syntezę błonowego kanału chlorkowego (jest niezbędne do zajścia procesu regulacji transportu jonów chlorkowych przez błony cytoplazmatyczne) ''[[CFTR]]'' (cystic fibrosis transmembrane conductance regulator), umiejscowionego jest na długim ramieniu [[chromosom 7|chromosomu 7]]<ref name="pmid10798353-s259-268">{{cytuj pismo | nazwisko = Dörk | imię = T. | nazwisko2 = Macek | imię2 = M. | nazwisko3 = Mekus | imię3 = F. | nazwisko4 = Tümmler | imię4 = B. | nazwisko5 = Tzountzouris | imię5 = J. | tytuł = Characterization of a novel 21-kb deletion, CFTRdele2,3(21 kb), in the CFTR gene: a cystic fibrosis mutation of Slavic origin common in Central and East Europe | czasopismo = Hum Genet | wolumin = 106 | numer = 3 | strony = 259-268 | rok = 2000 | doi = 10.1007/s004390000246 | pmid = 10798353}}</ref><ref name="E Kerem et al The relation">{{Cytuj pismo | nazwisko = Kerem | imię = E. | nazwisko2 = Corey | imię2 = M. | nazwisko3 = Kerem | imię3 = BS. | nazwisko4 = Rommens | imię4 = J. | nazwisko5 = Markiewicz | imię5 = D. | tytuł = The relation between genotype and phenotype in cystic fibrosis--analysis of the most common mutation (delta F508) | czasopismo = N Engl J Med | wolumin = 323 | numer = 22 | strony = 1517-1522 | rok = 1990 | doi = 10.1056/NEJM199011293232203 | pmid = 2233932 |url=http://www.nejm.org/doi/pdf/10.1056/NEJM199011293232203}}</ref>. Brak syntezy tego białka powoduje niewydolność układu oddechowego, polegająca na wytwarzaniu dużych ilości śluzu o dużej lepkości, co sprzyja powstawaniu [[Zakażenie|infekcji]] (''[[pałeczka ropy błękitnej|Pseudomonas aeruginosa]]'' i (lub) ''[[gronkowiec złocisty|Staphylococcus aureus]]''), [[niedrożność smółkowa]] (''meconium ileus'') jelit w okresie noworodkowym, spowodowana czopem gęstej [[Smółka (medycyna)|smółki]] zatykającym [[jelito grube]] i jej ekwiwalenty: [[zespół korka smółkowego]], nawracające epizody bólu brzucha z objawami niedrożności przepuszczającej określane jako dystalna niedrożność jelit (DIOS, distal intestinal obstruction syndrome). Towarzyszy mu również niewydolność [[wątroba|wątroby]] (u ok. 85% pacjentów) i wszystkich narządów posiadających gruczoły śluzowe. Do innych objawów należeć mogą: [[palce pałeczkowate]], [[acrodermatitis enteropathica]], [[hiperprotrombinemia]]nawracający obrzęk [[ślinianka przyuszna|ślinianek przyusznych]]<ref>{{cytuj pismo | autor = Brian D. Riedel | tytuł = Gastrointestinal manifestations of cystic fibrosis | czasopismo = Pediatric Annals | wolumin = 26 | strony = 235–241 | data = 1997|pmid=9114442}} Tłumaczenie z komentarzem Wojciecha Cichego: {{cytuj pismo | tytuł = Objawy ze strony układu pokarmowego u chorych na mukowiscydozę | czasopismo = Medycyna Praktyczna Pediatria | wolumin = 2 | strony = 85-98 | data = 1999 | url = http://www.mp.pl/download/pdf.php?id_pdf=00009171.pdf}}</ref><ref name="Medycyna Praktyczna Pediatria">{{cytuj pismo | tytuł = Zasady rozpoznawania i leczenia mukowiscydozy. Stanowisko Polskiej Grupy Roboczej Mukowiscydozy przy Zarządzie Głównym Polskiego Towarzystwa Pediatrycznego (1999) | czasopismo = Medycyna Praktyczna Pediatria | wolumin = 3 | strony = 64–74 | data = 2000 | url = http://www.mp.pl/download/pdf.php?id_pdf=00001158.pdf}}</ref>. Częstotliwość występowania mukowiscydozy wynosi 1 do 2 tys., a częstość heterozygot (nosicieli) w populacji ocenia się na ok. 1 do 22 nosicieli{{odn|Mizerski|2013|s=314}}. Dziedziczona autosomalnie recesywnie<ref name="pmid7524148-s107-109">{{cytuj pismo | nazwisko = Gabriel | imię = SE. | nazwisko2 = Brigman | imię2 = KN. | nazwisko3 = Koller | imię3 = BH. | nazwisko4 = Boucher | imię4 = RC. | nazwisko5 = Stutts | imię5 = MJ. | tytuł = Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model | czasopismo = Science | wolumin = 266 | numer = 5182 | strony = 107-109 | rok = 1994 | doi = 10.1126/science.7524148 | pmid = 7524148}}</ref><ref name="pmid18938114">{{cytuj pismo | autor = Collazo T., Bofill AM., Clark Y., Hernández Y., Gómez M., Rodríguez F., Ramos MD., Giménez J., Casals T., Rojo M | tytuł = Common mutations in cuban cystic fibrosis patients. | rok = 2009 | czasopismo = Journal of cystic fibrosis : official journal of the European Cystic Fibrosis Society | doi = 10.1016/j.jcf.2008.09.004 | wydanie = 8 | wolumin = 1 | miesiąc = styczeń | pmid = 18938114 | strony = 47–9}}</ref>. |
Jedną z częściej występujących chorób genetycznych jest [[mukowiscydoza]], której podłoże molekularne stanowi mutacja (najczęściej <tt>ΔF508</tt> lub F508del<ref name="ŚN241">{{cytuj pismo | nazwisko = Rowe | imię = Steven M. | nazwisko2 = Clancy | imię2 = J.P. | nazwisko3 = Sorscher | imię3 = Eric J. | tytuł = Głęboki oddech | czasopismo = [[Świat Nauki]] | wydawca = Prószyński Media | wolumin = nr. 9 (241) | issn = 0867-6380 | data = wrzesień 2011 | strony = 51-53}}</ref>) genu odpowiedzialnego za syntezę błonowego kanału chlorkowego (jest niezbędne do zajścia procesu regulacji transportu jonów chlorkowych przez błony cytoplazmatyczne) ''[[CFTR]]'' (cystic fibrosis transmembrane conductance regulator), umiejscowionego jest na długim ramieniu [[chromosom 7|chromosomu 7]]<ref name="pmid10798353-s259-268">{{cytuj pismo | nazwisko = Dörk | imię = T. | nazwisko2 = Macek | imię2 = M. | nazwisko3 = Mekus | imię3 = F. | nazwisko4 = Tümmler | imię4 = B. | nazwisko5 = Tzountzouris | imię5 = J. | tytuł = Characterization of a novel 21-kb deletion, CFTRdele2,3(21 kb), in the CFTR gene: a cystic fibrosis mutation of Slavic origin common in Central and East Europe | czasopismo = Hum Genet | wolumin = 106 | numer = 3 | strony = 259-268 | rok = 2000 | doi = 10.1007/s004390000246 | pmid = 10798353}}</ref><ref name="E Kerem et al The relation">{{Cytuj pismo | nazwisko = Kerem | imię = E. | nazwisko2 = Corey | imię2 = M. | nazwisko3 = Kerem | imię3 = BS. | nazwisko4 = Rommens | imię4 = J. | nazwisko5 = Markiewicz | imię5 = D. | tytuł = The relation between genotype and phenotype in cystic fibrosis--analysis of the most common mutation (delta F508) | czasopismo = N Engl J Med | wolumin = 323 | numer = 22 | strony = 1517-1522 | rok = 1990 | doi = 10.1056/NEJM199011293232203 | pmid = 2233932 |url=http://www.nejm.org/doi/pdf/10.1056/NEJM199011293232203}}</ref>. Brak syntezy tego białka powoduje niewydolność układu oddechowego, polegająca na wytwarzaniu dużych ilości śluzu o dużej lepkości, co sprzyja powstawaniu [[Zakażenie|infekcji]] (''[[pałeczka ropy błękitnej|Pseudomonas aeruginosa]]'' i (lub) ''[[gronkowiec złocisty|Staphylococcus aureus]]''), [[niedrożność smółkowa]] (''meconium ileus'') jelit w okresie noworodkowym, spowodowana czopem gęstej [[Smółka (medycyna)|smółki]] zatykającym [[jelito grube]] i jej ekwiwalenty: [[zespół korka smółkowego]], nawracające epizody bólu brzucha z objawami niedrożności przepuszczającej określane jako dystalna niedrożność jelit (DIOS, distal intestinal obstruction syndrome). Towarzyszy mu również niewydolność [[wątroba|wątroby]] (u ok. 85% pacjentów) i wszystkich narządów posiadających gruczoły śluzowe. Do innych objawów należeć mogą: [[palce pałeczkowate]], [[acrodermatitis enteropathica]], [[hiperprotrombinemia]]nawracający obrzęk [[ślinianka przyuszna|ślinianek przyusznych]]<ref>{{cytuj pismo | autor = Brian D. Riedel | tytuł = Gastrointestinal manifestations of cystic fibrosis | czasopismo = Pediatric Annals | wolumin = 26 | strony = 235–241 | data = 1997|pmid=9114442}} Tłumaczenie z komentarzem Wojciecha Cichego: {{cytuj pismo | tytuł = Objawy ze strony układu pokarmowego u chorych na mukowiscydozę | czasopismo = Medycyna Praktyczna Pediatria | wolumin = 2 | strony = 85-98 | data = 1999 | url = http://www.mp.pl/download/pdf.php?id_pdf=00009171.pdf}}</ref><ref name="Medycyna Praktyczna Pediatria">{{cytuj pismo | tytuł = Zasady rozpoznawania i leczenia mukowiscydozy. Stanowisko Polskiej Grupy Roboczej Mukowiscydozy przy Zarządzie Głównym Polskiego Towarzystwa Pediatrycznego (1999) | czasopismo = Medycyna Praktyczna Pediatria | wolumin = 3 | strony = 64–74 | data = 2000 | url = http://www.mp.pl/download/pdf.php?id_pdf=00001158.pdf}}</ref>. Częstotliwość występowania mukowiscydozy wynosi 1 do 2 tys., a częstość heterozygot (nosicieli) w populacji ocenia się na ok. 1 do 22 nosicieli{{odn|Mizerski|2013|s=314}}. Dziedziczona autosomalnie recesywnie<ref name="pmid7524148-s107-109">{{cytuj pismo | nazwisko = Gabriel | imię = SE. | nazwisko2 = Brigman | imię2 = KN. | nazwisko3 = Koller | imię3 = BH. | nazwisko4 = Boucher | imię4 = RC. | nazwisko5 = Stutts | imię5 = MJ. | tytuł = Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model | czasopismo = Science | wolumin = 266 | numer = 5182 | strony = 107-109 | rok = 1994 | doi = 10.1126/science.7524148 | pmid = 7524148}}</ref><ref name="pmid18938114">{{cytuj pismo | autor = Collazo T., Bofill AM., Clark Y., Hernández Y., Gómez M., Rodríguez F., Ramos MD., Giménez J., Casals T., Rojo M | tytuł = Common mutations in cuban cystic fibrosis patients. | rok = 2009 | czasopismo = Journal of cystic fibrosis : official journal of the European Cystic Fibrosis Society | doi = 10.1016/j.jcf.2008.09.004 | wydanie = 8 | wolumin = 1 | miesiąc = styczeń | pmid = 18938114 | strony = 47–9}}</ref>. |
||
=== Niedokrwistość Fanconiego === |
==== Niedokrwistość Fanconiego ==== |
||
{{osobny artykuł|Niedokrwistość Fanconiego}} |
{{osobny artykuł|Niedokrwistość Fanconiego}} |
||
Jest to heterogenna genetycznie uwarunkowana grupa chorób, będących rzadko występującą postacią wrodzonej [[niedokrwistość aplastyczna|niedokrwistości aplastycznej]], przebiegająca z [[malformacja]]mi kośćca, wadami nerek i serca oraz predyspozycją do [[nowotwór|nowotworów]], pierwszy raz opisana przez [[Guido Fanconi|Guida Fanconiego]] w [[1927]] roku<ref>G. Fanconi. Familiäre, infantile perniciosähnliche Anämie (perniziöses Blutbild und Konstitution). Jahrbuch für Kinderheilkunde und physische Erziehung, Wien,1927, 117: 257-280.</ref>. Do tej pory zidentyfikowano przynajmniej 13 genów, których mutacje mogą ją wywoływać. Typy choroby oznaczane są A, B, C, D1, D2, E, F, G, I, J, L, M i N. Typ B wywołany mutacjami w genie ''FANCB'' jest jedyną postacią niedziedziczoną w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]], lecz sprzężoną z [[chromosom X|chromosomem X]]<ref>{{Cytuj pismo|autor=Levitus M, Rooimans MA, Steltenpool J, Cool NF, Oostra AB, Mathew CG, Hoatlin ME, Waisfisz Q, Arwert F, de Winter JP, Joenje H|tytuł=Heterogeneity in Fanconi anemia: evidence for 2 new genetic subtypes|czasopismo=Blood|oznaczenie=103|strony=2498-2503|rok=2004|pmid=14630800}}</ref>. Na obraz kliniczny składają się objawy takie jak: niski wzrost, nieprawidłowy kciuk (brak lub [[hipoplazja]]), [[mikrocefalia]], przebarwienia skóry, charakterystyczny wygląd twarzy (szeroka nasada nosa, [[mikrognacja]]). Mogą również występować: nieprawidłowości kości ramiennej i kości nadgarstka, [[dysplazja stawu biodrowego|dysplazja stawów biodrowych]], wady serca, niedorozwój gruczołów płciowych, wady układu moczowego, zaburzenia układu nerwowego, [[niepełnosprawność intelektualna|upośledzenie umysłowe]], zaburzenia słuchu i wzroku<ref>{{WhoNamedIt|synd|61|Fanconi's anaemia}}</ref>. |
Jest to heterogenna genetycznie uwarunkowana grupa chorób, będących rzadko występującą postacią wrodzonej [[niedokrwistość aplastyczna|niedokrwistości aplastycznej]], przebiegająca z [[malformacja]]mi kośćca, wadami nerek i serca oraz predyspozycją do [[nowotwór|nowotworów]], pierwszy raz opisana przez [[Guido Fanconi|Guida Fanconiego]] w [[1927]] roku<ref>G. Fanconi. Familiäre, infantile perniciosähnliche Anämie (perniziöses Blutbild und Konstitution). Jahrbuch für Kinderheilkunde und physische Erziehung, Wien,1927, 117: 257-280.</ref>. Do tej pory zidentyfikowano przynajmniej 13 genów, których mutacje mogą ją wywoływać. Typy choroby oznaczane są A, B, C, D1, D2, E, F, G, I, J, L, M i N. Typ B wywołany mutacjami w genie ''FANCB'' jest jedyną postacią niedziedziczoną w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]], lecz sprzężoną z [[chromosom X|chromosomem X]]<ref>{{Cytuj pismo|autor=Levitus M, Rooimans MA, Steltenpool J, Cool NF, Oostra AB, Mathew CG, Hoatlin ME, Waisfisz Q, Arwert F, de Winter JP, Joenje H|tytuł=Heterogeneity in Fanconi anemia: evidence for 2 new genetic subtypes|czasopismo=Blood|oznaczenie=103|strony=2498-2503|rok=2004|pmid=14630800}}</ref>. Na obraz kliniczny składają się objawy takie jak: niski wzrost, nieprawidłowy kciuk (brak lub [[hipoplazja]]), [[mikrocefalia]], przebarwienia skóry, charakterystyczny wygląd twarzy (szeroka nasada nosa, [[mikrognacja]]). Mogą również występować: nieprawidłowości kości ramiennej i kości nadgarstka, [[dysplazja stawu biodrowego|dysplazja stawów biodrowych]], wady serca, niedorozwój gruczołów płciowych, wady układu moczowego, zaburzenia układu nerwowego, [[niepełnosprawność intelektualna|upośledzenie umysłowe]], zaburzenia słuchu i wzroku<ref>{{WhoNamedIt|synd|61|Fanconi's anaemia}}</ref>. |
||
==== Padaczka miokloniczna Unverrichta-Lundborga ==== |
|||
=== Niedokrwistość aplastyczna spowodowana chloramfenikolem === |
|||
{{osobny artykuł|Niedokrwistość aplastyczna spowodowana chloramfenikolem}} |
|||
Choroba mitochondrialna, w której u około 1:19 000 przypadków [[chloramfenikol]] wywołuje reakcję [[idiosynkrazja|idiosynkrazji]], czyli powoduje działania niepożądane po podaniu dawki leczniczej. Występuje wówczas zagrażająca życiu [[niedokrwistość aplastyczna]]. Udowodniono, że jest to spowodowane punktowymi [[mutacja]]mi w [[Mitochondrialny DNA|mitochondrialnym DNA]]. Zmiany dotyczą genu ''[[MTRNR2]]'' kodującego podjednostkę 16S [[rRNA]]. Zidentyfikowane mutacje wywołujące wrażliwość na chloramfenikol to <tt>T2991C</tt><ref name=blanc/><ref>{{Cytuj pismo|autor=Kearsey SE, Craig IW|tytuł=Altered ribosomal RNA genes in mitochondria from mammalian cells with chloramphenicol resistance|czasopismo=[[Nature]]|oznaczenie=290|strony=607-608|rok=1981|pmid=7219548}}</ref> i <tt>C2939A</tt><ref name=blanc>{{Cytuj pismo|autor=Blanc H, Adams CA, Wallace DC|tytuł=Differential nucleotide changes on the large rRNA gene of the mitochondrial DNA confer chloramphenicol resistance to two human cell lines|czasopismo=Nucleic Acids Res|oznaczenie=9|strony=5785-5795|rok=1981|pmid=6273808}}</ref>. |
|||
=== Padaczka miokloniczna Unverrichta-Lundborga === |
|||
{{osobny artykuł|Choroba Unverrichta-Lundborga}} |
{{osobny artykuł|Choroba Unverrichta-Lundborga}} |
||
Rzadkie schorzenie, którego przyczyną są mutacje w genie ''[[CSTB]]'' kodującym białko cystatyny B<ref>{{OMIM|id=254800|nazwa=MYOCLONIC EPILEPSY OF UNVERRICHT AND LUNDBORG}}</ref>; opisana po raz pierwszy przez [[Heinrich Unverricht|Heinricha Unverrichta]] w 1891<ref>H. Unverricht: Die Myoclonie. Wiedeń, F. Deutiche, 1891.</ref> i Lundborga w 1903 roku<ref>H. B. Lundborg: Die progressive Myoklonus-Epilepsie (Unverricht's Myoklonie). Uppsala : Almqvist & Wiksell, 1903. 207 pages.</ref>. Praca Lundborga ma znaczenia dla historii genetyki klinicznej, ponieważ została użyta do analizy statystycznej mającej określić prawdziwość hipotezy o [[dziedziczenie autosomalne recesywne|dziedziczeniu autosomalnym recesywnym]], co zrobił [[Wilhelm Weinberg]] w 1912 roku<ref>Weinberg, W. Weitere Beitrage zur Theorie der Vererbung. 4. Ueber Methode und Fehlerquellen der Untersuchung auf Mendelsche Zahlen beim Menschen. Arch. Rass. Ges. Biol. 9: 165-174, 1912.</ref>. |
Rzadkie schorzenie, którego przyczyną są mutacje w genie ''[[CSTB]]'' kodującym białko cystatyny B<ref>{{OMIM|id=254800|nazwa=MYOCLONIC EPILEPSY OF UNVERRICHT AND LUNDBORG}}</ref>; opisana po raz pierwszy przez [[Heinrich Unverricht|Heinricha Unverrichta]] w 1891<ref>H. Unverricht: Die Myoclonie. Wiedeń, F. Deutiche, 1891.</ref> i Lundborga w 1903 roku<ref>H. B. Lundborg: Die progressive Myoklonus-Epilepsie (Unverricht's Myoklonie). Uppsala : Almqvist & Wiksell, 1903. 207 pages.</ref>. Praca Lundborga ma znaczenia dla historii genetyki klinicznej, ponieważ została użyta do analizy statystycznej mającej określić prawdziwość hipotezy o [[dziedziczenie autosomalne recesywne|dziedziczeniu autosomalnym recesywnym]], co zrobił [[Wilhelm Weinberg]] w 1912 roku<ref>Weinberg, W. Weitere Beitrage zur Theorie der Vererbung. 4. Ueber Methode und Fehlerquellen der Untersuchung auf Mendelsche Zahlen beim Menschen. Arch. Rass. Ges. Biol. 9: 165-174, 1912.</ref>. |
||
==== Płód arlekin ==== |
|||
=== Pęcherzowe oddzielanie się naskórka === |
|||
{{Osobny artykuł|Pęcherzowe oddzielanie się naskórka}} |
|||
Grupa [[genodermatozy|genodermatoz]], których wspólną cechą jest występowanie [[pęcherz]]y wskutek urazów mechanicznych. Wyróżnia się trzy główne grupy, w zależności od miejsca tworzenia się pęcherza: w obrębie [[naskórek|naskórka]] (''EB simplex''), w obrębie [[błona podstawna|błony podstawnej]] (''EB junctionalis''), poniżej błony podstawnej, w [[skóra właściwa|skórze właściwej]] (''EB epidermolytica''). |
|||
==== Grupa ''epidermolysis bullosa simplex'' ==== |
|||
===== EB Webera-Cockayne'a ===== |
|||
Dziedziczona autosomalnie dominująco<ref>{{Cytuj|autor=Kana Yasukawa, Daisuke Sawamura, James R. McMillan, Hideki Nakamura, Hiroshi Shimizu|tytuł=Dominant and Recessive Compound Heterozygous Mutations in Epidermolysis Bullosa Simplex Demonstrate the Role of the Stutter Region in Keratin Intermediate Filament Assembly|czasopismo=Journal of Biological Chemistry|data=2002-06-28|data dostępu=2017-01-03|issn=0021-9258|wydanie=26|s=23670–23674|doi=10.1074/jbc.M200974200|pmid=11973334|url=http://www.jbc.org/content/277/26/23670|język=en}}</ref>. Etiopatogeneza: mutacja genu ''KRT14'' kodującego [[keratyna|keratynę]] 5 i 14 oraz defektem enzymów proteolitycznych<ref name="Fine">Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. ''The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB''. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations] http://www.jaad.org/article/S0190-9622(08)00208-9/abstract</ref>. Obraz kliniczny: zmiany występują najczęściej na stopach, rzadziej na dłoniach, pęcherze zwykle pojawiają się u dzieci w wieku około 18 miesięcy, gdy wykazują dużą aktywność ruchową. Zmiany mogą się ujawnić w późniejszym wieku, w późnym dzieciństwie albo u młodych dorosłych. Czynniki nasilające tworzenie pęcherzy to duża wilgotność, wzmożone pocenie się. [[Błona śluzowa|Błony śluzowe]] i płytki paznokciowe nie są zajęte<ref>Pfendner, E. G., Sadowski, S. G., Uitto, J. ''Epidermolysis bullosa simplex: recurrent and de novo mutations in the KRT5 and KRT14 genes, phenotype/genotype correlations, and implications for genetic counseling and prenatal diagnosis''. J. Invest. Derm. 125: 239-243, 2005. [PubMed: 16098032, related citations]</ref>. |
|||
===== EB Dowlinga-Meary (EB herpetiformis) ===== |
|||
Od innych chorób z grupy ''epidermolysis bullosa simplex'' różni się ciężkim przebiegiem i charakterystycznym obrazem w [[mikroskop elektronowy|mikroskopie elektronowym]] ([[cytoplazma]]tyczne "kępki" tonofilamentów). Tak jak typ Koebnera i typ Webera-Cockayne'a, typ Dowlinga-Meary EBS wiąże się z mutacjami w genach ''KRT5'' (region 12q13.13) i ''KRT14'' (region 17q21.2)<ref>Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. ''The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB''. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations]</ref>. Objawy<ref>{{OMIM|id=131900|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX, GENERALIZED}}</ref><ref>Hacham-Zadeh, S., Rappersberger, K., Livshin, R., Konrad, K. ''Epidermolysis bullosa herpetiformis Dowling-Meara in a large family''. J. Am. Acad. Derm. 18: 702-706, 1988. [PubMed: 3372762, related citations]</ref>: uogólnione tworzenie pęcherzy o opryszczkowatym (zgrupowanym) układzie (stąd inna nazwa schorzenia, ''epidermolysis bullosa simplex herpetiformis''), surowicze i krwotoczne pęcherze tworzą się w każdej lokalizacji, przede wszystkim jednak na stopach i podeszwach, dookoła ust, na karku i szyi. Czynnikami zaostrzającymi przebieg choroby są: [[gorączka]], pora roku (miesiące letnie), a także wiek (zmiany nasilają się z wiekiem). |
|||
===== EB wariant Koebnera ===== |
|||
Etiopatogeneza: mutacje w genach [[keratyna|keratyny]] 5 i 14 (''KRT4'', ''KRT15'')<ref name="Fine"/>. Ponieważ mutacje w tych samych genach odpowiadają za wystąpienie cech fenotypowych EBS typu Webera-Cockayne'a i typu Dowlinga-Meary, często cechy tych trzech chorób nakładają się na siebie. Zdarza się, że w obrębie jednej rodziny diagnozowano przypadki dwóch różnych typów EBS. Objawy: zmiany są hiperkeratotyczne, pęcherzowe, czasem pęcherze są krwotoczne, niekiedy tworzą się [[prosak]]i, mogą wystąpić zaburzenia pigmentacji (hipo- lub hiperpigmentacja) tak jak w odmianie Dowlinga-Meary, czasem zajęte są paznokcie i błony śluzowe<ref>{{OMIM|id=131960|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX WITH MOTTLED PIGMENTATION; EBSMP}}</ref>. |
|||
==== Grupa ''epidermolysis bullosa junctionalis'' ==== |
|||
===== EB Herlitza ===== |
|||
Postać śmiertelna, rzadka, dziedziczona autosomalnie recesywnie, spowodowana mutacją w jednym z genów kodujących trzy polipeptydy [[laminina|lamininy]] 5: α-3 (gen ''LAMA3''), β-3 (gen ''LAMB3''), albo γ-2 (gen ''LAMC2'')<ref>{{Cytuj|autor=F. J. D. Smith, R. a. J. Eady, I. M. Leigh, J. R. McMillan, E. L. Rugg|tytuł=Plectin deficiency results in muscular dystrophy with epidermolysis bullosa|czasopismo=Nature Genetics|data=1996-08-01|data dostępu=2017-01-03|wydanie=4|s=450–457|doi=10.1038/ng0896-450|url=http://www.nature.com/ng/journal/v13/n4/abs/ng0896-450.html|język=en}}</ref>. Obraz kliniczny: występowanie licznych pęcherzy, które łatwo pękają, pozostawiając rozległe [[nadżerka|nadżerki]] w obrębie całej skóry i błon śluzowych, również [[drogi oddechowe|dróg oddechowych]] (już wewnątrzmacicznie następuje tworzenie pęcherzy i nadżerek, tak że dziecko rodzi się z rozległymi ubytkami naskórka). Ręce i stopy są zwykle relatywnie najmniej dotknięte przez proces chorobowy. Nigdy nie występuje [[blizna|bliznowacenie]], [[syndaktylia]], nie tworzą się [[prosaki]]. W wieku około 6 miesięcy wokół ust bądź nosa tworzy się patognomoniczny, niegojący się [[strup]]<ref>Skoczylas M., Kordek A., Łoniewska B., Maleszka R., Rudnicki J., Problemy kliniczne u chorych na odmianę Herlitza pęcherzowego oddzielania się naskórka. Postępy Neonatologii 2011;2(17):54-56</ref><ref>{{OMIM|id= 226670|nazwa=EPIDERMOLYSIS BULLOSA SIMPLEX WITH MUSCULAR DYSTROPHY; EBSMD}}</ref>. |
|||
===== EB z atrezją odźwiernika ===== |
|||
Bardzo rzadka choroba, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genach ''ITGB4'' i ''ITGA6'', która skutkuje obniżoną ekspresją kodowanych przez te geny α6 i (lub) β4 integryny<ref>{{Cytuj|autor=S. Chavanas, Y. Gache, J. Vailly, J. Kanitakis, L. Pulkkinen|tytuł=Splicing Modulation of Integrin (β4 Pre-mRNA Carrying a Branch Point Mutation Underlies Epidermolysis Bullosa with Pyloric Atresia Undergoing Spontaneous Amelioration With Ageing|czasopismo=Human Molecular Genetics|data=1999-10-01|data dostępu=2017-01-03|issn=0964-6906|wydanie=11|s=2097–2105|doi=10.1093/hmg/8.11.2097|pmid=10484780|url=http://hmg.oxfordjournals.org/content/8/11/2097|język=en}}</ref><ref>{{Cytuj|autor=Frédérique Vidal, Daniel Aberdam, Corinne Miquel, Angela M. Christiano, Leena Pulkkinen|tytuł=Integrin β4 mutations associated with junctional epidermolysis bullosa with pyloric atresia|czasopismo=Nature Genetics|data=1995-06-01|data dostępu=2017-01-03|wydanie=2|s=229–234|doi=10.1038/ng0695-229|url=http://www.nature.com/ng/journal/v10/n2/abs/ng0695-229.html|język=en}}</ref>. Objawy: zmianom skórnym z reguły towarzyszy wrodzona [[atrezja]] [[odźwiernik]]a (rzadziej [[atrezja przełyku]] lub [[dwunastnica|dwunastnicy]]), dystrofia paznokci i anomalie w zakresie uzębienia, takie jak [[hipoplazja]] [[Szkliwo (anatomia)|szkliwa]]. Tworzenie pęcherzy jest uogólnione, rokowanie bardzo złe, mimo chirurgicznej interwencji; mutacja często jest letalna<ref>{{Cytuj|autor=L Ruzzi, L Gagnoux-Palacios, M Pinola, S Belli, G Meneguzzi|tytuł=A homozygous mutation in the integrin alpha6 gene in junctional epidermolysis bullosa with pyloric atresia.|czasopismo=The Journal of Clinical Investigation|data=1997-06-15|data dostępu=2017-01-03|issn=0021-9738|wydanie=12|doi=10.1172/JCI119474|pmid=9185503|pmc=508131|url=http://www.jci.org/articles/view/119474|język=en}}</ref><ref>{{OMIM|id= 226730 |nazwa=EPIDERMOLYSIS BULLOSA JUNCTIONALIS WITH PYLORIC ATRESIA}}</ref>. |
|||
==== Grupa ''epidermolysis bullosa dystrophica'' ==== |
|||
===== EB dystroficzna, postać Pasiniego ===== |
|||
Dziedziczona jest w sposób autosomalny dominujący. Obraz kliniczny: pęcherze ustępują z pozostawieniem drobnych, białawych wykwitów [[grudka|grudkowych]], umiejscowionych głównie na tułowiu w okolicy krzyżowej, zajęte są śluzówka jamy ustnej i zęby, paznokcie mogą być [[dystrofia|dystroficzne]]. W starszym wieku choroba może złagodzić swój przebieg<ref name="Fine"/><ref>{{OMIM|id=131750|nazwa=EPIDERMOLYSIS BULLOSA DYSTROPHICA, AUTOSOMAL DOMINANT; DDEB}}</ref>. |
|||
===== EB dystroficzna, postać Cockayne'a-Toureine'a ===== |
|||
Dziedziczona jest w sposób autosomalny dominujący. Wykwity głównie na kończynach, śluzówka i zęby zajęte w minimalnym stopniu<ref>{{Cytuj|autor=C. A. Oakley, D. J. Gawkrodger, J. A. Ross, J. A. Hunter|tytuł=The Cockayne-Touraine type of dominant dystrophic epidermolysis bullosa--ultrastructural similarities to the Pasini variant|czasopismo=Acta Dermato-Venereologica|data=1984-01-01|data dostępu=2017-01-03|issn=0001-5555|wydanie=3|s=253–256|pmid=6204490|url=https://www.ncbi.nlm.nih.gov/pubmed/6204490}}</ref>. |
|||
===== EB Hallopeau-Siemensa ===== |
|||
Podłoże molekularne: mutacja w genie kodującym [[kolagen]] typu VII (''COL7A1''). Objawy: charakterystyczne jest uogólnione tworzenie pęcherzy w momencie urodzenia lub we wczesnym niemowlęctwie, rozległe bliznowacenie, zmiany w obrębie skóry kończyn, [[pseudosyndaktylia]] dłoni i stóp, niekiedy są zajęte paznokcie i zęby, śluzówka przełyku (czego skutkiem jest [[zwężenie przełyku]]), stenoza cewki moczowej, odbytu, [[stulejka]], bliznowacenie rogówki lub spojówki. W EB Hallopeau-Siemensa wyraźnie zwiększone jest ryzyko wystąpienia [[rak kolczystokomórkowy skóry|raka kolczystokomórkowego skóry]]; nowotwór rozwija się na podłożu blizn<ref>{{Cytuj|autor=J. Diedrichson, D. Talanow, A. Safi|tytuł=[Epidermolysis bullosa dystrophica (Hallopeau-Siemens syndrome) of the hand -- surgical strategy and results]|czasopismo=Handchirurgie, Mikrochirurgie, Plastische Chirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Handchirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Mikrochirurgie Der Peripheren Nerven Und Gefasse: Organ Der V...|data=2005-10-01|data dostępu=2017-01-03|issn=0722-1819|wydanie=5|s=316–322|doi=10.1055/s-2005-872849|pmid=16287016|url=https://www.ncbi.nlm.nih.gov/pubmed/16287016}}</ref>. |
|||
=== Płód arlekin === |
|||
[[Plik:Harlequin fetus.JPG|100px|Litografia z pracy z 1886 roku przedstawiającą płód z rybią łuską wrodzoną typu arlekinowego<ref>{{Cytuj pismo|tytuł=A Case of General Seborrhœa or “Harlequin” Fœtus|autor=J. Bland Sutton|autor link=John Bland Sutton|czasopismo=Med Chir Trans|rok=1886|oznaczenie=69|strony=291–296|id=PMCID 2121560}}</ref>|thumb]] |
[[Plik:Harlequin fetus.JPG|100px|Litografia z pracy z 1886 roku przedstawiającą płód z rybią łuską wrodzoną typu arlekinowego<ref>{{Cytuj pismo|tytuł=A Case of General Seborrhœa or “Harlequin” Fœtus|autor=J. Bland Sutton|autor link=John Bland Sutton|czasopismo=Med Chir Trans|rok=1886|oznaczenie=69|strony=291–296|id=PMCID 2121560}}</ref>|thumb]] |
||
{{osobny artykuł|Płód arlekin}} |
{{osobny artykuł|Płód arlekin}} |
||
| Linia 464: | Linia 526: | ||
Rzadka [[genodermatozy|genodermatoza]] o dziedziczeniu autosomalnym recesywnym. Objawy charakteryzują się pokrywającymi całą powierzchnię skóry [[Blaszka (medycyna)|łuskami]] [[hiperkeratoza|hiperkeratotycznego]] naskórka o kształcie rombów i wielokątów, o ułożeniu przywodzącym na myśl kostium [[arlekin]]a – stąd nazwa jednostki chorobowej. Ponadto stwierdza się niską masę urodzeniową, [[erytrodermia|erytrodermię]], wywinięcie warg (''eclabium'') i powiek ([[ektropion]]). Z powodu utraty wody i [[sepsa|sepsy]] oraz nieprawidłowej [[termoregulacja|termoregulacji]] noworodek umiera zwykle w ciągu tygodnia. Przynajmniej część przypadków wiąże się z [[mutacja]]mi [[gen]]u ''[[ABCA12]]'' na [[chromosom 2|chromosomie 2]]<ref>{{Cytuj pismo|autor=Kelsell DP, Norgett EE, Unsworth H, Teh MT, Cullup T, Mein CA, Dopping-Hepenstal PJ, Dale BA, Tadini G, Fleckman P, Stephens KG, Sybert VP, Mallory SB, North BV, Witt DR, Sprecher E, Taylor AE, Ilchyshyn A, Kennedy CT, Goodyear H, Moss C, Paige D, Harper JI, Young BD, Leigh IM, Eady RA, O'Toole EA|tytuł=Mutations in ''ABCA12'' underlie the severe congenital skin disease harlequin ichthyosis|czasopismo=Am J Hum Genet|oznaczenie=76|strony=794-803|rok=2005|pmid=15756637}}</ref><ref>{{cytuj stronę|url=http://web.archive.org/web/20090124090537/http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=li-ar|tytuł=Autosomal Recessive Congenital Ichthyosis|autor=Sherri J Bale, Gabriele Richard|opublikowany=GeneReviews}}</ref><ref>{{cytuj stronę|url=http://dermatlas.med.jhmi.edu/derm/result.cfm?Diagnosis=1877354016|tytuł=DermAtlas}}</ref>. |
Rzadka [[genodermatozy|genodermatoza]] o dziedziczeniu autosomalnym recesywnym. Objawy charakteryzują się pokrywającymi całą powierzchnię skóry [[Blaszka (medycyna)|łuskami]] [[hiperkeratoza|hiperkeratotycznego]] naskórka o kształcie rombów i wielokątów, o ułożeniu przywodzącym na myśl kostium [[arlekin]]a – stąd nazwa jednostki chorobowej. Ponadto stwierdza się niską masę urodzeniową, [[erytrodermia|erytrodermię]], wywinięcie warg (''eclabium'') i powiek ([[ektropion]]). Z powodu utraty wody i [[sepsa|sepsy]] oraz nieprawidłowej [[termoregulacja|termoregulacji]] noworodek umiera zwykle w ciągu tygodnia. Przynajmniej część przypadków wiąże się z [[mutacja]]mi [[gen]]u ''[[ABCA12]]'' na [[chromosom 2|chromosomie 2]]<ref>{{Cytuj pismo|autor=Kelsell DP, Norgett EE, Unsworth H, Teh MT, Cullup T, Mein CA, Dopping-Hepenstal PJ, Dale BA, Tadini G, Fleckman P, Stephens KG, Sybert VP, Mallory SB, North BV, Witt DR, Sprecher E, Taylor AE, Ilchyshyn A, Kennedy CT, Goodyear H, Moss C, Paige D, Harper JI, Young BD, Leigh IM, Eady RA, O'Toole EA|tytuł=Mutations in ''ABCA12'' underlie the severe congenital skin disease harlequin ichthyosis|czasopismo=Am J Hum Genet|oznaczenie=76|strony=794-803|rok=2005|pmid=15756637}}</ref><ref>{{cytuj stronę|url=http://web.archive.org/web/20090124090537/http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=li-ar|tytuł=Autosomal Recessive Congenital Ichthyosis|autor=Sherri J Bale, Gabriele Richard|opublikowany=GeneReviews}}</ref><ref>{{cytuj stronę|url=http://dermatlas.med.jhmi.edu/derm/result.cfm?Diagnosis=1877354016|tytuł=DermAtlas}}</ref>. |
||
=== Rdzeniowy zanik mięśni === |
==== Rdzeniowy zanik mięśni ==== |
||
{{osobny artykuł|Rdzeniowy zanik mięśni}} |
{{osobny artykuł|Rdzeniowy zanik mięśni}} |
||
Jest to rzadka nieuleczalna choroba nerwowo-mięśniowa, związana jest z [[mutacja|mutacją]] genu ''[[SMN1]]'' (locus [[chromosom 5|5q]]13.2), przejawiające się degeneracją jąder przednich [[rdzeń kręgowy|rdzenia kręgowego]], skutkującą postępującym upośledzeniem [[mięsień poprzecznie prążkowany|mięśni szkieletowych]], w ciężkich przypadkach prowadzącym do śmierci. Obraz kliniczny obejmuje: ogólne osłabienie mięśni szkieletowych – w zależności od typu niemożność samodzielnego siadania, stania, chodzenia, ograniczoną ruchomość [[niewydolność oddechowa|niewydolność oddechową]], skutkującą podatnością na infekcje układu oddechowego, problemy z przełykaniem i trawieniem, przykurcze mięśniowe, skutkujące między innymi [[skolioza|skoliozą]], drgania (fascykulacje) języka. Rozwój intelektualny i emocjonalny jest normalny<ref>{{cytuj książkę|inni=[[Andrzej Szczeklik]] (red.)|tytuł=Choroby wewnętrzne. Tom II|wydawca=Wydawnictwo Medycyna Praktyczna|miejsce=Kraków|rok=2006|isbn=83-7430-069-8|strony=1951-1952}}</ref><ref>[http://www.fsma.pl Fundacja SMA] – objawy, klasyfikacja i leczenie rdzeniowego zaniku mięśni</ref>. |
Jest to rzadka nieuleczalna choroba nerwowo-mięśniowa, związana jest z [[mutacja|mutacją]] genu ''[[SMN1]]'' (locus [[chromosom 5|5q]]13.2), przejawiające się degeneracją jąder przednich [[rdzeń kręgowy|rdzenia kręgowego]], skutkującą postępującym upośledzeniem [[mięsień poprzecznie prążkowany|mięśni szkieletowych]], w ciężkich przypadkach prowadzącym do śmierci. Obraz kliniczny obejmuje: ogólne osłabienie mięśni szkieletowych – w zależności od typu niemożność samodzielnego siadania, stania, chodzenia, ograniczoną ruchomość [[niewydolność oddechowa|niewydolność oddechową]], skutkującą podatnością na infekcje układu oddechowego, problemy z przełykaniem i trawieniem, przykurcze mięśniowe, skutkujące między innymi [[skolioza|skoliozą]], drgania (fascykulacje) języka. Rozwój intelektualny i emocjonalny jest normalny<ref>{{cytuj książkę|inni=[[Andrzej Szczeklik]] (red.)|tytuł=Choroby wewnętrzne. Tom II|wydawca=Wydawnictwo Medycyna Praktyczna|miejsce=Kraków|rok=2006|isbn=83-7430-069-8|strony=1951-1952}}</ref><ref>[http://www.fsma.pl Fundacja SMA] – objawy, klasyfikacja i leczenie rdzeniowego zaniku mięśni</ref>. |
||
==== Skóra pergaminowa ==== |
|||
=== Rodzinna polipowatość gruczolakowata === |
|||
[[Plik:Familial adenomatous polyposis as seen on sigmoidoscopy.jpg|130px|Endoskopowy obraz zmian w [[esica|esicy]] u pacjenta z FAP|thumb]] |
|||
{{Osobny artykuł|Rodzinna polipowatość gruczolakowata}} |
|||
Inne nazwy: {{ang.|''familial adenomatous polyposis'', '''''FAP'''''}}.<br /> |
|||
Choroba ta charakteryzująca się licznymi [[polip (medycyna)|polipami gruczolakowatymi]] [[jelito grube|jelita grubego]], powstającymi w 2. dekadzie życia. U nieleczonych chorych niemal we wszystkich przypadkach rozwija się [[rak jelita grubego]]. Etiopatogenezę na poziomie molekularnym stanowi mutacja [[antyonkogen]]u ''[[APC (gen)|APC]]'' (''adenomatous poliposis coli gene'') w ''[[locus]]'' [[chromosom 5|5q]]21-22. Mutacje te prowadzą do powstania nieprawidłowych, skróconych, [[Białka|białek]]<ref>Bisgaard ML, Fenger K, Bülow S, Niebuhr E, Mohr J: Familial adenomatous polyposis (FAP): frequency, penetrance, and mutation rate. Hum Mutat 1994, 3:121–125.</ref><ref>Rozen P, Samuel Z, Rabau M, Goldman G, Shomrat R, Legum C, Orr-Urtreger A : Familial adenomatous polyposis at the Tel Aviv Medical Center: demographic and clinical features. Fam Cancer 2001, 1:75–82.</ref>. W patomorfologii charakterystyczne są polipy gruczolakowate, zarówno cewkowe, kosmkowe jak i mieszane, makroskopowo przypominające powiększone [[grudki chłonne]] [[Okrężnica (anatomia)|okrężnicy]], co może być przyczyną nierozpoznania choroby w badaniu [[kolonoskopia|kolonoskopowym]]. W przebiegu choroby występują setki [[polip (medycyna)|polipów gruczolakowatych]] różnej wielkości w [[Okrężnica (anatomia)|okrężnicy]] i [[odbytnica|odbytnicy]]. U połowy pacjentów z FAP polipy są obecne w wieku 15 lat, a w wieku 35 lat u 95%<ref name="pmid25931827"/>. Oprócz tego może współistnieć [[polipowatość dna żołądka]] (ang. ''fundic gland polyps'', FGP), polipy dwunastnicy i gruczolaki jelita cienkiego, na ich podłożu mogą rozwijać się nowotwory złośliwe, z których najczęściej występującym w zespole polipowatości gruczolakowatej jest rak jelita grubego, którego ryzyko wynosi niemal 100%<ref name="pmid26265988">{{Cytuj pismo | nazwisko = Campos | imię = FG. | nazwisko2 = Sulbaran | imię2 = M. | nazwisko3 = Safatle-Ribeiro | imię3 = AV. | nazwisko4 = Martinez | imię4 = CA. | tytuł = Duodenal adenoma surveillance in patients with familial adenomatous polyposis | czasopismo = World J Gastrointest Endosc | wolumin = 7 | numer = 10 | strony = 950-9 | miesiąc = Aug | rok = 2015 | doi = 10.4253/wjge.v7.i10.950 | pmid = 26265988}}</ref>. U nieleczonych chorych rak jelita grubego powstaje przeciętnie w wieku 35 lat, a rzadko przed 20. rokiem życia<ref name="pmid25931827">{{Cytuj pismo | nazwisko = Leoz | imię = ML. | nazwisko2 = Carballal | imię2 = S. | nazwisko3 = Moreira | imię3 = L. | nazwisko4 = Ocaña | imię4 = T. | nazwisko5 = Balaguer | imię5 = F. | tytuł = The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management | czasopismo = Appl Clin Genet | wolumin = 8 | numer = | strony = 95-107 | miesiąc = | rok = 2015 | doi = 10.2147/TACG.S51484 | pmid = 25931827}}</ref>. Do innych nowotworów często występujących w przebiegu choroby należą: [[Nowotwory tarczycy|rak tarczycy]]<ref name="Jasperson"/><ref name="pmid22425061">{{Cytuj pismo | nazwisko = Steinhagen | imię = E. | nazwisko2 = Guillem | imię2 = JG. | nazwisko3 = Chang | imię3 = G. | nazwisko4 = Salo-Mullen | imię4 = EE. | nazwisko5 = Shia | imię5 = J. | tytuł = The prevalence of thyroid cancer and benign thyroid disease in patients with familial adenomatous polyposis may be higher than previously recognized | czasopismo = Clin Colorectal Cancer | wolumin = 11 | numer = 4 | strony = 304-8 | miesiąc = Dec | rok = 2012 | doi = 10.1016/j.clcc.2012.01.006 | pmid = 22425061}}</ref>, [[gruczolakorak jelita cienkiego]]<ref name="pmid11355321">{{Cytuj pismo | nazwisko = Kadmon | imię = M. | nazwisko2 = Tandara | imię2 = A. | nazwisko3 = Herfarth | imię3 = C. | tytuł = Duodenal adenomatosis in familial adenomatous polyposis coli. A review of the literature and results from the Heidelberg Polyposis Register. | czasopismo = Int J Colorectal Dis | wolumin = 16 | numer = 2 | strony = 63-75 | miesiąc = Apr | rok = 2001 | doi = | pmid = 11355321}}</ref><ref name="pmid19626156">{{Cytuj pismo | nazwisko = Dasari | imię = BV. | nazwisko2 = Gardiner | imię2 = KR. | tytuł = Management of adenocarcinoma of the small intestine. | czasopismo = Gastrointest Cancer Res | wolumin = 3 | numer = 3 | strony = 121-2 | miesiąc = May | rok = 2009 | doi = | pmid = 19626156}}</ref>, [[Wątrobiak zarodkowy|hepatoblastoma]]<ref name="pmid16317745">{{Cytuj pismo | nazwisko = Aretz | imię = S. | nazwisko2 = Koch | imię2 = A. | nazwisko3 = Uhlhaas | imię3 = S. | nazwisko4 = Friedl | imię4 = W. | nazwisko5 = Propping | imię5 = P. | tytuł = Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations? | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 811-8 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20698 | pmid = 16317745}}</ref><ref name="pmid18612695"/><ref name="pmid1329510">{{Cytuj pismo | nazwisko = Hughes | imię = LJ. | nazwisko2 = Michels | imię2 = VV. | tytuł = Risk of hepatoblastoma in familial adenomatous polyposis. | czasopismo = Am J Med Genet | wolumin = 43 | numer = 6 | strony = 1023-5 | miesiąc = Aug | rok = 1992 | doi = 10.1002/ajmg.1320430621 | pmid = 1329510}}</ref><ref name="pmid18612695"/><ref name="pmid16317745">{{Cytuj pismo | nazwisko = Aretz | imię = S. | nazwisko2 = Koch | imię2 = A. | nazwisko3 = Uhlhaas | imię3 = S. | nazwisko4 = Friedl | imię4 = W. | nazwisko5 = Propping | imię5 = P. | tytuł = Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations? | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 811-8 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20698 | pmid = 16317745}}</ref><ref name="pmid16106429">{{Cytuj pismo | nazwisko = Sanders | imię = RP. | nazwisko2 = Furman | imię2 = WL. | tytuł = Familial adenomatous polyposis in two brothers with hepatoblastoma: implications for diagnosis and screening | czasopismo = Pediatr Blood Cancer | wolumin = 47 | numer = 6 | strony = 851-4 | miesiąc = Nov | rok = 2006 | doi = 10.1002/pbc.20556 | pmid = 16106429}}</ref>, [[rak trzustki]]<ref name="Jasperson">{{Cytuj | autor= Kory W. Jasperson, Randall W. Burt | tytuł= [http://www.ncbi.nlm.nih.gov/books/NBK1345/ APC-Associated Polyposis Conditions]| data= 1998}}</ref><ref name="pmid8244108">{{Cytuj pismo | nazwisko = Giardiello | imię = FM. | nazwisko2 = Offerhaus | imię2 = GJ. | nazwisko3 = Lee | imię3 = DH. | nazwisko4 = Krush | imię4 = AJ. | nazwisko5 = Tersmette | imię5 = AC. | tytuł = Increased risk of thyroid and pancreatic carcinoma in familial adenomatous polyposis | czasopismo = Gut | wolumin = 34 | numer = 10 | strony = 1394-6 | miesiąc = Oct | rok = 1993 | doi = | pmid = 8244108}}</ref><ref name="pmid18612695"/><ref name="pmid12171972">{{Cytuj pismo | nazwisko = Maire | imię = F. | nazwisko2 = Hammel | imię2 = P. | nazwisko3 = Terris | imię3 = B. | nazwisko4 = Olschwang | imię4 = S. | nazwisko5 = O'Toole | imię5 = D. | tytuł = Intraductal papillary and mucinous pancreatic tumour: a new extracolonic tumour in familial adenomatous polyposis. | czasopismo = Gut | wolumin = 51 | numer = 3 | strony = 446-9 | miesiąc = Sep | rok = 2002 | doi = | pmid = 12171972}}</ref>, [[rak żołądka]]<ref name="Jasperson"/><ref name="pmid10370594">{{Cytuj pismo | nazwisko = Offerhaus | imię = GJ. | nazwisko2 = Entius | imię2 = MM. | nazwisko3 = Giardiello | imię3 = FM. | tytuł = Upper gastrointestinal polyps in familial adenomatous polyposis | czasopismo = Hepatogastroenterology | wolumin = 46 | numer = 26 | strony = 667-9 | miesiąc = | rok = | doi = | pmid = 10370594}}</ref><ref name="pmid18274437">{{Cytuj pismo | nazwisko = Garrean | imię = S. | nazwisko2 = Hering | imię2 = J. | nazwisko3 = Saied | imię3 = A. | nazwisko4 = Jani | imię4 = J. | nazwisko5 = Espat | imię5 = NJ. | tytuł = Gastric adenocarcinoma arising from fundic gland polyps in a patient with familial adenomatous polyposis syndrome. | czasopismo = Am Surg | wolumin = 74 | numer = 1 | strony = 79-83 | miesiąc = Jan | rok = 2008 | doi = | pmid = 18274437}}</ref>, [[Rak nadnercza|rak nadnerczy]]<ref name="pmid18612695"/>, [[Nowotwory ośrodkowego układu nerwowego|guzy mózgu]] – najczęstszym guzem [[Ośrodkowy układ nerwowy|OUN]] związany z FAP jest [[rdzeniak]], stanowi około 80% guzów związanych z zespołem FAP, ryzyko zachorowania w ciągu życia wynosi około 1%<ref name="Jasperson"/><ref name="pmid18612695"/>. W obrazie klinicznym mogą być widoczne zróżnicowane objawy pozajelitowe, takie jak<ref name="pmid18612695">{{Cytuj pismo | nazwisko = Groen | imię = EJ. | nazwisko2 = Roos | imię2 = A. | nazwisko3 = Muntinghe | imię3 = FL. | nazwisko4 = Enting | imię4 = RH. | nazwisko5 = de Vries | imię5 = J. | tytuł = Extra-intestinal manifestations of familial adenomatous polyposis | czasopismo = Ann Surg Oncol | wolumin = 15 | numer = 9 | strony = 2439-50 | miesiąc = Sep | rok = 2008 | doi = 10.1245/s10434-008-9981-3 | pmid = 18612695}}</ref>: [[kostniak]]i – występują u 20% chorych, zwykle w obrębie żuchwy i czaszki; nieprawidłowości uzębienia – występują u 17% chorych, nieprawidłowości obejmują [[Ząb nadliczbowy|zęby nadliczbowe]], wrodzone braki zębów, torbiele zębowe, [[odontoma|zębiaki]]; [[Guz desmoidalny|guzy desmoidalne]] – [[Nowotwór miejscowo złośliwy|miejscowo złośliwy guz]] najczęściej zlokalizowany w jamie brzusznej, tylko 10% z nich znajduje się poza jamą brzuszną. Często rosną do ogromnych rozmiarów, stanowią duże zagrożenie dla sąsiednich struktur; [[torbiel epidermoidalna|torbiele epidermoidalne]] – nie wykazują potencjału złośliwego, stanowią problem kosmetyczny<ref name="Jasperson"/>; [[wrodzona hipertrofia barwnikowa siatkówki]]. Odmiany FAP: '''[[Zespół Gardnera (gastrologia)|zespół Gardnera]]''' - w przebiegu choroby występują setki, a nawet tysiące polipów jelita grubego, którym towarzyszy powstawanie guzów mezodermalnych o typie [[kostniak]]ów, [[Guz desmoidalny|guzów desmoidalnych]], torbieli naskórkowych oraz przerostu nabłonka barwnikowego siatkówki (CHRPE, ang. ''Congenital Hypertrophy of the Retinal Pigment Epithelium''); '''[[zespół Turcota]]''' - współwystępują guzy mózgu i polipy okrężnicy; '''poronna postać FAP''' - mniej agresywny wariant FAP, w jego przebiegu powstaje mniej polipów (10-100) i rozwijają się one w późniejszym wieku<ref name=ojrd>{{Cytuj pismo | nazwisko = Half | imię = E. | nazwisko2 = Bercovich | imię2 = D. | nazwisko3 = Rozen | imię3 = P. | tytuł = Familial adenomatous polyposis | czasopismo = Orphanet J Rare Dis | wolumin = 4 | numer = 1 | strony = 22 | miesiąc = Oct | rok = 2009 | doi = 10.1186/1750-1172-4-22 | pmid = 19822006}}</ref>. Ryzyko nowotworu złośliwego jest mniejsze i nie przekracza 70%<ref name="pmid25931827"/>. |
|||
=== Skóra pergaminowa === |
|||
[[Plik:Xeroderma pigmentosum 02.jpg|thumb|Xeroderma pigmentosum 02|Ośmioletnia dziewczyna z Gwatemali z Xeroderma pigmentosum.]] |
[[Plik:Xeroderma pigmentosum 02.jpg|thumb|Xeroderma pigmentosum 02|Ośmioletnia dziewczyna z Gwatemali z Xeroderma pigmentosum.]] |
||
{{osobny artykuł|Skóra pergaminowa}} |
{{osobny artykuł|Skóra pergaminowa}} |
||
| Linia 483: | Linia 537: | ||
Te bardzo rzadkie schorzenie [[dziedziczenie autosomalne recesywne|dziedziczone autosomalnie recesywnie]] spowodowane jest genetycznym defektem [[polimeraza DNA|polimerazy DNA β]], skutkiem czego dochodzi do nieodwracalnych uszkodzeń DNA w komórkach skóry narażonych na działanie promieni [[Ultrafiolet|UV]]; system naprawy uszkodzeń DNA funkcjonuje nieprawidłowo, mutacje kumulują się. Dochodzi do mutacji w [[Antyonkogen|genach supresorowych]] albo [[protoonkogen]]ach, dlatego też u pacjentów z XP występuje znacznie zwiększone ryzyko [[Nowotwór złośliwy skóry|nowotworów skóry]]. Do widocznych objawów należą m.in.: drobne [[plama (dermatologia)|plamy]] przypominające piegi, większe plamy barwnikowe<ref>{{Cytuj pismo|autor=Kaposi M|tytuł=Xeroderma pigmentosum|czasopismo=Medizinische Jahrbucher|rok=1882|strony=619-33|url=http://web2.bium.univ-paris5.fr/livanc/?cote=epo0546&p=1&do=page}}</ref>, oparzenia słoneczne, zaniki skóry, ścieńczenie skóry, odbarwienia skóry, znaczna suchość skóry, [[Teleangiektazja|teleangiektazje]], [[oftalmoplegia]], [[mikrocefalia]]. Najcięższą odmianą XP jest tzw. '''zespół de Sanctis-Cacchione''', gdzie zmiany skórne typowe dla XP współistnieją z [[Niepełnosprawność intelektualna|oligofrenią]], niedorozwojem fizycznym, głuchotą i [[ataksja|ataksją]]<ref>Stefania Jabłońska, Sławomir Majewski ''Choroby skóry i choroby przenoszone drogą płciową'' PZWL 2005, {{ISBN|83-200-3367-5}}</ref><ref>[http://dermnetnz.org/systemic/xeroderma-pigmentosum.html Informacje na stronie New Zealand Dermatological Society] {{lang|en}}</ref>. |
Te bardzo rzadkie schorzenie [[dziedziczenie autosomalne recesywne|dziedziczone autosomalnie recesywnie]] spowodowane jest genetycznym defektem [[polimeraza DNA|polimerazy DNA β]], skutkiem czego dochodzi do nieodwracalnych uszkodzeń DNA w komórkach skóry narażonych na działanie promieni [[Ultrafiolet|UV]]; system naprawy uszkodzeń DNA funkcjonuje nieprawidłowo, mutacje kumulują się. Dochodzi do mutacji w [[Antyonkogen|genach supresorowych]] albo [[protoonkogen]]ach, dlatego też u pacjentów z XP występuje znacznie zwiększone ryzyko [[Nowotwór złośliwy skóry|nowotworów skóry]]. Do widocznych objawów należą m.in.: drobne [[plama (dermatologia)|plamy]] przypominające piegi, większe plamy barwnikowe<ref>{{Cytuj pismo|autor=Kaposi M|tytuł=Xeroderma pigmentosum|czasopismo=Medizinische Jahrbucher|rok=1882|strony=619-33|url=http://web2.bium.univ-paris5.fr/livanc/?cote=epo0546&p=1&do=page}}</ref>, oparzenia słoneczne, zaniki skóry, ścieńczenie skóry, odbarwienia skóry, znaczna suchość skóry, [[Teleangiektazja|teleangiektazje]], [[oftalmoplegia]], [[mikrocefalia]]. Najcięższą odmianą XP jest tzw. '''zespół de Sanctis-Cacchione''', gdzie zmiany skórne typowe dla XP współistnieją z [[Niepełnosprawność intelektualna|oligofrenią]], niedorozwojem fizycznym, głuchotą i [[ataksja|ataksją]]<ref>Stefania Jabłońska, Sławomir Majewski ''Choroby skóry i choroby przenoszone drogą płciową'' PZWL 2005, {{ISBN|83-200-3367-5}}</ref><ref>[http://dermnetnz.org/systemic/xeroderma-pigmentosum.html Informacje na stronie New Zealand Dermatological Society] {{lang|en}}</ref>. |
||
=== Wrodzona ślepota Lebera === |
==== Wrodzona ślepota Lebera ==== |
||
{{osobny artykuł|Wrodzona ślepota Lebera}} |
{{osobny artykuł|Wrodzona ślepota Lebera}} |
||
Spowodowana jest przez wadę [[gen]]u ''[[RPE65]]''<ref name="Marlhens-1997">{{Cytuj pismo | nazwisko = Marlhens | imię = F. | nazwisko2 = Bareil | imię2 = C. | nazwisko3 = Griffoin | imię3 = JM. | nazwisko4 = Zrenner | imię4 = E. | nazwisko5 = Amalric | imię5 = P. | tytuł = Mutations in RPE65 cause Leber's congenital amaurosis. | czasopismo = Nat Genet | wolumin = 17 | numer = 2 | strony = 139-41 | miesiąc = Oct | rok = 1997 | doi = 10.1038/ng1097-139 | pmid = 9326927}}</ref>. W chorobie tej dochodzi do stopniowej utraty [[wzrok]]u, na skutek tego, iż [[fotoreceptory]] [[oko|oka]] przestają reagować na [[światło]]. Przyczyną jest wadliwe działanie genu kodującego [[białka|białko]] niezbędne do prawidłowego przeprowadzania procesu widzenia. Charakterystyczny jest oczopląs i [[światłowstręt]], które pojawiają się wkrótce po urodzeniu. |
Spowodowana jest przez wadę [[gen]]u ''[[RPE65]]''<ref name="Marlhens-1997">{{Cytuj pismo | nazwisko = Marlhens | imię = F. | nazwisko2 = Bareil | imię2 = C. | nazwisko3 = Griffoin | imię3 = JM. | nazwisko4 = Zrenner | imię4 = E. | nazwisko5 = Amalric | imię5 = P. | tytuł = Mutations in RPE65 cause Leber's congenital amaurosis. | czasopismo = Nat Genet | wolumin = 17 | numer = 2 | strony = 139-41 | miesiąc = Oct | rok = 1997 | doi = 10.1038/ng1097-139 | pmid = 9326927}}</ref>. W chorobie tej dochodzi do stopniowej utraty [[wzrok]]u, na skutek tego, iż [[fotoreceptory]] [[oko|oka]] przestają reagować na [[światło]]. Przyczyną jest wadliwe działanie genu kodującego [[białka|białko]] niezbędne do prawidłowego przeprowadzania procesu widzenia. Charakterystyczny jest oczopląs i [[światłowstręt]], które pojawiają się wkrótce po urodzeniu. |
||
=== Zespół Alströma === |
==== Zespół Alströma ==== |
||
{{osobny artykuł|Zespół Alströma}} |
{{osobny artykuł|Zespół Alströma}} |
||
Zespół Alströma<ref>{{OMIM|id=203800|nazwa=ALSTROM SYNDROME; ALMS}}</ref> spowodowany jest mutacją w genie ''[[ALMS1]]'' w ''locus'' [[chromosom 2|2p]]13<ref>{{Cytuj pismo|autor=Hearn T, Renforth GL, Spalluto C, Hanley NA, Piper K, Brickwood S, White C, Connolly V, Taylor JF, Russell-Eggitt I, Bonneau D, Walker M, Wilson DI|tytuł=Mutation of ''ALMS1'', a large gene with a tandem repeat encoding 47 amino acids, causes Alstrom syndrome|czasopismo=Nature Genet|oznaczenie=31|strony=79-83|rok=2002|pmid=11941370}} {{doi|10.1038/ng874}}</ref>. Zespół opisał szwedzki psychiatra [[Carl Henry Alström]] ze współpracownikami w 1959 roku<ref>{{Cytuj pismo|autor=Alstrom CH, Hallgren B, Nilsson LB, Asander H|tytuł=Retinal degeneration combined with obesity, diabetes mellitus and neurogenous deafness: a specific syndrome (not hitherto described) distinct from the Laurence-Moon-Biedl syndrome. A clinical endocrinological and genetic examination based on a large pedigree|czasopismo=Acta Psychiat Neurol Scand|oznaczenie=34|wolumin=suppl 129|strony=1-35|rok=1959}}</ref><ref>{{WhoNamedIt|synd|511|Alström's syndrome}}</ref>. Sposób dziedziczenia tej choroby jest autosomalny recesywny. Charakterystycznymi objawami są np.: [[cukrzyca|cukrzyca typu 1]], [[retinopatia]] barwnikową, [[głuchota]], [[otyłość]] i [[hipogonadyzm]]. Pierwsze objawy zespołu pojawiają się bezpośrednio po urodzeniu; później ujawniają się zaburzenia widzenia i głuchota<ref>{{Cytuj pismo|autor=Jan D Marshall, Sebastian Beck, Pietro Maffei, Jürgen K Naggert|tytuł=Alström Syndrome|czasopismo=European Journal of Human Genetics|rok=2007|oznaczenie=15|strony=1193–1202}} {{doi|10.1038/sj.ejhg.5201933}}</ref><ref>{{Cytuj pismo|autor=Tisha Joy, Henian Cao, Graeme Black, Rayaz Malik, Valentine Charlton-Menys, Robert A. Hegele, Paul N. Durrington|tytuł=Alstrom syndrome (OMIM 203800): a case report and literature review|czasopismo=Orphanet Journal of Rare Diseases|rok=2007|oznaczenie=2|wolumin=49}} {{doi|10.1186/1750-1172-2-49}}</ref>. |
Zespół Alströma<ref>{{OMIM|id=203800|nazwa=ALSTROM SYNDROME; ALMS}}</ref> spowodowany jest mutacją w genie ''[[ALMS1]]'' w ''locus'' [[chromosom 2|2p]]13<ref>{{Cytuj pismo|autor=Hearn T, Renforth GL, Spalluto C, Hanley NA, Piper K, Brickwood S, White C, Connolly V, Taylor JF, Russell-Eggitt I, Bonneau D, Walker M, Wilson DI|tytuł=Mutation of ''ALMS1'', a large gene with a tandem repeat encoding 47 amino acids, causes Alstrom syndrome|czasopismo=Nature Genet|oznaczenie=31|strony=79-83|rok=2002|pmid=11941370}} {{doi|10.1038/ng874}}</ref>. Zespół opisał szwedzki psychiatra [[Carl Henry Alström]] ze współpracownikami w 1959 roku<ref>{{Cytuj pismo|autor=Alstrom CH, Hallgren B, Nilsson LB, Asander H|tytuł=Retinal degeneration combined with obesity, diabetes mellitus and neurogenous deafness: a specific syndrome (not hitherto described) distinct from the Laurence-Moon-Biedl syndrome. A clinical endocrinological and genetic examination based on a large pedigree|czasopismo=Acta Psychiat Neurol Scand|oznaczenie=34|wolumin=suppl 129|strony=1-35|rok=1959}}</ref><ref>{{WhoNamedIt|synd|511|Alström's syndrome}}</ref>. Sposób dziedziczenia tej choroby jest autosomalny recesywny. Charakterystycznymi objawami są np.: [[cukrzyca|cukrzyca typu 1]], [[retinopatia]] barwnikową, [[głuchota]], [[otyłość]] i [[hipogonadyzm]]. Pierwsze objawy zespołu pojawiają się bezpośrednio po urodzeniu; później ujawniają się zaburzenia widzenia i głuchota<ref>{{Cytuj pismo|autor=Jan D Marshall, Sebastian Beck, Pietro Maffei, Jürgen K Naggert|tytuł=Alström Syndrome|czasopismo=European Journal of Human Genetics|rok=2007|oznaczenie=15|strony=1193–1202}} {{doi|10.1038/sj.ejhg.5201933}}</ref><ref>{{Cytuj pismo|autor=Tisha Joy, Henian Cao, Graeme Black, Rayaz Malik, Valentine Charlton-Menys, Robert A. Hegele, Paul N. Durrington|tytuł=Alstrom syndrome (OMIM 203800): a case report and literature review|czasopismo=Orphanet Journal of Rare Diseases|rok=2007|oznaczenie=2|wolumin=49}} {{doi|10.1186/1750-1172-2-49}}</ref>. |
||
=== Zespół |
==== Zespół Blooma ==== |
||
{{osobny artykuł|Zespół Bartha}} |
|||
Inaczej '''kwasica 3-metyloglutakonowa typu II''', '''acyduria 3-metyloglutakonowa typu II''', '''zwłóknienie sprężyste wsierdzia typu 2''' to choroba dziedziczona recesywnie, sprzężona z płcią, spowodowana uszkodzeniem [[gen]]u TAZ (G4.5) znajdującego się na długim ramieniu [[chromosom X|chromosomu X]] w regionie q28, kodującego [[tafazyna|tafazynę]]{{R|Werner}}. Opisano ponad 120 różnych mutacji tego genu{{r|Clarke}}. Gen TAZ koduje [[acylotransferaza|acylotransferazę]], która odpowiada za modyfikację struktury [[kardiolipina|kardiolipiny]], jedynego [[fosfolipidy|fosfolipidu]] syntetyzowanego w błonie{{r|Clarke}} mitochondrium{{R|Werner}}. Kardiolipina oddziałuje z licznymi [[białka]]mi związanymi z syntezą [[adenozyno-5′-trifosforan]]u (ATP){{R|Werner}} oraz bierze udział w procesie [[apoptoza|apoptozy]] mitochondriów{{r|Clarke}}. W wyniku mutacji dochodzi do upośledzenia włączania [[kwas linolowy|kwasu linolowego]] do kardiolipiny oraz zaburzeń czynności wewnętrznej i zewnętrznej błony mitochondriów{{R|Werner}}. |
|||
Objawy kliniczne: [[neutropenia]], która występuje u 90% pacjentów kardiomiopatie.7B.7B{{R|Werner}}, zmiany w [[układ krążenia|układzie sercowo-naczyniowym]] w okresie [[niemowlę]]cym, czasem bezpośrednio po [[poród|porodzie]], [[nagłe zatrzymanie krążenia]] oraz [[nagła śmierć sercowa]], których ryzyko wzrasta z wiekiem pacjenta{{r|Werner}}, twarz o wysokim płaskim [[czoło (anatomia)|czole]], okrągłej [[twarz człowieka|twarzy]] z pełnymi [[policzek człowieka|policzkami]], odstającymi [[Małżowina uszna|małżowiny uszne]] i głęboko osadzonymi [[oko|oczami]]), jednakże z okresem [[pokwitanie|pokwitania]] cechy te w znacznym stopniu zanikają{{R|Clarke}}. [[Miopatie|Miopatia]] jest częstym objawem i większość pacjentów ma opóźniony rozwój [[psychomotoryka|psychomotoryczny]]{{r|Clarke}}. Osłabienie dotyczy przede wszystkim [[kierunek proksymalny|proksymalnych]] [[mięsień|mięśni]] i nie pogarsza się wiekiem{{r|Clarke}}. Może być obecny [[objaw Gowersa]]{{r|Clarke}}. Rozwój umysłowy nie jest opóźniony, jednakże występują zaburzenia [[orientacja przestrzenna|orientacji przestrzennej]] i umiejętności [[matematyka|matematycznych]]{{r|Werner}}. Większość chorych umiera we wczesnym dzieciństwie, w przebiegu niewydolności serca lub [[zakażenie|zakażenia]]. W przypadku postawienia rozpoznania [[śmiertelność]] wynosi 10%{{R|Clarke}}. Długość życia u nosicielek jest taka sama jak w populacji ogólnej{{r|OMIM}}. |
|||
=== Zespół Blooma === |
|||
{{osobny artykuł|Zespół Blooma}} |
{{osobny artykuł|Zespół Blooma}} |
||
Charakteryzująca się zwiększoną predyspozycją do uszkodzeń [[chromosom]]ów<ref name="bloom">{{Cytuj pismo|autor=Bloom, D|rok=1954|tytuł=Congenital telangiectatic erythema resembling lupus erythematosus in dwarfs; probably a syndrome entity|czasopismo=AMA American Journal of Diseases of Children|oznaczenie=88|wolumin=6|754-758|pmid=13206391}}</ref>. Przyczyną zespołu jest [[mutacja]] w genie ''BLM'' mającym ''locus'' na długim ramieniu [[chromosom 15|15 chromosomu]] (15q26.1). Mutacja dziedziczona jest w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]]<ref name="pmid9482582">{{Cytuj pismo | autor=Straughen JE., Johnson J., McLaren D., Proytcheva M., Ellis N., German J., Groden J | tytuł=A rapid method for detecting the predominant Ashkenazi Jewish mutation in the Bloom's syndrome gene. | rok=1998 | czasopismo=Human mutation | doi=10.1002/(SICI)1098-1004(1998)11:2<175::AID-HUMU11>3.0.CO;2-W | wydanie=11 | wolumin=2 | miesiąc= | pmid= 9482582 | strony=175–8}}</ref>. Białko BLM kodowane przez ten gen należy do rodziny [[Helikazy|helikaz DNA]] i tak jak inne helikazy, bierze udział w procesie [[transkrypcja (genetyka)|transkrypcji]], katalizując reakcję rozplecenia podwójnej helisy DNA. Prawdopodobnie bierze też udział w procesie [[naprawa DNA|naprawy DNA]]. U pacjentów z zespołem Blooma stwierdza się także nadprodukcję [[anion ponadtlenkowy|anionu ponadtlenkowego]]. Występuje z wysoką częstością nosicieli wśród [[Żydzi aszkenazyjscy|Żydów aszkenazyjskich]]<ref name="pmid9482582"/><ref>{{Cytuj książkę | nazwisko= Connor | imię=J | nazwisko2= Ferguson-Smith | imię2=M | nazwisko3= Bocian | imię3=Ewa | nazwisko4= Mazurczak | imię4=Tadeusz Jerzy | inni= | tytuł= Podstawy genetyki medycznej | data=1998 | wydawca=Wydawnictwo Lekarskie PZWL | miejsce=Warszawa | isbn=83-200-2250-9 | strony=211|rozdział=17}}</ref>. Do objawów należą m.in.: [[Niedobór wzrostu|karłowatość]], [[mikrognacja]], długa, wąska czaszka ([[dolichocefalia]]), zwiększona predyspozycja do [[nowotwór|nowotworów]]<ref name="pmid15950375">{{Cytuj pismo | autor=Amor-Guéret M | tytuł=Bloom syndrome, genomic instability and cancer: the SOS-like hypothesis. | rok=2006 | czasopismo=Cancer letters | doi=10.1016/j.canlet.2005.04.023 | wydanie=236 | wolumin=1 | miesiąc=maj | pmid= 15950375 | strony=1–12}}</ref>. |
Charakteryzująca się zwiększoną predyspozycją do uszkodzeń [[chromosom]]ów<ref name="bloom">{{Cytuj pismo|autor=Bloom, D|rok=1954|tytuł=Congenital telangiectatic erythema resembling lupus erythematosus in dwarfs; probably a syndrome entity|czasopismo=AMA American Journal of Diseases of Children|oznaczenie=88|wolumin=6|754-758|pmid=13206391}}</ref>. Przyczyną zespołu jest [[mutacja]] w genie ''BLM'' mającym ''locus'' na długim ramieniu [[chromosom 15|15 chromosomu]] (15q26.1). Mutacja dziedziczona jest w sposób [[dziedziczenie autosomalne recesywne|autosomalny recesywny]]<ref name="pmid9482582">{{Cytuj pismo | autor=Straughen JE., Johnson J., McLaren D., Proytcheva M., Ellis N., German J., Groden J | tytuł=A rapid method for detecting the predominant Ashkenazi Jewish mutation in the Bloom's syndrome gene. | rok=1998 | czasopismo=Human mutation | doi=10.1002/(SICI)1098-1004(1998)11:2<175::AID-HUMU11>3.0.CO;2-W | wydanie=11 | wolumin=2 | miesiąc= | pmid= 9482582 | strony=175–8}}</ref>. Białko BLM kodowane przez ten gen należy do rodziny [[Helikazy|helikaz DNA]] i tak jak inne helikazy, bierze udział w procesie [[transkrypcja (genetyka)|transkrypcji]], katalizując reakcję rozplecenia podwójnej helisy DNA. Prawdopodobnie bierze też udział w procesie [[naprawa DNA|naprawy DNA]]. U pacjentów z zespołem Blooma stwierdza się także nadprodukcję [[anion ponadtlenkowy|anionu ponadtlenkowego]]. Występuje z wysoką częstością nosicieli wśród [[Żydzi aszkenazyjscy|Żydów aszkenazyjskich]]<ref name="pmid9482582"/><ref>{{Cytuj książkę | nazwisko= Connor | imię=J | nazwisko2= Ferguson-Smith | imię2=M | nazwisko3= Bocian | imię3=Ewa | nazwisko4= Mazurczak | imię4=Tadeusz Jerzy | inni= | tytuł= Podstawy genetyki medycznej | data=1998 | wydawca=Wydawnictwo Lekarskie PZWL | miejsce=Warszawa | isbn=83-200-2250-9 | strony=211|rozdział=17}}</ref>. Do objawów należą m.in.: [[Niedobór wzrostu|karłowatość]], [[mikrognacja]], długa, wąska czaszka ([[dolichocefalia]]), zwiększona predyspozycja do [[nowotwór|nowotworów]]<ref name="pmid15950375">{{Cytuj pismo | autor=Amor-Guéret M | tytuł=Bloom syndrome, genomic instability and cancer: the SOS-like hypothesis. | rok=2006 | czasopismo=Cancer letters | doi=10.1016/j.canlet.2005.04.023 | wydanie=236 | wolumin=1 | miesiąc=maj | pmid= 15950375 | strony=1–12}}</ref>. |
||
=== Zespół Chediaka-Higashiego === |
==== Zespół Chediaka-Higashiego ==== |
||
{{osobny artykuł|Zespół Chediaka-Higashiego}} |
{{osobny artykuł|Zespół Chediaka-Higashiego}} |
||
To zespół chorobowy przebiegający z upośledzeniem odporności, cechuje się nawracającymi zakażeniami bakteryjnymi oraz częściowym [[albinizm]]em. Powoduje go mutacja genu ''[[LYST]]'' znajdującego się na chromosomie 1q42. dziedziczy się autosomalnie recesywnie. Histopatologicznie i cytologicznie choroba charakteryzuje się obecnością dużych [[wakuola|wodniczek]] w [[leukocyty|leukocytach]], co utrudnia zabijanie wchłoniętych [[Bakterie|bakterii]]; proces [[fagocytoza|fagocytozy]] i inne zdolności komórek żernych są upośledzone<ref>{{OMIM|id=214500|nazwa=CHEDIAK-HIGASHI SYNDROME; CHS}}</ref><ref>{{WhoNamedIt|synd|1745|Béguez César's syndrome}}</ref><ref>[http://web.archive.org/web/20160304084929/http://www.gfmer.ch/genetic_diseases_v2/gendis_detail_list.php?cat3=60] {{lang|en}}</ref>. Pierwszym który opisał ten zespół objawów w 1933 roku był [[kuba]]ński lekarz, [[Antonio Béguez César]]<ref>A. Béguez César:''Neutropenia crònica maligna familial con granulaciones atipicas de los leucocitos.''Revista cubana de pediatría 15: 900-910 (1943).</ref>, w tym samym czasie niezależnie od niego przypadek zespołu opisał [[Japonia|japoński]] pediatra [[Otokata Higashi]]<ref>O. Higashi: ''Congenital gigantism of peroxidase granules. The first case ever reported of qualitative abnormality of proxidase.'' Tohoku Journal of Experimental Medicine 59: 315-332. (1953/1954)</ref>. |
To zespół chorobowy przebiegający z upośledzeniem odporności, cechuje się nawracającymi zakażeniami bakteryjnymi oraz częściowym [[albinizm]]em. Powoduje go mutacja genu ''[[LYST]]'' znajdującego się na chromosomie 1q42. dziedziczy się autosomalnie recesywnie. Histopatologicznie i cytologicznie choroba charakteryzuje się obecnością dużych [[wakuola|wodniczek]] w [[leukocyty|leukocytach]], co utrudnia zabijanie wchłoniętych [[Bakterie|bakterii]]; proces [[fagocytoza|fagocytozy]] i inne zdolności komórek żernych są upośledzone<ref>{{OMIM|id=214500|nazwa=CHEDIAK-HIGASHI SYNDROME; CHS}}</ref><ref>{{WhoNamedIt|synd|1745|Béguez César's syndrome}}</ref><ref>[http://web.archive.org/web/20160304084929/http://www.gfmer.ch/genetic_diseases_v2/gendis_detail_list.php?cat3=60] {{lang|en}}</ref>. Pierwszym który opisał ten zespół objawów w 1933 roku był [[kuba]]ński lekarz, [[Antonio Béguez César]]<ref>A. Béguez César:''Neutropenia crònica maligna familial con granulaciones atipicas de los leucocitos.''Revista cubana de pediatría 15: 900-910 (1943).</ref>, w tym samym czasie niezależnie od niego przypadek zespołu opisał [[Japonia|japoński]] pediatra [[Otokata Higashi]]<ref>O. Higashi: ''Congenital gigantism of peroxidase granules. The first case ever reported of qualitative abnormality of proxidase.'' Tohoku Journal of Experimental Medicine 59: 315-332. (1953/1954)</ref>. |
||
=== Zespół |
==== Zespół Fanconiego-Bickela ==== |
||
{{osobny artykuł|Zespół Fanconiego-Bickela}} |
|||
[[Plik:Costello syndrome facial manifestation 17-year-old female.png|thumb|140px|Costello syndrome facial manifestation 17-year-old female|17-letnia kobieta ze zdiagnozowanym zespołem Costello (grube rysy twarzy, rzadkie włosy, duże usta, grube wargi, luźna skóra){{r|Sriboonnark}}]] |
|||
{{Osobny artykuł|Zespół Costello}} |
|||
Rzadka, o dziedziczeniu autosomalnym recesywnym, której podłożem molekularnym jest [[Mutacja|mutacją]] w obrębie [[gen]]u [[GLUT2]] zlokalizowanego na [[Chromosom 3|chromosomie 3]] w ''locus'' q26.1-3, kodującego [[Transporter glukozy|białko błonowe transportujące glukozę]]. Jej skutkami są nadmierne spichrzanie [[glikogen]]u w [[Wątroba|wątrobie]], zaburzenia w obrębie cewek proksymalnych [[nefron]]u, a także nieprawidłowym metabolizmem [[Glukoza|glukozy]] i [[Galaktoza|galaktozy]]. Do objawów należą: ciężka [[tubulopatie|tubulopatia]], [[krzywica]] [[Hipofosfatemia|hipofosfatemiczna]], kwasica mleczanowa, [[hepatomegalia]], zahamowanie wzrostu<ref>{{Cytuj książkę|autor=Krystyna Kubicka, Wanda Kawalec|tytuł=Pediatria|miejsce=Warszawa|wydawca=Wydawnictwo Lekarskie PZWL|strony=176-9|rok=2004|isbn=8320030013}}</ref><ref>{{OMIM|id=227810|nazwa=FANCONI-BICKEL SYNDROME; FBS}}</ref><ref>{{WhoNamedIt|synd|65|Fanconi-Bickel syndrome}}</ref>. |
|||
Inne nazwy: {{łac.|syndroma Costello}}, {{ang.|Costello syndrome, faciocutaneoskeletal syndrome, FCS syndrome}}.<br />To choroba genetyczna i zespół wad wrodzonych, dziedzicząca się autosomalnie dominująco, która spowodowana jest uszkodzeniem genu HRAS zlokalizowanego na ramieniu krótkim [[chromosom 11|chromosomu 11]], w regionie p15{{r|OMIM5}}. GTP-aza kodowana przez gen HRAS bierze udział w szlaku Ras–[[Kinazy aktywowane mitogenami|MAPK]]{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=24}}. Zespół Costello jest zespołem genetycznym dziedziczonym autosomalnie dominująco, z pełną [[penetracja (genetyka)|penetracją]] genu{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=20}}{{r|Orphanet2}}{{r|Pelc}}. Częstość występowania: 1 na 24 000 000 żywych urodzeń{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=20}}. Charakterystyczne cechy fenotypowe osoby chorej: [[niedobór wzrostu]], opóźniony rozwój psychoruchowy, nadmierna wiotkość małych [[staw (anatomia)|stawów]], hiperpigmentacja skóry, charakterystyczny wygląd twarzy oraz niepełnosprawność intelektualna{{odn|Pelc|Ciara|Krajewska-Walasek|2012|s=22}}. Wśród objawów występują liczne zaburzenia kardiologiczne (np. [[zwężenie drogi odpływu prawej komory]]), [[gastroenterologia|gastroenterologiczne]] (np. [[przerostowe zwężenie odźwiernika]]), ortopedyczne (np. deformacja [[klatka piersiowa|klatki piersiowej]]) i neurologiczne (np. [[napad padaczkowy|napady padaczkowe]]){{r|Orphanet2}}. |
|||
=== Zespół |
==== Zespół nadnerczowo-płciowy ==== |
||
{{osobny artykuł| |
{{osobny artykuł|Wrodzony przerost nadnerczy}} |
||
CAH to grupa chorób charakteryzujących się nadmiernym wydzielaniem [[androgeny|androgenów nadnerczowych]] z niedoborem [[kortyzol]]u wskutek genetycznie uwarunkowanego braku (lub niedoboru) enzymów szlaku biosyntezy hormonów nadnerczy, przede wszystkim 21-hydroksylazy i 11β-hydroksylazy<ref>{{Cytuj|autor=A Slominski, G Ermak, M Mihm|tytuł=ACTH receptor, CYP11A1, CYP17 and CYP21A2 genes are expressed in skin.|czasopismo=The Journal of Clinical Endocrinology & Metabolism|data=1996-07-01|data dostępu=2017-01-04|issn=0021-972X|wydanie=7|s=2746–2749|doi=10.1210/jcem.81.7.8675607|url=http://press.endocrine.org/doi/abs/10.1210/jcem.81.7.8675607}}</ref>. Przyczyną (w podłożu molekularnym) jest mutacja genu ''CYP21'', powodująca niedobór lub brak enzymu 21-hydroksylazy. Skutkujący tym niedobór kortyzolu pobudza przedni płat przysadki do wydzielania [[Hormon adrenokortykotropowy|ACTH]], który z kolei pobudza czynność nadnerczy. Rezultatem tego jest nagromadzenie się 17-OH-progesteronu i steroidów nadnerczowych, których biosynteza nie jest zaburzona przez defekt enzymatyczny i którą nasila nadmiar ACTH: [[dehydroepiandrostendion]]u, [[androstendion]]u i [[testosteron]]u. Wyróżnia się kilka postaci choroby. Do najbardziej charakterystycznych, klasycznych objawów należą: odwodnienie (w niedoborze 21-hydroksylazy) lub przewodnienie (w niedoborze 11-hydroksylazy), [[hiponatremia]], [[hiperkaliemia]] (w niedoborze 21-hydroksylazy) lub [[hipokaliemia]] (w niedoborze 11-hydroksylazy), [[kwasica metaboliczna]]<ref>{{OMIM|id=201910|nazwa=ADRENAL HYPERPLASIA, CONGENITAL, DUE TO 21-HYDROXYLASE DEFICIENCY}}</ref>. W postaci nieklasycznej na obraz kliniczny składają się m.in.: [[hirsutyzm]]<ref>{{OMIM|id=202010|nazwa=ADRENAL HYPERPLASIA, CONGENITAL, DUE TO STEROID 11-BETA-HYDROXYLASE DEFICIENCY}}</ref>, [[łojotok]], łysienie skroniowe, [[zespół metaboliczny]]<ref>Michael Connor, Malcolm Ferguson-Smith ''Podstawy genetyki medycznej.'' Wydawnictwo Lekarskie PZWL, 1998, {{ISBN|83-200-2250-9}}</ref><ref>[[Gerd Herold]] (red.) ''Medycyna wewnętrzna'' Wydawnictwo lekarskie PZWL, 2006. {{ISBN|83-200-3380-2}}</ref>. |
|||
Zespół Crouzona, inaczej dysostoza czaszkowo-twarzowa ([[Łacina|łac.]] ''dysostosis craniofacialis'') to choroba genetyczna o najprawdopodobniej [[Dziedziczenie autosomalne dominujące|autosomalnym dominującym]] typie dziedziczenia{{odn|Boczkowski|1990|s=284}}. Spowodowana jest mutacją w genie ''FGFR2'' kodującym receptor czynnika wzrostu fibroblastów (ang. fibroblast growth factor receptor-2) w ''locus'' [[Chromosom 10|10q]]26<ref>{{OMIM|id=176943|nazwa=FIBROBLAST GROWTH FACTOR RECEPTOR 2; FGFR2}}</ref>. Objawia się licznymi deformacjami twarzy, m.in.: „gotyckim” podniebieniem, nisko osadzonymi uszami, hiperteloryzmem, wytrzeszczem [[Oko|gałek ocznych]] (łac. ''proptosis'') prowadzącym do zaniku [[Nerw wzrokowy|nerwu wzrokowego]], [[Hipoplazja|hipoplazją]] [[Szczęka|szczęki]] (pozorny [[prognatyzm]]) i nieprawidłowym uzębieniem. |
|||
=== Zespół |
==== Zespół Natowicza ==== |
||
{{ |
{{Osobny artykuł|Zespół Natowicza}} |
||
Inne nazwy to: {{łac.|syndroma Natowicz}}, {{ang.|Natowicz syndrome, hyaluronidase deficiency, hyaluronoglucosidase deficiency, MPS IX}}, [[mukopolisacharydoza]] typu IX<br />Zespół Natowicza jest chorobą metaboliczna, której molekularne podłoże stanowi mutacja [[gen]]u HYAL1 znajdującego się na krótkim ramieniu [[chromosom 21|chromosomu 21]], w regionie p21{{r|OMIM1}}. Takie uszkodzenie powoduje zamianę [[kwas glutaminowy|kwasu glutaminowego]] w pozycji 268 na [[lizyna|lizynę]] i poprzez to wytworzenie [[Kodon terminacyjny|kodonu nonsensownego]]{{r|OMIM1}}. Gen HYAL1 jest jednym z trzech genów kodujących [[hialuronidaza|hialuronidazę]]{{r|OMIM1|Triggs-Raine}}. |
|||
Rzadka, o dziedziczeniu autosomalnym recesywnym, której podłożem molekularnym jest [[Mutacja|mutacją]] w obrębie [[gen]]u [[GLUT2]] zlokalizowanego na [[Chromosom 3|chromosomie 3]] w ''locus'' q26.1-3, kodującego [[Transporter glukozy|białko błonowe transportujące glukozę]]. Jej skutkami są nadmierne spichrzanie [[glikogen]]u w [[Wątroba|wątrobie]], zaburzenia w obrębie cewek proksymalnych [[nefron]]u, a także nieprawidłowym metabolizmem [[Glukoza|glukozy]] i [[Galaktoza|galaktozy]]. Do objawów należą: ciężka [[tubulopatie|tubulopatia]], [[krzywica]] [[Hipofosfatemia|hipofosfatemiczna]], kwasica mleczanowa, [[hepatomegalia]], zahamowanie wzrostu<ref>{{Cytuj książkę|autor=Krystyna Kubicka, Wanda Kawalec|tytuł=Pediatria|miejsce=Warszawa|wydawca=Wydawnictwo Lekarskie PZWL|strony=176-9|rok=2004|isbn=8320030013}}</ref><ref>{{OMIM|id=227810|nazwa=FANCONI-BICKEL SYNDROME; FBS}}</ref><ref>{{WhoNamedIt|synd|65|Fanconi-Bickel syndrome}}</ref>. |
|||
Częstość występowania szacowana jest na poniżej 1 na 1 000 000 żywych urodzeń{{r|Orphanet}}.<br />Na obraz kliniczny składają się: niski wzrost, słabo wyrażone zmiany [[czaszka|twarzoczaszki]] (spłaszczone nasada nosa, rozdwojony [[Języczek ssaków|języczek]], podśluzówkowy [[rozszczep wargi i podniebienia|rozszczep podniebienia]]) oraz miękkie guzy wokół dużych oraz małych stawów{{r|OMIM1}}. Po zachorowaniu przebiegającym z [[gorączka|gorączką]] lub po wysiłku fizycznym guzy wokółstawowe ulegają bolesnemu obrzękowi, czemu towarzyszy uogólniony [[obrzęk]] skóry, które ustępują w ciągu 72 godzin{{r|OMIM1}}. |
|||
==== Zespół Rileya-Daya ==== |
|||
[[Plik:Riley day.jpg|thumb|Pacjentka z FD w wieku 1 roku, 6, 10 i 19 lat<ref>{{Cytuj pismo |autor=Axelrod FB, Gold-von Simson G|tytuł=Hereditary sensory and autonomic neuropathies: types II, III, and IV|rok=2007|czasopismo=Orphanet J Rare Dis |doi=10.1186/1750-1172-2-39|wolumin= |oznaczenie=2 |pmid= 17915006|strony=39}}</ref>.]] |
|||
{{osobny artykuł|Rodzinna dysautonomia}} |
|||
To choroba należąca do grupy [[dziedziczne neuropatie czuciowe i autonomiczne|dziedzicznych neuropatii czuciowych i autonomicznych]] (HSAN) o dziedziczeniu autosomalnym recesywnym, zakwalifikowana jako typ III HSAN. Choroba wiąże się z [[mutacja]]mi w genie ''IKBKAP'' w locus [[chromosom 9|9q]]31<ref>{{Cytuj pismo | autor=Slaugenhaupt S.A., Blumenfeld A., Gill S.P., Leyne M., Mull J., Cuajungco M.P., Liebert C.B., Chadwick B., Idelson M., Reznik L., Robbins C., Makalowska I., Brownstein M., Krappmann D., Scheidereit C., Maayan C., Axelrod F.B., Gusella J.F | tytuł=Tissue-specific expression of a splicing mutation in the IKBKAP gene causes familial dysautonomia | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179008 | strony=598-605}}</ref><ref>{{Cytuj pismo | autor=Anderson S.L., Coli R., Daly I.W., Kichula E.A., Rork M.J., Volpi S.A., Ekstein J., Rubin B.Y | tytuł=Familial dysautonomia is caused by mutations of the IKAP gene | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179021 | strony=753-758}}</ref>. Allel recesywny warunkujący w układzie homozygotycznym chorobę występuje niemal wyłącznie w [[populacja (biologia)|populacji]] [[Żydzi aszkenazyjscy|Żydów Aszkenazyjskich]]<ref>{{Cytuj pismo | autor=Brunt P.W., McKusick V.A | tytuł=Familial dysautonomia. A report of genetic and clinical studies, with a review of the literature | rok=1971 | czasopismo=Medicine (Baltimore) | doi= | wolumin=5 | oznaczenie=49 | pmid= 4322121 | strony=343-374}}</ref>. Jednostkę chorobową opisali jako pierwsi Riley i Day w [[1949]] roku<ref>{{Cytuj pismo | autor=Riley C.M., Day R.L | tytuł=Central autonomic dysfunction with defective lacrimation; report of five cases | rok=1949 | czasopismo=Pediatrics | doi= | wolumin=4 | oznaczenie=3 | pmid= 18118947 | strony=468-478}}</ref><ref>{{OMIM|id=223900|nazwa=Neuropathy, hereditary sensory and autonomic, Type III; HSAN3}}</ref>. |
|||
==== Zespół Rubinsteina-Taybiego ==== |
|||
{{osobny artykuł|Zespół Rubinsteina-Taybiego}} |
|||
Przyczyną zespołu Rubinsteina-Taybiego jest najczęściej autosomalnie recesywna mutacja w genie ''[[CREBBP]]'', zlokalizowanym na krótkim ramieniu [[chromosom 16|chromosomu 16]]<ref>{{Cytuj pismo | autor=Coupry I., Monnet L., Attia AA., Taine L., Lacombe D., Arveiler B | tytuł=Analysis of CBP (CREBBP) gene deletions in Rubinstein-Taybi syndrome patients using real-time quantitative PCR | rok=2004 | czasopismo=Hum Mutat | doi=10.1002/humu.20001 | wolumin=3 | oznaczenie= Mar;23 | pmid= 14974086 | strony=278-84}}</ref><ref>{{Cytuj pismo|autor=Bentivegna A, Milani D, Gervasini C, Castronovo P, Mottadelli F, Manzini S, Colapietro P, Giordano L, Atzeri F, Divizia MT, Uzielli ML, Neri G, Bedeschi MF, Faravelli F, Selicorni A, Larizza L|tytuł=Rubinstein-Taybi Syndrome: spectrum of CREBBP mutations in Italian patients|czasopismo=BMC Medical Genetics|rok=2006|oznaczenie=7|wolumin=77|url=http://www.biomedcentral.com/1471-2350/7/77|pmid=17052327}}</ref>. Jest to [[zespół wad wrodzonych]], na którego obraz kliniczny składają się [[Mikrocefalia|małogłowie]], skośno-dolne ustawienie szpar powiekowych, [[klinodaktylia]], szerokie [[kciuk]]i i [[Paluch (palec)|paluchy]], [[Wada serca|wrodzone wady serca]] i układu moczowego, wąskie usta, zwężenie szczęki, [[hipoplazja]] żuchwy, wysoko wysklepione [[Podniebienie (anatomia)|podniebienie]], [[tyłozgryz]], gruszkowate guzki na zębach, [[wnętrostwo (medycyna)|wnętrostwo]]. Pacjenci z zespołem Rubinsteina i Taybiego wykazują [[Niepełnosprawność intelektualna|opóźnienie umysłowe]]<ref name=rubinstein>{{Cytuj pismo|autor=Rubinstein JH, Taybi H|rok=1963|tytuł=Broad thumbs and toes and facial abnormalities. A possible mental retardation syndrome|czasopismo=American Journal of Diseases of Children|oznaczenie=105|strony=588-608|pmid=13983033}}</ref>. |
|||
==== Zespół Schwartza-Jampela ==== |
|||
[[Plik:Schwartz Jampel syndrome OMIM 255800.jpg|120px|Pacjent z zespołem Schwartza-Jampela<ref name=ho>{{Cytuj pismo|autor=Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC|tytuł=Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report|czasopismo=BMC Neurol|rok=2003|oznaczenie=3|wolumin=3|pmid=12839625|url=http://www.biomedcentral.com/1471-2377/3/3}}</ref>|thumb]] |
|||
{{osobny artykuł|Zespół Schwartza-Jampela}} |
|||
Przyczyna, jak również sposób dziedziczenia są podobne do zespołu Stüve-Wiedemanna, który jest jej noworodkową postacią. Do najważniejszych objawów należą: [[miotonia]], dysplazja kostną, sztywność mięśni, łagodna słabość mięśni (zazwyczaj niepostępująca). Przebieg schorzenia może być postępujący. Fenotyp choroby nie jest jednorodny<ref>{{Cytuj pismo|autor=Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC|tytuł=Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report|czasopismo=BMC Neurol|rok=2003|oznaczenie=3|wolumin=3|pmid=12839625|url=http://www.biomedcentral.com/1471-2377/3/3}}</ref><ref>{{cytuj stronę|url=http://www.emedicine.com/neuro/topic337.htm|tytuł=Schwartz-Jampel Syndrome|autor=Stephen A Berman, Eric Dinnerstein|data dostępu=22 września 2007|język=en|data=2007|opublikowany=eMedicine Neurology}}</ref><ref>{{OMIM|id=|nazwa=SCHWARTZ-JAMPEL SYNDROME, TYPE 1; SJS1}}</ref>. |
|||
==== Zespół Stüve-Wiedemanna ==== |
|||
{{osobny artykuł|Zespół Stüve-Wiedemanna}} |
|||
Dziedziczony jest w sposób autosomalny recesywny, spowodowany mutacjami w genie ''[[LIFR]]'' (''leukemia inhibitory factor receptor gene'') w ''locus'' [[chromosom 5|5p]]13<ref>{{Cytuj pismo | autor=Dagoneau N, Scheffer D, Huber C, Al-Gazali LI, Di Rocco M, Godard A, Martinovic J, Raas-Rothschild A, Sigaudy S, Unger S, Nicole S, Fontaine B, Taupin JL, Moreau JF, Superti-Furga A, Le Merrer M, Bonaventure J, Munnich A., Legeai-Mallet L, Cormier-Daire V | tytuł=Null leukemia inhibitory factor receptor (LIFR) mutations in Stuve-Wiedemann/Schwartz-Jampel type 2 syndrome | rok=2004 | czasopismo=American journal of human genetics | doi=10.1086/381715 | wydanie=74 | wolumin=2 | miesiąc=luty | pmid= 14740318 | strony=298–305}}</ref>. Na fenotyp składają się cechy, takie jak: niskorosłość, łukowate [[kości długie]], [[kamptodaktylia]]. Na obraz kliniczny składają się także poważne powikłania: [[niewydolność oddechowa]] i niewytłumaczalna [[hipertermia]], będące głównymi przyczynami zgonu dzieci z tym zespołem w okresie noworodkowym<ref>{{Cytuj pismo | autor=Raas-Rothschild A, Ergaz-Schaltiel Z, Bar-Ziv J, Rein AJ | tytuł=Cardiovascular abnormalities associated with the Stuve-Wiedemann syndrome | rok=2003 | czasopismo=American journal of medical genetics. Part A | doi=10.1002/ajmg.a.20066 | wydanie=121A | wolumin=2 | miesiąc=sierpień | pmid= 12910496 | strony=156–8}}</ref><ref>{{Cytuj pismo | autor=Di Rocco M, Stella G, Bruno C, Doria Lamba L, Bado M, Superti-Furga A | tytuł=Long-term survival in Stuve-Wiedemann syndrome: a neuro-myo-skeletal disorder with manifestations of dysautonomia | rok=2003 | czasopismo=Am J Med Genet A | doi=10.1002/ajmg.a.10242 | wolumin=4 | oznaczenie=118A | pmid= 12687669 | strony=362-8}}</ref><ref>{{Cytuj pismo | autor=Al-Gazali LI, Ravenscroft A, Feng A, Shubbar A, Al-Saggaf A, Haas D | tytuł=Stüve-Wiedemann syndrome in children surviving infancy: clinical and radiological features| rok=2003 | czasopismo=Clin Dysmorphol | doi=10.1097/01.mcd.0000049260.13501.ec | wolumin=1 | oznaczenie=12 | pmid= 12514358 | strony=1-8}}</ref><ref>{{Cytuj pismo | autor=Gaspar IM, Saldanha T, Cabral P, Vilhena MM, Tuna M, Costa C, Dagoneau N, Daire VC, Hennekam RC | tytuł=Long-term follow-up in Stuve-Wiedemann syndrome: a clinical report | rok=2008 | czasopismo=Am J Med Genet A | doi=10.1002/ajmg.a.32325 | wolumin=13 | oznaczenie=146A | pmid= 18546280 | strony=1748-53}}</ref>, dysautonomia ([[ageuzja|zaburzenia smaku]], [[dysfagia]])<ref>{{Cytuj pismo | autor=Gardiner J, Barton D, Vanslambrouck JM, Braet F, Hall D, Marc J, Overall R | tytuł=Defects in tongue papillae and taste sensation indicate a problem with neurotrophic support in various neurological diseases | rok=2008 | czasopismo=Neuroscientist | doi=10.1177/1073858407312382 | wolumin=3 | oznaczenie=14 | pmid= 18270312 | strony=240-50}}</ref>. Zespół Stüve-Wiedemanna znany jest także jako noworodkowa postać '''[[zespół Schwartza-Jampela|zespołu Schwartza-Jampela typu 2]]''' (SJS2)<ref>{{OMIM|id=601559|nazwa=STUVE-WIEDEMANN SYNDROME}}</ref> i zaliczany także do [[zespół wad wrozdonych|zespołów wad wrodzonych]]<ref>{{WhoNamedIt|synd|1624|Stüve-Wiedemann syndrome}}</ref>. |
|||
=== Choroby mitochondrialne === |
|||
{{Osobny artykuł|Choroby mitochondrialne}} |
|||
Dziedziczą się na ogół niezgodnie z prawami mendla, ponieważ mutacje stanowiące podłoże molekularne występują przede wszytkim w mtDNA (mitochondrialnym), który replikuje się niezależnie od DNA jądrowego. Choroby te są przekazywane potomstwu głównie przez matkę, czyli w tzw. linii matczynej<ref>[http://web.archive.org/web/*/http://www.osteoporoza.org/materialy/pdf/57c334796d72264ff7bc1b4fc45c8403.pdf „Miopatie mitochondrialne” A. Kotulska, E. J. Kucharz, „Terapia” 5/2004 (pdf)]</ref>. Jest to spowodowane faktem, iż plemnik - w porównaniu z gametą żeńską - ma niewiele mitochondriów i nie są one przekazywane potomstwu. Komórki ciała matki, zarówno [[komórka somatyczna|somatyczne]], jak i [[komórka generatywna|generatywne]], mogą zawierać zaróno prawidłowy genom, jak i zmutowany<ref name="Dubert" /><ref>[http://www.ncbi.nlm.nih.gov/pubmed/17053512 Mitochondrial myopathies. S. DiMauro, Curr Opin Rheumatol. 2006 Nov;18(6):636-41]</ref><ref name="Dubert" />. Podczas [[oogeneza|oogenezy]] do komórej jajowych trafia losowo część mitochondriów pochodzących z komórki macierzystej gamety. W związku z różnicami w ilości mitochondriów ze zmutowanym DNA między poszczególnymi komórkami jajowymi, stopień nasilenia objawów u potomstwa będzie różny. W rodzinie, w której chory jest ojciec, żadne z dzieci nie odziedziczy choroby<ref name="Dubert" />.<br /> |
|||
Choroby mitochondrialne są zwykle chorobami wieloukładowymi, ich objawy związane są najczęściej z tkankami o wysokim zapotrzebowaniu energetycznym np. [[Mięsień poprzecznie prążkowany|mięśniami szkieletowymi]] lub [[układ nerwowy człowieka|układem nerwowym]], i zazwyczaj obejmują [[miopatia|miopatie]], [[encefalopatia|encefalopatie]] oraz [[neuropatia|neuropatie]]<ref name="Dubert" />. Szacuje się, że na choroby mitochondrialne zapada 1 na 15 000 osób<ref>[http://www.umdf.org/ United Mitochondrial Disease Foundation] {{lang|en}}</ref><ref>[http://www.mitoaction.org/ Mitochondrial Disease Action Committee] {{lang|en}}</ref>. |
|||
==== Niedokrwistość aplastyczna spowodowana chloramfenikolem ==== |
|||
{{osobny artykuł|Niedokrwistość aplastyczna spowodowana chloramfenikolem}} |
|||
Choroba mitochondrialna, w której u około 1:19 000 przypadków [[chloramfenikol]] wywołuje reakcję [[idiosynkrazja|idiosynkrazji]], czyli powoduje działania niepożądane po podaniu dawki leczniczej. Występuje wówczas zagrażająca życiu [[niedokrwistość aplastyczna]]. Udowodniono, że jest to spowodowane punktowymi [[mutacja]]mi w [[Mitochondrialny DNA|mitochondrialnym DNA]]. Zmiany dotyczą genu ''[[MTRNR2]]'' kodującego podjednostkę 16S [[rRNA]]. Zidentyfikowane mutacje wywołujące wrażliwość na chloramfenikol to <tt>T2991C</tt><ref name=blanc/><ref>{{Cytuj pismo|autor=Kearsey SE, Craig IW|tytuł=Altered ribosomal RNA genes in mitochondria from mammalian cells with chloramphenicol resistance|czasopismo=[[Nature]]|oznaczenie=290|strony=607-608|rok=1981|pmid=7219548}}</ref> i <tt>C2939A</tt><ref name=blanc>{{Cytuj pismo|autor=Blanc H, Adams CA, Wallace DC|tytuł=Differential nucleotide changes on the large rRNA gene of the mitochondrial DNA confer chloramphenicol resistance to two human cell lines|czasopismo=Nucleic Acids Res|oznaczenie=9|strony=5785-5795|rok=1981|pmid=6273808}}</ref>. |
|||
=== Zespół Kearnsa-Sayre’a === |
==== Zespół Kearnsa-Sayre’a ==== |
||
{{osobny artykuł|Zespół Kearnsa-Sayre’a}} |
{{osobny artykuł|Zespół Kearnsa-Sayre’a}} |
||
Niedziedziczna [[choroby mitochondrialne|mitochondrialna choroba]] genetyczna spowodowana delecjami w mitochondrialnym DNA<ref name="Hanna Mierzejewska" />, która objawia się m.in.: postępującą oftalmoplegią zewnętrzną (niedowład mięśni gałkoruchowych), zwyrodnieniami barwnikowymi siatkówki (początek objawów przed 20. rokiem życia), [[ataksja|ataksją móżdżkową]], podwyższonym poziomem białka w [[płyn mózgowo-rdzeniowy|płynie mózgowo-rdzeniowym]], zaburzeniami przewodzenia w mięśniu sercowym (blok pęczka Hisa, blok AV II°, blok całkowity), [[mioklonie|mikrokloniami]], [[drgawki|napadami drgawek]], otępieniem, zmianami w istocie białej<ref name="pmid17541738">{{Cytuj pismo | autor=Filosto M., Tomelleri G., Tonin P., Scarpelli M., Vattemi G., Rizzuto N., Padovani A., Simonati A | tytuł=Neuropathology of mitochondrial diseases. | rok=2007 | czasopismo=Bioscience reports | doi=10.1007/s10540-007-9034-3 | wydanie=27 | wolumin=1-3 | miesiąc=czerwiec | pmid= 17541738 | strony=23–30}}</ref><ref name="Hanna Mierzejewska" />. |
Niedziedziczna [[choroby mitochondrialne|mitochondrialna choroba]] genetyczna spowodowana delecjami w mitochondrialnym DNA<ref name="Hanna Mierzejewska" />, która objawia się m.in.: postępującą oftalmoplegią zewnętrzną (niedowład mięśni gałkoruchowych), zwyrodnieniami barwnikowymi siatkówki (początek objawów przed 20. rokiem życia), [[ataksja|ataksją móżdżkową]], podwyższonym poziomem białka w [[płyn mózgowo-rdzeniowy|płynie mózgowo-rdzeniowym]], zaburzeniami przewodzenia w mięśniu sercowym (blok pęczka Hisa, blok AV II°, blok całkowity), [[mioklonie|mikrokloniami]], [[drgawki|napadami drgawek]], otępieniem, zmianami w istocie białej<ref name="pmid17541738">{{Cytuj pismo | autor=Filosto M., Tomelleri G., Tonin P., Scarpelli M., Vattemi G., Rizzuto N., Padovani A., Simonati A | tytuł=Neuropathology of mitochondrial diseases. | rok=2007 | czasopismo=Bioscience reports | doi=10.1007/s10540-007-9034-3 | wydanie=27 | wolumin=1-3 | miesiąc=czerwiec | pmid= 17541738 | strony=23–30}}</ref><ref name="Hanna Mierzejewska" />. |
||
=== Zespół Lebera === |
==== Zespół Lebera ==== |
||
{{osobny artykuł|Dziedziczna neuropatia nerwu wzrokowego Lebera}} |
{{osobny artykuł|Dziedziczna neuropatia nerwu wzrokowego Lebera}} |
||
Choroba mitochondrialna, na której obraz kliniczny składa się zanik [[nerw wzrokowy|nerwów wzrokowych]] w wyniku zwyrodnienia komórek zwojowych [[siatkówka (anatomia)|siatkówki]] i ich [[neuryt|aksonów]]. Choroba jest spowodowana różnymi [[mutacja]]mi w [[Mitochondrialny DNA|mitochondrialnym DNA]] (mtDNA). Mutacje punktowe genów: ''MT-ND1'', ''MT-ND4'', ''MT-ND4L'', i ''MT-ND6'' skutkują zaburzeniem transportu [[elektron]]ów w [[łańcuch oddechowy|łańcuchu oddechowym]]. W przebiegu choroby dochodzi do uszkodzenia nerwu wzrokowego i związanej z tym [[ślepota|ślepoty]]. Chorują przede wszystkim młodzi mężczyźni; choroba ujawnia się przeważnie w 10.-20. roku życia<ref>{{cytuj pismo|autor=Patrick Yu-Wai-Man, Patrick F Chinnery|tytuł=Leber Hereditary Optic Neuropathy|url=http://web.archive.org/web/20090515053931/http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=lhon|czasopismo=GeneRewievs}}</ref><ref>{{Cytuj pismo | autor=Nikoskelainen EK, Marttila RJ, Huoponen K, Juvonen V, Lamminen T, Sonninen P, Savontaus ML | tytuł=Leber's "plus": neurological abnormalities in patients with Leber's hereditary optic neuropathy | rok=1995 | czasopismo=J Neurol Neurosurg Psychiatry | doi= | wolumin=2 | oznaczenie=59 | pmid= 7629530 | strony=160-4}}</ref>. |
Choroba mitochondrialna, na której obraz kliniczny składa się zanik [[nerw wzrokowy|nerwów wzrokowych]] w wyniku zwyrodnienia komórek zwojowych [[siatkówka (anatomia)|siatkówki]] i ich [[neuryt|aksonów]]. Choroba jest spowodowana różnymi [[mutacja]]mi w [[Mitochondrialny DNA|mitochondrialnym DNA]] (mtDNA). Mutacje punktowe genów: ''MT-ND1'', ''MT-ND4'', ''MT-ND4L'', i ''MT-ND6'' skutkują zaburzeniem transportu [[elektron]]ów w [[łańcuch oddechowy|łańcuchu oddechowym]]. W przebiegu choroby dochodzi do uszkodzenia nerwu wzrokowego i związanej z tym [[ślepota|ślepoty]]. Chorują przede wszystkim młodzi mężczyźni; choroba ujawnia się przeważnie w 10.-20. roku życia<ref>{{cytuj pismo|autor=Patrick Yu-Wai-Man, Patrick F Chinnery|tytuł=Leber Hereditary Optic Neuropathy|url=http://web.archive.org/web/20090515053931/http://www.ncbi.nlm.nih.gov/bookshelf/br.fcgi?book=gene&part=lhon|czasopismo=GeneRewievs}}</ref><ref>{{Cytuj pismo | autor=Nikoskelainen EK, Marttila RJ, Huoponen K, Juvonen V, Lamminen T, Sonninen P, Savontaus ML | tytuł=Leber's "plus": neurological abnormalities in patients with Leber's hereditary optic neuropathy | rok=1995 | czasopismo=J Neurol Neurosurg Psychiatry | doi= | wolumin=2 | oznaczenie=59 | pmid= 7629530 | strony=160-4}}</ref>. |
||
=== Zespół |
==== Zespół MELAS ==== |
||
{{osobny artykuł|Zespół Lyncha}} |
|||
To dziedziczny rak jelita grubego niezwiązany z polipowatością<ref>{{cytuj stronę|url=http://www.puo.pl/pdf/rak_jelita_grubego.pdf|tytuł=Rak jelita grubego|autor=Marek P. Nowacki (red.)|archiwum=http://web.archive.org/web/20130923173744/http://www.puo.pl/pdf/rak_jelita_grubego.pdf|zarchiwizowano=2013-09-23}}</ref> ({{ang.|hereditary non-polyposis colorectal cancer, HNPCC}}), stanowiący około 1-3% wszystkich [[rak jelita grubego|raków jelita grubego]]<ref name="pmid19375789">{{Cytuj pismo | nazwisko = Resnick | imię = KE. | nazwisko2 = Hampel | imię2 = H. | nazwisko3 = Fishel | imię3 = R. | nazwisko4 = Cohn | imię4 = DE. | tytuł = Current and emerging trends in Lynch syndrome identification in women with endometrial cancer. | czasopismo = Gynecol Oncol | wolumin = 114 | numer = 1 | strony = 128-34 | miesiąc = Jul | rok = 2009 | doi = 10.1016/j.ygyno.2009.03.003 | pmid = 19375789}}</ref><ref name="pmid16136383">{{Cytuj pismo | nazwisko = de la Chapelle | imię = A. | tytuł = The incidence of Lynch syndrome. | czasopismo = Fam Cancer | wolumin = 4 | numer = 3 | strony = 233-7 | miesiąc = | rok = 2005 | doi = 10.1007/s10689-004-5811-3 | pmid = 16136383}}</ref>. Średni wiek wystąpienia [[nowotwór złośliwy|nowotworu złośliwego]] [[jelito grube|jelita grubego]] wynosi około 44 lata<ref name="pmid24533633">{{Cytuj pismo | nazwisko = Baiocchi | imię = GL. | nazwisko2 = Portolani | imię2 = N. | nazwisko3 = Vermi | imię3 = W. | nazwisko4 = Baronchelli | imię4 = C. | nazwisko5 = Gheza | imię5 = F. | tytuł = Lynch syndrome from a surgeon perspective: retrospective study of clinical impact of mismatch repair protein expression analysis in colorectal cancer patients less than 50 years old. | czasopismo = BMC Surg | wolumin = 14 | numer = | strony = 9 | miesiąc = | rok = 2014 | doi = 10.1186/1471-2482-14-9 | pmid = 24533633}}</ref>. Zespół wiąże się z 80% ryzykiem zachorowania na raka jelita grubego<ref name="pmid12667026">{{Cytuj pismo | nazwisko = Chung | imię = DC. | nazwisko2 = Rustgi | imię2 = AK. | tytuł = The hereditary nonpolyposis colorectal cancer syndrome: genetics and clinical implications. | czasopismo = Ann Intern Med | wolumin = 138 | numer = 7 | strony = 560-70 | miesiąc = Apr | rok = 2003 | doi = | pmid = 12667026}}</ref>. Najczęściej stwierdza się mutacje genów ''hMSH2''((human mutS homolog 2) w ''locus'' [[chromosom 2|2p]]21-22) i ''hMLH1'' ((human mutL homolog 1) w ''locus'' [[chromosom 3|3p]]21.3-23)<ref>{{cytuj książkę|autor=M. Nowacki (red.)|tytuł=Nowotwory jelita grubego|wydawca=Wydawnictwo Wiedza i Życie|miejsce=Warszawa|data=1996|isbn=83-86805-86-2}}</ref>. Dziedziczenie zespołu jest [[dziedziczenie autosomalne dominujące|autosomalne dominujące]]. W przeważającej części (około 70% przypadków) rak występuje w prawej połowie [[Okrężnica (anatomia)|okrężnicy]]<ref name="pmid12621137">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = de la Chapelle | imię2 = A. | tytuł = Hereditary colorectal cancer. | url = http://www.nejm.org/doi/full/10.1056/NEJMra012242 | czasopismo = N Engl J Med | wolumin = 348 | numer = 10 | strony = 919-32 | miesiąc = Mar | rok = 2003 | doi = 10.1056/NEJMra012242 | pmid = 12621137}}</ref><ref name="pmid19654196">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = Lynch | imię2 = JF. | nazwisko3 = Attard | imię3 = TA. | tytuł = Diagnosis and management of hereditary colorectal cancer syndromes: Lynch syndrome as a model. | czasopismo = CMAJ | wolumin = 181 | numer = 5 | strony = 273-80 | miesiąc = Sep | rok = 2009 | doi = 10.1503/cmaj.071574 | pmid = 19654196}}</ref>. Występują dwie różniące się od siebie postacie choroby: zespół Lyncha I – rak dotyczy tylko [[jelito grube|jelita grubego]]; zespół Lyncha II – z rakiem jelita grubego współistnieją [[nowotwór złośliwy|nowotwory złośliwe]] [[rak trzonu macicy|trzonu macicy]], [[rak jajnika|jajnika]], [[rak żołądka człowieka|żołądka]], [[Gruczolakorak jelita cienkiego|jelita cienkiego]], [[rak nerki|nerek]], [[rak moczowodu|moczowodu]], a rzadziej [[rak podstawnokomórkowy skóry|skóry]], [[Rak dróg żółciowych|dróg żółciowych]] i [[Nowotwory ośrodkowego układu nerwowego|guzy centralnego układu nerwowego]]<ref name="pmid2804907">{{Cytuj pismo | nazwisko = Lynch | imię = HT. | nazwisko2 = Smyrk | imię2 = TC. | nazwisko3 = Lynch | imię3 = PM. | nazwisko4 = Lanspa | imię4 = SJ. | nazwisko5 = Boman | imię5 = BM. | tytuł = Adenocarcinoma of the small bowel in lynch syndrome II. | czasopismo = Cancer | wolumin = 64 | numer = 10 | strony = 2178-83 | miesiąc = Nov | rok = 1989 | doi = | pmid = 2804907}}</ref><ref name="pmid8612988">{{Cytuj pismo | nazwisko = Vasen | imię = HF. | nazwisko2 = Wijnen | imię2 = JT. | nazwisko3 = Menko | imię3 = FH. | nazwisko4 = Kleibeuker | imię4 = JH. | nazwisko5 = Taal | imię5 = BG. | tytuł = Cancer risk in families with hereditary nonpolyposis colorectal cancer diagnosed by mutation analysis. | czasopismo = Gastroenterology | wolumin = 110 | numer = 4 | strony = 1020-7 | miesiąc = Apr | rok = 1996 | doi = | pmid = 8612988}}</ref><ref name="pmid10188721">{{Cytuj pismo | nazwisko = Aarnio | imię = M. | nazwisko2 = Sankila | imię2 = R. | nazwisko3 = Pukkala | imię3 = E. | nazwisko4 = Salovaara | imię4 = R. | nazwisko5 = Aaltonen | imię5 = LA. | tytuł = Cancer risk in mutation carriers of DNA-mismatch-repair genes. | czasopismo = Int J Cancer | wolumin = 81 | numer = 2 | strony = 214-8 | miesiąc = Apr | rok = 1999 | doi = | pmid = 10188721}}</ref><ref name="pmid12624141">{{Cytuj pismo | nazwisko = Parc | imię = Y. | nazwisko2 = Boisson | imię2 = C. | nazwisko3 = Thomas | imię3 = G. | nazwisko4 = Olschwang | imię4 = S. | tytuł = Cancer risk in 348 French MSH2 or MLH1 gene carriers. | czasopismo = J Med Genet | wolumin = 40 | numer = 3 | strony = 208-13 | miesiąc = Mar | rok = 2003 | doi = | pmid = 12624141}}</ref>. |
|||
=== Zespół MELAS === |
|||
{{osobny artykuł|Zespół MELAS}} |
{{osobny artykuł|Zespół MELAS}} |
||
Jest to mitochondrialna choroba wieloukładowa, której przyczyną jest [[mutacja punktowa]] <tt>A3243G</tt> polegająca na zamianie [[adenina|adeniny]] na [[guanina|guaninę]] w pozycji 3243 w obrębie genu ''MTTL1'' ([http://omim.org/entry/590050 OMIM*590050]) kodującego [[tRNA]] dla [[leucyna|leucyny]]. Skutkuje ona nadmiernym gromadzeniem się we krwi [[kwas mlekowy|kwasu mlekowego]]<ref>[http://web.archive.org/web/*/http://www.osteoporoza.org/materialy/pdf/57c334796d72264ff7bc1b4fc45c8403.pdf „Miopatie mitochondrialne” A. Kotulska, E. J. Kucharz, „Terapia” 5/2004 (pdf)]</ref>, czego efektem jest nieprawidłowe działanie głównie [[tkanka nerwowa|tkanki nerwowej]] i [[tkanka mięśniowa|tkanki mięśniowej]]<ref>{{Cytuj pismo | nazwisko = Pavlakis | imię = SG. | nazwisko2 = Phillips | imię2 = PC. | nazwisko3 = DiMauro | imię3 = S. | nazwisko4 = De Vivo | imię4 = DC. | nazwisko5 = Rowland | imię5 = LP. | tytuł = Mitochondrial myopathy, encephalopathy, lactic acidosis, and strokelike episodes: a distinctive clinical syndrome | czasopismo = Ann Neurol | wolumin = 16 | numer = 4 | strony = 481-8 | miesiąc = Oct | rok = 1984 | doi = 10.1002/ana.410160409 | pmid = 6093682}}</ref>. Objawami są: napady drgawek, paraliż, [[Otępienie|demencja]] i osłabienie mięśniowe, [[Retinopatia barwnikowa|zwyrodnienie barwnikowe siatkówki]], [[głuchota]] korowa, [[neuropatia|neuropatia czuciowa]] typu aksonalnego, ciężkie [[zaparcie|zaparcia]], [[cukrzyca typu 2|cukrzyca typu II]], [[niedoczynność przytarczyc]], [[Niedobór wzrostu|niskorosłość]], [[Kardiomiopatie|kardiomiopatia]] (rzadko), [[nefropatia]] (rzadko)<ref name="Hanna Mierzejewska" /><ref>{{OMIM|id=540000|nazwa=MITOCHONDRIAL MYOPATHY, ENCEPHALOPATHY, LACTIC ACIDOSIS, AND STROKE-LIKE EPISODES; MELAS}}</ref>. |
Jest to mitochondrialna choroba wieloukładowa, której przyczyną jest [[mutacja punktowa]] <tt>A3243G</tt> polegająca na zamianie [[adenina|adeniny]] na [[guanina|guaninę]] w pozycji 3243 w obrębie genu ''MTTL1'' ([http://omim.org/entry/590050 OMIM*590050]) kodującego [[tRNA]] dla [[leucyna|leucyny]]. Skutkuje ona nadmiernym gromadzeniem się we krwi [[kwas mlekowy|kwasu mlekowego]]<ref>[http://web.archive.org/web/*/http://www.osteoporoza.org/materialy/pdf/57c334796d72264ff7bc1b4fc45c8403.pdf „Miopatie mitochondrialne” A. Kotulska, E. J. Kucharz, „Terapia” 5/2004 (pdf)]</ref>, czego efektem jest nieprawidłowe działanie głównie [[tkanka nerwowa|tkanki nerwowej]] i [[tkanka mięśniowa|tkanki mięśniowej]]<ref>{{Cytuj pismo | nazwisko = Pavlakis | imię = SG. | nazwisko2 = Phillips | imię2 = PC. | nazwisko3 = DiMauro | imię3 = S. | nazwisko4 = De Vivo | imię4 = DC. | nazwisko5 = Rowland | imię5 = LP. | tytuł = Mitochondrial myopathy, encephalopathy, lactic acidosis, and strokelike episodes: a distinctive clinical syndrome | czasopismo = Ann Neurol | wolumin = 16 | numer = 4 | strony = 481-8 | miesiąc = Oct | rok = 1984 | doi = 10.1002/ana.410160409 | pmid = 6093682}}</ref>. Objawami są: napady drgawek, paraliż, [[Otępienie|demencja]] i osłabienie mięśniowe, [[Retinopatia barwnikowa|zwyrodnienie barwnikowe siatkówki]], [[głuchota]] korowa, [[neuropatia|neuropatia czuciowa]] typu aksonalnego, ciężkie [[zaparcie|zaparcia]], [[cukrzyca typu 2|cukrzyca typu II]], [[niedoczynność przytarczyc]], [[Niedobór wzrostu|niskorosłość]], [[Kardiomiopatie|kardiomiopatia]] (rzadko), [[nefropatia]] (rzadko)<ref name="Hanna Mierzejewska" /><ref>{{OMIM|id=540000|nazwa=MITOCHONDRIAL MYOPATHY, ENCEPHALOPATHY, LACTIC ACIDOSIS, AND STROKE-LIKE EPISODES; MELAS}}</ref>. |
||
=== Zespół MNGIE === |
==== Zespół MNGIE ==== |
||
{{osobny artykuł|Zespół MNGIE}} |
{{osobny artykuł|Zespół MNGIE}} |
||
'''Zespół mitochondrialnej encefalomiopatii dotyczącej układu nerwowego, żołądka i jelit''' jest rzadką [[Choroby mitochondrialne|choroba mitochondrialna]]<ref name="hirano" />, spowodowaną [[Mutacja|mutacją]] w genie ''ECGF1''<ref name="omim131222" /> w ''locus'' [[Chromosom 22|22q13.32-qter]] kodującym fosforylazę tymidyny, której towarzyszą [[Delecja|delecje]] w [[Mitochondrialny DNA|mtDNA]]. Postać MNGIE bez leukoencefalopatii może być związana z mutacjami w genie ''POLG''<ref name="omim174763" /> kodującym białko [[Polimeraza DNA|polimerazy DNA γ]]. Do najbardziej charakterystycznych objawów należą: [[Ptoza|opadanie powiek]], postępująca zewnętrzna [[oftalmoplegia]] (niedowład mięśni gałkoruchowych), zaburzenia motoryki przewodu pokarmowego: [[Biegunka|biegunki]], [[Zaparcie|zaparcia]], [[nudności]] i [[wymioty]], [[miopatia mięśni szkieletowych]] (w badaniu w badaniu histologicznym bioptatu mięśnia widoczne postrzępione, „szmatowate” czerwone włókna, z ang. ''red ragged fibers'')<ref>{{OMIM|id=603041|nazwa=MITOCHONDRIAL NEUROGASTROINTESTINAL ENCEPHALOPATHY SYNDROME; MNGIE}}</ref>. |
'''Zespół mitochondrialnej encefalomiopatii dotyczącej układu nerwowego, żołądka i jelit''' jest rzadką [[Choroby mitochondrialne|choroba mitochondrialna]]<ref name="hirano" />, spowodowaną [[Mutacja|mutacją]] w genie ''ECGF1''<ref name="omim131222" /> w ''locus'' [[Chromosom 22|22q13.32-qter]] kodującym fosforylazę tymidyny, której towarzyszą [[Delecja|delecje]] w [[Mitochondrialny DNA|mtDNA]]. Postać MNGIE bez leukoencefalopatii może być związana z mutacjami w genie ''POLG''<ref name="omim174763" /> kodującym białko [[Polimeraza DNA|polimerazy DNA γ]]. Do najbardziej charakterystycznych objawów należą: [[Ptoza|opadanie powiek]], postępująca zewnętrzna [[oftalmoplegia]] (niedowład mięśni gałkoruchowych), zaburzenia motoryki przewodu pokarmowego: [[Biegunka|biegunki]], [[Zaparcie|zaparcia]], [[nudności]] i [[wymioty]], [[miopatia mięśni szkieletowych]] (w badaniu w badaniu histologicznym bioptatu mięśnia widoczne postrzępione, „szmatowate” czerwone włókna, z ang. ''red ragged fibers'')<ref>{{OMIM|id=603041|nazwa=MITOCHONDRIAL NEUROGASTROINTESTINAL ENCEPHALOPATHY SYNDROME; MNGIE}}</ref>. |
||
=== Zespół |
==== Zespół NARP ==== |
||
{{Osobny artykuł|Zespół Morgagniego-Stewarta-Morela}} |
|||
Inne nazwy: {{ang.|Morgagni-Stewart-Morel syndrome, Morgagni's trias}}<ref>Henschen F: Morgagni’s syndrome. Jena, 1937.</ref>, [[Łacina|łac.]] ''hyperostosis frontalis interna''.<br />Jest to rzadka choroba genetyczna o nie do końca poznanej etiologii i etiopatogenezie, dziedziczona autosomalnie dominująco<ref>{{Cytuj pismo | autor=Koller MF, Papassotiropoulos A, Henke K, Behrends B, Noda S, Kratzer A, Hock C, Hofmann M | tytuł=Evidence of a genetic basis of Morgagni-Stewart-Morel syndrome. A case report of identical twins| rok=2005 | czasopismo=Neuro-degenerative diseases | doi=10.1159/000089284 | wydanie=2 | wolumin=2 | miesiąc= | pmid= 16909048 | strony=56–60}} |
|||
</ref><ref>Knies PT, Le Fever HE. Metabolic craniopathy: hyperostosis frontalis interna. ''Ann Intern Med'' 14: 1858-1892 (1941)</ref>, związana z przerostem i nadreaktywnością kory [[nadnercze|nadnerczy]] wskutek nadmiernego wydzielania [[hormon adrenokortykotropowy|ACTH]]. Sugerowano również związek objawów z podwyższonymi poziomami [[prolaktyna|prolaktyny]], ponieważ w populacji kobiet z [[mlekotok]]iem na tym tle ''hyperostosis frontalis'' występowała w 43% przypadków<ref>{{Cytuj pismo | autor=Pawlikowski M, Komorowski J | tytuł=Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome| rok=1983 | czasopismo=Lancet | doi= | wydanie=1 | wolumin=8322 | miesiąc=luty | pmid= 6131191 | strony=474}}</ref>. Na obraz kliniczny składają się objawy, takie jak: [[otyłość]], przerost wewnętrznej powierzchni [[kość czołowa|kości czołowej]] (''hyperostosis frontalis interna'')<ref>Stewart RM: ''Localized cranial hyperostosis in insane.'' Journal of Neurology and Psychopathology 8, 321 (1928).</ref>, [[Maskulinizacja|wirylizm]] i [[hirsutyzm]]<ref>Morgagni GB: ''Adversaria anatomica. VI. Animadversio 74.'' Padwa, 1719.</ref><ref>Morgagni GB: ''De sedibus et causis morborum.Liv II.'' Wenecja, 1761.</ref>, [[brak miesiączki]]<ref>Morel F: ''L'hyperostose frontale interne. Syndrome de l'hyperostose frontale interne avec adipose et troubles cérébraux.'' Paryż, 1930.</ref>, zaburzenia tolerancji glukozy, [[cukrzyca]], [[hiperfagia|polifagia]], [[polidypsja]], [[wielomocz|poliuria]]<ref>{{WhoNamedIt|synd|1746|Morgagni-Stewart-Morel syndrome}}</ref><ref>Pawlikowski, M., Komorowski, J. Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome. (Letter) Lancet 321: 474 only, 1983. Note: Originally Volume I..</ref>. Objawy podmiotowe stanowią: [[zmęczenie]], [[somnolencja|senność]], zaburzenia widzenia, [[zawroty głowy|zawroty]] i [[ból głowy|bóle głowy]], [[Szumy uszne|dzwonienie w uszach]], zaburzenia węchu. Mogą występować zaburzenia psychiczne, spowodowane przerostem kości czołowych i rozpoznawane jako [[zespół czołowy]]<ref>Psychiatria. Podręcznik dla studentów medycyny. Bilikiewicz A (red.). Wydanie III Wydawnictwo Lekarskie PZWL, Warszawa 2006 s. 150 {{ISBN|83-200-3388-8}}</ref>. |
|||
=== Zespół nadnerczowo-płciowy === |
|||
{{osobny artykuł|Wrodzony przerost nadnerczy}} |
|||
CAH to grupa chorób charakteryzujących się nadmiernym wydzielaniem [[androgeny|androgenów nadnerczowych]] z niedoborem [[kortyzol]]u wskutek genetycznie uwarunkowanego braku (lub niedoboru) enzymów szlaku biosyntezy hormonów nadnerczy, przede wszystkim 21-hydroksylazy i 11β-hydroksylazy<ref>{{Cytuj|autor=A Slominski, G Ermak, M Mihm|tytuł=ACTH receptor, CYP11A1, CYP17 and CYP21A2 genes are expressed in skin.|czasopismo=The Journal of Clinical Endocrinology & Metabolism|data=1996-07-01|data dostępu=2017-01-04|issn=0021-972X|wydanie=7|s=2746–2749|doi=10.1210/jcem.81.7.8675607|url=http://press.endocrine.org/doi/abs/10.1210/jcem.81.7.8675607}}</ref>. Przyczyną (w podłożu molekularnym) jest mutacja genu ''CYP21'', powodująca niedobór lub brak enzymu 21-hydroksylazy. Skutkujący tym niedobór kortyzolu pobudza przedni płat przysadki do wydzielania [[Hormon adrenokortykotropowy|ACTH]], który z kolei pobudza czynność nadnerczy. Rezultatem tego jest nagromadzenie się 17-OH-progesteronu i steroidów nadnerczowych, których biosynteza nie jest zaburzona przez defekt enzymatyczny i którą nasila nadmiar ACTH: [[dehydroepiandrostendion]]u, [[androstendion]]u i [[testosteron]]u. Wyróżnia się kilka postaci choroby. Do najbardziej charakterystycznych, klasycznych objawów należą: odwodnienie (w niedoborze 21-hydroksylazy) lub przewodnienie (w niedoborze 11-hydroksylazy), [[hiponatremia]], [[hiperkaliemia]] (w niedoborze 21-hydroksylazy) lub [[hipokaliemia]] (w niedoborze 11-hydroksylazy), [[kwasica metaboliczna]]<ref>{{OMIM|id=201910|nazwa=ADRENAL HYPERPLASIA, CONGENITAL, DUE TO 21-HYDROXYLASE DEFICIENCY}}</ref>. W postaci nieklasycznej na obraz kliniczny składają się m.in.: [[hirsutyzm]]<ref>{{OMIM|id=202010|nazwa=ADRENAL HYPERPLASIA, CONGENITAL, DUE TO STEROID 11-BETA-HYDROXYLASE DEFICIENCY}}</ref>, [[łojotok]], łysienie skroniowe, [[zespół metaboliczny]]<ref>Michael Connor, Malcolm Ferguson-Smith ''Podstawy genetyki medycznej.'' Wydawnictwo Lekarskie PZWL, 1998, {{ISBN|83-200-2250-9}}</ref><ref>[[Gerd Herold]] (red.) ''Medycyna wewnętrzna'' Wydawnictwo lekarskie PZWL, 2006. {{ISBN|83-200-3380-2}}</ref>. |
|||
=== Zespół NARP === |
|||
{{osobny artykuł|Zespół NARP}} |
{{osobny artykuł|Zespół NARP}} |
||
- '''Neurogenna miopatia z ataksją i zwyrodnieniem barwnikowym siatkówki''' to bardzo rzadka [[Choroby mitochondrialne|choroba mitochondrialna]] będąca skutkiem [[mutacja punktowa|mutacji punktowej]] w [[Mitochondrialny DNA|mitochondrialnym DNA]] <tt>T8993G</tt> w genie ''MTATP6'' ([http://omim.org/entry/516060 OMIM*516060]) kodującym podjednostkę 6 mitochondrialnej [[syntaza ATP|syntazy ATP]]. Zespół NARP dziedziczy się w linii matczynej, jak inne choroby mitochondrialne.Choroba ujawnia się najczęściej w wieku dorosłym, rzadko u dzieci. Na obraz kliniczny NARP składają się objawy takie jak, np.: zwyrodnienie barwnikowe siatkówki, napady [[drgawki|drgawek]], [[ataksja|ataksja móżdżkowa]], osłabienie mięśni proksymalnych (odsiebnych), [[neuropatia|neuropatia czuciowa]], opóźnienie rozwoju, dysfunkcja [[pień mózgu|pnia mózgu]]<ref name="Hanna Mierzejewska" /><ref>{{OMIM|id=551500|nazwa=NEUROPATHY, ATAXIA, AND RETINITIS PIGMENTOSA}}</ref>. |
- '''Neurogenna miopatia z ataksją i zwyrodnieniem barwnikowym siatkówki''' to bardzo rzadka [[Choroby mitochondrialne|choroba mitochondrialna]] będąca skutkiem [[mutacja punktowa|mutacji punktowej]] w [[Mitochondrialny DNA|mitochondrialnym DNA]] <tt>T8993G</tt> w genie ''MTATP6'' ([http://omim.org/entry/516060 OMIM*516060]) kodującym podjednostkę 6 mitochondrialnej [[syntaza ATP|syntazy ATP]]. Zespół NARP dziedziczy się w linii matczynej, jak inne choroby mitochondrialne.Choroba ujawnia się najczęściej w wieku dorosłym, rzadko u dzieci. Na obraz kliniczny NARP składają się objawy takie jak, np.: zwyrodnienie barwnikowe siatkówki, napady [[drgawki|drgawek]], [[ataksja|ataksja móżdżkowa]], osłabienie mięśni proksymalnych (odsiebnych), [[neuropatia|neuropatia czuciowa]], opóźnienie rozwoju, dysfunkcja [[pień mózgu|pnia mózgu]]<ref name="Hanna Mierzejewska" /><ref>{{OMIM|id=551500|nazwa=NEUROPATHY, ATAXIA, AND RETINITIS PIGMENTOSA}}</ref>. |
||
=== Zespół |
==== Zespół szpikowo-trzustkowy Pearsona ==== |
||
{{osobny artykuł|Zespół |
{{osobny artykuł|Zespół Pearsona}} |
||
Jego przyczyną jest delecja w mtDNA<ref>{{Cytuj pismo|autor=Rotig A, Colonna M, Bonnefont JP, Blanche S, Fischer A, Saudubray JM, Munnich A|tytuł=Mitochondrial DNA deletion in Pearson's marrow/pancreas syndrome (Letter)|czasopismo=Lancet|oznaczenie=I|strony=902-3|rok=1989}}</ref>, do objawów zalicza się ciężka [[niedokrwistość]] makrocytowa w pierwszych tygodniach życia, zmienna [[neutropenia]] i [[małopłytkowość]], podwyższony poziom [[hemoglobina|hemoglobiny]], zaburzenia pracy [[trzustka|trzustki]], [[cukrzyca]], zanik [[kosmki jelitowe|kosmków jelitowych]], zaburzenia funkcji [[wątroba|wątroby]], zaburzenia [[krzepnięcie krwi|krzepnięcia]] [[krew|krwi]]. W wieku dojrzewania mogą wystąpić objawy [[zespół Kearnsa-Sayre’a|zespołu Kearnsa-Sayre’a]] (objawy neurologiczne, utrata słuchu, [[ataksja]], neuropatia obwodowa, upośledzenie umysłowe), a także [[niedokrwistość syderoblastyczna]] w pierwszych tygodniach życia, zmienna [[neutropenia]] i [[małopłytkowość|trombocytopenia]], zaburzenia pracy [[Trzustka|trzustki]], [[cukrzyca]], [[atrofia]] [[kosmki jelitowe|kosmków jelitowych]]<ref>{{OMIM|id=557000|nazwa=PEARSON MARROW-PANCREAS SYNDROME}}</ref>. |
|||
[[Dziedziczenie autosomalne dominujące|Dziedziczona autosomalnie dominująco]] choroba z grupy [[dyzostozy kończynowo-twarzowe|dyzostoz kończynowo-twarzowych]]{{r|Fakim}}, wynik zaburzeń kształtowania się drugiej i trzeciej [[kieszonki skrzelowe]]j oraz [[zawiązek|zawiązków]] kończyn podczas rozwoju embrionalnego{{r|Fakim}}. Spowodowana jest uszkodzeniem [[gen]]u SF3B4 znajdującego się na długim ramieniu [[chromosom 1|chromosomu 1]], w regionie q21{{r|Smigiel}}. Gen SF3B4 koduje nukleoproteinę U2 [[splicesom]]u{{r|Smigiel}}, który bierze udział w regulacji genów wczesnej [[embriogeneza|embriogenezy]] poprzez [[splicing|wycinanie sekwencji niekodujących (splicing)]] z [[pre-mRNA|prekursorowego mRNA]] oraz w specjalizacji tkanek{{r|Smigiel}}. Obraz kliniczny stanowią objawy, takie jak: zaburzenia rozwoju [[czaszka|twarzoczaszki]] (hipoplazja [[łuk jarzmowy|łuków jarzmowych]], [[mikrognacja]], małe i obrócone ku tyłowi [[małżowina uszna|małżowiny uszne]]) oraz brak [[kciuk]]ów, niedorozwój [[krtań|krtani]], [[głuchota]], niedorozwój [[przewód słuchowy zewnętrzny|przewodów słuchowych zewnętrznych]], bez objawów [[niepełnosprawność intelektualna|niepełnosprawności intelektualnej]]{{r|Smigiel}}. |
|||
=== |
=== Sprzężone z płcią recesywne === |
||
Sprzężenie z płcią najczęściej oznacza wystąpienie mutacji w genie zlokalizowanym w chromosomie X{{odn|Boczkowski|1990|s=174}}, ponieważ homologiczny [[chromosom Y]] zawiera mniej genów, jest znacznie krótszy. Większość z tych genów warunkuje rozwój męskich zarodków zgodnie z ich genetyczną płcią, a mutacje w obrębie tych genów zazwyczaj skutkują bezpłodnością, dlatego nie są przekazywane potomstwu. Wyjątek stanowi [[oligospermia]] (duży spadek zawartości plemników w spermie), która choć obniza znacznie płodność, to nie wyklucza posiadania potomstwa<ref name="Dubert" />. Jej przyczyną jest jedna z kilku występujących mutacji znajdujących się w obrębie chromosomu Y, które mogą być dziedziczone jedynie w lini męskiej. Najczęstszą przyczyną tych zaburzeń są delecje w obrębie długiego ramienia chromosomu, zwanego regionem AZFc ({{ang.|azoospermia factor c}})<ref name="Dubert" />.<br /> |
|||
{{Osobny artykuł|Zespół Natowicza}} |
|||
Dziedziczenie cech sprzężonych z chromosomem X jest charakterystyczne i można je rozpoznać już na podstawie zwykłego rodowodu{{odn|Boczkowski|1990|s=174-176}}: |
|||
* choroba nie musi ujawnić się w każdym pokoleniu, |
|||
* chorują wyłącznie mężczyźni i homozygotyczne kobiety (dlatego mężczyźni znacznie częściej), |
|||
* chory mężczyzna przekazuje zmutowany allel córkom, ale nigdy synom, |
|||
* mężczyźni, którzy mieli chorą matkę, ze stuprocentową pewnością również będą chorzy (mają tylko jeden chromosom X<ref group=uwaga>Jeśli rzecz jasna pod względem liczby chromosomów płci, konkretnie X, będą zdrowi</ref>), |
|||
* zwykle choroba jest ciężka i mężczyźni nie dożywają wieku reprodukcyjnego, wtedy w kolejnych pokoleniach występują serie kobiet nosicielek, |
|||
* kobieta, która jest nosicielem wadliwej wersji genu dziedziczonej recesywnie sprzężonej z chromosomem X (X<sup>R</sup>X<sup>r</sup>) ma 50% szans na posiadanie synów, którzy są chorzy i 50% szans posiadania córek, które posiadają jedną kopię zmutowanego genu, są więc nosicielkami. |
|||
==== Choroba Menkesa ==== |
|||
Inne nazwy to: {{łac.|syndroma Natowicz}}, {{ang.|Natowicz syndrome, hyaluronidase deficiency, hyaluronoglucosidase deficiency, MPS IX}}, [[mukopolisacharydoza]] typu IX<br />Zespół Natowicza jest chorobą metaboliczna, której molekularne podłoże stanowi mutacja [[gen]]u HYAL1 znajdującego się na krótkim ramieniu [[chromosom 21|chromosomu 21]], w regionie p21{{r|OMIM1}}. Takie uszkodzenie powoduje zamianę [[kwas glutaminowy|kwasu glutaminowego]] w pozycji 268 na [[lizyna|lizynę]] i poprzez to wytworzenie [[Kodon terminacyjny|kodonu nonsensownego]]{{r|OMIM1}}. Gen HYAL1 jest jednym z trzech genów kodujących [[hialuronidaza|hialuronidazę]]{{r|OMIM1|Triggs-Raine}}. |
|||
[[Plik:Menkes disease3.jpg|120px|Włosy pacjenta z chorobą Menkesa<ref>{{Cytuj pismo | autor=Datta AK, Ghosh T, Nayak K, Ghosh M | tytuł=Menkes kinky hair disease: A case report | rok=2008 | czasopismo=Cases J | doi=10.1186/1757-1626-1-158 | wolumin=1 | oznaczenie=1 | pmid= 18801184 | strony=158}}</ref>|thumb]] |
|||
Częstość występowania szacowana jest na poniżej 1 na 1 000 000 żywych urodzeń{{r|Orphanet}}.<br />Na obraz kliniczny składają się: niski wzrost, słabo wyrażone zmiany [[czaszka|twarzoczaszki]] (spłaszczone nasada nosa, rozdwojony [[Języczek ssaków|języczek]], podśluzówkowy [[rozszczep wargi i podniebienia|rozszczep podniebienia]]) oraz miękkie guzy wokół dużych oraz małych stawów{{r|OMIM1}}. Po zachorowaniu przebiegającym z [[gorączka|gorączką]] lub po wysiłku fizycznym guzy wokółstawowe ulegają bolesnemu obrzękowi, czemu towarzyszy uogólniony [[obrzęk]] skóry, które ustępują w ciągu 72 godzin{{r|OMIM1}}. |
|||
{{osobny artykuł|Choroba Menkesa}} |
|||
=== Zespół Retta === |
|||
Inne nazwy to: ''choroba kręconych włosów'', ''zespół Menkesa'', [[Język angielski|ang.]] ''Menkes disease'', ''Menkes syndrome'', ''kinky hair disease'' i ''steely hair syndrome''. |
|||
{{osobny artykuł|Zespół Retta}} |
|||
Jest to ciężkie, kompleksowe schorzenie neurologiczne<ref>{{Cytuj|tytuł=Zespół Retta {{!}}|data dostępu=2016-12-17|opublikowany=rettsyndrome.pl|url=http://rettsyndrome.pl/?page_id=6}}</ref>, spowodowane mutacją genu MECP2 na [[chromosom X|chromosomie X]]<ref>{{cytuj stronę|url=http://akson.org/x.pro/ModArticles/ShowArticle/611|autor=A.T.Midro|tytuł=Genetyczne podłoże zespołu Retta – gen MECP2|opublikowany=Neurologia Dziecięca|data dostępu=16 kwietnia 2010}}</ref>w lokalizacji q28., dziedziczona jako cecha dominująca, w większości przypadków letalna dla mężczyzn<ref>{{Cytuj|tytuł=Zespół Retta|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/ciaza-i-dziecko/choroby-dzieciece,zespol-retta,artykul,1644883.html}}</ref>. Mutacja najczęściej (w około 99%) zachodzi ''de novo''. Choroba objawia się zaburzeniami rozwoju psychoruchowego (często mylona z autyzmem) i wadami somatycznymi (m.in. [[skrzywienie kręgosłupa|skoliozą]])<ref>{{cytuj pismo|autor= Rett A|tytuł=Cerebral atrophy associated with hyperammonaemia|czasopismo=Clin Neurol|rok=1977|strony=305–329}}</ref>. Zespół Retta pojawia się u dziewczynek z częstotliwością od 1:10000 do 1:23000 żywych urodzeń<ref name="bentkowski">{{Cytuj pismo|autor=Bentkowski Z., Tylko-Szymańska A.|tytuł=Zespół Retta – aktualny stan wiedzu|czasopismo=Pediatria Polska|rok=1997|wolumin=LXXII.2|strony=104}}</ref>. |
|||
Jest chorobą neurodegeneracyjną, związaną z zaburzeniem metabolizmu [[miedź|miedzi]], sprzężoną z płcią<ref>{{Cytuj pismo | autor=Kim BE., Smith K., Meagher CK., Petris MJ | tytuł=A conditional mutation affecting localization of the Menkes disease copper ATPase. Suppression by copper supplementation. | rok=2002 | czasopismo=The Journal of biological chemistry | doi=10.1074/jbc.M208737200 | wydanie=277 | wolumin=46 | miesiąc=listopad | pmid= 12221109 | strony=44079–84}} |
|||
=== Zespół Rileya-Daya === |
|||
</ref>, dlatego częściej spotykamy chorych chłopców. W badanich na populacji europejskiej stwierdzono, że występuje z częstością około 1:254.000 urodzeń<ref name=autonazwa1>{{Cytuj pismo | autor=Tønnesen T., Kleijer WJ., Horn N | tytuł=Incidence of Menkes disease. | rok=1991 | czasopismo=Human genetics | doi= | wydanie=86 | wolumin=4 | miesiąc=luty | pmid= 1999344 | strony=408–10}}</ref>. Przyczyną choroby Menkesa jest [[mutacja]] w genie ''ATP7A''<ref>{{Cytuj pismo | autor=Voskoboinik I., Camakaris J | tytuł=Menkes copper-translocating P-type ATPase (ATP7A): biochemical and cell biology properties, and role in Menkes disease. | rok=2002 | czasopismo=Journal of bioenergetics and biomembranes | doi= | wydanie=34 | wolumin=5 | miesiąc=październik | pmid= 12539963 | strony=363–71}}</ref> w ''locus'' [[chromosom X|Xq]]12-q13. |
|||
[[Plik:Riley day.jpg|thumb|Pacjentka z FD w wieku 1 roku, 6, 10 i 19 lat<ref>{{Cytuj pismo |autor=Axelrod FB, Gold-von Simson G|tytuł=Hereditary sensory and autonomic neuropathies: types II, III, and IV|rok=2007|czasopismo=Orphanet J Rare Dis |doi=10.1186/1750-1172-2-39|wolumin= |oznaczenie=2 |pmid= 17915006|strony=39}}</ref>.]] |
|||
{{osobny artykuł|Rodzinna dysautonomia}} |
|||
Zmiany strukturalne występują w mózgu, wątrobie, naczyniach krwionośnych i w tkance kostnej – co powoduje zaburzenia neurologiczne, kostne i osteoporozę. Chorzy wykazują również nietypową budowę włosa – włosy są sztywne i bardzo łamliwe, lub przeciwnie, bardzo wiotkie. Odmianą alleliczną choroby Menkesa jest tzw. '''zespół rogu potylicznego''' ({{ang.|occipital horn syndrome}}<ref>[http://omim.org/entry/304150 OMIM#304150]</ref>, który charakteryzuje się zmianami kostnymi, a objawy neurologiczne mają stosunkowo niewielkie nasilenie<ref>{{cytuj książkę|tytuł=Neurologia. Podręcznik dla studentów medycyny|inni=Wojciech Kozubski, Paweł P. Liberski (red.)|wydawca=[[Wydawnictwo Lekarskie PZWL]]|miejsce=Warszawa|rok=2006|isbn=83-200-3244-X|strony=252-253}}</ref>. |
|||
To choroba należąca do grupy [[dziedziczne neuropatie czuciowe i autonomiczne|dziedzicznych neuropatii czuciowych i autonomicznych]] (HSAN) o dziedziczeniu autosomalnym recesywnym, zakwalifikowana jako typ III HSAN. Choroba wiąże się z [[mutacja]]mi w genie ''IKBKAP'' w locus [[chromosom 9|9q]]31<ref>{{Cytuj pismo | autor=Slaugenhaupt S.A., Blumenfeld A., Gill S.P., Leyne M., Mull J., Cuajungco M.P., Liebert C.B., Chadwick B., Idelson M., Reznik L., Robbins C., Makalowska I., Brownstein M., Krappmann D., Scheidereit C., Maayan C., Axelrod F.B., Gusella J.F | tytuł=Tissue-specific expression of a splicing mutation in the IKBKAP gene causes familial dysautonomia | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179008 | strony=598-605}}</ref><ref>{{Cytuj pismo | autor=Anderson S.L., Coli R., Daly I.W., Kichula E.A., Rork M.J., Volpi S.A., Ekstein J., Rubin B.Y | tytuł=Familial dysautonomia is caused by mutations of the IKAP gene | rok=2001 | czasopismo=Am J Hum Genet | doi= | wolumin=3 | oznaczenie=68 | pmid= 11179021 | strony=753-758}}</ref>. Allel recesywny warunkujący w układzie homozygotycznym chorobę występuje niemal wyłącznie w [[populacja (biologia)|populacji]] [[Żydzi aszkenazyjscy|Żydów Aszkenazyjskich]]<ref>{{Cytuj pismo | autor=Brunt P.W., McKusick V.A | tytuł=Familial dysautonomia. A report of genetic and clinical studies, with a review of the literature | rok=1971 | czasopismo=Medicine (Baltimore) | doi= | wolumin=5 | oznaczenie=49 | pmid= 4322121 | strony=343-374}}</ref>. Jednostkę chorobową opisali jako pierwsi Riley i Day w [[1949]] roku<ref>{{Cytuj pismo | autor=Riley C.M., Day R.L | tytuł=Central autonomic dysfunction with defective lacrimation; report of five cases | rok=1949 | czasopismo=Pediatrics | doi= | wolumin=4 | oznaczenie=3 | pmid= 18118947 | strony=468-478}}</ref><ref>{{OMIM|id=223900|nazwa=Neuropathy, hereditary sensory and autonomic, Type III; HSAN3}}</ref>. |
|||
=== |
==== Daltonizm ==== |
||
{{osobny artykuł| |
{{osobny artykuł|Daltonizm}} |
||
Podobnie jak hemofilia jest to choroba recesywna sprzężona z płcią, co oznacza, że allel warunkujący zapadanie na tą chorobę nie ujawnia się, jeśli obok niego występuje allel dominujący odpowiadający za prawidłowe widzenie barw (inna nazwa tej choroby to ''ślepota barw'' i zdradza częściowo jej objawy). W związku z tym, że wadliwy gen znajduje się jedynie na chromosomie X, u mężczyzn wystarczy odziedziczenie go po matce, by ujawnił się pełen zespół objawów, nawet jeśli ojciec jest zdrowy. To powoduje, że mężczyźni zapadają na tą chorobę znacznie częściej niż kobiety, które w tym wypadku muszą być [[Homozygota recesywna|homozygotą recesywną]] żeby być daltonistkami (znacznie mniejsze prawdopodobieństwo)<ref>Sharpe, L.T.; Stockman, A.; Jägle, H.; Nathans, J. (1999). ''Opsin genes, cone photopigments, color vision and color blindness'', rozdział w: Gegenfurtner, K. R.; Sharpe, L. T. ''Color Vision: From Genes to Perception''. Cambridge University Press. {{ISBN|978-0-521-00439-8}}</ref>. Do głównych skutków mutacji jednogenowej należy brak lub zmniejszona ilość barwników wzrokowych (np. [[Jodopsyna|jodopsyny]]) odpowiedzialnych za rozróżnianie barw. Objawy kliniczne to najczęściej niezdolność do odróżniania barwy zielonej lub czerwonej lub obu. Występuje w różnym nasileniu{{odn|Mizerski|2013|s=314}}. Inna nazwa tej choroby, to: deuteranopia<ref>{{Cytuj stronę|url = http://encyklopedia.pwn.pl/haslo/daltonizm;3890431.html|tytuł = Internetowa encyklopedia PWN|autor = |data dostępu = 2014-11-02|opublikowany = |język =}}</ref>. |
|||
Przyczyną zespołu Rubinsteina-Taybiego jest najczęściej autosomalnie recesywna mutacja w genie ''[[CREBBP]]'', zlokalizowanym na krótkim ramieniu [[chromosom 16|chromosomu 16]]<ref>{{Cytuj pismo | autor=Coupry I., Monnet L., Attia AA., Taine L., Lacombe D., Arveiler B | tytuł=Analysis of CBP (CREBBP) gene deletions in Rubinstein-Taybi syndrome patients using real-time quantitative PCR | rok=2004 | czasopismo=Hum Mutat | doi=10.1002/humu.20001 | wolumin=3 | oznaczenie= Mar;23 | pmid= 14974086 | strony=278-84}}</ref><ref>{{Cytuj pismo|autor=Bentivegna A, Milani D, Gervasini C, Castronovo P, Mottadelli F, Manzini S, Colapietro P, Giordano L, Atzeri F, Divizia MT, Uzielli ML, Neri G, Bedeschi MF, Faravelli F, Selicorni A, Larizza L|tytuł=Rubinstein-Taybi Syndrome: spectrum of CREBBP mutations in Italian patients|czasopismo=BMC Medical Genetics|rok=2006|oznaczenie=7|wolumin=77|url=http://www.biomedcentral.com/1471-2350/7/77|pmid=17052327}}</ref>. Jest to [[zespół wad wrodzonych]], na którego obraz kliniczny składają się [[Mikrocefalia|małogłowie]], skośno-dolne ustawienie szpar powiekowych, [[klinodaktylia]], szerokie [[kciuk]]i i [[Paluch (palec)|paluchy]], [[Wada serca|wrodzone wady serca]] i układu moczowego, wąskie usta, zwężenie szczęki, [[hipoplazja]] żuchwy, wysoko wysklepione [[Podniebienie (anatomia)|podniebienie]], [[tyłozgryz]], gruszkowate guzki na zębach, [[wnętrostwo (medycyna)|wnętrostwo]]. Pacjenci z zespołem Rubinsteina i Taybiego wykazują [[Niepełnosprawność intelektualna|opóźnienie umysłowe]]<ref name=rubinstein>{{Cytuj pismo|autor=Rubinstein JH, Taybi H|rok=1963|tytuł=Broad thumbs and toes and facial abnormalities. A possible mental retardation syndrome|czasopismo=American Journal of Diseases of Children|oznaczenie=105|strony=588-608|pmid=13983033}}</ref>. |
|||
=== |
==== Dystrofia mięśniowa ==== |
||
{{osobny artykuł|Dystrofia mięśniowa Duchenne’a}} |
|||
[[Plik:Schwartz Jampel syndrome OMIM 255800.jpg|120px|Pacjent z zespołem Schwartza-Jampela<ref name=ho>{{Cytuj pismo|autor=Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC|tytuł=Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report|czasopismo=BMC Neurol|rok=2003|oznaczenie=3|wolumin=3|pmid=12839625|url=http://www.biomedcentral.com/1471-2377/3/3}}</ref>|thumb]] |
|||
Mutacje w pojedynczym genie zlokalizowanym na chromosomie X ([[locus|prążek]] Xp21) są przyczyną [[Dystrofie mięśniowe|dystrofii mięśniowych]] typu [[Dystrofia mięśniowa Duchenne’a|Duchenne’a]] (DMD) i Beckera (BMD)<ref>{{OMIM|id=310200|nazwa=MUSCULAR DYSTROPHY, DUCHENNE TYPE; DMD}}</ref>. Szacuje się, że DMD występuje u 1 na 3500 chłopców, ujawniając się w 2-3 roku życia postępującym zanikiem mięśni. BMD ma przebieg łagodniejszy<ref name=":2" />. To najczęstsza prowadząca do śmierci dziedziczona recesywnie [[Choroby sprzężone z płcią|choroba sprzężona z płcią]]<ref>{{Cytuj pismo | nazwisko = Mendell | imię = JR | nazwisko2 = Sahenk | imię2 = Z | nazwisko3 = Prior | imię3 = TW | tytuł = The childhood muscular dystrophies: diseases sharing a common pathogenesis of membrane instability | czasopismo = J Child Neurol | wolumin = 10 | numer = 2 | strony = 150–159 | rok = 1995 | doi = 10.1177/088307389501000219 | pmid = 7782608}}</ref>. Choroba ma charakter postępujący, początkowo zajmuje [[Mięsień poprzecznie prążkowany|mięśnie szkieletowe]], potem także [[mięsień sercowy]] – prowadząc do [[Kardiomiopatie|kardiomiopatii]]. Pierwsze objawy występują w wieku 3–8 lat. Obejmują opóźniony rozwój ruchowy, kaczkowaty chód i kłopoty z bieganiem oraz chodzeniem po schodach. Chorzy przy wstawaniu pomagają sobie rękami ([[objaw Gowersa]])<ref>{{otwarty dostęp}} {{Cytuj pismo | nazwisko = Ferrier | imię = P. | nazwisko2 = Bamatter | imię2 = F. | nazwisko3 = Klein | imię3 = D. | tytuł = Muscular Dystrophy (Duchenne) in a Girl with Turner's Syndrome | czasopismo = J Med Genet | wolumin = 2 | numer = 1 | strony = 38-46 | rok = 1965 | doi = 10.1136/jmg.2.1.38 | pmid = 14296923 | pmc = 1012803| url = http://jmg.bmj.com/content/2/1/38.full.pdf}}</ref>. |
|||
{{osobny artykuł|Zespół Schwartza-Jampela}} |
|||
==== Hemofilia ==== |
|||
Przyczyna, jak również sposób dziedziczenia są podobne do zespołu Stüve-Wiedemanna, który jest jej noworodkową postacią. Do najważniejszych objawów należą: [[miotonia]], dysplazja kostną, sztywność mięśni, łagodna słabość mięśni (zazwyczaj niepostępująca). Przebieg schorzenia może być postępujący. Fenotyp choroby nie jest jednorodny<ref>{{Cytuj pismo|autor=Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC|tytuł=Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report|czasopismo=BMC Neurol|rok=2003|oznaczenie=3|wolumin=3|pmid=12839625|url=http://www.biomedcentral.com/1471-2377/3/3}}</ref><ref>{{cytuj stronę|url=http://www.emedicine.com/neuro/topic337.htm|tytuł=Schwartz-Jampel Syndrome|autor=Stephen A Berman, Eric Dinnerstein|data dostępu=22 września 2007|język=en|data=2007|opublikowany=eMedicine Neurology}}</ref><ref>{{OMIM|id=|nazwa=SCHWARTZ-JAMPEL SYNDROME, TYPE 1; SJS1}}</ref>. |
|||
{{osobny artykuł|Hemofilia}} |
|||
Jest to choroba recesywna jednogenowa sprzężona z płcią powodująca poważne zaburzenia [[krzepnięcie krwi|krzepliwości krwi]]<ref>[http://wayback.archive.org/web/*/http://www.idn.org.pl/hemofilia/biuletyn7.rtf Biuletyn informacyjny Polskiego Stowarzyszenia Chorych na Hemofilię]</ref>, zwana też ''krwawiączką'' albo ''chorobą królów''. Wadliwy gen znajduje się na chromosomie X, dlatego też u mężczyzn nie ma możliwości zdominowania go przez gen z homologicznego chromosomu (mają genotyp XY). Z tego powodu wystarczy, by jedno z rodziców przekazało ten gen dziecku, aby zachorował mężczyzna, lecz w przypadku kobiet oboje rodzice muszą posiadać wadliwy gen{{odn|Mizerski|2013|s=314}}. Wyróżnia się cztery typy hemofilii. Klasyczną postacią jest '''hemofilia A''' spowodowana mutacją w ''locus'' Xq28 powodującą niedobór VIII czynnika krzepnięcia krwi (czynnika antyhemolitycznego), zaś jedną z najrzadszych jest '''nabyta hemofilia''', której bezpośrednią przyczyną są [[autoprzeciwciała]] skierowane przeciwko czynnikowi VIII<ref name="Buczma-">{{Cytuj pismo | nazwisko = Buczma | imię = A. | nazwisko2 = Windyga | imię2 = J. | tytuł = Acquired haemophilia | czasopismo = Pol Arch Med Wewn | wolumin = 117 | numer = 5-6 | strony = 241-5 | miesiąc = | rok = 2007 | doi = | pmid = 18030874 |url=http://tip.org.pl/pamw/files/articlepdf/54/en.html}} (wersja polska: [http://tip.org.pl/pamw/files/articlepdf/54/pl.html Hemofilia nabyta])</ref>. Pozostałe typy to: '''hemofilia B''' (mutacja w ''locus'' Xq27.1-q27.2, niedobór IX czynnika krzepnięcia krwi – czynnika Christmasa), '''hemofilia C''' (mutacja w ''locus'' [[chromosom 4|4q]]35, niedobór XI czynnika krzepnięcia krwi (czynnika Rosenthala), najczęściej w [[genetyka populacyjna|populacji]] Żydów Aszkenazyjskich, dziedziczenie autosomalne recesywne). Do objawów należą: krwawienia wewnętrzne (krwawienia podskórne – tzw. siniaki,krwawienia do stawów szczególnie kolanowych, skokowych i łokciowych, krwawienia do mięśni np. mięśnia biodrowo-lędźwiowego, łydki, [[hematuria|krwiomocz]]); krwawienia zewnętrzne (krwawienia z błony śluzowej jamy ustnej i [[krwawienie z nosa|nosa]]0 oraz krwawienia które mogą zagrażać życiu (krwawienie [[przestrzeń zaotrzewnowa|pozaotrzewnowe]], krwawienie do ośrodkowego układu nerwowego, krwawienie w okolicach szyi)<ref>{{cytuj książkę|tytuł=Podstawy hematologii|inni=Anna Dmoszyńska, Tadeusz Robak|miejsce=Lublin|rok=2003|wydawca=Wydawnictwo Czelej|strony=374-382|isbn = 83-88063-94-4}}</ref>. |
|||
=== Zespół Stüve-Wiedemanna === |
|||
{{osobny artykuł|Zespół Stüve-Wiedemanna}} |
|||
==== Zespół Bartha ==== |
|||
Dziedziczony jest w sposób autosomalny recesywny, spowodowany mutacjami w genie ''[[LIFR]]'' (''leukemia inhibitory factor receptor gene'') w ''locus'' [[chromosom 5|5p]]13<ref>{{Cytuj pismo | autor=Dagoneau N, Scheffer D, Huber C, Al-Gazali LI, Di Rocco M, Godard A, Martinovic J, Raas-Rothschild A, Sigaudy S, Unger S, Nicole S, Fontaine B, Taupin JL, Moreau JF, Superti-Furga A, Le Merrer M, Bonaventure J, Munnich A., Legeai-Mallet L, Cormier-Daire V | tytuł=Null leukemia inhibitory factor receptor (LIFR) mutations in Stuve-Wiedemann/Schwartz-Jampel type 2 syndrome | rok=2004 | czasopismo=American journal of human genetics | doi=10.1086/381715 | wydanie=74 | wolumin=2 | miesiąc=luty | pmid= 14740318 | strony=298–305}}</ref>. Na fenotyp składają się cechy, takie jak: niskorosłość, łukowate [[kości długie]], [[kamptodaktylia]]. Na obraz kliniczny składają się także poważne powikłania: [[niewydolność oddechowa]] i niewytłumaczalna [[hipertermia]], będące głównymi przyczynami zgonu dzieci z tym zespołem w okresie noworodkowym<ref>{{Cytuj pismo | autor=Raas-Rothschild A, Ergaz-Schaltiel Z, Bar-Ziv J, Rein AJ | tytuł=Cardiovascular abnormalities associated with the Stuve-Wiedemann syndrome | rok=2003 | czasopismo=American journal of medical genetics. Part A | doi=10.1002/ajmg.a.20066 | wydanie=121A | wolumin=2 | miesiąc=sierpień | pmid= 12910496 | strony=156–8}}</ref><ref>{{Cytuj pismo | autor=Di Rocco M, Stella G, Bruno C, Doria Lamba L, Bado M, Superti-Furga A | tytuł=Long-term survival in Stuve-Wiedemann syndrome: a neuro-myo-skeletal disorder with manifestations of dysautonomia | rok=2003 | czasopismo=Am J Med Genet A | doi=10.1002/ajmg.a.10242 | wolumin=4 | oznaczenie=118A | pmid= 12687669 | strony=362-8}}</ref><ref>{{Cytuj pismo | autor=Al-Gazali LI, Ravenscroft A, Feng A, Shubbar A, Al-Saggaf A, Haas D | tytuł=Stüve-Wiedemann syndrome in children surviving infancy: clinical and radiological features| rok=2003 | czasopismo=Clin Dysmorphol | doi=10.1097/01.mcd.0000049260.13501.ec | wolumin=1 | oznaczenie=12 | pmid= 12514358 | strony=1-8}}</ref><ref>{{Cytuj pismo | autor=Gaspar IM, Saldanha T, Cabral P, Vilhena MM, Tuna M, Costa C, Dagoneau N, Daire VC, Hennekam RC | tytuł=Long-term follow-up in Stuve-Wiedemann syndrome: a clinical report | rok=2008 | czasopismo=Am J Med Genet A | doi=10.1002/ajmg.a.32325 | wolumin=13 | oznaczenie=146A | pmid= 18546280 | strony=1748-53}}</ref>, dysautonomia ([[ageuzja|zaburzenia smaku]], [[dysfagia]])<ref>{{Cytuj pismo | autor=Gardiner J, Barton D, Vanslambrouck JM, Braet F, Hall D, Marc J, Overall R | tytuł=Defects in tongue papillae and taste sensation indicate a problem with neurotrophic support in various neurological diseases | rok=2008 | czasopismo=Neuroscientist | doi=10.1177/1073858407312382 | wolumin=3 | oznaczenie=14 | pmid= 18270312 | strony=240-50}}</ref>. Zespół Stüve-Wiedemanna znany jest także jako noworodkowa postać '''[[zespół Schwartza-Jampela|zespołu Schwartza-Jampela typu 2]]''' (SJS2)<ref>{{OMIM|id=601559|nazwa=STUVE-WIEDEMANN SYNDROME}}</ref> i zaliczany także do [[zespół wad wrozdonych|zespołów wad wrodzonych]]<ref>{{WhoNamedIt|synd|1624|Stüve-Wiedemann syndrome}}</ref>. |
|||
{{osobny artykuł|Zespół Bartha}} |
|||
Inaczej '''kwasica 3-metyloglutakonowa typu II''', '''acyduria 3-metyloglutakonowa typu II''', '''zwłóknienie sprężyste wsierdzia typu 2''' to choroba dziedziczona recesywnie, sprzężona z płcią, spowodowana uszkodzeniem [[gen]]u TAZ (G4.5) znajdującego się na długim ramieniu [[chromosom X|chromosomu X]] w regionie q28, kodującego [[tafazyna|tafazynę]]{{R|Werner}}. Opisano ponad 120 różnych mutacji tego genu{{r|Clarke}}. Gen TAZ koduje [[acylotransferaza|acylotransferazę]], która odpowiada za modyfikację struktury [[kardiolipina|kardiolipiny]], jedynego [[fosfolipidy|fosfolipidu]] syntetyzowanego w błonie{{r|Clarke}} mitochondrium{{R|Werner}}. Kardiolipina oddziałuje z licznymi [[białka]]mi związanymi z syntezą [[adenozyno-5′-trifosforan]]u (ATP){{R|Werner}} oraz bierze udział w procesie [[apoptoza|apoptozy]] mitochondriów{{r|Clarke}}. W wyniku mutacji dochodzi do upośledzenia włączania [[kwas linolowy|kwasu linolowego]] do kardiolipiny oraz zaburzeń czynności wewnętrznej i zewnętrznej błony mitochondriów{{R|Werner}}. |
|||
=== Zespół szpikowo-trzustkowy Pearsona === |
|||
Objawy kliniczne: [[neutropenia]], która występuje u 90% pacjentów kardiomiopatie.7B.7B{{R|Werner}}, zmiany w [[układ krążenia|układzie sercowo-naczyniowym]] w okresie [[niemowlę]]cym, czasem bezpośrednio po [[poród|porodzie]], [[nagłe zatrzymanie krążenia]] oraz [[nagła śmierć sercowa]], których ryzyko wzrasta z wiekiem pacjenta{{r|Werner}}, twarz o wysokim płaskim [[czoło (anatomia)|czole]], okrągłej [[twarz człowieka|twarzy]] z pełnymi [[policzek człowieka|policzkami]], odstającymi [[Małżowina uszna|małżowiny uszne]] i głęboko osadzonymi [[oko|oczami]]), jednakże z okresem [[pokwitanie|pokwitania]] cechy te w znacznym stopniu zanikają{{R|Clarke}}. [[Miopatie|Miopatia]] jest częstym objawem i większość pacjentów ma opóźniony rozwój [[psychomotoryka|psychomotoryczny]]{{r|Clarke}}. Osłabienie dotyczy przede wszystkim [[kierunek proksymalny|proksymalnych]] [[mięsień|mięśni]] i nie pogarsza się wiekiem{{r|Clarke}}. Może być obecny [[objaw Gowersa]]{{r|Clarke}}. Rozwój umysłowy nie jest opóźniony, jednakże występują zaburzenia [[orientacja przestrzenna|orientacji przestrzennej]] i umiejętności [[matematyka|matematycznych]]{{r|Werner}}. Większość chorych umiera we wczesnym dzieciństwie, w przebiegu niewydolności serca lub [[zakażenie|zakażenia]]. W przypadku postawienia rozpoznania [[śmiertelność]] wynosi 10%{{R|Clarke}}. Długość życia u nosicielek jest taka sama jak w populacji ogólnej{{r|OMIM}}. |
|||
{{osobny artykuł|Zespół Pearsona}} |
|||
==== Zespół Wiskotta-Aldricha ==== |
|||
Jego przyczyną jest delecja w mtDNA<ref>{{Cytuj pismo|autor=Rotig A, Colonna M, Bonnefont JP, Blanche S, Fischer A, Saudubray JM, Munnich A|tytuł=Mitochondrial DNA deletion in Pearson's marrow/pancreas syndrome (Letter)|czasopismo=Lancet|oznaczenie=I|strony=902-3|rok=1989}}</ref>, do objawów zalicza się ciężka [[niedokrwistość]] makrocytowa w pierwszych tygodniach życia, zmienna [[neutropenia]] i [[małopłytkowość]], podwyższony poziom [[hemoglobina|hemoglobiny]], zaburzenia pracy [[trzustka|trzustki]], [[cukrzyca]], zanik [[kosmki jelitowe|kosmków jelitowych]], zaburzenia funkcji [[wątroba|wątroby]], zaburzenia [[krzepnięcie krwi|krzepnięcia]] [[krew|krwi]]. W wieku dojrzewania mogą wystąpić objawy [[zespół Kearnsa-Sayre’a|zespołu Kearnsa-Sayre’a]] (objawy neurologiczne, utrata słuchu, [[ataksja]], neuropatia obwodowa, upośledzenie umysłowe), a także [[niedokrwistość syderoblastyczna]] w pierwszych tygodniach życia, zmienna [[neutropenia]] i [[małopłytkowość|trombocytopenia]], zaburzenia pracy [[Trzustka|trzustki]], [[cukrzyca]], [[atrofia]] [[kosmki jelitowe|kosmków jelitowych]]<ref>{{OMIM|id=557000|nazwa=PEARSON MARROW-PANCREAS SYNDROME}}</ref>. |
|||
{{osobny artykuł|Zespół Wiskotta-Aldricha}} |
|||
To rzadki dziedziczny [[choroba|zespół chorobowy]], sprzężony z chromosomem X, o typie dziedziczenia recesywnym, na który choruje jedynie płeć męska. Choroba przebiega z zaburzeniami [[układ odpornościowy|układu odpornościowego]]. Wystąpienie objawów choroby jest uwarunkowane mutacją genu ''WAS'' w locus Xp11.23-p11.22, kodującego białko o tej samej nazwie<ref>{{Cytuj pismo |autor=Binder V, Albert MH, Kabus M, Bertone M, Meindl A, Belohradsky BH |tytuł=The genotype of the original Wiskott phenotype |czasopismo=N. Engl. J. Med. |rocznik=355 |wydanie=17 |strony=1790-3 |rok=2006 |pmid=17065640 |doi=10.1056/NEJMoa062520}}</ref>. Białko to jest niezbędne do prawidłowego różnicowania się i funkcjonowania komórek progenitorowych krwi, [[Limfocyty T|limfocytów T]] i [[Limfocyty B|B]], [[Makrofagi|makrofagów]] oraz [[trombocyt]]ów<ref name=Aldrich>{{Cytuj pismo|autor=Aldrich RA, Steinberg AG, Campbell DC|rok=1954|tytuł=Pedigree demonstrating a sex-linked recessive condition characterized by draining ears, eczematoid dermatitis and bloody diarrhea|czasopismo=Pediatrics|oznaczenie=13|wolumin=2|strony=133-9|pmid=13133561}}</ref>. Do objawów należą: [[wyprysk]]i, [[Małopłytkowość|trombocytopenia]], krwawa [[biegunka]], wybroczyny skórne, nawracające [[zakażenie|zakażenia]] ([[zapalenie płuc]], [[zapalenie oskrzeli]], [[zapalenie ucha środkowego]]), zakażenia [[Skóra|skóry]] (zakażenia [[Wirusy|wirusem]], [[Zakażenia opryszczkowe|opryszczki]])<ref name="pmid15284122">{{Cytuj pismo | autor=Jin Y., Mazza C., Christie JR., Giliani S., Fiorini M., Mella P., Gandellini F., Stewart DM., Zhu Q., Nelson DL., Notarangelo LD., Ochs HD | tytuł=Mutations of the Wiskott-Aldrich Syndrome Protein (WASP): hotspots, effect on transcription, and translation and phenotype/genotype correlation. | rok=2004 | czasopismo=Blood | doi=10.1182/blood-2003-05-1592 | wydanie=104 | wolumin=13 | miesiąc=grudzień | pmid= 15284122 | strony=4010–9}}</ref><ref>{{Cytuj pismo |nazwisko=Wiskott |imię=A |rok=1937 |tytuł=''Familiärer, angeborener Morbus Werlhofii?'' ("Familial congenital Werlhof's disease?") |czasopismo=Montsschr Kinderheilkd |rocznik=68 |wydanie= |strony=212-16}}</ref>. |
|||
=== Zespół Tourette'a === |
|||
{{osobny artykuł|Zespół Tourette'a}} |
|||
=== Sprzężone z płcią dominujące === |
|||
Jest to choroba dziedziczona w sposób autosomalny dominujący. Skutkiem mutacji są zmiany w niezidentyfikowanych genach. Część przypadków można wyjaśnić zaburzeniami w syntezie [[Histamina|histaminy]]<ref>Sonya Collins: Treating Tourette's: Histamine Gene May Be Behind Some Tic Disorders. Scientific American, 2011-05-17. [dostęp 2015-10-08].</ref><ref>Sonya Collins. ''Terapia zespołu Tourette'a''. „Świat Nauki”. nr 7 (239), s. 8, lipiec 2011. Prószyński Media. ISSN 0867-6380.</ref>. Objawami klinicznymi są [[tiki]] (w tym wokalne) i zachowania obsesyjne, pojawia się zjawisko [[Echolalia (psychopatologia)|echolalii]]. Występuje w nim szereg neurologiczno-psychicznych objawów o niewyjaśnionym podłożu<ref>Adam Bilikiewicz, Stanisław Pużyński, Jacek Wciórka, Janusz Rybakowski: ''Psychiatria''. T. 2. Wrocław: Urban & Parner, 2003. {{ISBN|83-87944-72-6}}. </ref>. Choroba pojawia się przed 18 rokiem życia i nasila z wiekiem. Nasilenie objawów bywa bardzo różne (wiele nie wymaga leczenia). |
|||
Niewiele chorób genetycznych jest dziedziczonych w ten sposób. Praktycznym faktem jest to, że w ten sposób dziedziczy się cecha grupowa krwi X<small>g</small>{{odn|Boczkowski|1990|s=176}}. Objawy choroby są lżejsze u heterozygot płci żeńskiej niż u [[hemizygota|hemizygot]] (płci męskiej). Powyższy typ dziedziczenia należy podejrzewać, jeżeli{{odn|Boczkowski|1990|s=176}}: |
|||
* chory mężczyzna ma wyłącznie chore córki i wyłacznie zdrowych synów, |
|||
* chore kobiety heterozygoty przekazują cechę całemu potomstwu, |
|||
* choroba występuje dwukrotnie częściej u kobiet niż u męzczyzn, |
|||
* choroba ujawnia się w każdym pokoleniu{{odn|Boczkowski|1990|s=176}}. |
|||
==== Krzywica witamino-D-oporna (hipofosfatemia) ==== |
|||
=== Zespół Wiskotta-Aldricha === |
|||
Rzadka choroba spowodowana uszkodzeniem genu ''PHEX'' kodującego białko enzymatyczne - [[Endopeptydazy|endopeptydazę]], występujące głównie w komórkach kości i [[zęby|zębów]], odpowiedzialnego za [[Inaktywator|inaktywację]] innego białka – czynnika fosfaturycznego, który – dla odróżnienia od parathormonu – nazwano [[fosfatonina|fosfatoniną]], pełniącego funkcję regulacyjną przy [[resorpcja w nerkach|wchłanianiu zwrotnym]] [[fosforany|fosforanów]] w [[nerka]]ch. Cechuje się brakiem reakcji na witaminę D w dawkach stosowanych w leczeniu [[krzywica|krzywicy niedoborowej]]. Choroby te spowodowane są zaburzeniami metabolizmu i działania witaminy D i/lub zaburzeniami gospodarki fosforowej. Najczęstszą postacią krzywicy opornej na witaminę D jest krzywica hipofosfatemiczna rodzinna – sprzężona z chromosomem X. Do innych postaci należą: osteomalacja onkogeniczna, autosomalna dominująca krzywica hipofosfatemiczna, krzywica hipofosfatemiczna rodzinna z [[Hiperkalciuria|hiperkalciurią]] i krzywice pseudoniedoborowe. Nadmierna aktywność białka regulującego wpływa na wzmożone wydalanie fosforanów w moczu i niską ich zawartość we krwi. Skutkiem choroby jest deformacja szkieletu oraz brak szkliwa na zębach. Choroba ta częściej dotyka kobiet niż mężczyzn, ale efekt fenotypowy jest u obu płci taki sam<ref>{{Cytuj|autor=Katarzyna Grzanka, Eugeniusz Józef Kucharz|tytuł=KRZYWICA OPORNA NA WITAMINĘ D|czasopismo=ResearchGate|data dostępu=2016-12-22|url=https://www.researchgate.net/publication/242695537_KRZYWICA_OPORNA_NA_WITAMINE_D}}</ref><ref name="pmid19169476">{{OMIM|id=131222|nazwa=THYMIDINE PHOSPHORYLASE: TYMP}}</ref><ref name="pmid17451081">{{OMIM|id=174763|nazwa=POLYMERASE, DNA, GAMMA; POLG}}</ref><ref name="Macedo">{{Cytuj pismo | autor=Macedo LC., Soardi FC., Ananias N., Belangero VM., Rigatto SZ., De-Mello MP., D'Souza-Li L | tytuł=Mutations in the vitamin D receptor gene in four patients with hereditary 1,25-dihydroxyvitamin D-resistant rickets. | rok=2008 | czasopismo=Arquivos brasileiros de endocrinologia e metabologia | doi= | wydanie=52 | wolumin=8 | miesiąc=listopad | pmid= 19169476 | strony=1244–51}}</ref><ref name="Nicolaidou"/>. |
|||
{{osobny artykuł|Zespół Wiskotta-Aldricha}} |
|||
=== Zespół Retta === |
|||
To rzadki dziedziczny [[choroba|zespół chorobowy]], sprzężony z [[Chromosom X|chromosomem X]], o typie dziedziczenia recesywnym, na który choruje jedynie płeć męska. Choroba przebiega z zaburzeniami [[układ odpornościowy|układu odpornościowego]]. Wystąpienie objawów choroby jest uwarunkowane [[mutacja|mutacją]] [[gen]]u ''WAS'' w locus Xp11.23-p11.22, kodującego białko o tej samej nazwie<ref>{{Cytuj pismo |autor=Binder V, Albert MH, Kabus M, Bertone M, Meindl A, Belohradsky BH |tytuł=The genotype of the original Wiskott phenotype |czasopismo=N. Engl. J. Med. |rocznik=355 |wydanie=17 |strony=1790-3 |rok=2006 |pmid=17065640 |doi=10.1056/NEJMoa062520}}</ref>. Białko to jest niezbędne do prawidłowego różnicowania się i funkcjonowania komórek progenitorowych krwi, [[Limfocyty T|limfocytów T]] i [[Limfocyty B|B]], [[Makrofagi|makrofagów]] oraz [[trombocyt]]ów<ref name=Aldrich>{{Cytuj pismo|autor=Aldrich RA, Steinberg AG, Campbell DC|rok=1954|tytuł=Pedigree demonstrating a sex-linked recessive condition characterized by draining ears, eczematoid dermatitis and bloody diarrhea|czasopismo=Pediatrics|oznaczenie=13|wolumin=2|strony=133-9|pmid=13133561}}</ref>. Do objawów należą: [[wyprysk]]i, [[Małopłytkowość|trombocytopenia]], krwawa [[biegunka]], wybroczyny skórne, nawracające [[zakażenie|zakażenia]] ([[zapalenie płuc]], [[zapalenie oskrzeli]], [[zapalenie ucha środkowego]]), zakażenia [[Skóra|skóry]] (zakażenia [[Wirusy|wirusem]], [[Zakażenia opryszczkowe|opryszczki]])<ref name="pmid15284122">{{Cytuj pismo | autor=Jin Y., Mazza C., Christie JR., Giliani S., Fiorini M., Mella P., Gandellini F., Stewart DM., Zhu Q., Nelson DL., Notarangelo LD., Ochs HD | tytuł=Mutations of the Wiskott-Aldrich Syndrome Protein (WASP): hotspots, effect on transcription, and translation and phenotype/genotype correlation. | rok=2004 | czasopismo=Blood | doi=10.1182/blood-2003-05-1592 | wydanie=104 | wolumin=13 | miesiąc=grudzień | pmid= 15284122 | strony=4010–9}}</ref><ref>{{Cytuj pismo |nazwisko=Wiskott |imię=A |rok=1937 |tytuł=''Familiärer, angeborener Morbus Werlhofii?'' ("Familial congenital Werlhof's disease?") |czasopismo=Montsschr Kinderheilkd |rocznik=68 |wydanie= |strony=212-16}}</ref>. |
|||
{{osobny artykuł|Zespół Retta}} |
|||
Jest to ciężkie, kompleksowe schorzenie neurologiczne<ref>{{Cytuj|tytuł=Zespół Retta {{!}}|data dostępu=2016-12-17|opublikowany=rettsyndrome.pl|url=http://rettsyndrome.pl/?page_id=6}}</ref>, spowodowane mutacją genu MECP2 na [[chromosom X|chromosomie X]]<ref>{{cytuj stronę|url=http://akson.org/x.pro/ModArticles/ShowArticle/611|autor=A.T.Midro|tytuł=Genetyczne podłoże zespołu Retta – gen MECP2|opublikowany=Neurologia Dziecięca|data dostępu=16 kwietnia 2010}}</ref>w lokalizacji q28., dziedziczona jako cecha dominująca, w większości przypadków letalna dla mężczyzn<ref>{{Cytuj|tytuł=Zespół Retta|czasopismo=medonet.pl|data dostępu=2016-12-17|url=http://www.medonet.pl/ciaza-i-dziecko/choroby-dzieciece,zespol-retta,artykul,1644883.html}}</ref>. Mutacja najczęściej (w około 99%) zachodzi ''de novo''. Choroba objawia się zaburzeniami rozwoju psychoruchowego (często mylona z autyzmem) i wadami somatycznymi (m.in. [[skrzywienie kręgosłupa|skoliozą]])<ref>{{cytuj pismo|autor= Rett A|tytuł=Cerebral atrophy associated with hyperammonaemia|czasopismo=Clin Neurol|rok=1977|strony=305–329}}</ref>. Zespół Retta pojawia się u dziewczynek z częstotliwością od 1:10000 do 1:23000 żywych urodzeń<ref name="bentkowski">{{Cytuj pismo|autor=Bentkowski Z., Tylko-Szymańska A.|tytuł=Zespół Retta – aktualny stan wiedzu|czasopismo=Pediatria Polska|rok=1997|wolumin=LXXII.2|strony=104}}</ref>. |
|||
== Choroby spowodowane powtórzeniami trinukleotydów == |
== Choroby spowodowane powtórzeniami trinukleotydów == |
||
| Linia 621: | Linia 700: | ||
W podłożu molekularnym tych chorób ({{ang.|''Triplet Repeat Expansion Diseases''}} w skrócie ''TREDs'') leżą '''mutacje kodonowe (dynamiczne)''' polegające na powieleniu się (ekspansji) fragmentu genu, zwykle o długości 3-4 nukleotydów - u większości chorób z tej grupy przyczyną jest ekspansja kodonu CAG (oznaczającego [[aminokwas]] [[glutamina|glutaminę]]) w sekwencji kodującej genu. Na poziomie białka tworzy się tzw. trakt poliglutaminowy, który zaburza prawidłowe jego funkcjonowanie. Tego typu mutacje określa się jako mutacje kodonowe, a schorzenia nią spowodowane jako choroby poliQ<ref>{{Cytuj pismo | autor=Richards RI | tytuł=Dynamic mutations: a decade of unstable expanded repeats in human genetic disease. | rok=2001 | czasopismo=Hum Mol Genet | doi= | wolumin=20 | oznaczenie=Oct 1;10 | pmid= 11673400 | strony=2187-94}}</ref> |
W podłożu molekularnym tych chorób ({{ang.|''Triplet Repeat Expansion Diseases''}} w skrócie ''TREDs'') leżą '''mutacje kodonowe (dynamiczne)''' polegające na powieleniu się (ekspansji) fragmentu genu, zwykle o długości 3-4 nukleotydów - u większości chorób z tej grupy przyczyną jest ekspansja kodonu CAG (oznaczającego [[aminokwas]] [[glutamina|glutaminę]]) w sekwencji kodującej genu. Na poziomie białka tworzy się tzw. trakt poliglutaminowy, który zaburza prawidłowe jego funkcjonowanie. Tego typu mutacje określa się jako mutacje kodonowe, a schorzenia nią spowodowane jako choroby poliQ<ref>{{Cytuj pismo | autor=Richards RI | tytuł=Dynamic mutations: a decade of unstable expanded repeats in human genetic disease. | rok=2001 | czasopismo=Hum Mol Genet | doi= | wolumin=20 | oznaczenie=Oct 1;10 | pmid= 11673400 | strony=2187-94}}</ref> |
||
. Jedną z prawdopodobnych przyczyn tej mutacji jest zjawisko poślizgu polimerazy DNA podczas replikacji DNA. Choroby mają charakter neurodegeneracyjny i neuromięśniowy, towarzyszy im często zjawisko [[antycypacja (genetyka)|antycypacji]] – prawdopodobieństwo dalszego wydłużania się obszaru podlegającego ekspansji w kolejnych rundach [[replikacja DNA|replikacji]] ma tendencję wzrostową, przez co choroba z pokolenia na pokolenie ujawnia się wcześniej, a jej objawy są coraz cięższe<ref>{{cytuj książkę |nazwisko= Brown T.A.|imię= |autor link= |inni= |tytuł= Genomy|url= |data= |rok= 2001|miesiąc= |wydawca= Wydawnictwo Naukowe PWN|miejsce= Warszawa|isbn = 83-01-13439-9|strony= |rozdział= |adres rozdziału= |cytat =}}</ref>. Etiopatogenezę u części tych chorób mogą też stanowić trójnukleotydowe trakty (złożone z CTG, CGG, CCG, AAG) znajdują się w niekodujących fragmentach genu – [[5'UTR]], [[3'UTR]] oraz [[intron]]ach<ref>Sobczak K, de Mezer M, Michlewski G, Krol J, Krzyzosiak WJ. (2003) RNA structure of trinucleotide repeats associated with human neurological diseases. Nucleic Acids Research. Oct 1;31(19):5469-82 [http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=14500809&ordinalpos=5&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum PMID 14500809]</ref>. |
. Jedną z prawdopodobnych przyczyn tej mutacji jest zjawisko poślizgu polimerazy DNA podczas replikacji DNA. Choroby mają charakter neurodegeneracyjny i neuromięśniowy, towarzyszy im często zjawisko [[antycypacja (genetyka)|antycypacji]] – prawdopodobieństwo dalszego wydłużania się obszaru podlegającego ekspansji w kolejnych rundach [[replikacja DNA|replikacji]] ma tendencję wzrostową, przez co choroba z pokolenia na pokolenie ujawnia się wcześniej, a jej objawy są coraz cięższe<ref>{{cytuj książkę |nazwisko= Brown T.A.|imię= |autor link= |inni= |tytuł= Genomy|url= |data= |rok= 2001|miesiąc= |wydawca= Wydawnictwo Naukowe PWN|miejsce= Warszawa|isbn = 83-01-13439-9|strony= |rozdział= |adres rozdziału= |cytat =}}</ref>. Etiopatogenezę u części tych chorób mogą też stanowić trójnukleotydowe trakty (złożone z CTG, CGG, CCG, AAG) znajdują się w niekodujących fragmentach genu – [[5'UTR]], [[3'UTR]] oraz [[intron]]ach<ref name="Sobczak">Sobczak K, de Mezer M, Michlewski G, Krol J, Krzyzosiak WJ. (2003) RNA structure of trinucleotide repeats associated with human neurological diseases. Nucleic Acids Research. Oct 1;31(19):5469-82 [http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=14500809&ordinalpos=5&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum PMID 14500809]</ref>. |
||
=== Choroba Friedreicha === |
=== Choroba Friedreicha === |
||
| Linia 637: | Linia 716: | ||
Inne nazwy: {{ang.|spinocerebellar ataxia 3; SCA3 spinocerebellar atropfy III; azorean neurologic disease; spinopontine atrophy, nigrospinodentatal degeneration}}<ref name="OMIM109150">{{OMIM|id=109150|nazwa=MACHADO-JOSEPH DISEASE; MJD}}</ref>.<br /> |
Inne nazwy: {{ang.|spinocerebellar ataxia 3; SCA3 spinocerebellar atropfy III; azorean neurologic disease; spinopontine atrophy, nigrospinodentatal degeneration}}<ref name="OMIM109150">{{OMIM|id=109150|nazwa=MACHADO-JOSEPH DISEASE; MJD}}</ref>.<br /> |
||
To choroba należąca do [[Choroby spowodowane powtórzeniami trinukleotydów|TREDs]], bowiem jest spowodowana ekspansją trójek nukleotydowych <code>CAG</code> - determinujących glutaminę (chorobotwórcze allele zawierają 52 do 86 powtórzeń<ref name="OMIM109150"/>) genu ''ATXN3'' (locus 14q24.3-q31<ref>{{Cytuj|autor=E. C. Twist, L. K. Casaubon, M. H. Ruttledge, V. S. Rao, P. M. Macleod|tytuł=Machado Joseph disease maps to the same region of chromosome 14 as the spinocerebellar ataxia type 3 locus.|czasopismo=Journal of Medical Genetics|data=1995-01-01|data dostępu=2017-01-04|issn=1468-6244|wydanie=1|s=25–31|doi=10.1136/jmg.32.1.25|pmid=7897622|url=http://jmg.bmj.com/content/32/1/25|język=en}}</ref> ), kodującego [[ataksyna-3|ataksynę-3]]<ref>{{Cytuj|autor=André Toulouse, Faith Au-Yeung, Claudia Gaspar, Julie Roussel, Patrick Dion|tytuł=Ribosomal frameshifting on MJD-1 transcripts with long CAG tracts|czasopismo=Human Molecular Genetics|data=2005-09-15|data dostępu=2017-01-04|issn=0964-6906|wydanie=18|s=2649–2660|doi=10.1093/hmg/ddi299|pmid=16087686|url=http://hmg.oxfordjournals.org/content/14/18/2649|język=en}}</ref><ref name="OMIM109150"/>. Jest to ciężkie zaburzenie neurologiczne dziedziczone autosomalnie dominująco<ref>{{Cytuj|autor=S. Gispert, R. Twells, G. Orozco, A. Brice, J. Weber|tytuł=Chromosomal assignment of the second locus for autosomal dominant cerebellar ataxia (SCA2) to chromosome 12q23–24.1|czasopismo=Nature Genetics|data=1993-07-01|data dostępu=2017-01-04|wydanie=3|s=295–299|doi=10.1038/ng0793-295|url=http://www.nature.com/ng/journal/v4/n3/abs/ng0793-295.html|język=en}}</ref>, charakteryzujące się postępującą ataksją, spastycznością, zaburzeniami ruchowymi i oczu<ref name="OMIM109150"/><ref>Franca, M. C., Jr., D'Abreu, A., Nucci, A., Lopes-Cendes, I. ''Muscle excitability abnormalities in Machado-Joseph disease''. Arch. Neurol. 65: 525-529, 2008. [PubMed: 18413477, related citations]</ref>. Na obraz kliniczny składają się także objawy takie jak np<ref>{{Cytuj|autor=A Trott, Lb Jardim, Ht Ludwig, Jam Saute, O Artigalás|tytuł=Spinocerebellar ataxias in 114 Brazilian families: clinical and molecular findings|czasopismo=Clinical Genetics|data=2006-08-01|data dostępu=2017-01-04|issn=1399-0004|wydanie=2|s=173–176|doi=10.1111/j.1399-0004.2006.00656.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2006.00656.x/abstract|język=en}}</ref><ref name="OMIM109150"/>.: [[parkinsonizm]], spowolnienie ruchowe, niestabilność postawy, [[dyzartria]], sztywność, utrata neuronów i [[glejoza]] w zwojach podstawy mózgu, [[nerwy czaszkowe|nerwów czaszkowych]], jąder i rdzenia kręgowego, zanik móżdżku, łagodne powiększenie [[komora czwarta mózgu|komory czwartej]], utrata neuronów w móżdżku, neuropatia obwodowa, zmniejszone poczucie wibracji, zaburzenia zmysłu termicznego, zmniejszenie lub brak odruchów skokowych; ponadto<ref name="OMIM109150"/>: zaburzenia połykania, zaburzenia [[zwieracz]]y, [[oftalmoplegia|oftalmoplegia zewnętrzna]]<ref>Coutinho, P., Andrade, C. ''Autosomal dominant system degeneration in Portuguese families of the Azores Islands: a new genetic disorder involving cerebellar, pyramidal, extrapyramidal and spinal cord motor functions''. Neurology 28: 703-709, 1978. [PubMed: 566869, related citations]</ref>, oczopląs, wytrzeszcz oczu, nienormalna [[elektrookulografia]] (EOG)<ref>Eto, K., Sumi, S. M., Bird, T. D., McEvoy-Bush, T., Boehnke, M., Schellenberg, G. ''Family with dominantly inherited ataxia, amyotrophy, and peripheral sensory loss: spinopontine atrophy or Machado-Joseph Azorean disease in another non-Portuguese family?'' Arch. Neurol. 47: 968-974, 1990. [PubMed: 2396938, related citations]</ref>. |
To choroba należąca do [[Choroby spowodowane powtórzeniami trinukleotydów|TREDs]], bowiem jest spowodowana ekspansją trójek nukleotydowych <code>CAG</code> - determinujących glutaminę (chorobotwórcze allele zawierają 52 do 86 powtórzeń<ref name="OMIM109150"/>) genu ''ATXN3'' (locus 14q24.3-q31<ref>{{Cytuj|autor=E. C. Twist, L. K. Casaubon, M. H. Ruttledge, V. S. Rao, P. M. Macleod|tytuł=Machado Joseph disease maps to the same region of chromosome 14 as the spinocerebellar ataxia type 3 locus.|czasopismo=Journal of Medical Genetics|data=1995-01-01|data dostępu=2017-01-04|issn=1468-6244|wydanie=1|s=25–31|doi=10.1136/jmg.32.1.25|pmid=7897622|url=http://jmg.bmj.com/content/32/1/25|język=en}}</ref> ), kodującego [[ataksyna-3|ataksynę-3]]<ref>{{Cytuj|autor=André Toulouse, Faith Au-Yeung, Claudia Gaspar, Julie Roussel, Patrick Dion|tytuł=Ribosomal frameshifting on MJD-1 transcripts with long CAG tracts|czasopismo=Human Molecular Genetics|data=2005-09-15|data dostępu=2017-01-04|issn=0964-6906|wydanie=18|s=2649–2660|doi=10.1093/hmg/ddi299|pmid=16087686|url=http://hmg.oxfordjournals.org/content/14/18/2649|język=en}}</ref><ref name="OMIM109150"/>. Jest to ciężkie zaburzenie neurologiczne dziedziczone autosomalnie dominująco<ref>{{Cytuj|autor=S. Gispert, R. Twells, G. Orozco, A. Brice, J. Weber|tytuł=Chromosomal assignment of the second locus for autosomal dominant cerebellar ataxia (SCA2) to chromosome 12q23–24.1|czasopismo=Nature Genetics|data=1993-07-01|data dostępu=2017-01-04|wydanie=3|s=295–299|doi=10.1038/ng0793-295|url=http://www.nature.com/ng/journal/v4/n3/abs/ng0793-295.html|język=en}}</ref>, charakteryzujące się postępującą ataksją, spastycznością, zaburzeniami ruchowymi i oczu<ref name="OMIM109150"/><ref>Franca, M. C., Jr., D'Abreu, A., Nucci, A., Lopes-Cendes, I. ''Muscle excitability abnormalities in Machado-Joseph disease''. Arch. Neurol. 65: 525-529, 2008. [PubMed: 18413477, related citations]</ref>. Na obraz kliniczny składają się także objawy takie jak np<ref>{{Cytuj|autor=A Trott, Lb Jardim, Ht Ludwig, Jam Saute, O Artigalás|tytuł=Spinocerebellar ataxias in 114 Brazilian families: clinical and molecular findings|czasopismo=Clinical Genetics|data=2006-08-01|data dostępu=2017-01-04|issn=1399-0004|wydanie=2|s=173–176|doi=10.1111/j.1399-0004.2006.00656.x|url=http://onlinelibrary.wiley.com/doi/10.1111/j.1399-0004.2006.00656.x/abstract|język=en}}</ref><ref name="OMIM109150"/>.: [[parkinsonizm]], spowolnienie ruchowe, niestabilność postawy, [[dyzartria]], sztywność, utrata neuronów i [[glejoza]] w zwojach podstawy mózgu, [[nerwy czaszkowe|nerwów czaszkowych]], jąder i rdzenia kręgowego, zanik móżdżku, łagodne powiększenie [[komora czwarta mózgu|komory czwartej]], utrata neuronów w móżdżku, neuropatia obwodowa, zmniejszone poczucie wibracji, zaburzenia zmysłu termicznego, zmniejszenie lub brak odruchów skokowych; ponadto<ref name="OMIM109150"/>: zaburzenia połykania, zaburzenia [[zwieracz]]y, [[oftalmoplegia|oftalmoplegia zewnętrzna]]<ref>Coutinho, P., Andrade, C. ''Autosomal dominant system degeneration in Portuguese families of the Azores Islands: a new genetic disorder involving cerebellar, pyramidal, extrapyramidal and spinal cord motor functions''. Neurology 28: 703-709, 1978. [PubMed: 566869, related citations]</ref>, oczopląs, wytrzeszcz oczu, nienormalna [[elektrookulografia]] (EOG)<ref>Eto, K., Sumi, S. M., Bird, T. D., McEvoy-Bush, T., Boehnke, M., Schellenberg, G. ''Family with dominantly inherited ataxia, amyotrophy, and peripheral sensory loss: spinopontine atrophy or Machado-Joseph Azorean disease in another non-Portuguese family?'' Arch. Neurol. 47: 968-974, 1990. [PubMed: 2396938, related citations]</ref>. |
||
=== Choroba (pląsawica) Huntingtona === |
=== Choroba (pląsawica) Huntingtona === |
||
{{osobny artykuł|Pląsawica Huntingtona}} |
{{osobny artykuł|Pląsawica Huntingtona}} |
||
Choroba ta należy do cech autosomalnych dominujących, choć i tak jest ona rzadka (występuje w Polsce z częstotliwością 1 na 15 000 osób). W wyniku mutacji powstaje za duża ilość powtórzeń sekwencji CAG (odpowiadającej za wbudowanie aminokwasu [[Glutamina|glutaminy]]) w końcu genu położonym na krótkim ramieniu [[Chromosom 4|chromosomu 4]], kodującego białko [[Huntingtyna|huntingtynę]]{{odn|Mizerski|2013}}. Choroba ujawnia się w późnym wieku (ok. 30 – 50 lat). Młodzieńcza odmiana choroby ('''postać Westphala''') dotyczy ludzi przed 20 rokiem życia. Pląsawica Huntingtona objawia się złożonymi zaburzeniami neurologicznymi ([[Polineuropatia|polineuropatie]]) m.in. niekontrolowanymi, przypadkowymi ruchami. Dodatkowo występuje postępujące [[otępienie]] (łac. ''dementia),'' często także różne [[zaburzenia psychiczne]], [[Zaburzenia depresyjne|depresja]]. [[Zachłystowe zapalenie płuc]] spowodowane zaburzeniami połykania jest pierwszą przyczyną śmierci pacjentów z HD, odpowiadając za 85% zgonów<ref>Andrzej Szczeklik (red.) ''Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom I.'' Wydawnictwo Medycyna Praktyczna, 2005. {{ISBN|83-7430-031-0}}. </ref>. |
Choroba ta należy do cech autosomalnych dominujących<ref name="Griffiths" />, choć i tak jest ona rzadka (występuje w Polsce z częstotliwością 1 na 15 000 osób). W wyniku mutacji powstaje za duża ilość powtórzeń sekwencji CAG (odpowiadającej za wbudowanie aminokwasu [[Glutamina|glutaminy]]) w końcu genu położonym na krótkim ramieniu [[Chromosom 4|chromosomu 4]], kodującego białko [[Huntingtyna|huntingtynę]]{{odn|Mizerski|2013}}. Choroba ujawnia się w późnym wieku (ok. 30 – 50 lat). Młodzieńcza odmiana choroby ('''postać Westphala''') dotyczy ludzi przed 20 rokiem życia. Pląsawica Huntingtona objawia się złożonymi zaburzeniami neurologicznymi ([[Polineuropatia|polineuropatie]]) m.in. niekontrolowanymi, przypadkowymi ruchami. Dodatkowo występuje postępujące [[otępienie]] (łac. ''dementia),'' często także różne [[zaburzenia psychiczne]], [[Zaburzenia depresyjne|depresja]]. [[Zachłystowe zapalenie płuc]] spowodowane zaburzeniami połykania jest pierwszą przyczyną śmierci pacjentów z HD, odpowiadając za 85% zgonów<ref>Andrzej Szczeklik (red.) ''Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom I.'' Wydawnictwo Medycyna Praktyczna, 2005. {{ISBN|83-7430-031-0}}. </ref>. |
||
=== Dystrofia miotoniczna === |
=== Dystrofia miotoniczna === |
||
| Linia 660: | Linia 739: | ||
Inne nazwy: zespół kruchego chromosomu X, zespół Martina-Bell<ref group=uwaga>Pierwsze przypadki opisali James Purdon Martin i [[Julia Bell]] w [http://jnnp.bmj.com/content/6/3-4/154.citation J Neurol Psychiatry 1943;6:154-157].</ref>, {{ang.|fragile X syndrome, FraX, FRA-X, Martin-Bell syndrome}}.<br />Jedna z najczęstszych przyczyn uwarunkowanego genetycznie [[Niepełnosprawność intelektualna|obniżenia poziomu rozwoju intelektualnego]]. Przyczyną jest powielenie [[kodon]]u CGG w genie ''[[FMR1]]'' (65-200 powtórzeń to tzw. [[premutacja]]) na długim ramieniu [[chromosom X|chromosomu X]], upośledzające tworzenie [[synapsa|synaps]] w [[Kresomózgowie|mózgu]]<ref name="Premutation">{{Cytuj stronę | url = http://ghr.nlm.nih.gov/glossary=premutation | tytuł = Glossary > Premutation | data = November 19, 2013 | praca = Genetics Home Reference | opublikowany = ghr.nlm.nih.gov | język = en | data dostępu = 2013-11-23}}</ref><ref>{{cytuj książkę|nazwisko=Krzyżowski|imię=Janusz|tytuł=Leksykon Psychiatrii i Nauk Pokrewnych|wydawca=Medyk|miejsce=Warszawa|rok=2010| isbn=978-83-89745-68-2}}</ref><ref name=freedict>{{Cytuj stronę | url = http://medical-dictionary.thefreedictionary.com/Martin-Bell+syndrome | tytuł = Fragile X Syndrome | praca = Medical TheFreeDictionary | opublikowany = Farlex | język = en | data dostępu = 2013-11-23}}</ref>. W związku z tym faktem zespół łamliwego chromosomu X należy do grupy [[Choroby spowodowane powtórzeniami trinukleotydów|chorób spowodowanych powtórzeniami trinukleotydów]]. Zespół dziedziczony jest podobnie jak schorzenia [[hemizygota|sprzężone z chromosomem X]], związane z genem dominującym o ograniczonej penetracji<ref>''The Merck Manual. Podręcznik diagnostyki i terapii''</ref>. Objawy przypominają [[choroba Parkinsona|chorobę Parkinsona]], u chorych po 50. roku życia występują często: [[ataksja]], drżenie, zaburzenia równowagi, ubytki [[pamięć człowieka|pamięci]]<ref>{{OMIM|id=300624|nazwa=FRAGILE X MENTAL RETARDATION SYNDROME}}</ref>. Charakterystyczne cechy wyglądu zewnętrznego: pociągła [[twarz]], wypukłe [[czoło (anatomia)|czoło]], duży obwód [[czaszka|czaszki]] (powyżej 50. [[siatka centylowa|centyla]]), odstające [[Ucho|uszy]], [[zez]], wystająca [[żuchwa]] ([[prognatyzm]]), nadmierna ruchomość w [[staw (anatomia)|stawach]], [[płaskostopie]], [[skolioza]], [[klatka piersiowa lejkowata]], makroorchidyzm – duże [[jądro (anatomia)|jądra]] (powyżej 25 ml u dorosłych)<ref>{{Cytuj|tytuł=Zespół łamliwego chromosomu X - leczenie, objawy na Zdrowegeny.pl|data dostępu=2016-07-11|opublikowany=zdrowegeny.pl|url=https://zdrowegeny.pl/poradnik/zespol-lamliwego-chromosomu-przyczyny-objawy-diagnostyka-leczenie}}</ref>. |
Inne nazwy: zespół kruchego chromosomu X, zespół Martina-Bell<ref group=uwaga>Pierwsze przypadki opisali James Purdon Martin i [[Julia Bell]] w [http://jnnp.bmj.com/content/6/3-4/154.citation J Neurol Psychiatry 1943;6:154-157].</ref>, {{ang.|fragile X syndrome, FraX, FRA-X, Martin-Bell syndrome}}.<br />Jedna z najczęstszych przyczyn uwarunkowanego genetycznie [[Niepełnosprawność intelektualna|obniżenia poziomu rozwoju intelektualnego]]. Przyczyną jest powielenie [[kodon]]u CGG w genie ''[[FMR1]]'' (65-200 powtórzeń to tzw. [[premutacja]]) na długim ramieniu [[chromosom X|chromosomu X]], upośledzające tworzenie [[synapsa|synaps]] w [[Kresomózgowie|mózgu]]<ref name="Premutation">{{Cytuj stronę | url = http://ghr.nlm.nih.gov/glossary=premutation | tytuł = Glossary > Premutation | data = November 19, 2013 | praca = Genetics Home Reference | opublikowany = ghr.nlm.nih.gov | język = en | data dostępu = 2013-11-23}}</ref><ref>{{cytuj książkę|nazwisko=Krzyżowski|imię=Janusz|tytuł=Leksykon Psychiatrii i Nauk Pokrewnych|wydawca=Medyk|miejsce=Warszawa|rok=2010| isbn=978-83-89745-68-2}}</ref><ref name=freedict>{{Cytuj stronę | url = http://medical-dictionary.thefreedictionary.com/Martin-Bell+syndrome | tytuł = Fragile X Syndrome | praca = Medical TheFreeDictionary | opublikowany = Farlex | język = en | data dostępu = 2013-11-23}}</ref>. W związku z tym faktem zespół łamliwego chromosomu X należy do grupy [[Choroby spowodowane powtórzeniami trinukleotydów|chorób spowodowanych powtórzeniami trinukleotydów]]. Zespół dziedziczony jest podobnie jak schorzenia [[hemizygota|sprzężone z chromosomem X]], związane z genem dominującym o ograniczonej penetracji<ref>''The Merck Manual. Podręcznik diagnostyki i terapii''</ref>. Objawy przypominają [[choroba Parkinsona|chorobę Parkinsona]], u chorych po 50. roku życia występują często: [[ataksja]], drżenie, zaburzenia równowagi, ubytki [[pamięć człowieka|pamięci]]<ref>{{OMIM|id=300624|nazwa=FRAGILE X MENTAL RETARDATION SYNDROME}}</ref>. Charakterystyczne cechy wyglądu zewnętrznego: pociągła [[twarz]], wypukłe [[czoło (anatomia)|czoło]], duży obwód [[czaszka|czaszki]] (powyżej 50. [[siatka centylowa|centyla]]), odstające [[Ucho|uszy]], [[zez]], wystająca [[żuchwa]] ([[prognatyzm]]), nadmierna ruchomość w [[staw (anatomia)|stawach]], [[płaskostopie]], [[skolioza]], [[klatka piersiowa lejkowata]], makroorchidyzm – duże [[jądro (anatomia)|jądra]] (powyżej 25 ml u dorosłych)<ref>{{Cytuj|tytuł=Zespół łamliwego chromosomu X - leczenie, objawy na Zdrowegeny.pl|data dostępu=2016-07-11|opublikowany=zdrowegeny.pl|url=https://zdrowegeny.pl/poradnik/zespol-lamliwego-chromosomu-przyczyny-objawy-diagnostyka-leczenie}}</ref>. |
||
=== Choroby wieloczynnikowe === |
|||
Zaburzenia genetyczne mogą być również złożone, wieloczynnikowe lub wielogenowe, co oznacza, że są prawdopodobnie związane ze skutkami wielu genów w połączeniu ze stylem życia i czynnikami środowiskowymi. Do zaburzeń wieloczynnikowych należą choroby serca i cukrzyca{{odn|Boczkowski|1990|s=138}}. Analiza wielu częstych chorób wskazuje na to, że istotną rolę odgrywają w nich czynniki genetyczne; jednak nie dziedziczą się zgodnie z prawami Mendla. To sprawia, że trudno jest określić ryzyko odziedziczenia lub przekazywanie tych zaburzeń u różnych osób{{odn|Boczkowski|1990|s=132-142}}. Te skomplikowane zaburzenia są również trudne do badania i leczenia, ze względu na specyficzne czynniki powodujące większość z tych zaburzeń, które nie zostały jeszcze zidentyfikowane. Badania, których celem jest określenie przyczyn zaburzeń złożonych, można zastosować kilka podejść metodologicznych, aby określić skojarzony genotyp - fenotyp. W jednej metodzie podejście do okreslenia pierwszego genotypu, rozpoczyna się od identyfikacji wariantów genetycznych występujących u chorych i określenia związanych z nimi objawów klinicznych. Jest to w przeciwieństwie do bardziej tradycyjnego podejścia fenotypu pierwszego i może zidentyfikować czynniki przyczynowe, które wcześniej były zasłonięte przez kliniczną heterogeniczność, penetrację i ekspresyjność. Ryzyko wystapienia choroby jest tym większe, im więcej genów patologicznych ma dany osobnik oraz im więcej działa na niego zewnątrzpochodnych czynników szkodliwych{{odn|Boczkowski|1990|s=132-142}}. Do chorób wieloczynnikowych należą{{odn|Boczkowski|1990|s=138}}: |
|||
* [[choroba nadciśnieniowa]]{{odn|Boczkowski|1990|s=138}}, |
|||
* niektóre postacie [[miażdżyca|miażdżycy]]{{odn|Boczkowski|1990|s=138}}, |
|||
* [[choroba wrzodowa]]{{odn|Boczkowski|1990|s=138}}, |
|||
* niektóre postacie [[odczyn alergiczny|odczynów alergicznych]], mi.in. [[dychawica oskrzelowa]]{{odn|Boczkowski|1990|s=138}}, |
|||
* niektóre postacie [[jaskra|jaskry]], [[łuszczyca|łuszczycy]]{{odn|Boczkowski|1990|s=138}}, |
|||
* niektóre choroby psychiczne, jak np. [[psychoza maniakalno-depresyjna]]{{odn|Boczkowski|1990|s=138}}; |
|||
również różne [[wady rozwojowe]]{{odn|Boczkowski|1990|s=138}}: |
|||
* [[wrodzone wady serca]]{{odn|Boczkowski|1990|s=138}}, |
|||
* [[rozszczep podniebienia]]{{odn|Boczkowski|1990|s=138}}, |
|||
* [[rozszczep wargi i podniebienia]]{{odn|Boczkowski|1990|s=138}}, |
|||
* wady ośrodkowego układu nerwowego{{odn|Boczkowski|1990|s=138}}. |
|||
=== Choroba Leśniowskiego-Crohna === |
|||
[[Plik:CD serpiginous ulcer.jpg|thumb|100px|Wrzód pełzający okrężnicy w obrazie ednoskopowym, klasycznie występującego w chorobie Crohna]] |
|||
{{osobny artykuł|Choroba Crohna}} |
|||
Jest to nieuleczalna zapalna choroba jelita o niewyjaśnionej [[Etiologia|etiologii]], zaliczana do grupy [[Nieswoiste zapalenia jelit|nieswoistych zapaleń jelit]] (IBD), przewlekły, nieswoisty [[zapalenie|proces zapalny]] ściany [[przewód pokarmowy|przewodu pokarmowego]]; może dotyczyć każdego jego odcinka, lecz najczęściej lokalizuje się w końcowej części [[jelito cienkie|jelita cienkiego]] oraz początkowej [[jelito grube|jelita grubego]] (z tego względu dawniejsza nazwa to ''ileitis terminalis'')<ref>{{Cytuj pismo|autor=Gary R. Lichtenstein, Stephen B. Hanauer, William J. Sandborn, and The Practice Parameters Committee of the American College of Gastroenterology |
|||
|czasopismo=The American Journal of GASTROENTEROLOGY|tytuł=Management of Crohn’s Disease in Adults|wolumin=104|strony=465–483|rok=2009|url=http://www.gi.org/physicians/guidelines/CrohnsDiseaseinAdults2009.pdf|doi=10.1038/ajg.2008.168|język=en}}</ref><ref>{{Cytuj pismo|autor= E F Stange|autor2= S P L Travis|autor3= S Vermeire|autor4= C Beglinger|autor5= L Kupcinkas|autor6= K Geboes|autor7= A Barakauskiene|autor8= V Villanacci|autor9= A Von Herbay|autor10= B F Warren|autor11= C Gasche|autor12= H Tilg|autor13= Stefan W Schreiber|autor14= J Schölmerich|autor15= W Reinisch|czasopismo=GUT. An International Journal of Gastroenterology and Hepatology|tytuł=European evidence based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis|rok=2006|wolumin=55(suppl 1)|strony=i1-i15|doi =10.1136/gut.2005.081950a|język=en|url=http://gut.bmj.com/content/55/suppl_1/i1.full.html}}</ref>. Opisana została po raz pierwszy przez polskiego lekarza [[Antoni Leśniowski|Antoniego Leśniowskiego]] w 1904<ref name="leśniowski">{{Cytuj pismo|autor=Leśniowski, A|tytuł=Przyczynek do chirurgii kiszek|czasopismo=Medycyna (Warszawa)|rok=1903|wolumin=31|strony=460-464, 483–489, 514-518}}</ref>, a dokładniejszego opisu dostarczył [[Burrill Bernard Crohn]] ze współpracownikami w 1932<ref name="crohn">{{Cytuj pismo|autor=Crohn, BB, Ginzburg, L, Oppenheimer, GD|tytuł=Regional ileitis; a pathologic and clinical entity|czasopismo=Journal of the American Medical Association (Chicago)|rok=1932|wolumin=99|strony=1323-1329}}</ref>. Etiopatogeneza choroby może być związana z [[mutacja|mutacją]] genu ''[[NOD2]]'' oraz defektem immunologicznym [[monocyt]]ów, jednak dokładne jej podłoże nie jest znane<ref> {{Cytuj pismo| autor= Vermeire S |tytuł=NOD2/CARD15: relevance in clinical practice |czasopismo= Best Pract Res Clin Gastroenterol |wolumin =18|strony=569-75 |rok=2004 |pmid= 15157828}} </ref><ref> {{Cytuj pismo| autor= Hugot J P et al. |tytuł=Prevalence of CARD15/NOD2 mutations in Caucasian healthy people|czasopismo= Am J Gastroenterol |wolumin =102|strony=1259-1267 |rok=2007 |pmid= 17319929 |doi= 10.1111/j.1572-0241.2007.01149.x}}</ref>. Jej występowanie jest uwarunkowane geograficznie (największa zachorowalność w krajach Europy Zachodniej i Ameryki Północnej)<ref>{{cytuj książkę|autor=Grażyna Rydzewska, Ewa Małecka-Panas (red)|tytuł=Choroba Leśniowskiego-Crohna – 100 lat diagnostyki i terapii|autor r= Agata Witanowska, Grażyna Rydzewska|rozdział=Epidemiologia i przebieg kliniczny choroby Leśniowskiego-Crohna|wydawca=Termedia Wydawnictwa Medyczne|miejsce=Poznań|data=2008|strony=23–36|isbn=978-83-89825-53-7}}</ref>. Charakterystyczne dla przebiegu choroby jest zajęcie całej grubości ściany narządu oraz możliwość występowania w całym przewodzie pokarmowym, podczas gdy we [[wrzodziejące zapalenie jelita grubego|wrzodziejącym zapaleniu jelita grubego]] zajęte są tylko błona śluzowa i podśluzowa jelita grubego). Zmiany mają charakter ogniskowy. Główne objawy dotyczące [[przewód pokarmowy|przewodu pokarmowego]] to: przewlekła biegunka (zwykle bez krwi), czasem nocna. W poważnych przypadkach może istnieć potrzeba oddania ponad 20 stolców na dzień<ref name=Hanauer/><ref name=Podolsky>{{Cytuj pismo | autor=Mueller MH., Kreis ME., Gross ML., Becker HD., Zittel TT., Jehle EC | tytuł=Anorectal functional disorders in the absence of anorectal inflammation in patients with Crohn's disease. | rok=2002 | czasopismo=Br J Surg | doi=10.1046/j.1365-2168.2002.02173.x | wolumin=8 | oznaczenie= Aug;89 | pmid= 12153630 | strony=1027-31}}</ref>, bóle brzucha (często prawe podbrzusze), [[niedrożność jelit]], guzowaty opór w jamie brzusznej, zmiany okołoodbytniczne ([[Rozpadlina (medycyna)|szczelina]], [[przetoka]], [[ropień]]). Do rzadziej występujących objawów pozajelitowych należą<ref name=Hanauer>{{Cytuj pismo | autor=Hanauer SB | tytuł=Inflammatory bowel disease | rok=1996 | czasopismo=N Engl J Med | doi= | wolumin=13 | oznaczenie=334 | pmid= 8596552 | strony=841-8}}</ref>: skórne – [[rumień guzowaty]] (łac. ''erythema nodosum''), [[piodermia zgorzelinowa]]; stawowe; oczne – ''episcleritis'' lub ''keratoconjunctivitis'', ''uveitis''<ref>{{Cytuj pismo|autor=Hampe, J, Grebe, J, Nikolaus, S, Solberg, C, Croucher, PJ, Mascheretti, S, Jahnsen, J, Moum, B, Klump, B, Krawczak, M, Mirza, MM, Foelsch, UR, Vatn, M, Schreiber, S|czasopismo=Lancet|tytuł=Association of ''NOD2'' (CARD 15) with clinical course of Crohn's disease: a cohort study|pmid=12020527|rok=2002|oznaczenie=359|wolumin=9318|strony=1661-1665}}</ref><ref>{{Cytuj pismo|autor=Wu, S, Lim, KC, Huang, J, Saidi, RF, Sears, CL|tytuł=''Bacteroides fragilis'' enterotoxin cleaves the zonula adherens protein, E-cadherin|czasopismo=Proc Natl Acad Sci U S A|url=http://www.pnas.org/cgi/content/full/95/25/14979|oznaczenie=95|wolumin=25|strony=14979-14984|rok=1998|pmid=9844001}}</ref>. |
|||
== Zobacz też == |
== Zobacz też == |
||
| Linia 731: | Linia 831: | ||
<ref name="pmid18612695">{{Cytuj pismo | nazwisko = Groen | imię = EJ. | nazwisko2 = Roos | imię2 = A. | nazwisko3 = Muntinghe | imię3 = FL. | nazwisko4 = Enting | imię4 = RH. | nazwisko5 = de Vries | imię5 = J. | tytuł = Extra-intestinal manifestations of familial adenomatous polyposis | czasopismo = Ann Surg Oncol | wolumin = 15 | numer = 9 | strony = 2439-50 | miesiąc = Sep | rok = 2008 | doi = 10.1245/s10434-008-9981-3 | pmid = 18612695}}</ref> |
<ref name="pmid18612695">{{Cytuj pismo | nazwisko = Groen | imię = EJ. | nazwisko2 = Roos | imię2 = A. | nazwisko3 = Muntinghe | imię3 = FL. | nazwisko4 = Enting | imię4 = RH. | nazwisko5 = de Vries | imię5 = J. | tytuł = Extra-intestinal manifestations of familial adenomatous polyposis | czasopismo = Ann Surg Oncol | wolumin = 15 | numer = 9 | strony = 2439-50 | miesiąc = Sep | rok = 2008 | doi = 10.1245/s10434-008-9981-3 | pmid = 18612695}}</ref> |
||
<ref name=ojrd>{{Cytuj pismo | nazwisko = Half | imię = E. | nazwisko2 = Bercovich | imię2 = D. | nazwisko3 = Rozen | imię3 = P. | tytuł = Familial adenomatous polyposis | czasopismo = Orphanet J Rare Dis | wolumin = 4 | numer = 1 | strony = 22 | miesiąc = Oct | rok = 2009 | doi = 10.1186/1750-1172-4-22 | pmid = 19822006}}</ref> |
<ref name=ojrd>{{Cytuj pismo | nazwisko = Half | imię = E. | nazwisko2 = Bercovich | imię2 = D. | nazwisko3 = Rozen | imię3 = P. | tytuł = Familial adenomatous polyposis | czasopismo = Orphanet J Rare Dis | wolumin = 4 | numer = 1 | strony = 22 | miesiąc = Oct | rok = 2009 | doi = 10.1186/1750-1172-4-22 | pmid = 19822006}}</ref> |
||
<ref name="Dubert">{{Cytuj|autor=Franciszek Dubert, Marek Jurgowiak, Maria Marko-Worłowska, Władysław Zamachowski|rozdział=Mechanizmy dziedziczenia|tytuł=Biologia na czasie 3. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony.|data=2016|isbn=978-83-267-1711-6|wydanie=Wydanie III|miejsce=Warszawa|wydawca=Nowa Era|s=s.93-96}}</ref> |
|||
<ref name="pmid15758612">{{Cytuj pismo|autor=Kuliev A|autor2=Verlinsky Y |tytuł=Preimplantation diagnosis: A realistic option for assisted reproduction and genetic practice |pismo=Curr. Opin. Obstet. Gynecol. |wolumin=17 |wydanie=2 |strony=179–83 |data=2005 |pmid=15758612 |doi= 10.1097/01.gco.0000162189.76349.c5|url=http://meta.wkhealth.com/pt/pt-core/template-journal/lwwgateway/media/landingpage.htm?issn=1040-872X&volume=17&issue=2&spage=179 |data dostępu=2009-04-01}}</ref> |
|||
<ref name=Wade>{{Cytuj pismo|autor= Wade, Nicholas|tytuł=Japanese Scientists Identify Ear Wax Gene| pismo=New York Times|data= January 29, 2006}}</ref> |
|||
<ref name=Yoshiura>{{Cytuj pismo|autor=Yoshiura K|autor2=Kinoshita A|autor3=Ishida T|tytuł=A SNP in the ABCC11 gene is the determinant of human earwax type |pismo=Nat. Genet. |wolumin=38 |wydanie=3 |strony=324–30 |data=March 2006 |pmid=16444273 |doi=10.1038/ng1733}}</ref> |
|||
<ref name="Griffiths">{{Cytuj książkę|nazwisko=Griffiths|imię=Anthony J.F.|tytuł=Introduction to Genetic Analysis|data=2012|wydawnictwo=W.H. Freeman and Company|miejsce=New York|isbn=978-1-4292-2943-2|strona=58|wydanie=10|autor2=Wessler, Susan R. |autor3=Carroll, Sean B. |autor4=Doebley, John}}</ref> |
|||
<ref name="Sobczak">Sobczak K, de Mezer M, Michlewski G, Krol J, Krzyzosiak WJ. (2003) RNA structure of trinucleotide repeats associated with human neurological diseases. Nucleic Acids Research. Oct 1;31(19):5469-82 [http://www.ncbi.nlm.nih.gov/sites/entrez?Db=pubmed&Cmd=ShowDetailView&TermToSearch=14500809&ordinalpos=5&itool=EntrezSystem2.PEntrez.Pubmed.Pubmed_ResultsPanel.Pubmed_RVDocSum PMID 14500809]</ref> |
|||
}} |
}} |
||
| Linia 740: | Linia 846: | ||
== Linki zewnętrzne == |
== Linki zewnętrzne == |
||
* [http://www.gen.org.pl wortal Stowarzyszenia na Rzecz Dzieci z Zaburzeniami Genetycznymi] |
* [http://www.gen.org.pl wortal Stowarzyszenia na Rzecz Dzieci z Zaburzeniami Genetycznymi] |
||
* [http://www.ncbi.nlm.nih.gov/entrez/query.fcgi?db=OMIM OMIM — Online Mendelian Inheritance in Man, katalog genów człowieka i chorób genetycznych] |
|||
* [http://rarediseases.info.nih.gov/GARD/ Genetic and Rare Diseases Information Center (GARD)] Office of Rare Diseases (ORD), National Institutes of Health (NIH) |
|||
* [http://www.cdc.gov/ncbddd/single_gene/default.htm CDC’s National Center on Birth Defects and Developmental Disabilities] |
|||
* [http://www.ornl.gov/hgmis/medicine/assist.html Informacje o chorobach genetycznych z Human Genome Project] |
|||
* [http://globalgenes.org/ Global Genes Project, Genetic and Rare Diseases Organization] |
|||
{{Zastrzeżenia|Medycyna}} |
{{Zastrzeżenia|Medycyna}} |
||
Wersja z 23:30, 29 sty 2017
Choroby genetyczne człowieka – grupa chorób uwarunkowanych genetycznie występujących u człowieka; upośledzające sprawność życiową odchylenia od stanu prawidłowego (statystycznej normy), które mogą być przekazywane jako cecha dziedziczna z pokolenia na pokolenie lub powstawać de novo na skutek zmian i zaburzeń w mechanizmach przekazywania cech dziedzicznych. Powstałe de novo zmiany mogą być przekazywane potomstwu jako cecha (choroba) dziedziczna[1]. Mogą być spowodowane aberracjami strukturalnymi chromosomów, zmianami liczbowymi oraz mutacjami genowymi[2].
Podział chorób genetycznych jest oparty tradycyjnie na podstawowych prawach dziedziczenia. Wyróżnia się choroby jednogenowe[3], które są dziedziczone zgodnie z prawami Mendla i uwarunkowane treścią informacyjną jednego genu, tj. w obrębie pary alleli, występujących w określonym locus genowym. Wśród nich wyróżnia się autosomalne recesywne, autosomalne dominujące i sprzężone z chromosomem płciowym żeńskim X, zwykle określane jako sprzężone z płcią. Kolejną grupę stanowią choroby wielogenowe, warunkowane współdziałaniem wielu genów umiejscowionych w różnych loci[4]. Często objawy tych chorób występują na skutek interakcji z czynnikami środowiskowymi i ujawniają się dopiero wówczas, gdy nasilenie działania tych czynników osiągnie pewną wartość progową, dlatego też mówi się o chorobach wieloczynnikowych. Pojęcia choroby wieloczynnikowe i choroby wielogenowe w wielu pracach naukowych, podręcznikach są stosowane zamiennie i granica pomiędzy nimi jest płynna[5]. Ostatnią ważną grupę stanowią choroby występujące w związku z nieprawidłowościami liczby (aberracje liczbowe) lub struktury chromosomów (aberracje strukturalne), czyli choroby chromosomalne lub aberracje chromosomalne[5][2].
Genetyczne obciążenie populacji
Pojęcie genetycznego obciążenia populacji obejmuje wiele elementów składowych. Rozważa się częstość występowania chorób genetycznych, ich skutki dla zdrowia i stopień upośledzenia sprawności życiowej („ciężkość” choroby), czas przeżycia chorych oraz skutki emocjonalne i ekonomiczne dla dotkniętych osób, ich rodzin i społeczeństwa[5]. Większość z tych elementów jest niemożliwa do przedstawienia w sposób ilościowy[5]. Nie daje się jednoznacznie ocenić rozmiaru genetycznego obciążenia populacji ludzkiej, gdyż w miarę uzyskiwania nowych możliwości leczenia lub zapobiegania i zmian kosztów tego postępowania stopień obciążenia również podlega zmianom[4]. Poza tym ciężko jest ocenić i porównać choroby ujawniające się tuż po urodzeniu i prowadzące do ciężkiego zaburzenia rozwoju i śmierci w pierwszych latach życia (jak np. mukopolisacharydoza typu I - zespół Hurler), wrodzone choroby powodujące upośledzenie umysłowe i skracające czas życia do około połowy (jak np. trisomia chromosomu 21 - zespół Downa) i choroby występujące zazwyczaj między 30 a 40 rokiem życia, prowadzące stopniowo do głębokiego upośledzenia, a nieznacznie skracające życie (jak np. pląsawica Huntingtona[6]). Oceny te są zmienne w czasie[7].
Częstość występowania chorób genetycznych człowieka
Częstość występowania chorób genetycznych stanowi podstawową, wyjściową informację. Dzięki poznaniu częstości poszczególnych genów w populacji, częstości świeżych mutacji i aberracji chromosomowych, można by przewidzieć liczbę świeżych przypadków chorób genetycznych w kolejnych pokoleniach, natomiast znając czas przeżycia chorych genetycznie i rozkład grup wiekowych w danej populacji, można by obliczyć liczbę chorych[7]. Niestety brak danych całościowych zmusza do posługiwania się fragmentarycznymi, dostępnymi badaniami i na ich podstawie dokonać oceny szacunkowej. Dane o okresie przeżycia chorych są odmienne w różnych krajach, zaś dostępne rejestry chorób genetycznych wśród żywo urodzonych dzieci nie obejmują chorób ujawniających się w późniejszym wieku oraz genetycznych przyczyn martwych urodzeń i poronień samoistnych[7]. Jedną z najbardziej miarodajnych podstaw do oceny częstości chorób genetycznych jest prowadzony od wielu lat i stale aktualizowany rejestr kanadyjskiej prowincji Kolumbia Brytyjska[8][9]. Jest jedną z podstaw do szacowania częstości chorób genetycznych u ludzi przez Naukowy Komitet Skutków Promieniowania Atomowego Organizacji Narodów Zjednoczonych (ang. United Nations Scientyfic Committee on the Effects of Atomic Radiation - UNSCEAR). Dane zostały skorygowane w świetle badań częstości poszczególnych wybranych chorób genetycznych, zwłaszcza dominujących oraz danych innych rejestrów[7].
| Rodzaj choroby genetycznej | UNSCEAR 1977 | UNSCEAR szacunek 1982 |
|---|---|---|
| Autosomalne dominujące i sprzężone z chromosomem X | 0,12 | 1,00 |
| Recesywne | 0,11 | 0,10 |
| Chromosomalne | 0,20 | 0,40 |
| Wady wrodzone | 4,28 | 4,30 |
| Inne wieloczynnikowe | 4,73 | 4,70 |
| Wady i choroby wieloczynnikowe | 9,10 | 9,00 |
| Razem choroby genetyczne | 9,44 | 10,50 |
| Choroby | Częstość występowania |
|---|---|
| Pląsawica Huntingtona | 0,5 |
| Neurofibromatosis | 0,4 |
| Dystrofia miotoniczna | 0,2 |
| Torbielowatość nerek | 0,8 |
| Ślepota dominująca | 0,1 |
| Hipercholesterolemia | 2,0 |
| Sferocytoza wrodzona | 0,2 |
| Dentinogenesis imperfecta | 0,1 |
| Osteogenesis imperfecta | 0,04 |
| Zespół Marfana | 0,05 |
| Choroby | Częstość występowania |
|---|---|
| Autosomalne | |
| Mukowiscydoza | 0,4 |
| Głuchota (różne postaci) | 0,5 |
| Ślepota (różne postaci) | 0,2 |
| Fenyloketonuria | 0,08 |
| Galaktozemia | 0,025 |
| Mukopolisacharydozy (różne postaci) | 0,04 |
| Glikogenozy | 0,02 |
| Sprzężone z chromosomem X | |
| Dystrofia mięśniowa Duchenne'a | 0,14 |
| Hemofilia A | 0,01 |
| Cecha | Liczba mutantów na 106 gamet |
|---|---|
| Choroby autosomalne dominujące | |
| Achondroplazja | 6 - 13 |
| Aniridia | 5 |
| Dystrofia miotoniczna | 8 - 11 |
| Siatkówczak zarodkowy | 6 - 12 |
| Akrocefalosyndaktylia | 4 |
| Stwardnienie guzowate | 5 - 15 |
| Neurofibromatoza | 44 - 100 |
| Torbielowatość nerek | 65 - 120 |
| Cechy recesywne autosomalne | |
| Mikrocefalia | 25 - 49 |
| Rybia łuska wrodzona | 11 |
| Cereidolipofuscynoza - postać młodzieńcza | 38 |
| Ślepota na barwy całkowita | 28 |
| Fenyloketonuria | 25 |
| Cechy sprzeżone z chromosomem X | |
| Hemofilia A | 32 - 57 |
| Hemofilia B | 2 - 3 |
| Dystrofia mięśniowa Duchenne'a | 46 - 105 |
| Zespół Blocha i Sulzbergera | 6 - 20 |
Stopień obciążenia chorobą
Stopień obciążenia chorobą genetyczną jest bardzo trudny do ujęcia w wymiernych kategoriach i określenia ilościowego. Skutki choroby genetycznej należy rozważać z kilku punktów widzenia: dotkniętej osoby, rodziny i społeczeństwa[13]. Aspekt społeczny jest istotny dla optymalizacji wykorzystania dostępnych środków na ochronę zdrowia oraz dla oceny skutków wprowadzenia mutagenów do środowiska życia i pracy[13]. Próby ilościowej oceny skutków chorób genetycznych podejmowane były przez UNSCEAR i Międzynarodową Komisję Ochrony przed Promieniowaniem (ang. International Commission on Radiological Protection - ICRP). Pojęcia opracowane przez te komisje są pomocne w analizie obciążeń genetycznych. Możliwe podejścia do oceny wielkości obciążeń genetycznych[13]:
- wskaźnik szkodliwości (ang. index of harm), opiera się na śmiertelności, ciężkości uszkodzeń, obliczeniu straty czasu pracy w odniesieniu do normalnego zatrudnienia i wyrażona jako liczba lat roboczych na rok i na 1000 zatrudnionych[14];
- analiza odsetka dzieci hospitalizowanych z przyczyn genetycznych i niegenetycznych z uwzględnieniem długości przeciętnego czasu pobytu w szpitalu, liczby ponownych hospitalizacji i przeciętnych kosztów leczenia[c][14].
Formy i możliwości opieki genetycznej
W celu leczenia zaburzeń genetycznych, zostało zatwierdzonych ponad 1800 badań klinicznych na całym świecie. Wciąż jednak większość metod leczenia opiera się na leczeniu lub łagodzeniu objawów w celu poprawy jakości życia osób dotkniętych chorobą genetyczną[15]. Właściwe postępowanie genetyczne wymaga zaangażowania dużych wyspecjalizowanych zespołów, z poważnym udziałem specjalności niemedycznych i paramedycznych, jak psychologów, biologów, socjologów i pracowników socjalnych. Podstawę stanowi właściwe rozpoznanie choroby i ustalenie toku jej dziedziczenia, każda z nich wymaga jak najwcześniejszego wykrycia. Pozwala to na odpowiednio szybkie rozpoczęcie terapii przeciwdziałającej skutkom mutacji (np. w przypadku fenyloketonurii) oraz na udzielenie porady genetycznej rodzinie z chorym dzieckiem w porę przed urodzeniem się kolejnych, również mogących być dotkniętymi chorobą. Wprowadzone zostały diagnostyczne testy przesiewowe (diagnostyka prenatalna)[16]. Trwają także prace nad wykorzystaniem szczepionek DNA do walki z nowotworami i chorobami genetycznymi, jak np. rodzinna polipowatość gruczolakowata czy zespół Lyncha oraz nad uzyskaniem szczepionek produkowanych przez transgeniczne rośliny jadalne. Wprowadzona została także diagnostyka molekularna, czyli ogół metod diagnostycznych opartych na wykrywaniu DNA patogenu lub zmutowanych alleli pacjenta w pobranym od niego materiale biologicznym. Techniki stosowane w diagnostyce molekularnej[17][18]:
- łańcuchowa reakcja polimerazy (ang. polymerase chain reaction, PCR) - stosuje się w niej startery komplementarne np. tylko do zmutowanego allelu, jeżeli produkt PCR nie powstanie, oznacza to, że osoba jest zdrowa;
- hybrydyzacja DNA - stosuje się w niej sondę molekularną komplementarną do poszukiwanej sekwencji DNA, co pozwala również na zlokalizowanie zmutowanego allelu w chromosomie, w tej metodzie wykorzystuje się mikromacierze DNA zawierające tysiące sond molekularnych ułożonych w regularny sposób[19];
- sekwencjonowanie DNA jest wykorzystywane zwykle wtedy, gdy nie ma opracowanych testów diagnostycznych opartych na PCR lub hybrydyzacji DNA, w metodzie tej można ustalić sekwencję całego DNA[20];
- cytometria przepływowa umożliwia badanie, liczenie i sortowanie, a także pomiary cech pojedynczych komórek, tempo rutynowej analizy próbek może sięgać 10000 komórek na sekundę, posiada zdolność jednoczesnego mierzenia wielu parametrów (tzw. multipleksing ) pojedynczych komórek, co pozwala badaczom i klinicystom zebrać więcej informacji z jednej próbki szybciej, niż kiedykolwiek wcześniej[21].
Aberracje liczbowe
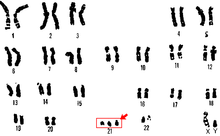
U człowieka często spotykane są trisomie trzech z 22 autosomów[4][2]:
- chromosomu 13. (powoduje zespół Pataua),
- chromosomu 18. (powoduje zespół Edwardsa),
- chromosomu 21. (powoduje zespół Downa),
a także zaburzenia w liczbie chromosomów płci (w tym trisomia chromosomu X). Inne trisomie praktycznie nie obserwuje się, gdyż powodują tak znaczne zaburzenia rozwojowe, że są przyczyną obumierania płodu we wczesnych etapach rozwoju zarodkowego. Podstawowe aberracje liczbowe chromosomów autosomalnych:
Trisomia chromosomu 21

Trisomia chromosomu 21. jest jedną z przyczyn wystąpienia tzw. zespołu Downa, dawniej zwanego pospolicie mongolizmem. Osoby z tą wadą mają mongoidalne rysy twarzy, niski wzrost, szczególny układ bruzd na dłoniach, niezborność ruchów i niedorozwój umysłowy, a przy tym pogodne usposobienie. Zespół Downa wykrywa się metodami diagnostyki prenatalnej. Zaobserwowano, że starsze kobiety w większym stopniu są narażone na ryzyko urodzenia dziecka z tą wadą, niż kobiety młodsze. U matek, które nie przekroczyły 28. roku życia, z zespołem Downa rodzi się jedno dziecko na tysiąc, u matek czterdziestoletnich częstość ta wynosi jeden do stu, a u starszych nawet jeden do pięćdziesięciu[22][23][24].
Zespół Pataua

Trisomia 13. pary chromosomów (kariotyp 47,XX,+13 albo 47,XY,+13)[26][27]. Najczęstsze objawy[28][29]: niedorozwój umysłowy, wady sercowo-naczyniowe (np. niezrośnięty otwór międzyprzedsionkowy w sercu, dekstrokardia), wnętrostwo, szczelina w tęczówce, rozszczep wargi (tzw. zajęcze usta), holoprozencefalia, anoftalmia, naczyniaki włośniczkowe, wady nerek (np. wielotorbielowatość nerek). Ok. 0,02% dzieci rodzi się z tą chorobą[30]. Takie dzieci najczęściej umierają w pierwszym roku życia, jedynie kilka procent dożywa 3 lat – spowodowane jest to wewnętrznymi wadami wrodzonymi[31][32][33][34].
Zespół Edwardsa
Spowodowany jest trisomią chromosomu 18 (47,XX,+18 albo 47,XY,+18)[35]. Częstość występowania zespołu szacowana jest na 1:8.000 urodzeń[36] Powoduje niedorozwój umysłowy. Prowadzi do śmierci we wczesnym dzieciństwie z powodu poważnych nieprawidłowości w budowie wewnętrznej (m.in. niezrośnięty otwór międzyprzedsionkowy). Rozszczep wargi i podniebienia. Poważne wady nerek i serca[2]. Do objawów należą także: mikrocefalia (małogłowie), łódkogłowie (scaphocephalia), dolichocefalia, wydatna potylica (91%[37]), hiperteloryzm, wąskie szpary powiekowe (80%[37]), wady rogówki i tęczówki, mikrognacja, mikrostomia (86%[37]), poszerzenie szwów i ciemiączek, nisko osadzone, dysplastyczne małżowiny uszne, pojedyncza bruzda zgięciowa dłoni, nadmiar skóry na szyi (86%[37]), szeroko rozstawione brodawki sutkowe (hiperteloryzm brodawek sutkowych – 90%[37], niedorozwój umysłowy.
Aberracje strukturalne
Poza mutacjami liczbowymi chromosomów ciężkie choroby genetyczne wywołują również aberracje strukturalne. Polegają one na nieprawidłowej budowie chromosomu. Największe prawdopodobieństwo ich wystąpienia istnieje w okresie podziału komórki, gdy chromosomy potomne przechodzą do nowo powstających komórek. Najczęściej spotykane choroby związane z aberracjami strukturalnymi, które zostaną poniżej krótko omówione, powstają przeważnie w wyniku przerwania ciągłości chromosomu, a więc odłamania się jego odcinka. Taki odłamany odcinek może połączyć się ponownie z tym samym lub innym chromosomem, co powoduje powstanie inwersji, translokacji, duplikacji lub deficjencji (w wielu źródłach delecji), gdy utracona zostaje część chromosomu (np. ramię)[4]. Wybrane choroby związane z uszkodzeniami chromosomów:
Zespół ustno-twarzowo-palcowy
Zespoły ustno-twarzowo-palcowe stanowią grupę około dziesięciu chorób. Częstą przyczyną jest translokacja części chromosomu 6 do 1. Objawia się m.in. wadą górnej wargi, podniebienia i jamy ustnej oraz grubymi palcami o krótkich paznokciach[38][39][40]. Jedną z odmian jest zespół Papillona-League-Psaume, (ang. orofaciodigital syndrome type I, OFD1), którego podłoże molekularne stanowi mutacja genu OFD1 sprzężonego z chromosomem X (region Xp22.2.), dziedziczącego się dominująco lub genu CXORF5[41][42]. Do głównych objawów patomorfologicznych należą[43]: malforacje twarzy i jamy ustnej: rozszczep podniebienia, pogrubienie wału dziąseł, nisko osadzone uszy, próchnica zębów, nieobecne boczne zęby sieczne, szeroki grzbiet nosa. Występują także wady ośrodkowego układu nerwowego (40%): brak ciała modzelowatego, heterotopia istoty szarej, przepuklina oponowo-rdzeniowa (rzadko), wodogłowie, torbiele pajęczynówki, nieprawidłowości móżdżku, porencefalia. Występuje często razem z wielotorbielowatością nereki[44][45]. Zespół występuje u kobiet, u mężczyzn jest letalny[46].
Zespół kociego krzyku
[franc. cri du chat] – wywołany delecją krótkiego ramienia chromosomu 5. Objawy: niepełnosprawność intelektualna (od lekkiej do głębokiej), jasna karnacja, płaczliwość, po porodzie specyficzny płacz dziecka przypominający miauczenie kota[47]. Malformacje podstawy czaszki wskazują na współistnienie nieprawidłowości rozwoju pierwotnego tyłomózgowia (rhomboencephalon) i krtani w trakcie rozwoju zarodkowego[48]. Płacz zanika w ciągu kilku miesięcy[49]. Częstość występowania zespołu ocenia się na od 1:15 000 do 1:50 000 żywych urodzeń[50].
Zespół Wolfa-Hirschhorna
Wywołany jest częściową delecją krótkiego ramienia chromosomu 4[51]. Objawia się szczególnym wyglądem twarzy, niedorozwojem żuchwy, zahamowaniem wzrostu, zaburzeniami rozwoju umysłowego oraz wrodzonymi wadami serca, niska masa urodzeniowa, hipotonia, opóźnienie rozwoju psychoruchowego, małogłowie, charakterystyczna dysmorfia twarzy, anomalia budowy małżowin usznych, wady zamknięcia (rozszczepy podniebienia albo wargi, coloboma tęczówki, wady przegród serca)[52].
Zespoły Angelmana oraz Pradera–Williego

Zespoły te wywołane są przez mikrodelecje w chromosomie 15 jako konsekwencja zaburzeń imprintingu[54] – brak imprintingu ojcowskiego powoduje zespół Pradera-Williego, a brak imprintingu matczynego – zespół Angelmana[55].
Wiele charakterystycznych cech zespołu Angelmana wynika z utraty funkcji genu UBE3A. Do objawów należą: niepełnosprawność intelektualna, ataksja, padaczka (zwykle ujawniająca się przed ukończeniem 3. roku życia), charakterystyczne ruchy przypominające marionetkę i napady śmiechu bez powodu (stąd dawna, zarzucona nazwa zespołu, ang. happy puppet syndrome). Mniej wyrażone są cechy dysmorficzne twarzy, takie jak duże usta (makrostomia), wystający język (glossoptosis), szeroko rozstawione zęby. Tęczówki prawie zawsze mają kolor niebieski. Dzieci z zespołem Angelmana przejawiają różne sensoryzmy, wśród nich częstym jest fascynacja wodą[56].
Zespół Pradera-Williego objawia się m.in.: niskim wzrostem, upośledzeniem umysłowym, niedorozwojem narządów płciowych (hipogonadyzm) oraz otyłością spowodowaną mniejszym niż u zdrowych ludzi zapotrzebowaniem energetycznym przy jednoczesnym ciągłym niepohamowanym uczuciu głodu (hiperfagia)[57]. Uważa się, że zespół Pradera-Williego jest najczęstszą genetycznie uwarunkowaną przyczyną otyłości[58], której powikłania są główną przyczyną zgonów pacjentów z PWS (należy do nich m.in. ostre rozdęcie żołądka, mogące skutkować jego martwicą[59][60]). Na obraz kliniczny składają się również: hipotonia mięśniowa (spadek napięcia mięśni), hipogonadyzm hipogonadotropowy[61], hipogenitalizm, wnętrostwo[62], zez zbieżny[63], skłonność do hipertermii[64], niezwykle gęsta ślina, zwiększająca podatność na próchnicę[65].
Zespół Di George’a
Wywołany jest mikrodelecją krótkiego ramienia chromosomu 22[66]. Przebiegają z pierwotnym niedoborem odporności. W zespole delecji 22q11.2 dochodzi do zaburzeń rozwoju grasicy i jej aplazji, najczęściej w 6.-10. tygodniu życia płodowego. Grasica rozwija się z III i IV kieszonki skrzelowej, więc zaburzenia jej rozwoju przebiegają wspólnie z zaburzeniami gruczołów przytarczycznych. Do objawów należą także: hipokalcemia (średnio 30%) spowodowana niedorozwojem gruczołów przytarczycznych, wrodzone wady nerek, trudności z karmieniem, choroby autoimmunologiczne, takie jak reumatoidalne zapalenie stawów (150 razy większe ryzyko), niedokrwistość hemolityczna autoimmunologiczna, idiopatyczna plamica małopłytkowa, autoimmunologiczne enteropatie (choroba trzewna), bielactwo, zwiększone ryzyko zachorowania na choroby psychiczne[67].
Chromosom „Filadelfia”
Jest to anomalia chromosomowa spowodowana delecją jednego ramienia chromosomu 21. Defekt molekularny polegający na translokacji (przeniesienie fragmentu jednego chromosomu na drugi) t(9;22)(q34;q11), powoduje powstanie genu fuzyjnego bcr-abl. Fragment bcr (ang. breakpoint cluster region), znajdujący się na chromosomie 22 w rejonie q11, zostaje połączony z genem abl znajdującym się na chromosomie 9 w rejonie q34. Do objawów klinicznych należy przewlekła białaczka granulocytarna[40][68]. Spotyka się go również w ostrych białaczkach limfoblastycznych (25-30% u dorosłych, około 6% u dzieci[68]), niekiedy również w ostrych białaczkach szpikowych (w poniżej 1% przypadków)[69][70].
Zespół Williamsa
Wywołany jest delecją materiału genetycznego z regionu q11.23 chromosomu 7. Usunięty region obejmuje więcej niż 25 genów[71]. Szczególną cechą wyglądu osób dotkniętych syndromem Williamsa jest charakterystyczna dysmorfia twarzy – tzw. „twarz elfa”. Osoby dotknięte zespołem Williamsa mogą mieć intelekt mieszczący się w szerokich granicach IQ od 20 do 106. Ludzie dotknięci zespołem Williamsa charakteryzują się tzw. „mową koktajlową”[72] – zdolności językowe są najczęściej obniżone w zakresie semantyki, morfologii, fonologii, ale nie słownictwa[73]. Jest to łatwo zauważalne dla otoczenia, z powodu bogatego słownictwa używanemu przez dzieci dotkniętych tym zespołem. Prawdopodobnie wynika to z połączenia dobrej pamięci słuchowej i trudności z przetwarzaniem języka, co prowadzi do zapamiętywania języka w postaci gotowych zwrotów[74].
Zaburzenia w liczbie chromosomów płci
Wśród chorób genetycznych częste są również zaburzenia w liczbie chromosomów płci. Niektóre z nich, np. dodatkowy chromosom Y u mężczyzn (XYY), trisomia chromosomu X u kobiet (XXX), rzadko powodują istotniejsze nienormalności: kobiety (jedna na 1000) mają uwydatnione cechy płciowe i niską inteligencję, natomiast mężczyźni (również 1 na 1000) charakteryzują się wysokim wzrostem oraz bywają nadpobudliwi i infantylni.
Zespół Turnera

45,X0, w pozostałych 30% obecny był izochromosom X zawierający podwójne długie ramię – 46,X i(Xq)Jedną z przyczyn chorób genetycznych jest monosomia, aberracja chromosomowa polegająca na występowaniu jednego chromosomu X, zw. zespołem Turnera (dysgenazja gonadialna[40]), to jedna z najczęściej występujących chorób spowodowanych tą aberracją chromosomową[75]. U człowieka występuje 5% zygot, ale tylko jedna na 40 rozwija się dalej. Występuje u 1 na 2000 – 2500 urodzonych dziewczynek[76][77]. Osoby z tą chorobą posiadają na ciele liczne znamiona barwnikowe. Charakteryzują się również niższym wzrostem, szerokim karkiem i niedorozwojem drugorzędowych cech płciowych (niewykształcone piersi, brak owłosienia łonowego); są bezpłodne. Poza monosomią chromosomu X zespół Turnera może być też spowodowany strukturalnymi zmianami jednego chromosomu X, takimi jak: częściowa lub całkowita delecja krótkiego ramienia chromosomu X (delXp); całkowita delecja długiego ramienia chromosomu X (delXq); izochromosom długiego ramienia chromosomu X (i(Xq)); chromosom pierścieniowy (kolisty, ring-chromosome, r(X)); chromosom markerowy (46,X+m); mozaicyzm, czyli obecność więcej niż dwóch linii komórkowych u jednej osoby, najczęściej 45,X/46,XX i 45,X/46,XY. W zależności od wielkości zmian objawy kliniczne są zróżnicowane i nie wszystkie występują. W wypadku mozaicyzmu też może nie występować pełne spektrum objawów.
Niektórzy badacze sugerują, że "czysty" kariotyp 45,X warunkuje letalny zespół i płody o takim kariotypie są ronione przez matki[78][79][80]. Hipotezę tę potwierdzają badania kariotypu komórek innych niż limfocyty na obecność mozaicyzmu[81].
Zespół Klinefeltera
Inną aberracją chromosomową jest występowanie u mężczyzn dodatkowego chromosomu X (kariotyp 47,XXY)[82]; nie leczona powoduje występowanie tzw. zespołu Klinefeltera, który charakteryzuje nienormalne wydłużenie członów, brak lub ograniczony rozwój drugorzędowych cech płciowych oraz niepłodność spowodowana brakiem spermatogenezy. Występuje on w przybliżeniu u jednego mężczyzny na 1000[2]. Jest najczęstszą aneuploidią człowieka[82]. Przyczyną nieprawidłowej liczby chromosomów X w komórce jest nondysjunkcja, zachodząca albo w pierwszym bądź drugim podziale mejotycznym w gametogenezie, albo w podziale mitotycznym rozwijającej się zygoty[83]. Do charakterystycznych objawów należą: wysoki wzrost (ostateczny wzrost chorych to 179,2 ± 6,2 cm[82]), słabiej rozwinięte mięśnie, bardziej kobieca (gynoidalna) sylwetka, wynikająca z charakterystycznej budowy klatki piersiowej i miednicy, dłuższe niż przeciętnie kończyny górne i dolne, cechy dysmorficzne: pacjenci z kariotypem 47,XXY nie mają w zasadzie charakterystycznych cech dysmorficznych, które ułatwiałyby rozpoznanie w okresie przedpokwitaniowym. U około 40% mężczyzn XXY stwierdza się taurodontyzm (powiększone zęby trzonowe)[84]; dosyć częsta jest klinodaktylia, objawy radiologiczne: zmniejszenie kąta podstawy czaszki, pogłębienie tylnego dołu czaszkowego, nadmiernie upowietrznione zatoki klinowe, małe lub średnich rozmiarów siodło tureckie z nadmiernie rozwiniętymi wyrostkami przednimi i tylnymi, zmniejszenie grubości żuchwy na wysokości jej kąta[85][86], obserwuje się zmniejszenie rozmiaru jąder, które dodatkowo mają nieprawidłowo twardą konsystencję; ich objętość po ukończeniu pokwitania zwykle nie przekracza 10 ml[87].
Trisomia chromosomu X
Kolejną nondysjunkcją chromosomów płci jest występowanie u kobiet dodatkowego chromosomu X(XXX). Budowa fizyczna zasadniczo bez zmian, jednak jest obniżona płodność. Uczeni nie są zgodni co do zdolności umysłowych. Pojawia się w przybliżeniu u jednej kobiety na 1000[2].
Zespół Swyera
To choroba genetyczna występująca u kobiet. Kobiety z tą chorobą mają kariotyp typowy dla mężczyzny (XY), jednak część chromosomu Y kluczowa dla rozwoju płci została utracona lub jest nieczynna wskutek mutacji. Do objawów klinicznych zalicza się bezpłodność: gonady obecne w jamie brzusznej nie funkcjonują. Drugorzędowe żeńskie cechy płciowe nie rozwijają się z powodu braku hormonów (estrogenów). Inteligencja niezaburzona[2][88].
Choroby jednogenowe
Choroby z tej grupy dziedziczą się zwykle zgodnie z prawami Mendla, a mutacje je powodujące znajdują się w pojedynczych genach[89]. Ponadto są one głównie związane z wystąpieniem mutacji w genach zlokalizowanych w DNA jądrowym. W zależności od tego, w jakim chromosomie zaszła mutacja (autosomie czy heterosomie) wyróżnia się choroby autosomalne i sprzężone z płcią[90][91]. Ze względu na charakter dziedziczonej cechy, choroby genetyczne jednogenowe dzieli się na dziedziczone dominująco i recesywnie[92]. Wyjątek stanowią choroby mitochondrialne, które dziedziczą się pozajądrowo, gdyż ich etiopatogeneza związana jest z mutacjami w DNA mitochondrialnym, niezależnym od DNA jądrowego. Ponad 4000 chorób człowieka jest spowodowanych przez mutacje pojedynczych genów (prawdopodobnie wiele recesywnych jeszcze nie zostało poznanych)[93].
Autosomalne dominujące
Tylko jedna zmutowana wersja genu jest potrzebna do ujawnienia się cechy (choroby). Zwykle osoba dotknięta chorobą ma jednego chorego rodzica[94]. Dziedziczenie tych chorób charakteryzuje się występowaniem osób o nieprawidłowym fenotypie „pionowo” w rodowodzie, czyli w kilku kolejnych pokoleniach. Niekiedy w poszczególnych rodzinach stwierdza się zjawisko antycypacji, tj. występowania w kolejnych pokoleniach bardziej nasilonych objawów choroby, albo też ich wystąpienie we wcześniejszym wieku. Wielu naukowców uważa jednak, że atycypacja jest zjawiskiem jedynie statystycznym[95]. W większości przypadków choroby dominujące są letalne w stanie homozygotycznym, toteż prawdopodobieństwo urodzenia się zdrowego dziecka rodziców heterozygotycznych wynosi 2:1, zaś gdy tylko jeden z rodziców jest chory, szansa ta wynosić będzie 50%[95]. Charakterystyczne cechy, po których należy podejrzewać autosomalny dominujący typ dziedziczenia[96]:
- choroba występuje we wszystkich pokoleniach,
- choroba występuje z równą częstością u obu płci i przez osoby obu płci jest przekazywana,
- dotknięta osoba przekazuje cechę połowie swego potomstwa,
- członkowie rodziny nie mający fenotypowych cech choroby mają zdrowe dzieci,
- dwie osoby z podobnymi miernymi nieprawidłowościami fenotypu mają dzieci z dużymi wadami (25%, przy założeniu, że układ homozygotyczny nie jest letalny), podobne do rodziców (50%) i prawidłowe (25%), to można podejrzewać, że rodzice są heterozygotami mającymi cechę dominującą.
Przy dziedziczeniu autosomalnym dominującym zdarza się, że gen ma ograniczoną penetrację, to znaczy, że choć potrzebna jest tylko jedna zmutowana kopia, to nie wszystkie osoby, które ją dziedziczą, będą miały pełny obraz kliniczny lub czy w ogóle będą chore[97]. Tego typu choroby są spowodowane najczęściej powtórzeniami trinukleotydów[d][98].
Achondroplazja
Inna nazwa: chondrodystrofia.
To choroba dziedziczona autosomalnie dominująco, prowadząca do nieprawidłowego kostnienia śródchrzęstnego, co powoduje zaburzenie rozwoju pewnych kości w organizmie i karłowatość[99]. Przyczyną schorzenia jest mutacja genu zlokalizowanego na krótkim ramieniu chromosomu 4 (4p16.3). W postaci homozygotycznej letalna na poziomie zarodkowym – upośledzenie w życiu płodowym. W ponad 99% przypadków tej choroby dochodzi do różnego typu mutacji receptora dla czynnika wzrostu fibroblastów (fibroblast growth factor receptor 3, FGFR3). Jest to zwykle mutacja punktowa, polegająca na substytucji Gly380Arg[100]. Częstość występowania w populacji wynosi 1:25000[99]. Choroba ta w 80% przypadków powstaje de novo. Częstość występowania tej mutacji wzrasta w przypadku ojca w wieku powyżej 35 lat[101]. Do objawów należą: karłowatość, skrócenie długości kończyn, szczególnie części proksymalnych, prawidłowa długość tułowia, nadmierna lordoza odcinka lędźwiowego kręgosłupa zwężenie kanału kręgowego w odcinku lędźwiowym, małe sześcienne trzony kręgów, szpotawe kolana, dłoń kształtu trójzębnego, wydatne czoło, zapadnięta nasada nosa, mikromelia (małe dłonie)[102][103].
Choroba Brugadów

Dziedziczona autosomalnie dominująco, charakteryzuje się skłonnością do występowania napadowych zaburzeń rytmu o typie częstoskurczu komorowego, który może ustąpić samoistnie lub przekształcić się w migotanie komór i doprowadzić do nagłego zatrzymania krążenia i śmierci. Podłoże molekularne stanowi mutacja w genie SCN5A kodującym kanał sodowy[104][105]. Wskutek tego dochodzi do skrócenia czasu trwania potencjału czynnościowego, zwłaszcza fazy 2, co powoduje zmiany repolaryzacji i wystąpienia zjawiska reentry[106][107].
Miotonia wrodzona Thomsena
To choroba mięśni szkieletowych o podłożu leżą mutacyjnym w genie CLCN1 znajdującym się na chromosomie 7q35, charakteryzujące się utrudnieniem wykonywania ruchu po dłuższym odpoczynku. Poprawa następuje po wykonaniu pierwszych kilku ruchów (warm up). Najczęściej zajęte schorzeniem są mięśnie dłoni, kończyn dolnych, żwaczy i powiek. Diagnostyka miotonii Thomsena opiera się na analizie rodowodu chorego i badaniu EMG, w którym obecność ciągów miotonicznych potwierdza chorobę[108].
Pęcherzowe oddzielanie się naskórka
Grupa genodermatoz, których wspólną cechą jest występowanie pęcherzy wskutek urazów mechanicznych. Wyróżnia się trzy główne grupy, w zależności od miejsca tworzenia się pęcherza: w obrębie naskórka (EB simplex), w obrębie błony podstawnej (EB junctionalis), poniżej błony podstawnej, w skórze właściwej (EB epidermolytica).
Grupa epidermolysis bullosa simplex
EB Webera-Cockayne'a
Dziedziczona autosomalnie dominująco[109]. Etiopatogeneza: mutacja genu KRT14 kodującego keratynę 5 i 14 oraz defektem enzymów proteolitycznych[110]. Obraz kliniczny: zmiany występują najczęściej na stopach, rzadziej na dłoniach, pęcherze zwykle pojawiają się u dzieci w wieku około 18 miesięcy, gdy wykazują dużą aktywność ruchową. Zmiany mogą się ujawnić w późniejszym wieku, w późnym dzieciństwie albo u młodych dorosłych. Czynniki nasilające tworzenie pęcherzy to duża wilgotność, wzmożone pocenie się. Błony śluzowe i płytki paznokciowe nie są zajęte[111].
EB Dowlinga-Meary (EB herpetiformis)
Od innych chorób z grupy epidermolysis bullosa simplex różni się ciężkim przebiegiem i charakterystycznym obrazem w mikroskopie elektronowym (cytoplazmatyczne "kępki" tonofilamentów). Tak jak typ Koebnera i typ Webera-Cockayne'a, typ Dowlinga-Meary EBS wiąże się z mutacjami w genach KRT5 (region 12q13.13) i KRT14 (region 17q21.2)[112]. Objawy[113][114]: uogólnione tworzenie pęcherzy o opryszczkowatym (zgrupowanym) układzie (stąd inna nazwa schorzenia, epidermolysis bullosa simplex herpetiformis), surowicze i krwotoczne pęcherze tworzą się w każdej lokalizacji, przede wszystkim jednak na stopach i podeszwach, dookoła ust, na karku i szyi. Czynnikami zaostrzającymi przebieg choroby są: gorączka, pora roku (miesiące letnie), a także wiek (zmiany nasilają się z wiekiem).
EB wariant Koebnera
Etiopatogeneza: mutacje w genach keratyny 5 i 14 (KRT4, KRT15)[110]. Ponieważ mutacje w tych samych genach odpowiadają za wystąpienie cech fenotypowych EBS typu Webera-Cockayne'a i typu Dowlinga-Meary, często cechy tych trzech chorób nakładają się na siebie. Zdarza się, że w obrębie jednej rodziny diagnozowano przypadki dwóch różnych typów EBS. Objawy: zmiany są hiperkeratotyczne, pęcherzowe, czasem pęcherze są krwotoczne, niekiedy tworzą się prosaki, mogą wystąpić zaburzenia pigmentacji (hipo- lub hiperpigmentacja) tak jak w odmianie Dowlinga-Meary, czasem zajęte są paznokcie i błony śluzowe[115].
Grupa epidermolysis bullosa junctionalis
EB Herlitza
Postać śmiertelna, rzadka, dziedziczona autosomalnie recesywnie, spowodowana mutacją w jednym z genów kodujących trzy polipeptydy lamininy 5: α-3 (gen LAMA3), β-3 (gen LAMB3), albo γ-2 (gen LAMC2)[116]. Obraz kliniczny: występowanie licznych pęcherzy, które łatwo pękają, pozostawiając rozległe nadżerki w obrębie całej skóry i błon śluzowych, również dróg oddechowych (już wewnątrzmacicznie następuje tworzenie pęcherzy i nadżerek, tak że dziecko rodzi się z rozległymi ubytkami naskórka). Ręce i stopy są zwykle relatywnie najmniej dotknięte przez proces chorobowy. Nigdy nie występuje bliznowacenie, syndaktylia, nie tworzą się prosaki. W wieku około 6 miesięcy wokół ust bądź nosa tworzy się patognomoniczny, niegojący się strup[117][118].
EB z atrezją odźwiernika
Bardzo rzadka choroba, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genach ITGB4 i ITGA6, która skutkuje obniżoną ekspresją kodowanych przez te geny α6 i (lub) β4 integryny[119][120]. Objawy: zmianom skórnym z reguły towarzyszy wrodzona atrezja odźwiernika (rzadziej atrezja przełyku lub dwunastnicy), dystrofia paznokci i anomalie w zakresie uzębienia, takie jak hipoplazja szkliwa. Tworzenie pęcherzy jest uogólnione, rokowanie bardzo złe, mimo chirurgicznej interwencji; mutacja często jest letalna[121][122].
Grupa epidermolysis bullosa dystrophica
EB dystroficzna, postać Pasiniego
Dziedziczona jest w sposób autosomalny dominujący. Obraz kliniczny: pęcherze ustępują z pozostawieniem drobnych, białawych wykwitów grudkowych, umiejscowionych głównie na tułowiu w okolicy krzyżowej, zajęte są śluzówka jamy ustnej i zęby, paznokcie mogą być dystroficzne. W starszym wieku choroba może złagodzić swój przebieg[110][123].
EB dystroficzna, postać Cockayne'a-Toureine'a
Dziedziczona jest w sposób autosomalny dominujący. Wykwity głównie na kończynach, śluzówka i zęby zajęte w minimalnym stopniu[124].
EB Hallopeau-Siemensa
Podłoże molekularne: mutacja w genie kodującym kolagen typu VII (COL7A1). Objawy: charakterystyczne jest uogólnione tworzenie pęcherzy w momencie urodzenia lub we wczesnym niemowlęctwie, rozległe bliznowacenie, zmiany w obrębie skóry kończyn, pseudosyndaktylia dłoni i stóp, niekiedy są zajęte paznokcie i zęby, śluzówka przełyku (czego skutkiem jest zwężenie przełyku), stenoza cewki moczowej, odbytu, stulejka, bliznowacenie rogówki lub spojówki. W EB Hallopeau-Siemensa wyraźnie zwiększone jest ryzyko wystąpienia raka kolczystokomórkowego skóry; nowotwór rozwija się na podłożu blizn[125].
Rodzinna polipowatość gruczolakowata

Inne nazwy: ang. familial adenomatous polyposis, FAP.
Choroba ta charakteryzująca się licznymi polipami gruczolakowatymi jelita grubego, powstającymi w 2. dekadzie życia. U nieleczonych chorych niemal we wszystkich przypadkach rozwija się rak jelita grubego. Etiopatogenezę na poziomie molekularnym stanowi mutacja antyonkogenu APC (adenomatous poliposis coli gene) w locus 5q21-22. Mutacje te prowadzą do powstania nieprawidłowych, skróconych, białek[126][127]. W patomorfologii charakterystyczne są polipy gruczolakowate, zarówno cewkowe, kosmkowe jak i mieszane, makroskopowo przypominające powiększone grudki chłonne okrężnicy, co może być przyczyną nierozpoznania choroby w badaniu kolonoskopowym. W przebiegu choroby występują setki polipów gruczolakowatych różnej wielkości w okrężnicy i odbytnicy. U połowy pacjentów z FAP polipy są obecne w wieku 15 lat, a w wieku 35 lat u 95%[128]. Oprócz tego może współistnieć polipowatość dna żołądka (ang. fundic gland polyps, FGP), polipy dwunastnicy i gruczolaki jelita cienkiego, na ich podłożu mogą rozwijać się nowotwory złośliwe, z których najczęściej występującym w zespole polipowatości gruczolakowatej jest rak jelita grubego, którego ryzyko wynosi niemal 100%[129]. U nieleczonych chorych rak jelita grubego powstaje przeciętnie w wieku 35 lat, a rzadko przed 20. rokiem życia[128]. Do innych nowotworów często występujących w przebiegu choroby należą: rak tarczycy[130][131], gruczolakorak jelita cienkiego[132][133], hepatoblastoma[134][135][136][135][134][137], rak trzustki[130][138][135][139], rak żołądka[130][140][141], rak nadnerczy[135], guzy mózgu – najczęstszym guzem OUN związany z FAP jest rdzeniak, stanowi około 80% guzów związanych z zespołem FAP, ryzyko zachorowania w ciągu życia wynosi około 1%[130][135]. W obrazie klinicznym mogą być widoczne zróżnicowane objawy pozajelitowe, takie jak[135]: kostniaki – występują u 20% chorych, zwykle w obrębie żuchwy i czaszki; nieprawidłowości uzębienia – występują u 17% chorych, nieprawidłowości obejmują zęby nadliczbowe, wrodzone braki zębów, torbiele zębowe, zębiaki; guzy desmoidalne – miejscowo złośliwy guz najczęściej zlokalizowany w jamie brzusznej, tylko 10% z nich znajduje się poza jamą brzuszną. Często rosną do ogromnych rozmiarów, stanowią duże zagrożenie dla sąsiednich struktur; torbiele epidermoidalne – nie wykazują potencjału złośliwego, stanowią problem kosmetyczny[130]; wrodzona hipertrofia barwnikowa siatkówki. Odmiany FAP: zespół Gardnera - w przebiegu choroby występują setki, a nawet tysiące polipów jelita grubego, którym towarzyszy powstawanie guzów mezodermalnych o typie kostniaków, guzów desmoidalnych, torbieli naskórkowych oraz przerostu nabłonka barwnikowego siatkówki (CHRPE, ang. Congenital Hypertrophy of the Retinal Pigment Epithelium); zespół Turcota - współwystępują guzy mózgu i polipy okrężnicy; poronna postać FAP - mniej agresywny wariant FAP, w jego przebiegu powstaje mniej polipów (10-100) i rozwijają się one w późniejszym wieku[142]. Ryzyko nowotworu złośliwego jest mniejsze i nie przekracza 70%[128].
Zespół Costello

Inne nazwy: łac. syndroma Costello, ang. Costello syndrome, faciocutaneoskeletal syndrome, FCS syndrome.
To choroba genetyczna i zespół wad wrodzonych, dziedzicząca się autosomalnie dominująco, która spowodowana jest uszkodzeniem genu HRAS zlokalizowanego na ramieniu krótkim chromosomu 11, w regionie p15[144]. GTP-aza kodowana przez gen HRAS bierze udział w szlaku Ras–MAPK[145]. Zespół Costello jest zespołem genetycznym dziedziczonym autosomalnie dominująco, z pełną penetracją genu[146][147][148]. Częstość występowania: 1 na 24 000 000 żywych urodzeń[146]. Charakterystyczne cechy fenotypowe osoby chorej: niedobór wzrostu, opóźniony rozwój psychoruchowy, nadmierna wiotkość małych stawów, hiperpigmentacja skóry, charakterystyczny wygląd twarzy oraz niepełnosprawność intelektualna[149]. Wśród objawów występują liczne zaburzenia kardiologiczne (np. zwężenie drogi odpływu prawej komory), gastroenterologiczne (np. przerostowe zwężenie odźwiernika), ortopedyczne (np. deformacja klatki piersiowej) i neurologiczne (np. napady padaczkowe)[147].
Zespół Crouzona
Zespół Crouzona, inaczej dysostoza czaszkowo-twarzowa (łac. dysostosis craniofacialis) to choroba genetyczna o najprawdopodobniej autosomalnym dominującym typie dziedziczenia[150]. Spowodowana jest mutacją w genie FGFR2 kodującym receptor czynnika wzrostu fibroblastów (ang. fibroblast growth factor receptor-2) w locus 10q26[151]. Objawia się licznymi deformacjami twarzy, m.in.: „gotyckim” podniebieniem, nisko osadzonymi uszami, hiperteloryzmem, wytrzeszczem gałek ocznych (łac. proptosis) prowadzącym do zaniku nerwu wzrokowego, hipoplazją szczęki (pozorny prognatyzm) i nieprawidłowym uzębieniem.
Zespół Lyncha
To dziedziczny rak jelita grubego niezwiązany z polipowatością[152] (ang. hereditary non-polyposis colorectal cancer, HNPCC), stanowiący około 1-3% wszystkich raków jelita grubego[153][154]. Średni wiek wystąpienia nowotworu złośliwego jelita grubego wynosi około 44 lata[155]. Zespół wiąże się z 80% ryzykiem zachorowania na raka jelita grubego[156]. Najczęściej stwierdza się mutacje genów hMSH2((human mutS homolog 2) w locus 2p21-22) i hMLH1 ((human mutL homolog 1) w locus 3p21.3-23)[157]. Dziedziczenie zespołu jest autosomalne dominujące. W przeważającej części (około 70% przypadków) rak występuje w prawej połowie okrężnicy[158][159]. Występują dwie różniące się od siebie postacie choroby: zespół Lyncha I – rak dotyczy tylko jelita grubego; zespół Lyncha II – z rakiem jelita grubego współistnieją nowotwory złośliwe trzonu macicy, jajnika, żołądka, jelita cienkiego, nerek, moczowodu, a rzadziej skóry, dróg żółciowych i guzy centralnego układu nerwowego[160][161][162][163].
Zespół Morgagniego-Stewarta-Morela
Inne nazwy: ang. Morgagni-Stewart-Morel syndrome, Morgagni's trias[164], łac. hyperostosis frontalis interna.
Jest to rzadka choroba genetyczna o nie do końca poznanej etiologii i etiopatogenezie, dziedziczona autosomalnie dominująco[165][166], związana z przerostem i nadreaktywnością kory nadnerczy wskutek nadmiernego wydzielania ACTH. Sugerowano również związek objawów z podwyższonymi poziomami prolaktyny, ponieważ w populacji kobiet z mlekotokiem na tym tle hyperostosis frontalis występowała w 43% przypadków[167]. Na obraz kliniczny składają się objawy, takie jak: otyłość, przerost wewnętrznej powierzchni kości czołowej (hyperostosis frontalis interna)[168], wirylizm i hirsutyzm[169][170], brak miesiączki[171], zaburzenia tolerancji glukozy, cukrzyca, polifagia, polidypsja, poliuria[172][173]. Objawy podmiotowe stanowią: zmęczenie, senność, zaburzenia widzenia, zawroty i bóle głowy, dzwonienie w uszach, zaburzenia węchu. Mogą występować zaburzenia psychiczne, spowodowane przerostem kości czołowych i rozpoznawane jako zespół czołowy[174].
Zespół Nagera
Dziedziczona autosomalnie dominująco choroba z grupy dyzostoz kończynowo-twarzowych[175], wynik zaburzeń kształtowania się drugiej i trzeciej kieszonki skrzelowej oraz zawiązków kończyn podczas rozwoju embrionalnego[175]. Spowodowana jest uszkodzeniem genu SF3B4 znajdującego się na długim ramieniu chromosomu 1, w regionie q21[176]. Gen SF3B4 koduje nukleoproteinę U2 splicesomu[176], który bierze udział w regulacji genów wczesnej embriogenezy poprzez wycinanie sekwencji niekodujących (splicing) z prekursorowego mRNA oraz w specjalizacji tkanek[176]. Obraz kliniczny stanowią objawy, takie jak: zaburzenia rozwoju twarzoczaszki (hipoplazja łuków jarzmowych, mikrognacja, małe i obrócone ku tyłowi małżowiny uszne) oraz brak kciuków, niedorozwój krtani, głuchota, niedorozwój przewodów słuchowych zewnętrznych, bez objawów niepełnosprawności intelektualnej[176].
Zespół Tourette'a
Jest to choroba dziedziczona w sposób autosomalny dominujący. Skutkiem mutacji są zmiany w niezidentyfikowanych genach. Część przypadków można wyjaśnić zaburzeniami w syntezie histaminy[177][178]. Objawami klinicznymi są tiki (w tym wokalne) i zachowania obsesyjne, pojawia się zjawisko echolalii. Występuje w nim szereg neurologiczno-psychicznych objawów o niewyjaśnionym podłożu[179]. Choroba pojawia się przed 18 rokiem życia i nasila z wiekiem. Nasilenie objawów bywa bardzo różne (wiele nie wymaga leczenia).
Autosomalne recesywne
Większość z opisanych dotychczas chorób jest dziedziczona autosomalnie recesywnie[91], choć jeszcze wiele z nich prawdopodobnie nie zostało poznanych[89]. Wiąże się to z tym, że aby cecha warunkowana przez allel recesywny się ujawniła, obie wersje genu muszą być wadliwe (zmutowane). Dotknięci chorobą mają zwykle zdrowych rodziców, którzy posiadają po jednym zmutowanym allelu (i są określani jako nosiciele)[180]. Jeśli jest dwoje zdrowych rodziców, z których każdy ma jedną kopię zmutowanego genu, to ryzyko posiadania dzieci dotkniętych zaburzeniem wynosi 25% z każdej ciążym[181][182].
Alfa-mannozydoza
To lizosomalna choroba spichrzeniowa[183], spowodowana niedoborem enzymu lizosomalnego, α-mannozydazy, dziedziczona autosomalnie recesywnie[184]. Podłoże molekularne stanowi mutacja w genie białka enzymu MAN2B1 w locus 19p13.2-q12). Rozpoznanie stawiane jest na podstawie pomiaru aktywności enzymu w leukocytach albo innych komórkach jądrzastych bądź testy genetyczne[185]. Możliwe jest rozpoznanie prenatalne[186]. Do objawów klinicznych należą: pierwotny niedobór odporności, nieprawidłowości szkieletu (np. stopa końsko-szpotawa) i cechami dysmorficznymi twarzy, upośledzenie słuchu, makroglosja i opóźnienie umysłowe. Chorobę opisał Ockerman w 1967 roku[187][188].
Alkaptonuria
Rzadka, genetycznie uwarunkowana choroba polegająca na enzymatycznym defekcie metabolicznym w szlaku przemian aminokwasów aromatycznych: tyrozyny i fenyloalaniny[189]. Alkaptonuria jest dziedziczona w sposób autosomalny recesywny i charakteryzuje się wydalaniem z moczem dużych ilości kwasu homogentyzynowego (ciemniejącego na powietrzu[190]), niebieskawo-czarnym zabarwieniem tkanki łącznej (ochronoza)[191] oraz zmianami zwyrodnieniowymi stawów i kręgosłupa. Mutacje dotyczą genu oksydazy kwasu homogentyzynowego (HGD), zlokalizowanego na chromosomie 3 (3q13.33)[192][193].
Analgezja wrodzona
Rzadka choroba spowodowana mutacją w genie SCN9A w locus 2q24[194], który odpowiada za przekazywanie pomiędzy komórkami nerwowymi impulsów bólowych do mózgu. Dziedziczona jest autosomalnie recesywnie[195]. Chorzy są zdolni do odbioru bodźców pozabólowych: dotyku, ciepła, zimna, łaskotania. Nie odczuwają jednak żadnych czynników bólowych, co może stwarzać zagrożenie życia[196]. Dzieci dotknięte chorobą mogą osiągnąć wiek dojrzały, ale ich przewidywana długość życia jest dużo krótsza od reszty populacji z uwagi na brak reakcji na stany zagrażające zdrowiu i życiu, np.: oparzenie, skaleczenie, złamanie nogi.
Anemia sierpowata
Anemia sierpowata to rodzaj wrodzonej anemii (niedokrwistości) polegającej na wadzie budowy hemoglobiny[197]. Mutacja punktowa w genie β-globiny powoduje zmianę pojedynczego aminokwasu w sekwencji białka (z kwasu glutaminowego na walinę). Hemoglobinę z taką mutacją określa się jako hemoglobinę S (HbS) w przeciwieństwie do normalnej hemoglobiny A (HbA) u dorosłych. Choroba dziedziczy się w sposób autosomalny (nie jest sprzężona z płcią) i częściowo recesywny – nosiciele tylko jednej kopii wadliwego genu (heterozygoty) zwykle nie mają objawów klinicznych, choć ich erytrocyty zawierają ok. 40% HbS[198]. Heterozygoty są również w dużym stopniu odporne na malarię. Zjawisko takie nazywa się przewagą heterozygot lub naddominacją. Naddominacja powoduje, że na terenach występowania malarii mutacja powodująca anemię sierpowatą utrzymuje się w populacji[2][199].
Choroba Andersen
Rzadka, śmiertelna (zgon następuje przeważnie w wieku 3-5 lat z powodu niewydolności wątroby) choroba genetyczna, dziedziczona autosomalnie recesywnie, spowodowana mutacją w genie GBE1, znajdującym się na chromosomie 3p12, która skutkuje defektem enzymu rozgałęziającego glikogen. Powstaje glikogen o nienormalnie długich łańcuchach podobnych do tych jakie znajdują się w amylopektynie. Efektem tego jest nagromadzenie nieprawidłowego strukturalnie glikogenu w narządach, głównie w wątrobie i mięśniach (mimo na ogół prawidłowej jego zawartości w wątrobie). Do objawów należą: hepatomegalia i splenomegalia, marskość wątroby, niewydolność wątroby, hipotonia mięśniowa, upośledzenie wzrostu, niewydolność serca[200][201].
Leukodystrofia gąbczasta (inna nazwa) jest dziedziczoną w sposób autosomalny recesywny, zwyrodnieniową chorobą układu nerwowego z początkiem w okresie prenatalnym. Istotą choroby jest zwyrodnienie istoty białej i szarej mózgu jako skutek niedoboru N-acetyloaspartazy, spowodowanego mutacją (najczęstsza mutacją jest tranzycja A>C, skutkująca zamianą kwasu glutaminowego przez alaninę w pozycji 285 białka enzymu. Ponieważ zmiana dotyczy centrum aktywnego dochodzi do całkowitego zablokowania aktywności enzymu) w kodującym ten enzym genie ASPA w locus 17pter-p13[202]. Zwyrodnienie gąbczaste wyodrębniono jako osobną jednostkę chorobową w 1949 roku, a pierwszy opis choroby pozostawiła Myrtelle Canavan w 1931[203]. W zależności od postaci choroby wyróżnia się następujące objawy: postać wrodzona i dziecięca – wielkogłowie, zespół wiotkiego dziecka, opóźnienie rozwoju motorycznego i umysłowego, napady padaczkowe. W dalszym etapie dochodzi do niedowładu spastycznego i zespołu opuszkowego co prowadzi do śmierci w ciągu kilku lat; postać młodzieńcza i dorosłych – otępienie, objawy móżdżkowe, zwyrodnienie barwnikowe siatkówki, obraz choroby jest mniej charakterystyczny. Mikroskopowo obserwuje się m.in.: zmiany w komórkach Purkiniego móżdżku i w jądrze zębatym, demielinizacja w obrębie zmian gąbczastych i poza nimi, aksony zazwyczaj zachowane, brak produktów rozpadu mieliny, w korze mózgu następuje rozplem astrogleju[204]. Dla patomorfologii charakterystyczny jest obraz makroskopowy: odpowiednio do klinicznie widocznego wielkogłowia mózg jest duży i ciężki (czasem nawet o 80% normy), jednak wraz z czasem trwania choroby ulega on zmniejszeniu[205][206][207].
Choroba Coriego
To choroba metaboliczna, dziedziczona w sposób autosomalny recesywny, spowodowana niedoborem amylo-1,6-glukozydazy (jednej części układu enzymatycznego glikogenu rozkładającej łańcuchy boczne)[208][209]. Przebieg kliniczny tej choroby jest podobny do glikogenozy typu I, ale łagodniejszy. Do objawów należy hepatomegalia, która jest obecna jest u małych dzieci z tą chorobą i czasami zmniejsza się, znika z wiekiem. Niedobór ten prowadzi do nadmiernego odkładania nieprawidłowego glikogenu w mięśniach, wątrobie a także w sercu. Zostało zidentyfikowanych sześć podgrup, z których podgrupy typu IIIa i IIIb są najczęstsze[210]. Szacuje się, ze w Stanach Zjednoczonych choroba występuje z częstością 1/100 000 żywych urodzeń[211].
Choroba Gauchera
Lizosomalna choroba spichrzeniowa, dziedzicząca się w sposób autosomalny recesywny, spowodowana mutacją w genie GBA kodującym białko enzymu glukocerebrozydazy[212]. Wyróżnia się kilka postaci klinicznych choroby: typ 1 nieneuronopatyczny o przewlekłym przebiegu (szacunkowo 1 przypadek na 50.000 urodzeń)[213], typ 2 ostry neuronopatyczny niemowlęcy (szacunkowo 1 przypadek na 100.000 urodzeń)[214], typ 3 podostry neuronopatyczny (szacunkowo 1 przypadek na 100.000 urodzeń)[215].
Choroba Hersa
Podobnie jak większość chorób jednogenowych dziedziczona w sposób autosomalny recesywny. Spowodowana jest mutacją w genie PYGL znajdującym się na chromosomie 14. Aberracja skutkuje brakiem fosforylazy glikogenowej (wątrobowej). Niedobór ten prowadzi do nadmiernego odkładania glikogenu w wątrobie (przy prawidłowej strukturze narządu). Objawami, które najczęściej występują są: hepatomegalia, hipoglikemia, hiperlipidemia[216].
Choroba McArdle'a
Najczęstszą mutacją będącą podłożem molekularnym tej rzadkiej choroby jest występująca w populacji białej (ang. Caucasian population) tranzycja cytozyny w tyminę (p.R50X) powodująca przedwczesną terminację translacji[217]. Drugą, pod względem częstości występowania, jest mutacja p.G205S skutkująca wytworzeniem nieaktywnego enzymu[218][219]. Dziedziczona jest w sposób autosomalny recesywny. Mutacja skutkuje niedoborem enzymu – mięśniowej fosforylazy glikogenowej, który powoduje nadmierne gromadzenie się glikogenu w mięśniach[220][221][222]. Do objawów należą: bóle mięśniowe, mioglobinuria, podwyższenie poziomu enzymów mięśniowych we krwi po wysiłku[223].
Choroba Niemanna-Picka
Lizosomalna choroba spichrzeniowa heterogenna pod względem etiologicznym i klinicznym . Wyróżnia się kilka typów schorzenia[224][225][226][227], łączy je obecność tzw. komórek Niemanna-Picka (komórek piankowatych), spotykanych w miejscach gdzie typowo spotyka się makrofagi, czyli we wszystkich narządach układu siateczkowo-śródbłonkowego[228]. Materiałem spichrzanym jest sfingomielina. Jako pierwszy jednostkę chorobową opisał Albert Niemann w 1914 roku[229].
Choroba Pompego
Jedyna z glikogenoz należąca do grupy lizosomalnych chorób spichrzeniowych. Podłoże molekularne stanowi mutacja w genie GAA w części chromosomu 17q25[230]. Skutkuje to brakiem enzymu – α-glukozydazy (kwaśnej maltazy). Efektem tego jest zaburzenie spichrzania glikogenu w organizmie, przy czym nie występują znaczące zaburzenia metabolizmu węglowodanów i epizody hipoglikemii. Niedobór ten powoduje zwiększone odkładanie glikogenu w wątrobie, mięśniach, sercu, komórkach glejowych, jądrach ruchowych pnia mózgu i rogach przednich rdzenia kręgowego. Występują trzy postacie choroby. Wspólnymi dla nich objawami są hipotonia i słabość mięśniowa, niewydolność serca i oddechowa[231][232][233][234][235].
Choroba Stargardta
Inne, często spotykane nazwy: dno żółto-plamiste ang. Stargardt's disease, STGD, łac. fundus flavimaculatus.
Choroba Stargardta jest najczęstszą postacią dziedzicznego zwyrodnienia plamki nieletnich, dziedziczona autosomalnie recesywnie, to ciężka forma MD, która rozpoczyna się w późnym dzieciństwie i prowadzi do całkowitej ślepoty. Schorzenie to objawowo podobne do związanego z wiekiem zwyrodnienia plamki żółtej, i występuje w przybliżeniu u 10000 dzieci[236][237]. Podłoże molekularne stanowi mutacja w genie ABCA4, rzadziej CNGB3 albo ELOVL4. W wyniku ekspresji ABCA4 wytwarzane jest białko zaangażowane w transportu energii do i z komórek fotoreceptorów w siatkówce. Mutacje w genie ABCA4 powodują wytwarzanie dysfunkcyjnego białka, które nie może wykonywać swojej funkcji transportowej. W wyniku degeneracji komórek fotoreceptorów następuje utrata wzroku. Niefunkcjonalnego białka ABCA4 prowadzi do akumulacji żółtej substancji tłuszczowej – lipofuscyny do gromadzenia się w siatkówce, materiał ten powoduje plamki, a ostatecznie utratę wzroku[236][238]. Chorobę jako pierwszy opisał berliński okulista Karl Stargardt w 1909 roku[239][240].
Choroba tangierska
Inne nazwy: choroba wyspy Tangier, rodzinny niedobór HDL, ang. Analphalipoproteinemia, TGD[241].
Choroba Tanger jest dziedziczona autosomalnie recesywnie, charakteryzuje się znacznie obniżonym poziomem w osoczu lipoprotein wysokiej gęstości (HDL), co powoduje nagromadzenie w tkankach estrów cholesterolu. Przyczynę stanowi mutacja w genie ABCA1 (ATP-binding cassette-1, 600046) na chromosomie 9q31[241][242].
Obraz kliniczny obejmuje bardzo wiele różnych objawów, należą do nich m.in.: żółto-pomarańczowy kolor migdałków, powiększenie wątroby, śledziony i węzłów chłonnych, hipertrójglicerydemia i nienormalne resztki chylomikronu, żółtaki, splenomegalia, zmętnienie rogówki[241]. Ten zespół chorobowy został odkryty na wyspie Tangier w pobliżu wybrzeży Wirginii.
Choroba Taruiego
Jest to bardzo rzadka choroba spichrzeniowa, której podłożem są mutacje w obrębie chromosomu 12p13, dziedziczona autosomalnie recesywnie. Bezpośrednią przyczyną choroby jest niedobór fosfofruktokinazy (w mięśniach prawie całkowity; w erytrocytach około 50% aktywności). Fosfofruktokinaza jest enzymem, który katalizuje konwersję fruktozo-6-fosforanu do fruktozo-1,6-difosforanu podczas glikolizy, toteż niedobór tego enzymu powoduje nadmierne nagromadzenie glikogenu w tkankach, w których występuje deficyt PFK. Objawy są podobne do tych jakie występują w chorobie McArdle’a (są to głównie bóle i skurcze mięśni, podwyższone stężenie enzymów mięśniowych po wysiłku, mioglobinuria). Występują trzy warianty choroby: wyjątkiem wariantu niemowlęcego, który szybko prowadzi do zgonu, pozostałe typy schorzenia przebiegają jedynie z niewielkim upośledzeniem komfortu życia[243][244][245].
Choroba Taya-Sachsa

To recesywna choroba z grupy chorób spichrzeniowych[246], spowodowana mutacją punktową (najczęstszy typ mutacji to insercja czterech par zasad w eksonie 11 lub mutacja miejsca splicingowego w intronie 12), która powoduje brak w lizosomach komórek nerwowych enzymu heksozaminidazy A rozkładającego gangliozydy, przez co odkładają się one w lizosomach. W związku z tym, niemowlę stopniowo traci nabyte umiejętności ruchowe, przestaje reagować na bodźce z otoczenia i ślepnie[247]. Najczęściej śmierć następuje ok. 2-5 roku życia na skutek wzrostu masy mózgu o ok. 50%. Jest to jednak jedna z najrzadszych chorób – występuje głównie we wschodnioeuropejskiej populacji Żydów aszkenazyjskich[248].
Choroba Urbacha-Wiethego
Przyczyną jest mutacja z utratą funkcji w genie ECM1, kodującym białko macierzy pozakomórkowej[249], prowadzi ona do nieprawidłowości w budowie skóry i błon śluzowych, a także zwapnień w płatach skroniowych (w tym w ciałach migdałowatych)[250]. Na obraz kliniczny choroby składają się objawy: bliznowacenie skóry, grudki powiek, chrypka, padaczka, zaburzenia psychiczne. Opisano około 300 przypadków, z czego około 25% wśród potomków Holendrów i Niemców w Afryce Południowej[251][252].
Choroba Wilsona
Jest to choroba wywołana dziedziczoną autosomalnie recesywnie mutacją genu ATP7B na chromosomie 13 (13q14.3), kodującego białko ATPazę ATP7B[253].
Choroba Wilsona jest chorobą metabolizmu miedzi, która powoduje objawy uszkodzenia narządów wewnętrznych związane ze odkładaniem się tego pierwiastka w: wątrobie, mózgu, rogówce oka i nerkach. Największe znaczenie kliniczne ma uszkodzenie wątroby prowadzące do marskości tego narządu i różnego typu zaburzenia neuro-psychiatryczne[254].
Choroba van Buchema
Inne nazwy to: łac. hyperostosis corticalis generalisata, ang. van Buchem syndrome, VBCH[255].
Tą rzadką chorobę powoduje duża delecja 52 kpz około 35 kpz w dół od locus genu SOST, obejmującą tzw. SOST-specific regulatory element. Podobny fenotyp określany jako typ 2 choroby van Buchema spowodowany jest mutacjami genu LRP5 w locus 11q13.4. Dziedziczenie typu 1 jest autosomalne recesywne[255], w typie 2 autosomalne dominujące[256].
Do charakterystycznych objawów należą: zwiększenie grubości kości, często rozszerzona szczęka, ale także powiększenie czaszki, żeber, trzonu kości długich, jak i rurowych kości dłoni i stóp, powodując hiperostozę korową zwiększenie gęstości kości korowej czaszki. Kliniczne konsekwencje zwiększonej grubości czaszki to porażenie nerwu twarzowego, powodujące utratę słuchu, zaburzeń widzenia, ból neurologiczny, a także bardzo rzadko ślepotę wynikającą z atrofią i zanikiem nerwu wzrokowego oraz osteoskleroza, hiperfosfatemia. Anomalie kostne pojawiają się w pierwszej dekadzie życia i postępują z wiekiem[255][257].
Choroba von Gierkego
Jest to najczęstsza z glikogenoz, stosunkowo rzadka choroba genetyczna, dziedziczona w sposób autosomalny recesywny. Polega na braku glukozo-6-fosfatazy, enzymu niezbędnego w procesie glukoneogenezy (w GSD Ia, czyli jej właściwej postaci). Wśród objawów klinicznych dominuje hepatomegalia, hipoglikemia, ketonuria, okresowa neutropenia oraz kwasica mleczanowa[258]. Odmiana GSD Ib jest spowodowana brakiem translokazy glukozo-6-fosforanu. W wyniku tego niedoboru glukozo-6-fosforan nie może przedostać się do mikrosomów (w błonie mikrosomalnej znajduje się glukozo-6-fosfataza)[259][260][261].
Cystynoza

Inne nazwy: ang. Cystinosis, late-onset juvenile or adolescent nephropathic[262].
Cystynoza to choroba metaboliczna zaliczana do lizosomalnych chorób spichrzeniowych, w której przebiegu w lizosomach gromadzi się aminokwas cystyna. Dziedziczona jest w sposób autosomalny recesywny. Nefropatyczna cystynoza jest spowodowana mutacją w obrębie genu kodującego cystynę (606272), który znajduje się na chromosomie 17p13[263].
Wyróżnia się trzy typy choroby: niemowlęcy nefropatyczny ([OMIM#219800][264]); dziecięcy lub młodzieńczy nefropatyczny ([OMIM#219900][262]); nienefropatyczny dorosłych ([OMIM#219750][265]). Objawy obejmują: niedobór wzrostu w pierwszym roku życia, niechęć do ssania w wieku niemowlęcym, wydatne czoło, nieprawidłowości oczne: światłowstręt, retinopatia, obniżona ostrość wzroku, kryształki w rogówce, różaniec krzywiczy, hepatomegalia, splenomegalia, niewydolność trzustki, zespół Fanconiego, niewydolność nerek, kamica nerkowa (moczanowa i szczawianowa), opóźniony wiek kostny, kolana koślawe, jasne włosy i skóra, męczliwość mięśni, miopatia, trudności w połykaniu, prawidłowa inteligencja, atrofia mózgu, nawracające epizody kwasicy i odwodnień, poliuria i polidypsja[266][263][267]. Do nieprawidłowości biochemicznych należą: białkomocz, glukozuria przy normoglikemii, hiponatremia, hipokaliemia, niedobór karnityny, hipofosfatemia, krwinkomocz, aminoacyduria[262][268][263].
Dysplazja Lewandowsky'ego-Lutza
Autosomalnie recesywnie dziedziczona rzadka choroba skóry, której molekularną przyczyną są mutacje w obrębie jednego z dwóch sąsiadujących genów na chromosomie 17: EVER1 albo EVER2, które powstają w wyniku zainfekowania wirusem HPV (typy 5, 8 i 14) u osób o określonej predyspozycji genetycznej[269]. Na obraz kliniczny składają się objawy: wykwity w EV o charakterze płaskich grudek, plam rumieniowych lub przebarwień, występujące zwykle w dzieciństwie, utrzymujące i nasilające się całe życie; dotyczą najczęściej czoła, grzbietów rąk, przedramion i podudzi, stopniowo się uogólniają; włosy, błony śluzowe i paznokcie pozostają nie zajęte[270]. Zmiany skórne w EV stanowią punkt wyjścia raków skóry[271].
Dziedziczny rak piersi i jajnika
Do najczęstszych przyczyn dziedzicznych raków tych narządów należą mutacje w genach BRCA1 i BRCA2. Dziedziczny rak piersi i jajnika jest heterogenną etiologicznie i klinicznie grupą zespołów predyspozycji do nowotworów sutka i (lub) jajnika[272][273]. Diagnostyce poddaje się komórki jajowe lub komórki zarodka przed podaniem do jamy macicy (implantacją). Jest to badanie genetyczne związane z technikami wspomaganego rozrodu. Z diagnostyki preimplantacyjnej korzystają przede wszystkim pary poddające się zapłodnieniu In vitro. Badanie to pozwala na wyeliminowanie zarodków obciążonych wadami genetycznymi przed implantacją do jamy macicy[274].
Fenyloketonuria
Skutkiem mutacji jest niedobór lub brak enzymu hydroksylazy fenyloalaninowej w wątrobie, co uniemożliwia przekształcenie fenyloalaniny w tyrozynę. Objawy kliniczne to: nieprawidłowy rozwój umysłowy dziecka niedowłady, drgawki, niedobór melaniny (powstającej z tyrozyny) – jasny kolor skóry, włosów, oczu, „mysi” zapach potu i moczu, uszkodzenie układu nerwowego[275].
Galaktozemia
W wyniku mutacji powstaje defekt enzymu przekształcającego galaktozę (zawartą w mleku) w glukozę; gromadzi się galaktozo-1-fosforan. Z tego powodu u chorych dzieci karmionych mlekiem występują zmiany w układzie nerwowym, uszkodzenia nerek i wątroby. Częstym objawem są również zaburzenia funkcji jajników[275].
Hemochromatoza pierwotna

Hemochromatoza pierwotna jest dziedziczną chorobą metaboliczną spowodowaną mutacją genu HFE, który znajduje się w chromosomie 6. i odpowiada za kontrolę wchłaniania żelaza w komórkach nabłonka jelit. Efektem mutacji jest recesywny allel genu HFE, kodujący łańcuch polipeptydowy enzymu, w którym tyrozyna została zastąpiona przez cysteinę[276][277]. Skutkuje to zwiększonym pobieraniem żelaza z pokarmu i jego stopniowym gromadzeniem się w niektórych narządach (szczególnie w wątrobie), co może po dłuższym czasie wywołać uszkodzenia tych narządów. Choroba ujawnia się przeważnie dopiero pomiędzy 40. i 60. rokiem życia (częściej i we wcześniejszym okresie życia jest diagnozowana u mężczyzn)[278]. Do objawów należ: ciągłe uczucie zmęczenia, bóle stawów, dolegliwości żołądkowo-jelitowe, powiększenie wątroby (która ulega marskości drobnoguzkowej) oraz zaburzenia rytmu serca, obniżone libido[279], szarobrązowe zabarwienie skóry spowodowane uszkodzeniem kory nadnerczy złogami hemosyderyny, co wywołuje zmniejszenie wydzielania hormonów nadnerczowych, co z kolei powoduje nadmierne wydzielanie proopiomelanokortyny z przysadki, z której na drodze enzymatycznej powstają: ACTH, beta-endorfina, LPH i MSH (hormon melanotropowy). MSH stymuluje melanocyty do wytwarzania melaniny, co przyczynia się do zmiany zabarwienia skóry[280]. Inne nazwy to: hemochromatoza wrodzona, cukrzyca brunatna i cukrzyca brązowa (diabetes bronze)[281].
Ksantynuria
Inne nazwy: niedobór oksydazy ksantynowej.
Ksantynuria jest rzadką wrodzoną chorobą metaboliczną, spowodowaną izolowanym niedoborem oksydoreduktazy ksantynowej (XDH) lub połączonym niedoborem oksydazy ksantynowej i oksydazy aldehydowej (AO)[282], enzymów niezbędnych do przekształcania ksantyny do kwasu moczowego. Podłoże molekularne stanowi mutacja genu oksyreduktazy ksantynowej zlokalizowany jest na chromosomie 2p22-p23 [7-9][282]. W konsekwencji występują objawy: niezwykle wysokie stężenie ksantyny i hipoksantyny we krwi i moczu, co może prowadzić do powikłań, takich jak niewydolność nerek i powstanie ksantynowych kamieni nerkowych (złogi niecieniujące), jednego z najrzadszych rodzajów kamieni nerkowych; w surowicy i moczu kwas moczowy występuje w niskim stężeniu; na pieluszkach chorego dziecka może wystąpić ceglasty osad[283][284][285][286].
Mukowiscydoza
Inne nazwy: zwłóknienie torbielowate, łac. mucoviscidosis, ang. cystic fibrosis, CF, mucoviscoidosis, mucoviscidosis.
Jedną z częściej występujących chorób genetycznych jest mukowiscydoza, której podłoże molekularne stanowi mutacja (najczęściej ΔF508 lub F508del[287]) genu odpowiedzialnego za syntezę błonowego kanału chlorkowego (jest niezbędne do zajścia procesu regulacji transportu jonów chlorkowych przez błony cytoplazmatyczne) CFTR (cystic fibrosis transmembrane conductance regulator), umiejscowionego jest na długim ramieniu chromosomu 7[288][289]. Brak syntezy tego białka powoduje niewydolność układu oddechowego, polegająca na wytwarzaniu dużych ilości śluzu o dużej lepkości, co sprzyja powstawaniu infekcji (Pseudomonas aeruginosa i (lub) Staphylococcus aureus), niedrożność smółkowa (meconium ileus) jelit w okresie noworodkowym, spowodowana czopem gęstej smółki zatykającym jelito grube i jej ekwiwalenty: zespół korka smółkowego, nawracające epizody bólu brzucha z objawami niedrożności przepuszczającej określane jako dystalna niedrożność jelit (DIOS, distal intestinal obstruction syndrome). Towarzyszy mu również niewydolność wątroby (u ok. 85% pacjentów) i wszystkich narządów posiadających gruczoły śluzowe. Do innych objawów należeć mogą: palce pałeczkowate, acrodermatitis enteropathica, hiperprotrombinemianawracający obrzęk ślinianek przyusznych[290][291]. Częstotliwość występowania mukowiscydozy wynosi 1 do 2 tys., a częstość heterozygot (nosicieli) w populacji ocenia się na ok. 1 do 22 nosicieli[2]. Dziedziczona autosomalnie recesywnie[292][293].
Niedokrwistość Fanconiego
Jest to heterogenna genetycznie uwarunkowana grupa chorób, będących rzadko występującą postacią wrodzonej niedokrwistości aplastycznej, przebiegająca z malformacjami kośćca, wadami nerek i serca oraz predyspozycją do nowotworów, pierwszy raz opisana przez Guida Fanconiego w 1927 roku[294]. Do tej pory zidentyfikowano przynajmniej 13 genów, których mutacje mogą ją wywoływać. Typy choroby oznaczane są A, B, C, D1, D2, E, F, G, I, J, L, M i N. Typ B wywołany mutacjami w genie FANCB jest jedyną postacią niedziedziczoną w sposób autosomalny recesywny, lecz sprzężoną z chromosomem X[295]. Na obraz kliniczny składają się objawy takie jak: niski wzrost, nieprawidłowy kciuk (brak lub hipoplazja), mikrocefalia, przebarwienia skóry, charakterystyczny wygląd twarzy (szeroka nasada nosa, mikrognacja). Mogą również występować: nieprawidłowości kości ramiennej i kości nadgarstka, dysplazja stawów biodrowych, wady serca, niedorozwój gruczołów płciowych, wady układu moczowego, zaburzenia układu nerwowego, upośledzenie umysłowe, zaburzenia słuchu i wzroku[296].
Padaczka miokloniczna Unverrichta-Lundborga
Rzadkie schorzenie, którego przyczyną są mutacje w genie CSTB kodującym białko cystatyny B[297]; opisana po raz pierwszy przez Heinricha Unverrichta w 1891[298] i Lundborga w 1903 roku[299]. Praca Lundborga ma znaczenia dla historii genetyki klinicznej, ponieważ została użyta do analizy statystycznej mającej określić prawdziwość hipotezy o dziedziczeniu autosomalnym recesywnym, co zrobił Wilhelm Weinberg w 1912 roku[300].
Płód arlekin

Rzadka genodermatoza o dziedziczeniu autosomalnym recesywnym. Objawy charakteryzują się pokrywającymi całą powierzchnię skóry łuskami hiperkeratotycznego naskórka o kształcie rombów i wielokątów, o ułożeniu przywodzącym na myśl kostium arlekina – stąd nazwa jednostki chorobowej. Ponadto stwierdza się niską masę urodzeniową, erytrodermię, wywinięcie warg (eclabium) i powiek (ektropion). Z powodu utraty wody i sepsy oraz nieprawidłowej termoregulacji noworodek umiera zwykle w ciągu tygodnia. Przynajmniej część przypadków wiąże się z mutacjami genu ABCA12 na chromosomie 2[302][303][304].
Rdzeniowy zanik mięśni
Jest to rzadka nieuleczalna choroba nerwowo-mięśniowa, związana jest z mutacją genu SMN1 (locus 5q13.2), przejawiające się degeneracją jąder przednich rdzenia kręgowego, skutkującą postępującym upośledzeniem mięśni szkieletowych, w ciężkich przypadkach prowadzącym do śmierci. Obraz kliniczny obejmuje: ogólne osłabienie mięśni szkieletowych – w zależności od typu niemożność samodzielnego siadania, stania, chodzenia, ograniczoną ruchomość niewydolność oddechową, skutkującą podatnością na infekcje układu oddechowego, problemy z przełykaniem i trawieniem, przykurcze mięśniowe, skutkujące między innymi skoliozą, drgania (fascykulacje) języka. Rozwój intelektualny i emocjonalny jest normalny[305][306].
Skóra pergaminowa

Te bardzo rzadkie schorzenie dziedziczone autosomalnie recesywnie spowodowane jest genetycznym defektem polimerazy DNA β, skutkiem czego dochodzi do nieodwracalnych uszkodzeń DNA w komórkach skóry narażonych na działanie promieni UV; system naprawy uszkodzeń DNA funkcjonuje nieprawidłowo, mutacje kumulują się. Dochodzi do mutacji w genach supresorowych albo protoonkogenach, dlatego też u pacjentów z XP występuje znacznie zwiększone ryzyko nowotworów skóry. Do widocznych objawów należą m.in.: drobne plamy przypominające piegi, większe plamy barwnikowe[307], oparzenia słoneczne, zaniki skóry, ścieńczenie skóry, odbarwienia skóry, znaczna suchość skóry, teleangiektazje, oftalmoplegia, mikrocefalia. Najcięższą odmianą XP jest tzw. zespół de Sanctis-Cacchione, gdzie zmiany skórne typowe dla XP współistnieją z oligofrenią, niedorozwojem fizycznym, głuchotą i ataksją[308][309].
Wrodzona ślepota Lebera
Spowodowana jest przez wadę genu RPE65[310]. W chorobie tej dochodzi do stopniowej utraty wzroku, na skutek tego, iż fotoreceptory oka przestają reagować na światło. Przyczyną jest wadliwe działanie genu kodującego białko niezbędne do prawidłowego przeprowadzania procesu widzenia. Charakterystyczny jest oczopląs i światłowstręt, które pojawiają się wkrótce po urodzeniu.
Zespół Alströma
Zespół Alströma[311] spowodowany jest mutacją w genie ALMS1 w locus 2p13[312]. Zespół opisał szwedzki psychiatra Carl Henry Alström ze współpracownikami w 1959 roku[313][314]. Sposób dziedziczenia tej choroby jest autosomalny recesywny. Charakterystycznymi objawami są np.: cukrzyca typu 1, retinopatia barwnikową, głuchota, otyłość i hipogonadyzm. Pierwsze objawy zespołu pojawiają się bezpośrednio po urodzeniu; później ujawniają się zaburzenia widzenia i głuchota[315][316].
Zespół Blooma
Charakteryzująca się zwiększoną predyspozycją do uszkodzeń chromosomów[317]. Przyczyną zespołu jest mutacja w genie BLM mającym locus na długim ramieniu 15 chromosomu (15q26.1). Mutacja dziedziczona jest w sposób autosomalny recesywny[318]. Białko BLM kodowane przez ten gen należy do rodziny helikaz DNA i tak jak inne helikazy, bierze udział w procesie transkrypcji, katalizując reakcję rozplecenia podwójnej helisy DNA. Prawdopodobnie bierze też udział w procesie naprawy DNA. U pacjentów z zespołem Blooma stwierdza się także nadprodukcję anionu ponadtlenkowego. Występuje z wysoką częstością nosicieli wśród Żydów aszkenazyjskich[318][319]. Do objawów należą m.in.: karłowatość, mikrognacja, długa, wąska czaszka (dolichocefalia), zwiększona predyspozycja do nowotworów[320].
Zespół Chediaka-Higashiego
To zespół chorobowy przebiegający z upośledzeniem odporności, cechuje się nawracającymi zakażeniami bakteryjnymi oraz częściowym albinizmem. Powoduje go mutacja genu LYST znajdującego się na chromosomie 1q42. dziedziczy się autosomalnie recesywnie. Histopatologicznie i cytologicznie choroba charakteryzuje się obecnością dużych wodniczek w leukocytach, co utrudnia zabijanie wchłoniętych bakterii; proces fagocytozy i inne zdolności komórek żernych są upośledzone[321][322][323]. Pierwszym który opisał ten zespół objawów w 1933 roku był kubański lekarz, Antonio Béguez César[324], w tym samym czasie niezależnie od niego przypadek zespołu opisał japoński pediatra Otokata Higashi[325].
Zespół Fanconiego-Bickela
Rzadka, o dziedziczeniu autosomalnym recesywnym, której podłożem molekularnym jest mutacją w obrębie genu GLUT2 zlokalizowanego na chromosomie 3 w locus q26.1-3, kodującego białko błonowe transportujące glukozę. Jej skutkami są nadmierne spichrzanie glikogenu w wątrobie, zaburzenia w obrębie cewek proksymalnych nefronu, a także nieprawidłowym metabolizmem glukozy i galaktozy. Do objawów należą: ciężka tubulopatia, krzywica hipofosfatemiczna, kwasica mleczanowa, hepatomegalia, zahamowanie wzrostu[326][327][328].
Zespół nadnerczowo-płciowy
CAH to grupa chorób charakteryzujących się nadmiernym wydzielaniem androgenów nadnerczowych z niedoborem kortyzolu wskutek genetycznie uwarunkowanego braku (lub niedoboru) enzymów szlaku biosyntezy hormonów nadnerczy, przede wszystkim 21-hydroksylazy i 11β-hydroksylazy[329]. Przyczyną (w podłożu molekularnym) jest mutacja genu CYP21, powodująca niedobór lub brak enzymu 21-hydroksylazy. Skutkujący tym niedobór kortyzolu pobudza przedni płat przysadki do wydzielania ACTH, który z kolei pobudza czynność nadnerczy. Rezultatem tego jest nagromadzenie się 17-OH-progesteronu i steroidów nadnerczowych, których biosynteza nie jest zaburzona przez defekt enzymatyczny i którą nasila nadmiar ACTH: dehydroepiandrostendionu, androstendionu i testosteronu. Wyróżnia się kilka postaci choroby. Do najbardziej charakterystycznych, klasycznych objawów należą: odwodnienie (w niedoborze 21-hydroksylazy) lub przewodnienie (w niedoborze 11-hydroksylazy), hiponatremia, hiperkaliemia (w niedoborze 21-hydroksylazy) lub hipokaliemia (w niedoborze 11-hydroksylazy), kwasica metaboliczna[330]. W postaci nieklasycznej na obraz kliniczny składają się m.in.: hirsutyzm[331], łojotok, łysienie skroniowe, zespół metaboliczny[332][333].
Zespół Natowicza
Inne nazwy to: łac. syndroma Natowicz, ang. Natowicz syndrome, hyaluronidase deficiency, hyaluronoglucosidase deficiency, MPS IX, mukopolisacharydoza typu IX
Zespół Natowicza jest chorobą metaboliczna, której molekularne podłoże stanowi mutacja genu HYAL1 znajdującego się na krótkim ramieniu chromosomu 21, w regionie p21[334]. Takie uszkodzenie powoduje zamianę kwasu glutaminowego w pozycji 268 na lizynę i poprzez to wytworzenie kodonu nonsensownego[334]. Gen HYAL1 jest jednym z trzech genów kodujących hialuronidazę[334][335].
Częstość występowania szacowana jest na poniżej 1 na 1 000 000 żywych urodzeń[336].
Na obraz kliniczny składają się: niski wzrost, słabo wyrażone zmiany twarzoczaszki (spłaszczone nasada nosa, rozdwojony języczek, podśluzówkowy rozszczep podniebienia) oraz miękkie guzy wokół dużych oraz małych stawów[334]. Po zachorowaniu przebiegającym z gorączką lub po wysiłku fizycznym guzy wokółstawowe ulegają bolesnemu obrzękowi, czemu towarzyszy uogólniony obrzęk skóry, które ustępują w ciągu 72 godzin[334].
Zespół Rileya-Daya

To choroba należąca do grupy dziedzicznych neuropatii czuciowych i autonomicznych (HSAN) o dziedziczeniu autosomalnym recesywnym, zakwalifikowana jako typ III HSAN. Choroba wiąże się z mutacjami w genie IKBKAP w locus 9q31[338][339]. Allel recesywny warunkujący w układzie homozygotycznym chorobę występuje niemal wyłącznie w populacji Żydów Aszkenazyjskich[340]. Jednostkę chorobową opisali jako pierwsi Riley i Day w 1949 roku[341][342].
Zespół Rubinsteina-Taybiego
Przyczyną zespołu Rubinsteina-Taybiego jest najczęściej autosomalnie recesywna mutacja w genie CREBBP, zlokalizowanym na krótkim ramieniu chromosomu 16[343][344]. Jest to zespół wad wrodzonych, na którego obraz kliniczny składają się małogłowie, skośno-dolne ustawienie szpar powiekowych, klinodaktylia, szerokie kciuki i paluchy, wrodzone wady serca i układu moczowego, wąskie usta, zwężenie szczęki, hipoplazja żuchwy, wysoko wysklepione podniebienie, tyłozgryz, gruszkowate guzki na zębach, wnętrostwo. Pacjenci z zespołem Rubinsteina i Taybiego wykazują opóźnienie umysłowe[345].
Zespół Schwartza-Jampela

Przyczyna, jak również sposób dziedziczenia są podobne do zespołu Stüve-Wiedemanna, który jest jej noworodkową postacią. Do najważniejszych objawów należą: miotonia, dysplazja kostną, sztywność mięśni, łagodna słabość mięśni (zazwyczaj niepostępująca). Przebieg schorzenia może być postępujący. Fenotyp choroby nie jest jednorodny[347][348][349].
Zespół Stüve-Wiedemanna
Dziedziczony jest w sposób autosomalny recesywny, spowodowany mutacjami w genie LIFR (leukemia inhibitory factor receptor gene) w locus 5p13[350]. Na fenotyp składają się cechy, takie jak: niskorosłość, łukowate kości długie, kamptodaktylia. Na obraz kliniczny składają się także poważne powikłania: niewydolność oddechowa i niewytłumaczalna hipertermia, będące głównymi przyczynami zgonu dzieci z tym zespołem w okresie noworodkowym[351][352][353][354], dysautonomia (zaburzenia smaku, dysfagia)[355]. Zespół Stüve-Wiedemanna znany jest także jako noworodkowa postać zespołu Schwartza-Jampela typu 2 (SJS2)[356] i zaliczany także do zespołów wad wrodzonych[357].
Choroby mitochondrialne
Dziedziczą się na ogół niezgodnie z prawami mendla, ponieważ mutacje stanowiące podłoże molekularne występują przede wszytkim w mtDNA (mitochondrialnym), który replikuje się niezależnie od DNA jądrowego. Choroby te są przekazywane potomstwu głównie przez matkę, czyli w tzw. linii matczynej[358]. Jest to spowodowane faktem, iż plemnik - w porównaniu z gametą żeńską - ma niewiele mitochondriów i nie są one przekazywane potomstwu. Komórki ciała matki, zarówno somatyczne, jak i generatywne, mogą zawierać zaróno prawidłowy genom, jak i zmutowany[91][359][91]. Podczas oogenezy do komórej jajowych trafia losowo część mitochondriów pochodzących z komórki macierzystej gamety. W związku z różnicami w ilości mitochondriów ze zmutowanym DNA między poszczególnymi komórkami jajowymi, stopień nasilenia objawów u potomstwa będzie różny. W rodzinie, w której chory jest ojciec, żadne z dzieci nie odziedziczy choroby[91].
Choroby mitochondrialne są zwykle chorobami wieloukładowymi, ich objawy związane są najczęściej z tkankami o wysokim zapotrzebowaniu energetycznym np. mięśniami szkieletowymi lub układem nerwowym, i zazwyczaj obejmują miopatie, encefalopatie oraz neuropatie[91]. Szacuje się, że na choroby mitochondrialne zapada 1 na 15 000 osób[360][361].
Niedokrwistość aplastyczna spowodowana chloramfenikolem
Choroba mitochondrialna, w której u około 1:19 000 przypadków chloramfenikol wywołuje reakcję idiosynkrazji, czyli powoduje działania niepożądane po podaniu dawki leczniczej. Występuje wówczas zagrażająca życiu niedokrwistość aplastyczna. Udowodniono, że jest to spowodowane punktowymi mutacjami w mitochondrialnym DNA. Zmiany dotyczą genu MTRNR2 kodującego podjednostkę 16S rRNA. Zidentyfikowane mutacje wywołujące wrażliwość na chloramfenikol to T2991C[362][363] i C2939A[362].
Zespół Kearnsa-Sayre’a
Niedziedziczna mitochondrialna choroba genetyczna spowodowana delecjami w mitochondrialnym DNA[364], która objawia się m.in.: postępującą oftalmoplegią zewnętrzną (niedowład mięśni gałkoruchowych), zwyrodnieniami barwnikowymi siatkówki (początek objawów przed 20. rokiem życia), ataksją móżdżkową, podwyższonym poziomem białka w płynie mózgowo-rdzeniowym, zaburzeniami przewodzenia w mięśniu sercowym (blok pęczka Hisa, blok AV II°, blok całkowity), mikrokloniami, napadami drgawek, otępieniem, zmianami w istocie białej[365][364].
Zespół Lebera
Choroba mitochondrialna, na której obraz kliniczny składa się zanik nerwów wzrokowych w wyniku zwyrodnienia komórek zwojowych siatkówki i ich aksonów. Choroba jest spowodowana różnymi mutacjami w mitochondrialnym DNA (mtDNA). Mutacje punktowe genów: MT-ND1, MT-ND4, MT-ND4L, i MT-ND6 skutkują zaburzeniem transportu elektronów w łańcuchu oddechowym. W przebiegu choroby dochodzi do uszkodzenia nerwu wzrokowego i związanej z tym ślepoty. Chorują przede wszystkim młodzi mężczyźni; choroba ujawnia się przeważnie w 10.-20. roku życia[366][367].
Zespół MELAS
Jest to mitochondrialna choroba wieloukładowa, której przyczyną jest mutacja punktowa A3243G polegająca na zamianie adeniny na guaninę w pozycji 3243 w obrębie genu MTTL1 (OMIM*590050) kodującego tRNA dla leucyny. Skutkuje ona nadmiernym gromadzeniem się we krwi kwasu mlekowego[368], czego efektem jest nieprawidłowe działanie głównie tkanki nerwowej i tkanki mięśniowej[369]. Objawami są: napady drgawek, paraliż, demencja i osłabienie mięśniowe, zwyrodnienie barwnikowe siatkówki, głuchota korowa, neuropatia czuciowa typu aksonalnego, ciężkie zaparcia, cukrzyca typu II, niedoczynność przytarczyc, niskorosłość, kardiomiopatia (rzadko), nefropatia (rzadko)[364][370].
Zespół MNGIE
Zespół mitochondrialnej encefalomiopatii dotyczącej układu nerwowego, żołądka i jelit jest rzadką choroba mitochondrialna[371], spowodowaną mutacją w genie ECGF1[372] w locus 22q13.32-qter kodującym fosforylazę tymidyny, której towarzyszą delecje w mtDNA. Postać MNGIE bez leukoencefalopatii może być związana z mutacjami w genie POLG[373] kodującym białko polimerazy DNA γ. Do najbardziej charakterystycznych objawów należą: opadanie powiek, postępująca zewnętrzna oftalmoplegia (niedowład mięśni gałkoruchowych), zaburzenia motoryki przewodu pokarmowego: biegunki, zaparcia, nudności i wymioty, miopatia mięśni szkieletowych (w badaniu w badaniu histologicznym bioptatu mięśnia widoczne postrzępione, „szmatowate” czerwone włókna, z ang. red ragged fibers)[374].
Zespół NARP
- Neurogenna miopatia z ataksją i zwyrodnieniem barwnikowym siatkówki to bardzo rzadka choroba mitochondrialna będąca skutkiem mutacji punktowej w mitochondrialnym DNA T8993G w genie MTATP6 (OMIM*516060) kodującym podjednostkę 6 mitochondrialnej syntazy ATP. Zespół NARP dziedziczy się w linii matczynej, jak inne choroby mitochondrialne.Choroba ujawnia się najczęściej w wieku dorosłym, rzadko u dzieci. Na obraz kliniczny NARP składają się objawy takie jak, np.: zwyrodnienie barwnikowe siatkówki, napady drgawek, ataksja móżdżkowa, osłabienie mięśni proksymalnych (odsiebnych), neuropatia czuciowa, opóźnienie rozwoju, dysfunkcja pnia mózgu[364][375].
Zespół szpikowo-trzustkowy Pearsona
Jego przyczyną jest delecja w mtDNA[376], do objawów zalicza się ciężka niedokrwistość makrocytowa w pierwszych tygodniach życia, zmienna neutropenia i małopłytkowość, podwyższony poziom hemoglobiny, zaburzenia pracy trzustki, cukrzyca, zanik kosmków jelitowych, zaburzenia funkcji wątroby, zaburzenia krzepnięcia krwi. W wieku dojrzewania mogą wystąpić objawy zespołu Kearnsa-Sayre’a (objawy neurologiczne, utrata słuchu, ataksja, neuropatia obwodowa, upośledzenie umysłowe), a także niedokrwistość syderoblastyczna w pierwszych tygodniach życia, zmienna neutropenia i trombocytopenia, zaburzenia pracy trzustki, cukrzyca, atrofia kosmków jelitowych[377].
Sprzężone z płcią recesywne
Sprzężenie z płcią najczęściej oznacza wystąpienie mutacji w genie zlokalizowanym w chromosomie X[96], ponieważ homologiczny chromosom Y zawiera mniej genów, jest znacznie krótszy. Większość z tych genów warunkuje rozwój męskich zarodków zgodnie z ich genetyczną płcią, a mutacje w obrębie tych genów zazwyczaj skutkują bezpłodnością, dlatego nie są przekazywane potomstwu. Wyjątek stanowi oligospermia (duży spadek zawartości plemników w spermie), która choć obniza znacznie płodność, to nie wyklucza posiadania potomstwa[91]. Jej przyczyną jest jedna z kilku występujących mutacji znajdujących się w obrębie chromosomu Y, które mogą być dziedziczone jedynie w lini męskiej. Najczęstszą przyczyną tych zaburzeń są delecje w obrębie długiego ramienia chromosomu, zwanego regionem AZFc (ang. azoospermia factor c)[91].
Dziedziczenie cech sprzężonych z chromosomem X jest charakterystyczne i można je rozpoznać już na podstawie zwykłego rodowodu[378]:
- choroba nie musi ujawnić się w każdym pokoleniu,
- chorują wyłącznie mężczyźni i homozygotyczne kobiety (dlatego mężczyźni znacznie częściej),
- chory mężczyzna przekazuje zmutowany allel córkom, ale nigdy synom,
- mężczyźni, którzy mieli chorą matkę, ze stuprocentową pewnością również będą chorzy (mają tylko jeden chromosom X[e]),
- zwykle choroba jest ciężka i mężczyźni nie dożywają wieku reprodukcyjnego, wtedy w kolejnych pokoleniach występują serie kobiet nosicielek,
- kobieta, która jest nosicielem wadliwej wersji genu dziedziczonej recesywnie sprzężonej z chromosomem X (XRXr) ma 50% szans na posiadanie synów, którzy są chorzy i 50% szans posiadania córek, które posiadają jedną kopię zmutowanego genu, są więc nosicielkami.
Choroba Menkesa

Inne nazwy to: choroba kręconych włosów, zespół Menkesa, ang. Menkes disease, Menkes syndrome, kinky hair disease i steely hair syndrome.
Jest chorobą neurodegeneracyjną, związaną z zaburzeniem metabolizmu miedzi, sprzężoną z płcią[380], dlatego częściej spotykamy chorych chłopców. W badanich na populacji europejskiej stwierdzono, że występuje z częstością około 1:254.000 urodzeń[381]. Przyczyną choroby Menkesa jest mutacja w genie ATP7A[382] w locus Xq12-q13.
Zmiany strukturalne występują w mózgu, wątrobie, naczyniach krwionośnych i w tkance kostnej – co powoduje zaburzenia neurologiczne, kostne i osteoporozę. Chorzy wykazują również nietypową budowę włosa – włosy są sztywne i bardzo łamliwe, lub przeciwnie, bardzo wiotkie. Odmianą alleliczną choroby Menkesa jest tzw. zespół rogu potylicznego (ang. occipital horn syndrome[383], który charakteryzuje się zmianami kostnymi, a objawy neurologiczne mają stosunkowo niewielkie nasilenie[384].
Daltonizm
Podobnie jak hemofilia jest to choroba recesywna sprzężona z płcią, co oznacza, że allel warunkujący zapadanie na tą chorobę nie ujawnia się, jeśli obok niego występuje allel dominujący odpowiadający za prawidłowe widzenie barw (inna nazwa tej choroby to ślepota barw i zdradza częściowo jej objawy). W związku z tym, że wadliwy gen znajduje się jedynie na chromosomie X, u mężczyzn wystarczy odziedziczenie go po matce, by ujawnił się pełen zespół objawów, nawet jeśli ojciec jest zdrowy. To powoduje, że mężczyźni zapadają na tą chorobę znacznie częściej niż kobiety, które w tym wypadku muszą być homozygotą recesywną żeby być daltonistkami (znacznie mniejsze prawdopodobieństwo)[385]. Do głównych skutków mutacji jednogenowej należy brak lub zmniejszona ilość barwników wzrokowych (np. jodopsyny) odpowiedzialnych za rozróżnianie barw. Objawy kliniczne to najczęściej niezdolność do odróżniania barwy zielonej lub czerwonej lub obu. Występuje w różnym nasileniu[2]. Inna nazwa tej choroby, to: deuteranopia[386].
Dystrofia mięśniowa
Mutacje w pojedynczym genie zlokalizowanym na chromosomie X (prążek Xp21) są przyczyną dystrofii mięśniowych typu Duchenne’a (DMD) i Beckera (BMD)[387]. Szacuje się, że DMD występuje u 1 na 3500 chłopców, ujawniając się w 2-3 roku życia postępującym zanikiem mięśni. BMD ma przebieg łagodniejszy[40]. To najczęstsza prowadząca do śmierci dziedziczona recesywnie choroba sprzężona z płcią[388]. Choroba ma charakter postępujący, początkowo zajmuje mięśnie szkieletowe, potem także mięsień sercowy – prowadząc do kardiomiopatii. Pierwsze objawy występują w wieku 3–8 lat. Obejmują opóźniony rozwój ruchowy, kaczkowaty chód i kłopoty z bieganiem oraz chodzeniem po schodach. Chorzy przy wstawaniu pomagają sobie rękami (objaw Gowersa)[389].
Hemofilia
Jest to choroba recesywna jednogenowa sprzężona z płcią powodująca poważne zaburzenia krzepliwości krwi[390], zwana też krwawiączką albo chorobą królów. Wadliwy gen znajduje się na chromosomie X, dlatego też u mężczyzn nie ma możliwości zdominowania go przez gen z homologicznego chromosomu (mają genotyp XY). Z tego powodu wystarczy, by jedno z rodziców przekazało ten gen dziecku, aby zachorował mężczyzna, lecz w przypadku kobiet oboje rodzice muszą posiadać wadliwy gen[2]. Wyróżnia się cztery typy hemofilii. Klasyczną postacią jest hemofilia A spowodowana mutacją w locus Xq28 powodującą niedobór VIII czynnika krzepnięcia krwi (czynnika antyhemolitycznego), zaś jedną z najrzadszych jest nabyta hemofilia, której bezpośrednią przyczyną są autoprzeciwciała skierowane przeciwko czynnikowi VIII[391]. Pozostałe typy to: hemofilia B (mutacja w locus Xq27.1-q27.2, niedobór IX czynnika krzepnięcia krwi – czynnika Christmasa), hemofilia C (mutacja w locus 4q35, niedobór XI czynnika krzepnięcia krwi (czynnika Rosenthala), najczęściej w populacji Żydów Aszkenazyjskich, dziedziczenie autosomalne recesywne). Do objawów należą: krwawienia wewnętrzne (krwawienia podskórne – tzw. siniaki,krwawienia do stawów szczególnie kolanowych, skokowych i łokciowych, krwawienia do mięśni np. mięśnia biodrowo-lędźwiowego, łydki, krwiomocz); krwawienia zewnętrzne (krwawienia z błony śluzowej jamy ustnej i nosa0 oraz krwawienia które mogą zagrażać życiu (krwawienie pozaotrzewnowe, krwawienie do ośrodkowego układu nerwowego, krwawienie w okolicach szyi)[392].
Zespół Bartha
Inaczej kwasica 3-metyloglutakonowa typu II, acyduria 3-metyloglutakonowa typu II, zwłóknienie sprężyste wsierdzia typu 2 to choroba dziedziczona recesywnie, sprzężona z płcią, spowodowana uszkodzeniem genu TAZ (G4.5) znajdującego się na długim ramieniu chromosomu X w regionie q28, kodującego tafazynę[393]. Opisano ponad 120 różnych mutacji tego genu[394]. Gen TAZ koduje acylotransferazę, która odpowiada za modyfikację struktury kardiolipiny, jedynego fosfolipidu syntetyzowanego w błonie[394] mitochondrium[393]. Kardiolipina oddziałuje z licznymi białkami związanymi z syntezą adenozyno-5′-trifosforanu (ATP)[393] oraz bierze udział w procesie apoptozy mitochondriów[394]. W wyniku mutacji dochodzi do upośledzenia włączania kwasu linolowego do kardiolipiny oraz zaburzeń czynności wewnętrznej i zewnętrznej błony mitochondriów[393]. Objawy kliniczne: neutropenia, która występuje u 90% pacjentów kardiomiopatie.7B.7B[393], zmiany w układzie sercowo-naczyniowym w okresie niemowlęcym, czasem bezpośrednio po porodzie, nagłe zatrzymanie krążenia oraz nagła śmierć sercowa, których ryzyko wzrasta z wiekiem pacjenta[393], twarz o wysokim płaskim czole, okrągłej twarzy z pełnymi policzkami, odstającymi małżowiny uszne i głęboko osadzonymi oczami), jednakże z okresem pokwitania cechy te w znacznym stopniu zanikają[394]. Miopatia jest częstym objawem i większość pacjentów ma opóźniony rozwój psychomotoryczny[394]. Osłabienie dotyczy przede wszystkim proksymalnych mięśni i nie pogarsza się wiekiem[394]. Może być obecny objaw Gowersa[394]. Rozwój umysłowy nie jest opóźniony, jednakże występują zaburzenia orientacji przestrzennej i umiejętności matematycznych[393]. Większość chorych umiera we wczesnym dzieciństwie, w przebiegu niewydolności serca lub zakażenia. W przypadku postawienia rozpoznania śmiertelność wynosi 10%[394]. Długość życia u nosicielek jest taka sama jak w populacji ogólnej[395].
Zespół Wiskotta-Aldricha
To rzadki dziedziczny zespół chorobowy, sprzężony z chromosomem X, o typie dziedziczenia recesywnym, na który choruje jedynie płeć męska. Choroba przebiega z zaburzeniami układu odpornościowego. Wystąpienie objawów choroby jest uwarunkowane mutacją genu WAS w locus Xp11.23-p11.22, kodującego białko o tej samej nazwie[396]. Białko to jest niezbędne do prawidłowego różnicowania się i funkcjonowania komórek progenitorowych krwi, limfocytów T i B, makrofagów oraz trombocytów[397]. Do objawów należą: wypryski, trombocytopenia, krwawa biegunka, wybroczyny skórne, nawracające zakażenia (zapalenie płuc, zapalenie oskrzeli, zapalenie ucha środkowego), zakażenia skóry (zakażenia wirusem, opryszczki)[398][399].
Sprzężone z płcią dominujące
Niewiele chorób genetycznych jest dziedziczonych w ten sposób. Praktycznym faktem jest to, że w ten sposób dziedziczy się cecha grupowa krwi Xg[400]. Objawy choroby są lżejsze u heterozygot płci żeńskiej niż u hemizygot (płci męskiej). Powyższy typ dziedziczenia należy podejrzewać, jeżeli[400]:
- chory mężczyzna ma wyłącznie chore córki i wyłacznie zdrowych synów,
- chore kobiety heterozygoty przekazują cechę całemu potomstwu,
- choroba występuje dwukrotnie częściej u kobiet niż u męzczyzn,
- choroba ujawnia się w każdym pokoleniu[400].
Krzywica witamino-D-oporna (hipofosfatemia)
Rzadka choroba spowodowana uszkodzeniem genu PHEX kodującego białko enzymatyczne - endopeptydazę, występujące głównie w komórkach kości i zębów, odpowiedzialnego za inaktywację innego białka – czynnika fosfaturycznego, który – dla odróżnienia od parathormonu – nazwano fosfatoniną, pełniącego funkcję regulacyjną przy wchłanianiu zwrotnym fosforanów w nerkach. Cechuje się brakiem reakcji na witaminę D w dawkach stosowanych w leczeniu krzywicy niedoborowej. Choroby te spowodowane są zaburzeniami metabolizmu i działania witaminy D i/lub zaburzeniami gospodarki fosforowej. Najczęstszą postacią krzywicy opornej na witaminę D jest krzywica hipofosfatemiczna rodzinna – sprzężona z chromosomem X. Do innych postaci należą: osteomalacja onkogeniczna, autosomalna dominująca krzywica hipofosfatemiczna, krzywica hipofosfatemiczna rodzinna z hiperkalciurią i krzywice pseudoniedoborowe. Nadmierna aktywność białka regulującego wpływa na wzmożone wydalanie fosforanów w moczu i niską ich zawartość we krwi. Skutkiem choroby jest deformacja szkieletu oraz brak szkliwa na zębach. Choroba ta częściej dotyka kobiet niż mężczyzn, ale efekt fenotypowy jest u obu płci taki sam[401][402][403][404][405].
Zespół Retta
Jest to ciężkie, kompleksowe schorzenie neurologiczne[406], spowodowane mutacją genu MECP2 na chromosomie X[407]w lokalizacji q28., dziedziczona jako cecha dominująca, w większości przypadków letalna dla mężczyzn[408]. Mutacja najczęściej (w około 99%) zachodzi de novo. Choroba objawia się zaburzeniami rozwoju psychoruchowego (często mylona z autyzmem) i wadami somatycznymi (m.in. skoliozą)[409]. Zespół Retta pojawia się u dziewczynek z częstotliwością od 1:10000 do 1:23000 żywych urodzeń[410].
Choroby spowodowane powtórzeniami trinukleotydów
W podłożu molekularnym tych chorób (ang. Triplet Repeat Expansion Diseases w skrócie TREDs) leżą mutacje kodonowe (dynamiczne) polegające na powieleniu się (ekspansji) fragmentu genu, zwykle o długości 3-4 nukleotydów - u większości chorób z tej grupy przyczyną jest ekspansja kodonu CAG (oznaczającego aminokwas glutaminę) w sekwencji kodującej genu. Na poziomie białka tworzy się tzw. trakt poliglutaminowy, który zaburza prawidłowe jego funkcjonowanie. Tego typu mutacje określa się jako mutacje kodonowe, a schorzenia nią spowodowane jako choroby poliQ[411] . Jedną z prawdopodobnych przyczyn tej mutacji jest zjawisko poślizgu polimerazy DNA podczas replikacji DNA. Choroby mają charakter neurodegeneracyjny i neuromięśniowy, towarzyszy im często zjawisko antycypacji – prawdopodobieństwo dalszego wydłużania się obszaru podlegającego ekspansji w kolejnych rundach replikacji ma tendencję wzrostową, przez co choroba z pokolenia na pokolenie ujawnia się wcześniej, a jej objawy są coraz cięższe[412]. Etiopatogenezę u części tych chorób mogą też stanowić trójnukleotydowe trakty (złożone z CTG, CGG, CCG, AAG) znajdują się w niekodujących fragmentach genu – 5'UTR, 3'UTR oraz intronach[98].
Choroba Friedreicha
Inne nazwy: FRDA1, ataksja Friedreicha, bezład Friedreicha, dziedziczna ataksja rdzeniowa, ang. Friedreich's ataxia[413].
To choroba człowieka dziedziczona autosomalnie recesywnie, spowodowana mutacją w pierwszym intronie genu FXN (poprzednio znany jako gen X25) znajdującym się na chromosomie 9[414]. W 2% przypadków jest to mutacja punktowa, natomiast w pozostałych 98% mutacja dynamiczna polegająca na ekspansji krótkiego fragmentu sekwencji genu (w tym przypadku trójki nukleotydów GAA w pierwszym intronie genu)[415], który koduje mitochondrialne białko frataksynę, które prawdopodobnie bierze udział w metabolizmie żelaza[416][417][418]. Wystąpienie nadmiernej ilości powtórzeń trójki nukleotydowej GAA powoduje represję transkrypcji tego genu, jednak mechanizm tej represji nie jest dokładnie poznany. Brak frataksyny powoduje gromadzenie się żelaza w mitochondriach, zaburzenia w aktywności białek żelazo-siarkowych (Fe-S) i nasilony stres oksydacyjny[413][419][420]. Do najczęstszych objawów należą m.in.: kardiomiopatia przerostowa, ataksja chodu, gorsza sprawność ruchowa, częściowa astereognozja, zanik nerwu wzrokowego, upośledzenie umysłowe, występowanie tzw. stopy fredreichowskiej, co oznacza stopę o nadmiernym wyżłobieniu. Zgon następuje 10 - 20 lat od początku objawów, z powodu powikłań. W przebiegu choroby dochodzi do zwyrodnienia w obrębie dróg rdzeniowo-móżdżkowych, sznurów tylnych rdzenia kręgowego oraz w drogach piramidowych i móżdżku[413][421].
Choroba Kennedy’ego
Inne nazwy: opuszkowo-rdzeniowy zanik mięśni, ang. Kennedy's disease, X-linked spinal and bulbar muscular atrophy, SBMA, SMAX1.
Choroba Kennedy'ego jest niealleliczną chorobą sprzężoną z chromosomem X, będącą recesywną postacią rdzeniowego zaniku mięśni, występującą tylko u mężczyzn. Najczęściej ujawnia się w trzeciej, piątej dekadzie życia. Zaburzenie to charakteryzuje się wolno postępującym osłabieniem i zanikiem mięśni oraz ginekomastiią[422][423]. Podłoże molekularne, etiopatogenezę choroby stanowią ekspansywne powtórzenia kodonów CAG (o charakterze polimorficznym i średniej liczbie powtórzeń 22 +/- 3) w intronie 1 genu AR, zlokalizowanego na chromosomie Xq12, kodującego receptor androgenowy[424]. Mutacje w tym genie (ale nie o charakterze wzrostu ilości trójek nukleotydów) mogą powodować zespół niewrażliwości na androgeny. Do objawów należą: przewlekłe osłabienie, zanik mięśni, fascykulacje, ścieńczenie skóry i hiporefleksja[425], zaburzenia połykania, hiperlipoproteinemia, asymetria twarzy[423][426][427].
Choroba Machado-Josepha
Inne nazwy: ang. spinocerebellar ataxia 3; SCA3 spinocerebellar atropfy III; azorean neurologic disease; spinopontine atrophy, nigrospinodentatal degeneration[428].
To choroba należąca do TREDs, bowiem jest spowodowana ekspansją trójek nukleotydowych CAG - determinujących glutaminę (chorobotwórcze allele zawierają 52 do 86 powtórzeń[428]) genu ATXN3 (locus 14q24.3-q31[429] ), kodującego ataksynę-3[430][428]. Jest to ciężkie zaburzenie neurologiczne dziedziczone autosomalnie dominująco[431], charakteryzujące się postępującą ataksją, spastycznością, zaburzeniami ruchowymi i oczu[428][432]. Na obraz kliniczny składają się także objawy takie jak np[433][428].: parkinsonizm, spowolnienie ruchowe, niestabilność postawy, dyzartria, sztywność, utrata neuronów i glejoza w zwojach podstawy mózgu, nerwów czaszkowych, jąder i rdzenia kręgowego, zanik móżdżku, łagodne powiększenie komory czwartej, utrata neuronów w móżdżku, neuropatia obwodowa, zmniejszone poczucie wibracji, zaburzenia zmysłu termicznego, zmniejszenie lub brak odruchów skokowych; ponadto[428]: zaburzenia połykania, zaburzenia zwieraczy, oftalmoplegia zewnętrzna[434], oczopląs, wytrzeszcz oczu, nienormalna elektrookulografia (EOG)[435].
Choroba (pląsawica) Huntingtona
Choroba ta należy do cech autosomalnych dominujących[97], choć i tak jest ona rzadka (występuje w Polsce z częstotliwością 1 na 15 000 osób). W wyniku mutacji powstaje za duża ilość powtórzeń sekwencji CAG (odpowiadającej za wbudowanie aminokwasu glutaminy) w końcu genu położonym na krótkim ramieniu chromosomu 4, kodującego białko huntingtynę[436]. Choroba ujawnia się w późnym wieku (ok. 30 – 50 lat). Młodzieńcza odmiana choroby (postać Westphala) dotyczy ludzi przed 20 rokiem życia. Pląsawica Huntingtona objawia się złożonymi zaburzeniami neurologicznymi (polineuropatie) m.in. niekontrolowanymi, przypadkowymi ruchami. Dodatkowo występuje postępujące otępienie (łac. dementia), często także różne zaburzenia psychiczne, depresja. Zachłystowe zapalenie płuc spowodowane zaburzeniami połykania jest pierwszą przyczyną śmierci pacjentów z HD, odpowiadając za 85% zgonów[437].
Dystrofia miotoniczna

Dystrofia miotoniczna typu 1
Inne nazwy: DM1, miotonia zanikowa, choroba Curschmanna-Steinerta, ang. myotonic dystrophy, dystrofia miotoniczna typu 1.
Jest to choroba o charakterze postępującym[438], będąca postacią dystrofii (zaniku) mięśni, dziedziczona w sposób autosomalny dominujący. Podłoże molekularne stanowi mutacja genu DMPK, położonego na chromosomie 19q13.32., polegająca na ekspansji sekwencji trinukleotydowej (trzech nukleotydów CTG) położonej w 3'UTR genu DMPK (kinazy białkowej, regionie nie podlegającym translacji genu. Stopień zaawansowania choroby zależy od liczby powtórzeń: normalne osoby mają od 5 do 37 powtórzeń, osoby dotknięte chorobą o łagodnym przebiegu mają od 50 do 150 powtórzeń, pacjenci z cukrzycą mają klasycznie od 100 do 1000 powtórzeń, a ci z wrodzonym początkiem mogą mieć więcej niż 2000 powtórzeń. Zaburzenie pokazuje antycypację genetyczną[439], z rozbudową liczby powtórzeń w zależności od płci przekazującego rodzica - ekspansja powtórzeń jest znacząco większa przy przekazywaniu zmutowanego genu przez matkę[440][441]. Występują liczne objawy[438]: mięśniowe: miotonia (po naprężeniu mięśni rozluźnienie następuje z opóźnieniem), zanik wielu mięśni (w tym twarzy), spadek siły, osłabienie pracy mięśni, opadanie rąk i stóp, osłabienie mięśni twarzy, żwaczowych, skroniowych, mostkowo-obojczykowo-sutkowych, szyi, przedramiona|przedramion i podudzi, słaby uścisk ręki[442], nierówne bicie serca, arytmie, kardiomiopatie, zaburzenia przewodzenia, blok serca, nieprawidłowości w EKG[443], zaparcia, trudności z połykaniem, utrudnione odkrztuszanie i infekcje oddechowe, zastój żółci w pęcherzyku żółciowym, nieregularne miesiączki, poronienia, trudne porody, zanik jąder, łysienie czołowe, cukrzyca i oporność na insulinę, ptoza, zaćma, upośledzenie ruchów gałek ocznych. Do zaburzeń neurologicznych należą[444][440]: trudności z mówieniem, demencja, senność, zmęczenie, zaburzenia poznawcze, przetwarzania komunikatów, percepcji, wyrażania emocji, zaburzenia osobowości, zaburzenia trawienia i bezdech.
Dystrofia miotoniczna typu 2
Inne nazwy: choroba Rickera, ang. Dystrophia Myotonica 2, proximal myotonic myopathy; PROMM, proximal Ricker syndrome.
Jest to zaburzenie wielonarządową i najbardziej rozpowszechnioną formą dystrofii mięśniowej u osób dorosłych., dziedziczona autosomalnie dominująco. Etiopatogenezę na poziomie molekularnym stanowi mutacja, będąca ekspansją powtórzeń sekwencji CCTG w intronie genu ZNF9[445] - 1 palca cynkowego, znajdującym się na chromosomie 3q21.3 (gen 9.). W obu typach dystrofii miotonicznej mRNA niosące mutacje gromadzi się w jądrze i zaburza splicing innych mRNA, np. kodującego kanał chlorkowy CLC1, co powoduje objawy miotonii, czy INSR (receptora insuliny), co powoduje oporność na insulinę[446]. Możliwe objawy[447]: zaćma, kardiomiopatie, kamica żółciowa, zaburzenia hormonalne, zajęte mięśnie ksobne, mięśnie twarzy niezajęte, ból mięśni, łysienie. Niektóre nieprawidłowości laboratoryjne: podwyższenie aktywności kinazy kreatynowej w surowicy, podwyższone stężenie gammaglutamylotransferazy (GGT), zwiększony poziom cholesterolu, zwiększona ilość dehydrogenazy mleczanowej w surowicy[448].
Zespół łamliwego chromosomu X

Inne nazwy: zespół kruchego chromosomu X, zespół Martina-Bell[f], ang. fragile X syndrome, FraX, FRA-X, Martin-Bell syndrome.
Jedna z najczęstszych przyczyn uwarunkowanego genetycznie obniżenia poziomu rozwoju intelektualnego. Przyczyną jest powielenie kodonu CGG w genie FMR1 (65-200 powtórzeń to tzw. premutacja) na długim ramieniu chromosomu X, upośledzające tworzenie synaps w mózgu[449][450][451]. W związku z tym faktem zespół łamliwego chromosomu X należy do grupy chorób spowodowanych powtórzeniami trinukleotydów. Zespół dziedziczony jest podobnie jak schorzenia sprzężone z chromosomem X, związane z genem dominującym o ograniczonej penetracji[452]. Objawy przypominają chorobę Parkinsona, u chorych po 50. roku życia występują często: ataksja, drżenie, zaburzenia równowagi, ubytki pamięci[453]. Charakterystyczne cechy wyglądu zewnętrznego: pociągła twarz, wypukłe czoło, duży obwód czaszki (powyżej 50. centyla), odstające uszy, zez, wystająca żuchwa (prognatyzm), nadmierna ruchomość w stawach, płaskostopie, skolioza, klatka piersiowa lejkowata, makroorchidyzm – duże jądra (powyżej 25 ml u dorosłych)[454].
Choroby wieloczynnikowe
Zaburzenia genetyczne mogą być również złożone, wieloczynnikowe lub wielogenowe, co oznacza, że są prawdopodobnie związane ze skutkami wielu genów w połączeniu ze stylem życia i czynnikami środowiskowymi. Do zaburzeń wieloczynnikowych należą choroby serca i cukrzyca[455]. Analiza wielu częstych chorób wskazuje na to, że istotną rolę odgrywają w nich czynniki genetyczne; jednak nie dziedziczą się zgodnie z prawami Mendla. To sprawia, że trudno jest określić ryzyko odziedziczenia lub przekazywanie tych zaburzeń u różnych osób[456]. Te skomplikowane zaburzenia są również trudne do badania i leczenia, ze względu na specyficzne czynniki powodujące większość z tych zaburzeń, które nie zostały jeszcze zidentyfikowane. Badania, których celem jest określenie przyczyn zaburzeń złożonych, można zastosować kilka podejść metodologicznych, aby określić skojarzony genotyp - fenotyp. W jednej metodzie podejście do okreslenia pierwszego genotypu, rozpoczyna się od identyfikacji wariantów genetycznych występujących u chorych i określenia związanych z nimi objawów klinicznych. Jest to w przeciwieństwie do bardziej tradycyjnego podejścia fenotypu pierwszego i może zidentyfikować czynniki przyczynowe, które wcześniej były zasłonięte przez kliniczną heterogeniczność, penetrację i ekspresyjność. Ryzyko wystapienia choroby jest tym większe, im więcej genów patologicznych ma dany osobnik oraz im więcej działa na niego zewnątrzpochodnych czynników szkodliwych[456]. Do chorób wieloczynnikowych należą[455]:
- choroba nadciśnieniowa[455],
- niektóre postacie miażdżycy[455],
- choroba wrzodowa[455],
- niektóre postacie odczynów alergicznych, mi.in. dychawica oskrzelowa[455],
- niektóre postacie jaskry, łuszczycy[455],
- niektóre choroby psychiczne, jak np. psychoza maniakalno-depresyjna[455];
również różne wady rozwojowe[455]:
- wrodzone wady serca[455],
- rozszczep podniebienia[455],
- rozszczep wargi i podniebienia[455],
- wady ośrodkowego układu nerwowego[455].
Choroba Leśniowskiego-Crohna

Jest to nieuleczalna zapalna choroba jelita o niewyjaśnionej etiologii, zaliczana do grupy nieswoistych zapaleń jelit (IBD), przewlekły, nieswoisty proces zapalny ściany przewodu pokarmowego; może dotyczyć każdego jego odcinka, lecz najczęściej lokalizuje się w końcowej części jelita cienkiego oraz początkowej jelita grubego (z tego względu dawniejsza nazwa to ileitis terminalis)[457][458]. Opisana została po raz pierwszy przez polskiego lekarza Antoniego Leśniowskiego w 1904[459], a dokładniejszego opisu dostarczył Burrill Bernard Crohn ze współpracownikami w 1932[460]. Etiopatogeneza choroby może być związana z mutacją genu NOD2 oraz defektem immunologicznym monocytów, jednak dokładne jej podłoże nie jest znane[461][462]. Jej występowanie jest uwarunkowane geograficznie (największa zachorowalność w krajach Europy Zachodniej i Ameryki Północnej)[463]. Charakterystyczne dla przebiegu choroby jest zajęcie całej grubości ściany narządu oraz możliwość występowania w całym przewodzie pokarmowym, podczas gdy we wrzodziejącym zapaleniu jelita grubego zajęte są tylko błona śluzowa i podśluzowa jelita grubego). Zmiany mają charakter ogniskowy. Główne objawy dotyczące przewodu pokarmowego to: przewlekła biegunka (zwykle bez krwi), czasem nocna. W poważnych przypadkach może istnieć potrzeba oddania ponad 20 stolców na dzień[464][465], bóle brzucha (często prawe podbrzusze), niedrożność jelit, guzowaty opór w jamie brzusznej, zmiany okołoodbytniczne (szczelina, przetoka, ropień). Do rzadziej występujących objawów pozajelitowych należą[464]: skórne – rumień guzowaty (łac. erythema nodosum), piodermia zgorzelinowa; stawowe; oczne – episcleritis lub keratoconjunctivitis, uveitis[466][467].
Zobacz też
- ↑ Po wliczeniu 0,19% aberracji strukturalnych nie znajdujących odbicia w fenotypie (aberracje euploidalne, jak translokacje zrównoważone i aberracje typu fuzji centrycznych, gdy przy aneuploidalnej liczbie modalnej wszystkie chromosomy są w zasadzie obecne), to częstość aberracji chromosomowych jest bliższa 0,60%
- ↑ Dane odnoszą się przede wszystkim do populacji europejskiej i północnoamerykańskiej pochodzenia europejskiego. Populacje o określonym pochodzeniu etnicznym lub zamieszkujące niektóre rejony mogą wykazywać odmienne częstości występowania chorób genetycznych.
- ↑ Przeciętny czas hospitalizacji pacjentów dotkniętych chorobami genetycznymi jest średnio 1,5 raza dłuższy niż p. niegenetycznych, zaś liczba ponownych hospitalizacji z powodu tej samej choroby wynosi przeciętnie 5,3 w porównaniu z 1,3 dla chorych niegenetycznych. Odsetek ten rośnie wraz ze wzrostem poziomu życia i opieki zdrowotnej w państwie
- ↑ Na tej stronie (w tym artykule) zostały one omówione osobno, gdyż stanowią szczególną grupę, w której znajdują się również niektóre choroby sprzężone z płcią.
- ↑ Jeśli rzecz jasna pod względem liczby chromosomów płci, konkretnie X, będą zdrowi
- ↑ Pierwsze przypadki opisali James Purdon Martin i Julia Bell w J Neurol Psychiatry 1943;6:154-157.
- ↑ Boczkowski 1990 ↓, s. 15.
- ↑ a b c d e f g h i j k Mizerski 2013 ↓, s. 314.
- ↑ WGBH Educational Foundation
- ↑ a b c d e Boczkowski 1990 ↓, s. 49.
- ↑ a b c d Boczkowski 1990 ↓, s. 16.
- ↑ Walker FO. Huntington's disease. . 369 (9557), s. 218–28 [221], 2007. DOI: 10.1016/S0140-6736(07)60111-1. PMID: 17240289.
- ↑ a b c d Boczkowski 1990 ↓, s. 17.
- ↑ Genome British Columbia :: Finding of Rare Disease Genes in Canada (FORGE Canada) [online], www.genomebc.ca [dostęp 2017-01-28] (ang.).
- ↑ Genetics, „HealthLink BC” [dostęp 2017-01-28].
- ↑ Boczkowski 1990 ↓, s. 18.
- ↑ Boczkowski 1990 ↓, s. 19.
- ↑ Boczkowski 1990 ↓, s. 184.
- ↑ a b c Boczkowski 1990 ↓, s. 20.
- ↑ a b Boczkowski 1990 ↓, s. 21.
- ↑ Samantha L. Ginn, Ian E. Alexander, Michael L. Edelstein, Mohammad R. Abedi i inni. Gene therapy clinical trials worldwide to 2012 - an update. . 15 (2), s. 65–77, February 2013. DOI: 10.1002/jgm.2698.
- ↑ Prenatal Screening [online], www.bcwomens.ca [dostęp 2017-01-28] (ang.).
- ↑ Diagnostyka molekularna – BioInf [online], bioinfo.imdik.pan.pl [dostęp 2017-01-28] (pol.).
- ↑ Poste, G. (2001). "Molecular diagnostics: A powerful new component of the healthcare value chain".Expert Review of Molecular Diagnostics 1 (1): 1–5
- ↑ Hybrydyzacja w diagnostyce molekularnej
- ↑ Metody sekwencjonowania DNA - Artykuły - Laboratoria.net [online], laboratoria.net [dostęp 2017-01-28] (pol.).
- ↑ Cytometria Przepływowa BD - Artykuły - Biotechnologia.pl - łączymy wszystkie strony biobiznesu [online], biotechnologia.pl [dostęp 2017-01-28] (pol.).
- ↑ Roizen NJ, Patterson D. Down’s syndrome. „Lancet”. 361. 9365, s. 1281–9, 2003. PMID: 12699967.
- ↑ Jacek J. Pietrzyk. Zespół Downa. „Medycyna Praktyczna Pediatria”.
- ↑ Down Syndrome Research Foundation: Bright Beginnings: A Guide for New Parents. Buckinghamshire, UK: Down Syndrome Research Foundation, 2005.
- ↑ Snijders RJ, Sebire NJ, Nicolaides KH. Maternal age and gestational age-specific risk for chromosomal defects. „Fetal Diagn Ther”. 10. 6, s. 356-67, 1995. PMID: 8579773.
- ↑ Bartholin-Patau syndrome w bazie Who Named It (ang.)
- ↑ Patau K, Smith DW, Therman E, Inhorn SL, Wagner HP. Multiple congenital anomaly caused by an extra autosome. „Lancet”. 790, 1960. PMID: 14430807.
- ↑ Ada Chan, Satyan Lakshminrusimha, Reid Heffner, Federico Gonzalez-Fernandez. Histogenesis of retinal dysplasia in trisomy 13. „Diagnostic Pathology”. 2. 48, 2007. Szablon:Doi
- ↑ Robert G Best: Patau syndrome. eMedicine Pediatrics, 2006. [dostęp 16 września 2007]. (ang.).
- ↑ Robert G Best: Patau syndrome. eMedicine Pediatrics, 2006. [dostęp 16 września 2007]. (ang.).
- ↑ Iliopoulos D, Sekerli E, Vassiliou G, Sidiropoulou V, Topalidis A, Dimopoulou D, Voyiatzis N. Patau syndrome with a long survival (146 months): a clinical report and review of literature. „Am J Med Genet A”. 140. 1, s. 92-3, 2006. PMID: 16333832.
- ↑ Zoll B, Wolf J, Lensing-Hebben D, Pruggmayer M, Thorpe B. Trisomy 13 (Patau syndrome) with an 11-year survival. „Clin Genet”. 43. 1, s. 46-50, 1993. PMID: 8462196.
- ↑ Duarte AC, Menezes AI, Devens ES, Roth JM, Garcias GL, Martino-Roth MG. Patau syndrome with a long survival. A case report. „Genet Mol Res”. 3. 2, s. 288-92, 2004. PMID: 15266400.
- ↑ Nanjiani A, Hossain A, Mahgoub N. Patau syndrome. „J Neuropsychiatry Clin Neurosci”. 19. 2, s. 201-202, 2007. PMID: 17431076.
- ↑ Jan M. Friedman, Fred J. Dill, Micheal R. Hayden, Barbara C. McGillivray: Genetyka. Wrocław: Urban & Partner, 2000. ISBN 83-85842-91-8
- ↑ Jerzy Szczapa: Neonatologia. Warszawa: PZWL, 2000. ISBN 83-200-2475-7.
- ↑ a b c d e Dobrzańska A, Ryżko J: Pediatria. Podręcznik do Państwowego Egzaminu Lekarskiego i egzaminu specjalizacyjnego. Urban&Partner, 2005. ISBN 83-89581-25-6.
- ↑ GORLIN RJ, ANDERSON VE, SCOTT CR. Hypertrophied frenuli, oligophrenia, famflial trembling and anomalies of the hand. Report of four casesin one family and a forme fruste in another. „N Engl J Med”. 264, s. 486-9, 1961. PMID: 13707262.
- ↑ Towfighi J, Berlin CM, Ladda RL, Frauenhoffer EE, Lehman RA. Neuropathology of oral-facial-digital syndromes. „Arch Pathol Lab Med”. 109. 7, s. 642-6, 1985. PMID: 3839363.
- ↑ a b c d Biologia Claude A. Villee, dział: „Struktura i funkcje genów”, Wydanie IX według VII wydania amerykańskiego PWRiL, Warszawa 1990, tabelka na str. 751. ISBN 83-09-00748-5
- ↑ Ferrante MI, Giorgio G, Feather SA, Bulfone A, Wright V, Ghiani M, Selicorni A, Gammaro L, Scolari F, Woolf AS, Sylvie O, Bernard L, Malcolm S, Winter R, Ballabio A, Franco B. Identification of the gene for oral-facial-digital type I syndrome. „Am J Hum Genet”. 68. 3, s. 569-76, 2001. PMID: 11179005.
- ↑ Shilpa Chetty-John i inni, Fibrocystic disease of liver and pancreas; under-recognized features of the X-linked ciliopathy oral-facial-digital syndrome type 1 (OFD I), „American Journal of Medical Genetics Part A”, 10, 2010, s. 2640–2645, DOI: 10.1002/ajmg.a.33666, ISSN 1552-4833, PMID: 20818665, PMCID: PMC2963649 [dostęp 2017-01-03] (ang.).
- ↑ Fiorella Gurrieri i inni, Oral–facial–digital syndromes: Review and diagnostic guidelines, „American Journal of Medical Genetics Part A”, 24, 2007, s. 3314–3323, DOI: 10.1002/ajmg.a.32032, ISSN 1552-4833 [dostęp 2017-01-03] (ang.).
- ↑ D. Donnai, L. Kerzin-Storrar, R. Harris, Familial orofaciodigital syndrome type I presenting as adult polycystic kidney disease., „Journal of Medical Genetics”, 2, 1987, s. 84–87, DOI: 10.1136/jmg.24.2.84, ISSN 1468-6244, PMID: 3560172 [dostęp 2017-01-03] (ang.).
- ↑ Harrod MJ, Stokes J, Peede LF, Goldstein JL. Polycystic kidney disease in a patient with the oral-facial-digital syndrome - type I. „Clin Genet”. 9. 2, s. 183-6, 1976. PMID: 1248177.
- ↑ OROFACIODIGITAL SYNDROME I; OFD1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Niebuhr E.. The cri du chat syndrome. Epidemiology, cytogenetics and clinical features. „Hum Genet”. 44. 3, s. 227-75, 1978. PMID: 365706.
- ↑ Kjaer I., Niebuhr E.. Studies of cranial base in 23 patients with cri-du-chat syndrome suggest a cranial developmental field involved in the condition. „Am J Med Genet”. 82, s. 6-14, 1999. PMID: 9916835.
- ↑ Posmyk R., Midro, AT. Poradnictwo genetyczne w zespole monosomii 5p („krzyku kociego”). Część I. Diagnoza fenotypu. Fenotyp morfologiczny i fenotyp zachowania (behawioralny). „Przegląd Pediatryczny”. 33. 4, s. 265-272, 2003.
- ↑ Mainardi, PC. Cri du Chat syndrome. „Orphanet Journal of Rare Diseases”. 1. 33, 2006.
- ↑ Shannon NL, Maltby EL, Rigby AS, Quarrell OW. An epidemiological study of Wolf-Hirschhorn syndrome: life expectancy and cause of mortality. „Journal of medical genetics”. 10 (38), s. 674–9, październik 2001. PMID: 11584045.
- ↑ Aslan, H, Karaca, N, Basaran, S, Ermis, H, Ceylan, Y. Prenatal diagnosis of Wolf-Hirschhorn syndrome (4p-) in association with congenital hypospadias and foot deformity. „BMC Pregnancy and Childbirth”. 3. 1, 2003. PMID: 12546710.
- ↑ Douglas C. Bittel, Merlin G. Butler. Prader–Willi syndrome: clinical genetics, cytogenetics and molecular biology. „Expert Rev Mol Med”. 7. 14, 2005. DOI: 10.1017/S1462399405009531.
- ↑ Nicholls RD et al. Genetic imprinting suggested by maternal heterodisomy in nondeletion Prader-Willi syndrome. „Nature”. 342, s. 281-285, 1989. PMID: 2812027.
- ↑ Nicholls RD et al. Genetic imprinting suggested by maternal heterodisomy in nondeletion Prader-Willi syndrome. „Nature”. 342, s. 281-285, 1989. PMID: 2812027.
- ↑ [1], Wspólnie, Stowarzyszenie na Rzecz Dzieci z Rzadkimi Chorobami Genetycznymi i Ich Rodzin
- ↑ Lindgren AC, Barkeling B, Hagg A, Ritzen EM, Marcus C, Rossner S. Eating behavior in Prader-Willi syndrome, normal weight, and obese control groups. „J Pediat”. 137, s. 50-55, 2000. PMID: 10891821.
- ↑ Butler MG. Prader-Willi syndrome: current understanding of cause and diagnosis. „Am J Med Genet”. 35, s. 319-332, 1990. PMID: 2309779.
- ↑ Wharton RH, Wang T, Graeme-Cook F, Briggs S, Cole RE. Acute idiopathic gastric dilation with gastric necrosis in individuals with Prader-Willi syndrome. „Am J Med Genet”. 73, s. 437-41, 1997. PMID: 9415471.
- ↑ Stevenson DA, Heinemann J, Angulo M, Butler MG, Loker J, Rupe N, Kendell P, Cassidy SB, Scheimann A. Gastric rupture and necrosis in Prader-Willi syndrome. „J Pediatr Gastroenterol Nutr”. 45. 2, s. 272-4, 2007. PMID: 17667731.
- ↑ Hamilton CR, Jr, Scully RE, Kliman B. Hypogonadotropism in Prader-Willi syndrome: induction of puberty and spermatogenesis by clomiphene citrate. „Am J Med”. 52, s. 322-329, 1972. PMID: 5011391.
- ↑ Crinò A, Schiaffini R, Ciampalini P, Spera S, Beccaria L, Benzi F, Bosio L, Corrias A, Gargantini L, Salvatoni A, Tonini G, Trifirò G, Livieri C; Genetic Obesity Study Group of Italian Society of Pediatric endocrinology and diabetology (SIEDP). Hypogonadism and pubertal development in Prader-Willi syndrome. „Eur J Pediatr”. 162. 5, s. 327-33, 2003. DOI: 10.1007/s00431-002-1132-4. PMID: 12692714.
- ↑ Hered RW, Rogers S, Zang YF, Biglan AW. Ophthalmologic features of Prader-Willi syndrome. „J Pediatr Ophthalmol Strabismus”. 25. 3, s. 145-50, 1988. PMID: 3397859.
- ↑ Wise MS, Zoghbi H, Edwards M, Byrd LK, Guttmacher AE, Greenberg F. Hyperthermia in infants with Prader-Willi syndrome (Abstract). „Am J Med Genet”. 41, s. 528, 1991.
- ↑ Scardina GA, Fucà G, Messina P. Oral diseases in a patient affected with Prader-Willi syndrome. „Eur J Paediatr Dent”. 8. 2, s. 96-9, 2007. PMID: 1757193.
- ↑ DiGeorge AM. Congenital absence of the thymus and its immunologic consequences: concurrence with congenital hypoparathyroidism. White Plains, NY: March of Dimes-Birth Defects Foundation IV(1): 116-21. 1968
- ↑ M. Debbané, B. Glaser, MK. David, C. Feinstein i inni. Psychotic symptoms in children and adolescents with 22q11.2 deletion syndrome: Neuropsychological and behavioral implications.. „Schizophr Res”. 84 (2-3), s. 187-93, Jun 2006. DOI: 10.1016/j.schres.2006.01.019. PMID: 16545541.
- ↑ a b Klaus Czerwenka: Einführung in die Molekularbiologie / von Klaus Czerwenka; Mahmood Manavi; Kerstin Pischinger. Wien: Maudrich, 2003, s. 169–170. ISBN 3-85175-796-3.
- ↑ Barbara J. Bain: Leukaemia diagnosis. Oxford: Blackwell Science, 1999, s. 83. ISBN 0-632-05165-5.
- ↑ Jerzy Stachura, Wenancjusz Domagała: Patologia znaczy słowo o chorobie. Kraków: Wydawnictwo PAU, 2003. ISBN 83-88857-65-7.
- ↑ „Williams syndrome – Genetics Home Reference”. The U.S. National Library of Medicine. 2010.
- ↑ Zespół Williamsa-Beurena prezentacja dra Pyrkosza
- ↑ X Carrasco, S Castillo, T Arevena, P Rothhammer i inni. Williams syndrome: Pediatric, neurologic, and cognitive development. „Pediatric neurology”. 32 (3), 2005. DOI: 10.1016/j.pediatrneurol.2004.09.013. (ang.).
- ↑ Zespół Williamsa – porady dla nauczycieli
- ↑ Stratakis, CA, Rennert, OM. Turner syndrome: molecular and cytogenetics, dysmorphology, endocrine, and other clinical manifestations and their management. „Endocrinologist”. 4, s. 442–453, 1994.
- ↑ Łącka, K. Zespół Turnera – korelacja pomiędzy kariotypem a fenotypem. „Endokrynologia Polska”. 56. 6, s. 986-983, 2005. PMID: 16821224.
- ↑ P. Saenger, KA. Wikland, GS. Conway, M. Davenport i inni. Recommendations for the diagnosis and management of Turner syndrome.. „J Clin Endocrinol Metab”. 86 (7), s. 3061-9, Jul 2001. PMID: 11443168.
- ↑ Kelly, TE, Ferguson, JE, Golden, W. Survival of fetuses with 45,X: an instructive case and an hypothesis. „Am J Med Genet”. 42. 6, s. 825-826, 1992. PMID: 1554022.
- ↑ Held, KR, Kerber, S, Kaminsky, E, Singh, S, Goetz, P, Seemanova, E, Goedde, HW. Mosaicism in 45,X Turner syndrome: does survival in early pregnancy depend on the presence of two sex chromosomes?. „Human Genetics”. 88, s. 288–294, 1992. PMID: 1733830.
- ↑ Fernandez, R, Mendez, J, Pasaro, E. Turner syndrome: a study of chromosomal mosaicism. „Human Genetics”. 98, s. 29–35, 1996. PMID: 8682502.
- ↑ Gravholt CH. Epidemiological, endocrine and metabolic features in Turner syndrome. „European Journal of Endocrinology”. 151, s. 657–687, 2004. PMID: 16544046.
- ↑ a b c Visootsak, J, Graham, JM. Klinefelter syndrome and other sex chromosomal aneuploidies. „Orphanet Journal of Rare Diseases”. 1 (42), 2006. PMID: 17062147.
- ↑ Morris JK, Alberman E, Scott C, Jacobs P. „European Journal of Human Genetics”, 2007. Szablon:Doi
- ↑ R. Steffen. Zahnanomalien als Hinweis zur Diagnose einer genetischen Erkrankung – ein Fallbericht. „Medizinische Genetik”. s. 432-434. Szablon:Doi
- ↑ Kosowicz J. Zmiany radiologiczne czaszki w niedoczynności gonady męskiej. „Endokr Pol”. 19, s. 276, 1968.
- ↑ Kosowicz J, Rzymski K. Radiological features of the skull in Klinefelter's syndrome and male hypogonadism. „Clin Radiol”. 26. 3, s. 371-8, 1975. PMID: 1201634.
- ↑ Smyth, CM, Bremner, WJ. Klinefelter syndrome. „Archives of Internal Medicine”. 158, s. 1309-1314, 1998. PMID: 9645824.
- ↑ Położnictwo i ginekologia, tom 2. Grzegorz H. Bręborowicz (red.). Wydawnictwo Lekarskie PZWL, s. 692. 83-200-3082-X.
- ↑ a b Boczkowski 1990 ↓, s. 114.
- ↑ Kuliev A, Verlinsky Y. Preimplantation diagnosis: A realistic option for assisted reproduction and genetic practice. . 17 (2), s. 179–83, 2005. DOI: 10.1097/01.gco.0000162189.76349.c5. PMID: 15758612. [dostęp 2009-04-01].
- ↑ a b c d e f g h Mechanizmy dziedziczenia, [w:] Franciszek Dubert i inni, Biologia na czasie 3. Podręcznik dla liceum ogólnokształcącego i technikum. Zakres rozszerzony., Wydanie III, Warszawa: Nowa Era, 2016, s.93-96, ISBN 978-83-267-1711-6.
- ↑ Williams T. N., Obaro S. K.. Sickle cell disease and malaria morbidity: a tale with two tails. . 27 (7), s. 315–320, 2011.
- ↑ Genetic link to 4,000 diseases.
- ↑ 2: Single-Gene Inheritance. W: Anthony J.F. Griffiths, Wessler, Susan R., Carroll, Sean B., Doebley, John: Introduction to Genetic Analysis. Wyd. 10. New York: 2012. ISBN 978-1-4292-2943-2.
- ↑ a b Boczkowski 1990 ↓, s. 173.
- ↑ a b Boczkowski 1990 ↓, s. 174.
- ↑ a b Anthony J.F. Griffiths, Wessler, Susan R., Carroll, Sean B., Doebley, John: Introduction to Genetic Analysis. Wyd. 10. New York: 2012. ISBN 978-1-4292-2943-2.
- ↑ a b Sobczak K, de Mezer M, Michlewski G, Krol J, Krzyzosiak WJ. (2003) RNA structure of trinucleotide repeats associated with human neurological diseases. Nucleic Acids Research. Oct 1;31(19):5469-82 PMID 14500809
- ↑ a b J. Wynn, TM. King, MJ. Gambello, DK. Waller i inni. Mortality in achondroplasia study: a 42-year follow-up.. „Am J Med Genet A”. 143A (21), s. 2502–11, Nov 2007. DOI: 10.1002/ajmg.a.31919. PMID: 17879967.
- ↑ Achondroplazja - badania genetyczne [online], www.genomed.pl [dostęp 2016-12-26] (pol.).
- ↑ M. Dakouane Giudicelli, V. Serazin, CR. Le Sciellour, M. Albert i inni. Increased achondroplasia mutation frequency with advanced age and evidence for G1138A mosaicism in human testis biopsies.. „Fertil Steril”. 89 (6), s. 1651–6, Jun 2008. DOI: 10.1016/j.fertnstert.2007.04.037. PMID: 17706214.
- ↑ Achondroplazja, „Healthline” [dostęp 2016-12-26].
- ↑ Achondroplazja - czyli wrodzona choroba kości - O genetyce bez tajemnic, „O genetyce bez tajemnic”, 5 maja 2015 [dostęp 2016-12-26] (pol.).
- ↑ Plewka M, Kasprzak J. Zespół Brugadów. Polski Przegląd Kardiologiczny 3, 1, 65-67 (2001) ISSN 1507-5540
- ↑ B.Dąbrowska: Zespół Brugadów. Medycyna Praktyczna 6 (2001)
- ↑ Napolitano C, Priori SG. Brugada syndrome. „Orphanet J Rare Dis”. 1, s. 35, 2006. DOI: 10.1186/1750-1172-1-35. PMID: 16972995.
- ↑ BRUGADA SYNDROME 1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Ryszard Józef Podemski: Kompendium neurologii. Gdańsk: Via Medica, 2008, s. 504. ISBN 978-83-7555-054-2.
- ↑ Kana Yasukawa i inni, Dominant and Recessive Compound Heterozygous Mutations in Epidermolysis Bullosa Simplex Demonstrate the Role of the Stutter Region in Keratin Intermediate Filament Assembly, „Journal of Biological Chemistry”, 26, 2002, s. 23670–23674, DOI: 10.1074/jbc.M200974200, ISSN 0021-9258, PMID: 11973334 [dostęp 2017-01-03] (ang.).
- ↑ a b c Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations] http://www.jaad.org/article/S0190-9622(08)00208-9/abstract
- ↑ Pfendner, E. G., Sadowski, S. G., Uitto, J. Epidermolysis bullosa simplex: recurrent and de novo mutations in the KRT5 and KRT14 genes, phenotype/genotype correlations, and implications for genetic counseling and prenatal diagnosis. J. Invest. Derm. 125: 239-243, 2005. [PubMed: 16098032, related citations]
- ↑ Fine, J.-D., Eady, R. A. J., Bauer, E. A., Bauer, J. W., Bruckner-Tuderman, L., Heagerty, A., Hintner, H., Hovnanian, A., Jonkman, M. F., Leigh, I., McGrath, J. A., Mellerio, J. E., Murrell, D. F., Shimizu, H., Uitto, J., Vahlquist, A., Woodley, D., Zambruno, G. The classification of inherited epidermolysis bullosa (EB): report of the Third International Consensus Meeting on diagnosis and classification of EB. J. Am. Acad. Derm. 58: 931-950, 2008. [PubMed: 18374450, related citations]
- ↑ EPIDERMOLYSIS BULLOSA SIMPLEX, GENERALIZED w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Hacham-Zadeh, S., Rappersberger, K., Livshin, R., Konrad, K. Epidermolysis bullosa herpetiformis Dowling-Meara in a large family. J. Am. Acad. Derm. 18: 702-706, 1988. [PubMed: 3372762, related citations]
- ↑ EPIDERMOLYSIS BULLOSA SIMPLEX WITH MOTTLED PIGMENTATION; EBSMP w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ F.J.D. Smith i inni, Plectin deficiency results in muscular dystrophy with epidermolysis bullosa, „Nature Genetics”, 4, 1996, s. 450–457, DOI: 10.1038/ng0896-450 [dostęp 2017-01-03] (ang.).
- ↑ Skoczylas M., Kordek A., Łoniewska B., Maleszka R., Rudnicki J., Problemy kliniczne u chorych na odmianę Herlitza pęcherzowego oddzielania się naskórka. Postępy Neonatologii 2011;2(17):54-56
- ↑ EPIDERMOLYSIS BULLOSA SIMPLEX WITH MUSCULAR DYSTROPHY; EBSMD w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ S. Chavanas i inni, Splicing Modulation of Integrin (β4 Pre-mRNA Carrying a Branch Point Mutation Underlies Epidermolysis Bullosa with Pyloric Atresia Undergoing Spontaneous Amelioration With Ageing, „Human Molecular Genetics”, 11, 1999, s. 2097–2105, DOI: 10.1093/hmg/8.11.2097, ISSN 0964-6906, PMID: 10484780 [dostęp 2017-01-03] (ang.).
- ↑ Frédérique Vidal i inni, Integrin β4 mutations associated with junctional epidermolysis bullosa with pyloric atresia, „Nature Genetics”, 2, 1995, s. 229–234, DOI: 10.1038/ng0695-229 [dostęp 2017-01-03] (ang.).
- ↑ L Ruzzi i inni, A homozygous mutation in the integrin alpha6 gene in junctional epidermolysis bullosa with pyloric atresia., „The Journal of Clinical Investigation”, 12, 1997, DOI: 10.1172/JCI119474, ISSN 0021-9738, PMID: 9185503, PMCID: PMC508131 [dostęp 2017-01-03] (ang.).
- ↑ EPIDERMOLYSIS BULLOSA JUNCTIONALIS WITH PYLORIC ATRESIA w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ EPIDERMOLYSIS BULLOSA DYSTROPHICA, AUTOSOMAL DOMINANT; DDEB w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ C.A. Oakley i inni, The Cockayne-Touraine type of dominant dystrophic epidermolysis bullosa--ultrastructural similarities to the Pasini variant, „Acta Dermato-Venereologica”, 3, 1984, s. 253–256, ISSN 0001-5555, PMID: 6204490 [dostęp 2017-01-03].
- ↑ J. Diedrichson, D. Talanow, A. Safi, [Epidermolysis bullosa dystrophica (Hallopeau-Siemens syndrome) of the hand -- surgical strategy and results], „Handchirurgie, Mikrochirurgie, Plastische Chirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Handchirurgie: Organ Der Deutschsprachigen Arbeitsgemeinschaft Fur Mikrochirurgie Der Peripheren Nerven Und Gefasse: Organ Der V...”, 5, 2005, s. 316–322, DOI: 10.1055/s-2005-872849, ISSN 0722-1819, PMID: 16287016 [dostęp 2017-01-03].
- ↑ Bisgaard ML, Fenger K, Bülow S, Niebuhr E, Mohr J: Familial adenomatous polyposis (FAP): frequency, penetrance, and mutation rate. Hum Mutat 1994, 3:121–125.
- ↑ Rozen P, Samuel Z, Rabau M, Goldman G, Shomrat R, Legum C, Orr-Urtreger A : Familial adenomatous polyposis at the Tel Aviv Medical Center: demographic and clinical features. Fam Cancer 2001, 1:75–82.
- ↑ a b c ML. Leoz, S. Carballal, L. Moreira, T. Ocaña i inni. The genetic basis of familial adenomatous polyposis and its implications for clinical practice and risk management. „Appl Clin Genet”. 8, s. 95-107, 2015. DOI: 10.2147/TACG.S51484. PMID: 25931827.
- ↑ FG. Campos, M. Sulbaran, AV. Safatle-Ribeiro, CA. Martinez. Duodenal adenoma surveillance in patients with familial adenomatous polyposis. „World J Gastrointest Endosc”. 7 (10), s. 950-9, Aug 2015. DOI: 10.4253/wjge.v7.i10.950. PMID: 26265988.
- ↑ a b c d e Kory W. Jasperson, Randall W. Burt, APC-Associated Polyposis Conditions, 1998.
- ↑ E. Steinhagen, JG. Guillem, G. Chang, EE. Salo-Mullen i inni. The prevalence of thyroid cancer and benign thyroid disease in patients with familial adenomatous polyposis may be higher than previously recognized. „Clin Colorectal Cancer”. 11 (4), s. 304-8, Dec 2012. DOI: 10.1016/j.clcc.2012.01.006. PMID: 22425061.
- ↑ M. Kadmon, A. Tandara, C. Herfarth. Duodenal adenomatosis in familial adenomatous polyposis coli. A review of the literature and results from the Heidelberg Polyposis Register.. „Int J Colorectal Dis”. 16 (2), s. 63-75, Apr 2001. PMID: 11355321.
- ↑ BV. Dasari, KR. Gardiner. Management of adenocarcinoma of the small intestine.. „Gastrointest Cancer Res”. 3 (3), s. 121-2, May 2009. PMID: 19626156.
- ↑ a b S. Aretz, A. Koch, S. Uhlhaas, W. Friedl i inni. Should children at risk for familial adenomatous polyposis be screened for hepatoblastoma and children with apparently sporadic hepatoblastoma be screened for APC germline mutations?. „Pediatr Blood Cancer”. 47 (6), s. 811-8, Nov 2006. DOI: 10.1002/pbc.20698. PMID: 16317745.
- ↑ a b c d e f EJ. Groen, A. Roos, FL. Muntinghe, RH. Enting i inni. Extra-intestinal manifestations of familial adenomatous polyposis. „Ann Surg Oncol”. 15 (9), s. 2439-50, Sep 2008. DOI: 10.1245/s10434-008-9981-3. PMID: 18612695.
- ↑ LJ. Hughes, VV. Michels. Risk of hepatoblastoma in familial adenomatous polyposis.. „Am J Med Genet”. 43 (6), s. 1023-5, Aug 1992. DOI: 10.1002/ajmg.1320430621. PMID: 1329510.
- ↑ RP. Sanders, WL. Furman. Familial adenomatous polyposis in two brothers with hepatoblastoma: implications for diagnosis and screening. „Pediatr Blood Cancer”. 47 (6), s. 851-4, Nov 2006. DOI: 10.1002/pbc.20556. PMID: 16106429.
- ↑ FM. Giardiello, GJ. Offerhaus, DH. Lee, AJ. Krush i inni. Increased risk of thyroid and pancreatic carcinoma in familial adenomatous polyposis. „Gut”. 34 (10), s. 1394-6, Oct 1993. PMID: 8244108.
- ↑ F. Maire, P. Hammel, B. Terris, S. Olschwang i inni. Intraductal papillary and mucinous pancreatic tumour: a new extracolonic tumour in familial adenomatous polyposis.. „Gut”. 51 (3), s. 446-9, Sep 2002. PMID: 12171972.
- ↑ GJ. Offerhaus, MM. Entius, FM. Giardiello. Upper gastrointestinal polyps in familial adenomatous polyposis. „Hepatogastroenterology”. 46 (26). s. 667-9. PMID: 10370594.
- ↑ S. Garrean, J. Hering, A. Saied, J. Jani i inni. Gastric adenocarcinoma arising from fundic gland polyps in a patient with familial adenomatous polyposis syndrome.. „Am Surg”. 74 (1), s. 79-83, Jan 2008. PMID: 18274437.
- ↑ E. Half, D. Bercovich, P. Rozen. Familial adenomatous polyposis. „Orphanet J Rare Dis”. 4 (1), s. 22, Oct 2009. DOI: 10.1186/1750-1172-4-22. PMID: 19822006.
- ↑
 L. Sriboonnark, H. Arora, L. Falto-Aizpurua, S. Choudhary i inni. Costello syndrome with severe nodulocystic acne: unexpected significant improvement of acanthosis nigricans after oral isotretinoin treatment.. „Case Rep Pediatr”. 2015, s. 934865, 2015. DOI: 10.1155/2015/934865. PMID: 25815234.
L. Sriboonnark, H. Arora, L. Falto-Aizpurua, S. Choudhary i inni. Costello syndrome with severe nodulocystic acne: unexpected significant improvement of acanthosis nigricans after oral isotretinoin treatment.. „Case Rep Pediatr”. 2015, s. 934865, 2015. DOI: 10.1155/2015/934865. PMID: 25815234.
- ↑ Costello syndrome; CSTLO. Online Mendelian Inheritance in Man, 1991-11-20. [dostęp 2016-04-20]. (ang.).
- ↑ Pelc, Ciara i Krajewska-Walasek 2012 ↓, s. 24.
- ↑ a b Pelc, Ciara i Krajewska-Walasek 2012 ↓, s. 20.
- ↑ a b Costello syndrome ORPHA3071. Orphanet. [dostęp 2016-06-20]. (ang.).
- ↑ Magdalena Pelc, Elżbieta Ciara, Małgorzata Krajewska-Walasek. Zespół Costello jako przykład rzadkich zaburzeń funkcji szlaku sygnalnego Ras-MAPK: obraz kliniczny i diagnostyka molekularna choroby. „Pediatria Polska”. 87 (1), s. 19-32, 2012. DOI: 10.1016/S0031-3939(12)70590-5.
- ↑ Pelc, Ciara i Krajewska-Walasek 2012 ↓, s. 22.
- ↑ Boczkowski 1990 ↓, s. 284.
- ↑ FIBROBLAST GROWTH FACTOR RECEPTOR 2; FGFR2 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Marek P. Nowacki (red.): Rak jelita grubego. [zarchiwizowane z tego adresu (2013-09-23)].
- ↑ KE. Resnick, H. Hampel, R. Fishel, DE. Cohn. Current and emerging trends in Lynch syndrome identification in women with endometrial cancer.. „Gynecol Oncol”. 114 (1), s. 128-34, Jul 2009. DOI: 10.1016/j.ygyno.2009.03.003. PMID: 19375789.
- ↑ A. de la Chapelle. The incidence of Lynch syndrome.. „Fam Cancer”. 4 (3), s. 233-7, 2005. DOI: 10.1007/s10689-004-5811-3. PMID: 16136383.
- ↑ GL. Baiocchi, N. Portolani, W. Vermi, C. Baronchelli i inni. Lynch syndrome from a surgeon perspective: retrospective study of clinical impact of mismatch repair protein expression analysis in colorectal cancer patients less than 50 years old.. „BMC Surg”. 14, s. 9, 2014. DOI: 10.1186/1471-2482-14-9. PMID: 24533633.
- ↑ DC. Chung, AK. Rustgi. The hereditary nonpolyposis colorectal cancer syndrome: genetics and clinical implications.. „Ann Intern Med”. 138 (7), s. 560-70, Apr 2003. PMID: 12667026.
- ↑ M. Nowacki (red.): Nowotwory jelita grubego. Warszawa: Wydawnictwo Wiedza i Życie, 1996. ISBN 83-86805-86-2.
- ↑ HT. Lynch, A. de la Chapelle. Hereditary colorectal cancer.. „N Engl J Med”. 348 (10), s. 919-32, Mar 2003. DOI: 10.1056/NEJMra012242. PMID: 12621137.
- ↑ HT. Lynch, JF. Lynch, TA. Attard. Diagnosis and management of hereditary colorectal cancer syndromes: Lynch syndrome as a model.. „CMAJ”. 181 (5), s. 273-80, Sep 2009. DOI: 10.1503/cmaj.071574. PMID: 19654196.
- ↑ HT. Lynch, TC. Smyrk, PM. Lynch, SJ. Lanspa i inni. Adenocarcinoma of the small bowel in lynch syndrome II.. „Cancer”. 64 (10), s. 2178-83, Nov 1989. PMID: 2804907.
- ↑ HF. Vasen, JT. Wijnen, FH. Menko, JH. Kleibeuker i inni. Cancer risk in families with hereditary nonpolyposis colorectal cancer diagnosed by mutation analysis.. „Gastroenterology”. 110 (4), s. 1020-7, Apr 1996. PMID: 8612988.
- ↑ M. Aarnio, R. Sankila, E. Pukkala, R. Salovaara i inni. Cancer risk in mutation carriers of DNA-mismatch-repair genes.. „Int J Cancer”. 81 (2), s. 214-8, Apr 1999. PMID: 10188721.
- ↑ Y. Parc, C. Boisson, G. Thomas, S. Olschwang. Cancer risk in 348 French MSH2 or MLH1 gene carriers.. „J Med Genet”. 40 (3), s. 208-13, Mar 2003. PMID: 12624141.
- ↑ Henschen F: Morgagni’s syndrome. Jena, 1937.
- ↑ Koller MF, Papassotiropoulos A, Henke K, Behrends B, Noda S, Kratzer A, Hock C, Hofmann M. Evidence of a genetic basis of Morgagni-Stewart-Morel syndrome. A case report of identical twins. „Neuro-degenerative diseases”. 2 (2), s. 56–60, 2005. DOI: 10.1159/000089284. PMID: 16909048.
- ↑ Knies PT, Le Fever HE. Metabolic craniopathy: hyperostosis frontalis interna. Ann Intern Med 14: 1858-1892 (1941)
- ↑ Pawlikowski M, Komorowski J. Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome. „Lancet”. 8322 (1), s. 474, luty 1983. PMID: 6131191.
- ↑ Stewart RM: Localized cranial hyperostosis in insane. Journal of Neurology and Psychopathology 8, 321 (1928).
- ↑ Morgagni GB: Adversaria anatomica. VI. Animadversio 74. Padwa, 1719.
- ↑ Morgagni GB: De sedibus et causis morborum.Liv II. Wenecja, 1761.
- ↑ Morel F: L'hyperostose frontale interne. Syndrome de l'hyperostose frontale interne avec adipose et troubles cérébraux. Paryż, 1930.
- ↑ Morgagni-Stewart-Morel syndrome w bazie Who Named It (ang.)
- ↑ Pawlikowski, M., Komorowski, J. Hyperostosis frontalis, galactorrhoea/hyperprolactinaemia, and Morgagni-Stewart-Morel syndrome. (Letter) Lancet 321: 474 only, 1983. Note: Originally Volume I..
- ↑ Psychiatria. Podręcznik dla studentów medycyny. Bilikiewicz A (red.). Wydanie III Wydawnictwo Lekarskie PZWL, Warszawa 2006 s. 150 ISBN 83-200-3388-8
- ↑ a b
 S. Abdollahi Fakhim, N. Shahidi, M. Mousaviagdas. A case report: nager acrofacial dysostosis.. „Iran J Otorhinolaryngol”. 24 (66), s. 45-50, 2012. PMID: 24303385.
S. Abdollahi Fakhim, N. Shahidi, M. Mousaviagdas. A case report: nager acrofacial dysostosis.. „Iran J Otorhinolaryngol”. 24 (66), s. 45-50, 2012. PMID: 24303385.
- ↑ a b c d Robert Śmigiel, Aleksandra Jakubiak, Michał Błoch, Renata Posmyk, Bożena Marszałek-Kruk. Heterogenność kliniczna i genetyczna dyzostoz twarzowych. „Pediatria Polska”. 90 (1), s. 1-12, 2015. DOI: 10.1016/j.pepo.2014.10.004.
- ↑ Sonya Collins: Treating Tourette's: Histamine Gene May Be Behind Some Tic Disorders. Scientific American, 2011-05-17. [dostęp 2015-10-08].
- ↑ Sonya Collins. Terapia zespołu Tourette'a. „Świat Nauki”. nr 7 (239), s. 8, lipiec 2011. Prószyński Media. ISSN 0867-6380.
- ↑ Adam Bilikiewicz, Stanisław Pużyński, Jacek Wciórka, Janusz Rybakowski: Psychiatria. T. 2. Wrocław: Urban & Parner, 2003. ISBN 83-87944-72-6.
- ↑ Pooya Khan Mohammad Beigi, Maverakis: http://link.springer.com/10.1007/978-3-319-17819-6. DOI: 10.1007/978-3-319-17819-6.
- ↑ Wade, Nicholas. Japanese Scientists Identify Ear Wax Gene. , January 29, 2006.
- ↑ Yoshiura K, Kinoshita A, Ishida T. A SNP in the ABCC11 gene is the determinant of human earwax type. . 38 (3), s. 324–30, March 2006. DOI: 10.1038/ng1733. PMID: 16444273.
- ↑ Roces DP., Lüllmann-Rauch R, Peng J, Balducci C, Andersson C, Tollersrud O, Fogh J, Orlacchio A, Beccari T, Saftig P, von Figura K. Efficacy of enzyme replacement therapy in alpha-mannosidosis mice: a preclinical animal study.. „Hum Mol Genet”. 13. 18, s. 1979–88, 2004. DOI: 10.1093/hmg/ddh220. PMID: 15269179.
- ↑ Gotoda Y., Wakamatsu N., Kawai H., Nishida Y., Matsumoto T. Missense and nonsense mutations in the lysosomal alpha-mannosidase gene (MANB) in severe and mild forms of alpha-mannosidosis.. „Am J Hum Genet”. Oct;63. 4, s. 1015–24, 1998. DOI: 10.1086/302048. PMID: 9758606.
- ↑ MANNOSIDOSIS, ALPHA B, LYSOSOMAL w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Poenaru L., Girard S., Thepot F., Madelenat P., Huraux-Rendu C., Vinet MC., Dreyfus JC. Antenatal diagnosis in three pregnancies at risk for mannosidosis.. „Clin Genet”. Dec;16. 6, s. 428–32, 1980. PMID: 393435.
- ↑ Ockerman PA. A generalized storage disorder resembling Hurler's syndrome. Lancet 2: 239–241, 1967.
- ↑ Malm D, Nilssen O. Alpha-mannosidosis. „Orphanet J Rare Dis”. 3. 1, s. 21, 2008. DOI: 10.1186/1750-1172-3-21. PMID: 18651971.
- ↑ Alkaptonuria, „medonet.pl” [dostęp 2016-12-17].
- ↑ K. Ziaja, Choroby rzadkie: Alkaptonuria - choroba czarnego moczu [online], Choroby rzadkie [dostęp 2016-12-17].
- ↑ Obraz kliniczny alkaptonurii i ochronozy, „Reumatologia/Rheumatology”, ISSN 0034-6233 [dostęp 2016-12-17].
- ↑ Online Mendelian Inheritance in Man (OMIM). [dostęp 2013-01-25]. (ang.).
- ↑ Eugeniusz Kucharz: Reumatologia ( w Wielka Interna). Warszawa: Medical Tribune Polska, 2011, s. 375-377. ISBN 978-83-62597-06-2.
- ↑ Drenth JP, Waxman SG. Mutations in sodium-channel gene SCN9A cause a spectrum of human genetic pain disorders. „The Journal of clinical investigation”. 12 (117), s. 3603–9, grudzień 2007. DOI: 10.1172/JCI33297. PMID: 18060017.
- ↑ Yp Goldberg i inni, Human Mendelian pain disorders: a key to discovery and validation of novel analgesics, „Clinical Genetics”, 4, 2012, s. 367–373, DOI: 10.1111/j.1399-0004.2012.01942.x, ISSN 1399-0004 [dostęp 2016-12-30] (ang.).
- ↑ INDIFFERENCE TO PAIN, CONGENITAL, AUTOSOMAL RECESSIVE w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Anemia Sierpowata - przyczyny, objawy, leczenie, diagnoza anemii, „ZdrowyPortal.org - Portal o Zdrowiu”, 25 marca 2015 [dostęp 2016-12-17] (pol.).
- ↑ Anemia sierpowata: dziedziczna, nieuleczalna, śmiertelna, „medonet.pl” [dostęp 2016-12-17].
- ↑ Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom II. Andrzej Szczeklik (red.). Wydawnictwo Medycyna Praktyczna, 2005, s. 1456–1457. ISBN 83-7430-031-0.
- ↑ Artykuł o chorobie Andersen w Who named it? (ang.)
- ↑ Choroba Andersen w bazie Online Mendelian Inheritance In Man (ang.)
- ↑ Kaul R, Gao G.P, Aloya M et al. "Canavan disease; mutations among Jewish and non-Jewish patients", Am J Hum.Genet, 1994;55:34-41
- ↑ Canavan MM. Schilder's encephalitis periaxialis diffusa. Report of a case in a child aged sixteen and one-half months. „Archives of Neurology and Psychiatry”. 25, s. 299-308, 1931.
- ↑ Kozubski Wojciech: "Zaburzenia metaboliczne i genetyczne układu nerwowego". W: Choroby układu nerwowego. Wydawnictwo Lekarskie PZWL, Warszawa, 2004, 287. ISBN 83-200-2636-9
- ↑ Choroby metaboliczne układu nerwowego. W: Mirosław Mossakowski: Podstawy neuropatologii. Warszawa: Państwowy Zakład Wydawnictw Lekarskich, 1981.
- ↑ Canavan's disease w bazie Who Named It (ang.)
- ↑ CANAVAN DISEASE w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ GLYCOGEN STORAGE DISEASE III; GSD3 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Glycogenosis type 3 information Diseases Database [online], www.diseasesdatabase.com, 22 grudnia 2016 [dostęp 2016-12-24] (ang.).
- ↑ Glycogen Storage Disease Type III [online], www.nlm.nih.gov [dostęp 2016-12-24] (ang.).
- ↑ Glycogen-Storage Disease Type III. eMedicine. [dostęp 2010-06-11]. (ang.).
- ↑ Gaucher PCE. De l'epithelioma primitif de la rate, hypertrophie idiopathique de la rate sans leucemie. Academic thesis, Paris, France, 1882.
- ↑ GAUCHER DISEASE, TYPE I w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ GAUCHER DISEASE, TYPE II w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ GAUCHER DISEASE, TYPE III w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ GLYCOGEN STORAGE DISEASE VI w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Gisela Nogales-Gadea i inni, Knock-in mice for the R50X mutation in the PYGM gene present with McArdle disease, „Brain: A Journal of Neurology”, Pt 7, 2012, s. 2048–2057, DOI: 10.1093/brain/aws141, ISSN 1460-2156, PMID: 22730558 [dostęp 2016-02-27].
- ↑ A.L. Andreu i inni, McArdle disease: molecular genetic update, „Acta Myologica: Myopathies and Cardiomyopathies: Official Journal of the Mediterranean Society of Myology / Edited by the Gaetano Conte Academy for the Study of Striated Muscle Diseases”, 1, 2007, s. 53–57, ISSN 1128-2460, PMID: 17915571, PMCID: PMC2949323 [dostęp 2016-02-27].
- ↑ A. Martinuzzi i inni, McArdle's disease. The unsolved mystery of the reappearing enzyme, „The American Journal of Pathology”, 6, 1999, s. 1893–1897, DOI: 10.1016/S0002-9440(10)65447-8, ISSN 0002-9440, PMID: 10362816, PMCID: PMC1866615 [dostęp 2016-02-27].
- ↑ Renata Siciliani Scalco i inni, From exercise intolerance to functional improvement: the second wind phenomenon in the identification of McArdle disease, „Arquivos De Neuro-Psiquiatria”, 7, 2014, s. 538–541, ISSN 1678-4227, PMID: 25054987 [dostęp 2016-02-27].
- ↑ R. Quinlivan i inni, McArdle disease: a clinical review, „Journal of Neurology, Neurosurgery, and Psychiatry”, 11, 2010, s. 1182–1188, DOI: 10.1136/jnnp.2009.195040, ISSN 1468-330X, PMID: 20861058 [dostęp 2016-02-27].
- ↑ MIGOCKA-PATRZAŁEK M. i inni, Choroba McArdle’a: patogeneza i perspektywy terapii, „POSTEPY BIOLOGII KOMORKI”, 42 (3), 12 maja 2015, s. 431-433.
- ↑ Artykuł o chorobie McArdle'a w eMedicine (en)
- ↑ NIEMANN-PICK DISEASE, TYPE A w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ NIEMANN-PICK DISEASE, TYPE B w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ NIEMANN-PICK DISEASE, TYPE C1; NPC1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ NIEMANN-PICK DISEASE, TYPE C2 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Paweł P Liberski, Wielisław Papierz, Wojciech Kozubski, Iwona Kłoszewska, Mirosław Jan Mossakowski: Neuropatologia Mossakowskiego. Lublin: Wydawnictwo Czelej, 2005, s. 77-78. ISBN 83-89309-63-7.
- ↑ Niemann A. Ein unbekanntes Krankheitsbild. „Jahrbuch für Kinderheilkunde”. 79, s. 1-10, 1914.
- ↑ GLYCOGEN STORAGE DISEASE II w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Choroba Pompego
- ↑ Polska strona poświęcona chorobie Pompego
- ↑ United Pompe Foundation (ang.)
- ↑ choroba Pompego w Association for Glycogen Storage Disease (UK) (ang.)
- ↑ strona firmy Genzyme o chorobie Pompego (ang.)
- ↑ a b Stargardt's Disease
- ↑ STARGARDT DISEASE 1; STGD1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Okulistyka. Podstawy kliniczne. Maria Hanna Niżankowska (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2007, s. 399-401. ISBN 978-83-200-3224-6.
- ↑ Stargardt's disease w bazie Who Named It (ang.)
- ↑ K. B. Stargardt. Über familiäre, progressive Degeneration in der Makulagegend des Auges. „Albrecht von Graefes Archiv für Ophthalmologie”. 71, s. 534-50, 1909.
- ↑ a b c Tangier disease; TGD w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Genetics Home Reference.
- ↑ W.Januszewicz, F.Kokot (red.), Interna, Warszawa, Wydawnictwo Lekarskie PZWL, tom III, s. 1141-1142, ISBN 83-200-2873-6
- ↑ Tarui’s disease w bazie Who Named It (ang.)
- ↑ Artykuł w eMedicine
- ↑ TAY-SACHS DISEASE; TSD w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Connor M, Ferguson-Smith M: Podstawy genetyki medycznej. Warszawa: Wydawnictwo Lekarskie PZWL, 1997. ISBN 83-200-2250-9.
- ↑ P. J. Vinken. Leucodystrophies and poliodystrophies. North-Holland, 1970 s. 212
- ↑ T. Hamada, W.H. McLean, M. Ramsay, G.H. Ashton i inni. Lipoid proteinosis maps to 1q21 and is caused by mutations in the extracellular matrix protein 1 gene (ECM1). „Human Molecular Genetics”. 11 (7), s. 833-840, 2002. DOI: 10.1093/hmg/11.7.833. PMID: 11929856.
- ↑ M. Siebert, H.J. Markowitsch, P. Bartel. Amygdala, affect and cognition: evidence from 10 patients with Urbach-Wiethe disease. „Brain”. 126 (Pt 12), s. 2627-2637, 2003. DOI: 10.1093/brain/awg271. PMID: 12937075.
- ↑ S. Di Giandomenico, R. Masi, D. Cassandrini, M. El-Hachem i inni. Lipoid proteinosis: case report and review of the literature. „Acta Otorhinolaryngologica Italica”. 26 (3), s. 162-167, 2006. PMID: 17063986.
- ↑ LIPOID PROTEINOSIS OF URBACH AND WIETHE w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ PC. Bull, GR. Thomas, JM. Rommens, JR. Forbes i inni. The Wilson disease gene is a putative copper transporting P-type ATPase similar to the Menkes gene. „Nat Genet”. 5 (4), s. 327-37, 1993. DOI: 10.1038/ng1293-327. PMID: 8298639.
- ↑ Richard J. Epstein: Biologia molekularna człowieka. Molekularne podłoże zjawisk w stanie zdrowia i w przebiegu chorób. Lublin: Czelej, 2005, s. 589-590. ISBN 83-89309-64-5.
- ↑ a b c HYPEROSTOSIS CORTICALIS GENERALISATA w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ VAN BUCHEM DISEASE, TYPE 2 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ http://omim.org/entry/239100#14
- ↑ Robert K. Murray, Daryl K. Granner, Peter A. Mayes, Vicor W. Rodwell, Biochemia Harpera, Warszawa, Wydawnictwo Lekarskie PZWL, str. 225, 1995, ISBN 83-200-1798-X
- ↑ W. Januszewicz, F. Kokot (red.), Interna, Warszawa, Wydawnictwo Lekarskie PZWL, tom III, ss. 1141-1142, ISBN 83-200-2873-6
- ↑ http://www.emedicine.com/ped/topic2416.htm
- ↑ GLYCOGEN STORAGE DISEASE I w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ a b c CYSTINOSIS, LATE-ONSET JUVENILE OR ADOLESCENT NEPHROPATHIC TYPE w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ a b c Marlene Attard i inni, Severity of phenotype in cystinosis varies with mutations in the CTNS gene: predicted effect on the model of cystinosin, „Human Molecular Genetics”, 13, 1999, s. 2507–2514, DOI: 10.1093/hmg/8.13.2507, ISSN 0964-6906, PMID: 10556299 [dostęp 2016-12-25] (ang.).
- ↑ CYSTINOSIS, NEPHROPATHIC; CTNS w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ CYSTINOSIS, ADULT NONNEPHROPATHIC w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ H. Goldman i inni, Adolescent Cystinosis: Comparisons with Infantile and Adult Forms, „Pediatrics”, 6, 1971, s. 979–988, ISSN 0031-4005, PMID: 5141767 [dostęp 2016-12-25] (ang.).
- ↑ J Macías-Vidal i inni, Analysis of the CTNS gene in 32 cystinosis patients from Spain, „Clinical Genetics”, 5, 2009, s. 486–489, DOI: 10.1111/j.1399-0004.2009.01222.x, ISSN 1399-0004 [dostęp 2016-12-25] (ang.).
- ↑ Geraldine A. McDowell i inni, Linkage of the gene for cystinosis to markers on the short arm of chromosome 17, „Nature Genetics”, 2, 1995, s. 246–248, DOI: 10.1038/ng0695-246 [dostęp 2016-12-25] (ang.).
- ↑ EPIDERMODYSPLASIA VERRUCIFORMIS; EV w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Epidermodysplasia verruciformis na stronie DermIS.net (ang.)
- ↑ Stefania Jabłońska, Sławomir Majewski Choroby skóry i choroby przenoszone drogą płciową PZWL 2005, ISBN 83-200-3367-5
- ↑ Dziedziczny rak piersi i jajnika. W: Jacek Gronwald, Tomasz Byrski, Tomasz Huzarski, Oleg Oszurek, Janusz Menkiszak, Izabella Rzepka–Górska, Jan Lubiński: Nowotwory dziedziczne 2002. Profilaktyka, diagnostyka, leczenie. Poznań: Termedia Wydawnictwa Medyczne, 2002, s. 35-49. ISBN 83-916594-1-0.
- ↑ Fiona Lalloo, D Gareth R Evans. The pathology of familial breast cancer: Clinical and genetic counselling implications of breast cancer pathology. „Breast Cancer Res”. 1, s. 48-51, 1999. Szablon:Doi
- ↑ ESHRE: Guidelines for FISH-based PGD.
- ↑ a b Mizerski 2013 ↓, s. 316.
- ↑ Mutacje założycielskie – Dennis Drayna, Świat Nauki Nr 11 (171), listopad 2005; s. 35-41
- ↑ Robbins Patologia - Kumar, Cotran, Robbins, wyd I polskie pod redakcją Włodzimierza T. Olszewskiego, Wydawnictwo Medyczne Urban&Partner Wrocław 2005 ISBN 978-83-89581-92-1 str. 707
- ↑ CKE, Informator o egzaminie maturalnym z biologii od roku szkolnego 2014/2015, Warszawa 2013, zad. 16.
- ↑ Common causes of Libido symptoms - WrongDiagnosis.com
- ↑ Jerzy Stachura, Wenancjusz Domagała: Patologia : znaczy słowo o chorobie. T. 2, Patologia narządowa. Cz. 1. Kraków: PAU, 2005. ISBN 83-88857-92-4 (t.2, cz.1).
- ↑ HCV, HCV Prometeusze [online], www.prometeusze.pl [dostęp 2016-12-17] (ang.).
- ↑ a b [http://www.urologiapolska.pl/artykul.php?3288 Urologia Polska 2008/61/2 - Wrodzona ksantynuria – bardzo rzadka przyczyna hipourykemii i kamicy nerkowej] [online], www.urologiapolska.pl [dostęp 2016-12-25] (pol.).
- ↑ Kojima T, Nishina T, Kitamura M, Hosoya T, Nishioka K. Biochemical studies on the purine metabolism of four cases with hereditary xanthinuria. „Clin Chim Acta”. 137 (2), s. 189-98, 1984-02-28. PMID: 6423323.
- ↑ Ichida K, Amaya Y, Kamatani N, Nishino T, Hosoya T, Sakai O. Identification of two mutations in human xanthine dehydrogenase gene responsible for classical type I xanthinuria. „J Clin Invest”. 99 (10), s. 2391-7, 1997-05-15. DOI: 10.1172/JCI119421. PMID: 9153281.
- ↑ Dent CE, Philpot GR. Xanthinuria, an inborn error (or deviation) of metabolism. „The Lancet”. 266 (6804), s. 182–5, 1954-01-23. DOI: 10.1016/S0140-6736(54)91257-X. PMID: 13118765.
- ↑ Hille R. Structure and Function of Xanthine Oxidoreductase. „European journal of Inorganic Chemistry”. 10, s. 1913–1926, 2006. DOI: 10.1002/ejic.200600087.
- ↑ Steven M. Rowe, J.P. Clancy, Eric J. Sorscher. Głęboki oddech. „Świat Nauki”. nr. 9 (241), s. 51-53, wrzesień 2011. Prószyński Media. ISSN 0867-6380.
- ↑ T. Dörk, M. Macek, F. Mekus, B. Tümmler i inni. Characterization of a novel 21-kb deletion, CFTRdele2,3(21 kb), in the CFTR gene: a cystic fibrosis mutation of Slavic origin common in Central and East Europe. „Hum Genet”. 106 (3), s. 259-268, 2000. DOI: 10.1007/s004390000246. PMID: 10798353.
- ↑ E. Kerem, M. Corey, BS. Kerem, J. Rommens i inni. The relation between genotype and phenotype in cystic fibrosis--analysis of the most common mutation (delta F508). „N Engl J Med”. 323 (22), s. 1517-1522, 1990. DOI: 10.1056/NEJM199011293232203. PMID: 2233932.
- ↑ Brian D. Riedel. Gastrointestinal manifestations of cystic fibrosis. „Pediatric Annals”. 26, s. 235–241, 1997. PMID: 9114442. Tłumaczenie z komentarzem Wojciecha Cichego: Objawy ze strony układu pokarmowego u chorych na mukowiscydozę. „Medycyna Praktyczna Pediatria”. 2, s. 85-98, 1999.
- ↑ Zasady rozpoznawania i leczenia mukowiscydozy. Stanowisko Polskiej Grupy Roboczej Mukowiscydozy przy Zarządzie Głównym Polskiego Towarzystwa Pediatrycznego (1999). „Medycyna Praktyczna Pediatria”. 3, s. 64–74, 2000.
- ↑ SE. Gabriel, KN. Brigman, BH. Koller, RC. Boucher i inni. Cystic fibrosis heterozygote resistance to cholera toxin in the cystic fibrosis mouse model. „Science”. 266 (5182), s. 107-109, 1994. DOI: 10.1126/science.7524148. PMID: 7524148.
- ↑ Collazo T., Bofill AM., Clark Y., Hernández Y., Gómez M., Rodríguez F., Ramos MD., Giménez J., Casals T., Rojo M. Common mutations in cuban cystic fibrosis patients.. „Journal of cystic fibrosis : official journal of the European Cystic Fibrosis Society”. 1 (8), s. 47–9, styczeń 2009. DOI: 10.1016/j.jcf.2008.09.004. PMID: 18938114.
- ↑ G. Fanconi. Familiäre, infantile perniciosähnliche Anämie (perniziöses Blutbild und Konstitution). Jahrbuch für Kinderheilkunde und physische Erziehung, Wien,1927, 117: 257-280.
- ↑ Levitus M, Rooimans MA, Steltenpool J, Cool NF, Oostra AB, Mathew CG, Hoatlin ME, Waisfisz Q, Arwert F, de Winter JP, Joenje H. Heterogeneity in Fanconi anemia: evidence for 2 new genetic subtypes. „Blood”. 103, s. 2498-2503, 2004. PMID: 14630800.
- ↑ Fanconi's anaemia w bazie Who Named It (ang.)
- ↑ MYOCLONIC EPILEPSY OF UNVERRICHT AND LUNDBORG w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ H. Unverricht: Die Myoclonie. Wiedeń, F. Deutiche, 1891.
- ↑ H. B. Lundborg: Die progressive Myoklonus-Epilepsie (Unverricht's Myoklonie). Uppsala : Almqvist & Wiksell, 1903. 207 pages.
- ↑ Weinberg, W. Weitere Beitrage zur Theorie der Vererbung. 4. Ueber Methode und Fehlerquellen der Untersuchung auf Mendelsche Zahlen beim Menschen. Arch. Rass. Ges. Biol. 9: 165-174, 1912.
- ↑ J. Bland Sutton. A Case of General Seborrhœa or “Harlequin” Fœtus. „Med Chir Trans”. 69, s. 291–296, 1886. PMCID 2121560.
- ↑ Kelsell DP, Norgett EE, Unsworth H, Teh MT, Cullup T, Mein CA, Dopping-Hepenstal PJ, Dale BA, Tadini G, Fleckman P, Stephens KG, Sybert VP, Mallory SB, North BV, Witt DR, Sprecher E, Taylor AE, Ilchyshyn A, Kennedy CT, Goodyear H, Moss C, Paige D, Harper JI, Young BD, Leigh IM, Eady RA, O'Toole EA. Mutations in ABCA12 underlie the severe congenital skin disease harlequin ichthyosis. „Am J Hum Genet”. 76, s. 794-803, 2005. PMID: 15756637.
- ↑ Sherri J Bale, Gabriele Richard: Autosomal Recessive Congenital Ichthyosis. GeneReviews.
- ↑ DermAtlas.
- ↑ Choroby wewnętrzne. Tom II. Andrzej Szczeklik (red.). Kraków: Wydawnictwo Medycyna Praktyczna, 2006, s. 1951-1952. ISBN 83-7430-069-8.
- ↑ Fundacja SMA – objawy, klasyfikacja i leczenie rdzeniowego zaniku mięśni
- ↑ Kaposi M. Xeroderma pigmentosum. „Medizinische Jahrbucher”, s. 619-33, 1882.
- ↑ Stefania Jabłońska, Sławomir Majewski Choroby skóry i choroby przenoszone drogą płciową PZWL 2005, ISBN 83-200-3367-5
- ↑ Informacje na stronie New Zealand Dermatological Society (ang.)
- ↑ F. Marlhens, C. Bareil, JM. Griffoin, E. Zrenner i inni. Mutations in RPE65 cause Leber's congenital amaurosis.. „Nat Genet”. 17 (2), s. 139-41, Oct 1997. DOI: 10.1038/ng1097-139. PMID: 9326927.
- ↑ ALSTROM SYNDROME; ALMS w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Hearn T, Renforth GL, Spalluto C, Hanley NA, Piper K, Brickwood S, White C, Connolly V, Taylor JF, Russell-Eggitt I, Bonneau D, Walker M, Wilson DI. Mutation of ALMS1, a large gene with a tandem repeat encoding 47 amino acids, causes Alstrom syndrome. „Nature Genet”. 31, s. 79-83, 2002. PMID: 11941370. Szablon:Doi
- ↑ Alstrom CH, Hallgren B, Nilsson LB, Asander H. Retinal degeneration combined with obesity, diabetes mellitus and neurogenous deafness: a specific syndrome (not hitherto described) distinct from the Laurence-Moon-Biedl syndrome. A clinical endocrinological and genetic examination based on a large pedigree. „Acta Psychiat Neurol Scand”. 34. suppl 129, s. 1-35, 1959.
- ↑ Alström's syndrome w bazie Who Named It (ang.)
- ↑ Jan D Marshall, Sebastian Beck, Pietro Maffei, Jürgen K Naggert. Alström Syndrome. „European Journal of Human Genetics”. 15, s. 1193–1202, 2007. Szablon:Doi
- ↑ Tisha Joy, Henian Cao, Graeme Black, Rayaz Malik, Valentine Charlton-Menys, Robert A. Hegele, Paul N. Durrington. Alstrom syndrome (OMIM 203800): a case report and literature review. „Orphanet Journal of Rare Diseases”. 2. 49, 2007. Szablon:Doi
- ↑ Bloom, D. Congenital telangiectatic erythema resembling lupus erythematosus in dwarfs; probably a syndrome entity. „AMA American Journal of Diseases of Children”. 88. 6, 1954. PMID: 13206391.
- ↑ a b Straughen JE., Johnson J., McLaren D., Proytcheva M., Ellis N., German J., Groden J. A rapid method for detecting the predominant Ashkenazi Jewish mutation in the Bloom's syndrome gene.. „Human mutation”. 2 (11), s. 175–8, 1998. DOI: <175::AID-HUMU11>3.0.CO;2-W 10.1002/(SICI)1098-1004(1998)11:2<175::AID-HUMU11>3.0.CO;2-W. PMID: 9482582.
- ↑ 17. W: J Connor, M Ferguson-Smith, Ewa Bocian, Tadeusz Jerzy Mazurczak: Podstawy genetyki medycznej. Warszawa: Wydawnictwo Lekarskie PZWL, 1998, s. 211. ISBN 83-200-2250-9.
- ↑ Amor-Guéret M. Bloom syndrome, genomic instability and cancer: the SOS-like hypothesis.. „Cancer letters”. 1 (236), s. 1–12, maj 2006. DOI: 10.1016/j.canlet.2005.04.023. PMID: 15950375.
- ↑ CHEDIAK-HIGASHI SYNDROME; CHS w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Béguez César's syndrome w bazie Who Named It (ang.)
- ↑ [2] (ang.)
- ↑ A. Béguez César:Neutropenia crònica maligna familial con granulaciones atipicas de los leucocitos.Revista cubana de pediatría 15: 900-910 (1943).
- ↑ O. Higashi: Congenital gigantism of peroxidase granules. The first case ever reported of qualitative abnormality of proxidase. Tohoku Journal of Experimental Medicine 59: 315-332. (1953/1954)
- ↑ Krystyna Kubicka, Wanda Kawalec: Pediatria. Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 176-9. ISBN 83-200-3001-3.
- ↑ FANCONI-BICKEL SYNDROME; FBS w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Fanconi-Bickel syndrome w bazie Who Named It (ang.)
- ↑ A Slominski, G Ermak, M Mihm, ACTH receptor, CYP11A1, CYP17 and CYP21A2 genes are expressed in skin., „The Journal of Clinical Endocrinology & Metabolism”, 7, 1996, s. 2746–2749, DOI: 10.1210/jcem.81.7.8675607, ISSN 0021-972X [dostęp 2017-01-04].
- ↑ ADRENAL HYPERPLASIA, CONGENITAL, DUE TO 21-HYDROXYLASE DEFICIENCY w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ ADRENAL HYPERPLASIA, CONGENITAL, DUE TO STEROID 11-BETA-HYDROXYLASE DEFICIENCY w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Michael Connor, Malcolm Ferguson-Smith Podstawy genetyki medycznej. Wydawnictwo Lekarskie PZWL, 1998, ISBN 83-200-2250-9
- ↑ Gerd Herold (red.) Medycyna wewnętrzna Wydawnictwo lekarskie PZWL, 2006. ISBN 83-200-3380-2
- ↑ a b c d e MUCOPOLYSACCHARIDOSIS TYPE IX; MPS9. Online Mendelian Inheritance in Man, 1999-14-07. [dostęp 2016-06-18].
- ↑
 B. Triggs-Raine, TJ. Salo, H. Zhang, BA. Wicklow i inni. Mutations in HYAL1, a member of a tandemly distributed multigene family encoding disparate hyaluronidase activities, cause a newly described lysosomal disorder, mucopolysaccharidosis IX.. „Proc Natl Acad Sci U S A”. 96 (11), s. 6296-300, 1999. DOI: 10.1073/pnas.96.11.6296. PMID: 10339581.
B. Triggs-Raine, TJ. Salo, H. Zhang, BA. Wicklow i inni. Mutations in HYAL1, a member of a tandemly distributed multigene family encoding disparate hyaluronidase activities, cause a newly described lysosomal disorder, mucopolysaccharidosis IX.. „Proc Natl Acad Sci U S A”. 96 (11), s. 6296-300, 1999. DOI: 10.1073/pnas.96.11.6296. PMID: 10339581.
- ↑ Hyaluronidase deficiency ORPHA67041. Orphanet. [dostęp 2016-06-18]. (ang.).
- ↑ Axelrod FB, Gold-von Simson G. Hereditary sensory and autonomic neuropathies: types II, III, and IV. „Orphanet J Rare Dis”. 2, s. 39, 2007. DOI: 10.1186/1750-1172-2-39. PMID: 17915006.
- ↑ Slaugenhaupt S.A., Blumenfeld A., Gill S.P., Leyne M., Mull J., Cuajungco M.P., Liebert C.B., Chadwick B., Idelson M., Reznik L., Robbins C., Makalowska I., Brownstein M., Krappmann D., Scheidereit C., Maayan C., Axelrod F.B., Gusella J.F. Tissue-specific expression of a splicing mutation in the IKBKAP gene causes familial dysautonomia. „Am J Hum Genet”. 68. 3, s. 598-605, 2001. PMID: 11179008.
- ↑ Anderson S.L., Coli R., Daly I.W., Kichula E.A., Rork M.J., Volpi S.A., Ekstein J., Rubin B.Y. Familial dysautonomia is caused by mutations of the IKAP gene. „Am J Hum Genet”. 68. 3, s. 753-758, 2001. PMID: 11179021.
- ↑ Brunt P.W., McKusick V.A. Familial dysautonomia. A report of genetic and clinical studies, with a review of the literature. „Medicine (Baltimore)”. 49. 5, s. 343-374, 1971. PMID: 4322121.
- ↑ Riley C.M., Day R.L. Central autonomic dysfunction with defective lacrimation; report of five cases. „Pediatrics”. 3. 4, s. 468-478, 1949. PMID: 18118947.
- ↑ Neuropathy, hereditary sensory and autonomic, Type III; HSAN3 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Coupry I., Monnet L., Attia AA., Taine L., Lacombe D., Arveiler B. Analysis of CBP (CREBBP) gene deletions in Rubinstein-Taybi syndrome patients using real-time quantitative PCR. „Hum Mutat”. Mar;23. 3, s. 278-84, 2004. DOI: 10.1002/humu.20001. PMID: 14974086.
- ↑ Bentivegna A, Milani D, Gervasini C, Castronovo P, Mottadelli F, Manzini S, Colapietro P, Giordano L, Atzeri F, Divizia MT, Uzielli ML, Neri G, Bedeschi MF, Faravelli F, Selicorni A, Larizza L. Rubinstein-Taybi Syndrome: spectrum of CREBBP mutations in Italian patients. „BMC Medical Genetics”. 7. 77, 2006. PMID: 17052327.
- ↑ Rubinstein JH, Taybi H. Broad thumbs and toes and facial abnormalities. A possible mental retardation syndrome. „American Journal of Diseases of Children”. 105, s. 588-608, 1963. PMID: 13983033.
- ↑ Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC. Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report. „BMC Neurol”. 3. 3, 2003. PMID: 12839625.
- ↑ Ho NC, Sandusky S, Madike V, Francomano CA, Dalakas MC. Clinico-pathogenetic findings and management of chondrodystrophic myotonia (Schwartz-Jampel syndrome): a case report. „BMC Neurol”. 3. 3, 2003. PMID: 12839625.
- ↑ Stephen A Berman, Eric Dinnerstein: Schwartz-Jampel Syndrome. eMedicine Neurology, 2007. [dostęp 22 września 2007]. (ang.).
- ↑ SCHWARTZ-JAMPEL SYNDROME, TYPE 1; SJS1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Dagoneau N, Scheffer D, Huber C, Al-Gazali LI, Di Rocco M, Godard A, Martinovic J, Raas-Rothschild A, Sigaudy S, Unger S, Nicole S, Fontaine B, Taupin JL, Moreau JF, Superti-Furga A, Le Merrer M, Bonaventure J, Munnich A., Legeai-Mallet L, Cormier-Daire V. Null leukemia inhibitory factor receptor (LIFR) mutations in Stuve-Wiedemann/Schwartz-Jampel type 2 syndrome. „American journal of human genetics”. 2 (74), s. 298–305, luty 2004. DOI: 10.1086/381715. PMID: 14740318.
- ↑ Raas-Rothschild A, Ergaz-Schaltiel Z, Bar-Ziv J, Rein AJ. Cardiovascular abnormalities associated with the Stuve-Wiedemann syndrome. „American journal of medical genetics. Part A”. 2 (121A), s. 156–8, sierpień 2003. DOI: 10.1002/ajmg.a.20066. PMID: 12910496.
- ↑ Di Rocco M, Stella G, Bruno C, Doria Lamba L, Bado M, Superti-Furga A. Long-term survival in Stuve-Wiedemann syndrome: a neuro-myo-skeletal disorder with manifestations of dysautonomia. „Am J Med Genet A”. 118A. 4, s. 362-8, 2003. DOI: 10.1002/ajmg.a.10242. PMID: 12687669.
- ↑ Al-Gazali LI, Ravenscroft A, Feng A, Shubbar A, Al-Saggaf A, Haas D. Stüve-Wiedemann syndrome in children surviving infancy: clinical and radiological features. „Clin Dysmorphol”. 12. 1, s. 1-8, 2003. DOI: 10.1097/01.mcd.0000049260.13501.ec. PMID: 12514358.
- ↑ Gaspar IM, Saldanha T, Cabral P, Vilhena MM, Tuna M, Costa C, Dagoneau N, Daire VC, Hennekam RC. Long-term follow-up in Stuve-Wiedemann syndrome: a clinical report. „Am J Med Genet A”. 146A. 13, s. 1748-53, 2008. DOI: 10.1002/ajmg.a.32325. PMID: 18546280.
- ↑ Gardiner J, Barton D, Vanslambrouck JM, Braet F, Hall D, Marc J, Overall R. Defects in tongue papillae and taste sensation indicate a problem with neurotrophic support in various neurological diseases. „Neuroscientist”. 14. 3, s. 240-50, 2008. DOI: 10.1177/1073858407312382. PMID: 18270312.
- ↑ STUVE-WIEDEMANN SYNDROME w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Stüve-Wiedemann syndrome w bazie Who Named It (ang.)
- ↑ „Miopatie mitochondrialne” A. Kotulska, E. J. Kucharz, „Terapia” 5/2004 (pdf)
- ↑ Mitochondrial myopathies. S. DiMauro, Curr Opin Rheumatol. 2006 Nov;18(6):636-41
- ↑ United Mitochondrial Disease Foundation (ang.)
- ↑ Mitochondrial Disease Action Committee (ang.)
- ↑ a b Blanc H, Adams CA, Wallace DC. Differential nucleotide changes on the large rRNA gene of the mitochondrial DNA confer chloramphenicol resistance to two human cell lines. „Nucleic Acids Res”. 9, s. 5785-5795, 1981. PMID: 6273808.
- ↑ Kearsey SE, Craig IW. Altered ribosomal RNA genes in mitochondria from mammalian cells with chloramphenicol resistance. „Nature”. 290, s. 607-608, 1981. PMID: 7219548.
- ↑ a b c d Choroby mitochondrialne z przeważającym zajęciem ośrodkowego układu nerwowego. W: Hanna Mierzejewska: Choroby układu nerwowego. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2004, s. 251-252. ISBN 83-200-2636-9.
- ↑ Filosto M., Tomelleri G., Tonin P., Scarpelli M., Vattemi G., Rizzuto N., Padovani A., Simonati A. Neuropathology of mitochondrial diseases.. „Bioscience reports”. 1-3 (27), s. 23–30, czerwiec 2007. DOI: 10.1007/s10540-007-9034-3. PMID: 17541738.
- ↑ Patrick Yu-Wai-Man, Patrick F Chinnery. Leber Hereditary Optic Neuropathy. „GeneRewievs”.
- ↑ Nikoskelainen EK, Marttila RJ, Huoponen K, Juvonen V, Lamminen T, Sonninen P, Savontaus ML. Leber's "plus": neurological abnormalities in patients with Leber's hereditary optic neuropathy. „J Neurol Neurosurg Psychiatry”. 59. 2, s. 160-4, 1995. PMID: 7629530.
- ↑ „Miopatie mitochondrialne” A. Kotulska, E. J. Kucharz, „Terapia” 5/2004 (pdf)
- ↑ SG. Pavlakis, PC. Phillips, S. DiMauro, DC. De Vivo i inni. Mitochondrial myopathy, encephalopathy, lactic acidosis, and strokelike episodes: a distinctive clinical syndrome. „Ann Neurol”. 16 (4), s. 481-8, Oct 1984. DOI: 10.1002/ana.410160409. PMID: 6093682.
- ↑ MITOCHONDRIAL MYOPATHY, ENCEPHALOPATHY, LACTIC ACIDOSIS, AND STROKE-LIKE EPISODES; MELAS w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Hirano M, Silvestri G, Blake DM, Lombes A, Minetti C, Bonilla E, Hays AP, Lovelace RE, Butler I, Bertorini TE, Threlkeld AB, Mitsumoto H, Salberg LM, Rowland LP, DiMauro S. Mitochondrial neurogastrointestinal encephalomyopathy (MNGIE): clinical, biochemical, and genetic features of an autosomal recessive mitochondrial disorder. „Neurology”. 44 (4), s. 721-7, kwiecień 1994. PMID: 8164833.
- ↑ THYMIDINE PHOSPHORYLASE: TYMP w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ POLYMERASE, DNA, GAMMA; POLG w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ MITOCHONDRIAL NEUROGASTROINTESTINAL ENCEPHALOPATHY SYNDROME; MNGIE w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ NEUROPATHY, ATAXIA, AND RETINITIS PIGMENTOSA w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Rotig A, Colonna M, Bonnefont JP, Blanche S, Fischer A, Saudubray JM, Munnich A. Mitochondrial DNA deletion in Pearson's marrow/pancreas syndrome (Letter). „Lancet”. I, s. 902-3, 1989.
- ↑ PEARSON MARROW-PANCREAS SYNDROME w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Boczkowski 1990 ↓, s. 174-176.
- ↑ Datta AK, Ghosh T, Nayak K, Ghosh M. Menkes kinky hair disease: A case report. „Cases J”. 1. 1, s. 158, 2008. DOI: 10.1186/1757-1626-1-158. PMID: 18801184.
- ↑ Kim BE., Smith K., Meagher CK., Petris MJ. A conditional mutation affecting localization of the Menkes disease copper ATPase. Suppression by copper supplementation.. „The Journal of biological chemistry”. 46 (277), s. 44079–84, listopad 2002. DOI: 10.1074/jbc.M208737200. PMID: 12221109.
- ↑ Tønnesen T., Kleijer WJ., Horn N. Incidence of Menkes disease.. „Human genetics”. 4 (86), s. 408–10, luty 1991. PMID: 1999344.
- ↑ Voskoboinik I., Camakaris J. Menkes copper-translocating P-type ATPase (ATP7A): biochemical and cell biology properties, and role in Menkes disease.. „Journal of bioenergetics and biomembranes”. 5 (34), s. 363–71, październik 2002. PMID: 12539963.
- ↑ OMIM#304150
- ↑ Neurologia. Podręcznik dla studentów medycyny. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2006, s. 252-253. ISBN 83-200-3244-X.
- ↑ Sharpe, L.T.; Stockman, A.; Jägle, H.; Nathans, J. (1999). Opsin genes, cone photopigments, color vision and color blindness, rozdział w: Gegenfurtner, K. R.; Sharpe, L. T. Color Vision: From Genes to Perception. Cambridge University Press. ISBN 978-0-521-00439-8
- ↑ Internetowa encyklopedia PWN. [dostęp 2014-11-02].
- ↑ MUSCULAR DYSTROPHY, DUCHENNE TYPE; DMD w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ JR Mendell, Z Sahenk, TW Prior. The childhood muscular dystrophies: diseases sharing a common pathogenesis of membrane instability. „J Child Neurol”. 10 (2), s. 150–159, 1995. DOI: 10.1177/088307389501000219. PMID: 7782608.
- ↑
 P. Ferrier, F. Bamatter, D. Klein. Muscular Dystrophy (Duchenne) in a Girl with Turner's Syndrome. „J Med Genet”. 2 (1), s. 38-46, 1965. DOI: 10.1136/jmg.2.1.38. PMID: 14296923. PMCID: PMC1012803.
P. Ferrier, F. Bamatter, D. Klein. Muscular Dystrophy (Duchenne) in a Girl with Turner's Syndrome. „J Med Genet”. 2 (1), s. 38-46, 1965. DOI: 10.1136/jmg.2.1.38. PMID: 14296923. PMCID: PMC1012803.
- ↑ Biuletyn informacyjny Polskiego Stowarzyszenia Chorych na Hemofilię
- ↑ A. Buczma, J. Windyga. Acquired haemophilia. „Pol Arch Med Wewn”. 117 (5-6), s. 241-5, 2007. PMID: 18030874. (wersja polska: Hemofilia nabyta)
- ↑ Podstawy hematologii. Anna Dmoszyńska, Tadeusz Robak. Lublin: Wydawnictwo Czelej, 2003, s. 374-382. ISBN 83-88063-94-4.
- ↑ a b c d e f g
 Bożena Werner, Joanna Trubicka, Ewa Pronicka. Aspekty kliniczne i diagnostyczne zespołu Bartha (kardiomiopatia sprzężona z chromosomem X). „Kardiologia Polska”. 59 (11), s. 1177–1180, 2011.
Bożena Werner, Joanna Trubicka, Ewa Pronicka. Aspekty kliniczne i diagnostyczne zespołu Bartha (kardiomiopatia sprzężona z chromosomem X). „Kardiologia Polska”. 59 (11), s. 1177–1180, 2011.
- ↑ a b c d e f g h
 Sarah L.N. Clarke, Ann Bowron, Iris L. Gonzalez, Sarah J. Groves i inni. Barth syndrome. „Orphanet Journal of Rare Diseases”, 2013. DOI: 10.1186/1750-1172-8-23. PMID: 23398819. (ang.).
Sarah L.N. Clarke, Ann Bowron, Iris L. Gonzalez, Sarah J. Groves i inni. Barth syndrome. „Orphanet Journal of Rare Diseases”, 2013. DOI: 10.1186/1750-1172-8-23. PMID: 23398819. (ang.).
- ↑ Barth syndrome, BTHS. [dostęp 2016-04-09].
- ↑ Binder V, Albert MH, Kabus M, Bertone M, Meindl A, Belohradsky BH. The genotype of the original Wiskott phenotype. „N. Engl. J. Med.”, s. 1790-3, 2006. DOI: 10.1056/NEJMoa062520. PMID: 17065640.
- ↑ Aldrich RA, Steinberg AG, Campbell DC. Pedigree demonstrating a sex-linked recessive condition characterized by draining ears, eczematoid dermatitis and bloody diarrhea. „Pediatrics”. 13. 2, s. 133-9, 1954. PMID: 13133561.
- ↑ Jin Y., Mazza C., Christie JR., Giliani S., Fiorini M., Mella P., Gandellini F., Stewart DM., Zhu Q., Nelson DL., Notarangelo LD., Ochs HD. Mutations of the Wiskott-Aldrich Syndrome Protein (WASP): hotspots, effect on transcription, and translation and phenotype/genotype correlation.. „Blood”. 13 (104), s. 4010–9, grudzień 2004. DOI: 10.1182/blood-2003-05-1592. PMID: 15284122.
- ↑ A Wiskott. Familiärer, angeborener Morbus Werlhofii? ("Familial congenital Werlhof's disease?"). „Montsschr Kinderheilkd”, s. 212-16, 1937.
- ↑ a b c Boczkowski 1990 ↓, s. 176.
- ↑ Katarzyna Grzanka, Eugeniusz Józef Kucharz, KRZYWICA OPORNA NA WITAMINĘ D, „ResearchGate” [dostęp 2016-12-22].
- ↑ THYMIDINE PHOSPHORYLASE: TYMP w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ POLYMERASE, DNA, GAMMA; POLG w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Macedo LC., Soardi FC., Ananias N., Belangero VM., Rigatto SZ., De-Mello MP., D'Souza-Li L. Mutations in the vitamin D receptor gene in four patients with hereditary 1,25-dihydroxyvitamin D-resistant rickets.. „Arquivos brasileiros de endocrinologia e metabologia”. 8 (52), s. 1244–51, listopad 2008. PMID: 19169476.
- ↑ Nicolaidou P., Tsitsika A., Papadimitriou A., Karantana A., Papadopoulou A., Psychou F., Liakopoulou D., Georgouli H., Kakourou T., Chrousos G. Hereditary vitamin D-resistant rickets in Greek children: genotype, phenotype, and long-term response to treatment.. „Journal of pediatric endocrinology & metabolism : JPEM”. 3 (20), s. 425–30, marzec 2007. PMID: 17451081.
- ↑ Zespół Retta | [online], rettsyndrome.pl [dostęp 2016-12-17].
- ↑ A.T.Midro: Genetyczne podłoże zespołu Retta – gen MECP2. Neurologia Dziecięca. [dostęp 16 kwietnia 2010].
- ↑ Zespół Retta, „medonet.pl” [dostęp 2016-12-17].
- ↑ Rett A. Cerebral atrophy associated with hyperammonaemia. „Clin Neurol”, s. 305–329, 1977.
- ↑ Bentkowski Z., Tylko-Szymańska A.. Zespół Retta – aktualny stan wiedzu. „Pediatria Polska”. LXXII.2, s. 104, 1997.
- ↑ Richards RI. Dynamic mutations: a decade of unstable expanded repeats in human genetic disease.. „Hum Mol Genet”. Oct 1;10. 20, s. 2187-94, 2001. PMID: 11673400.
- ↑ Brown T.A.: Genomy. Warszawa: Wydawnictwo Naukowe PWN, 2001. ISBN 83-01-13439-9.
- ↑ a b c Delatycki MB, Williamson R, Forrest SM. Friedreich ataxia: an overview. „J Med Genet”. 37. 1, s. 1-8, 2000. PMID: 10633128.
- ↑ European Friedreich's Ataxia Consortium for Translational Studies
- ↑ Christodoulou K, Deymeer F, Serdaroğlu P, Ozdemir C, Poda M, Georgiou DM, Ioannou P, Tsingis M, Zamba E, Middleton LT. Mapping of the second Friedreich's ataxia (FRDA2) locus to chromosome 9p23-p11: evidence for further locus heterogeneity. Neurogenetics. 2001;3(3):127-32. PMID 11523563
- ↑ Gottesfeld JM. Small molecules affecting transcription in Friedreich ataxia. Pharmacol Ther. 2007 Nov;116(2):236-48. PMID 17826840
- ↑ Cooper JM, Schapira AH. Friedreich's ataxia: coenzyme Q10 and vitamin E therapy. Mitochondrion. 2007;7 Suppl:S127-35. PMID 17485244
- ↑ Puccio H, Koenig M. Friedreich ataxia: a paradigm for mitochondrial diseases. Curr Opin Genet Dev. 2002; 12(3):272-7. PMID 12076669
- ↑ FRDA1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ FRDA2 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Palau F. Friedreich's ataxia and frataxin: molecular genetics, evolution and pathogenesis. Int J Mol Med. 2001;7(6):581-9. PMID 11351269
- ↑ Harding, A. E., Thomas, P. K., Baraitser, M., Bradbury, P. G., Morgan-Hughes, J. A., Ponsford, J. R. X-linked recessive bulbospinal neuronopathy: a report of ten cases. J. Neurol. Neurosurg. Psychiat. 45: 1012-1019, 1982.
- ↑ a b Spinal and bulbar muscular atrophy, X-linked 1; SMAX1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Albert R. La Spada i inni, Meiotic stability and genotype – phenotype correlation of the trinucleotide repeat in X–linked spinal and bulbar muscular atrophy, „Nature Genetics”, 4, 1992, s. 301–304, DOI: 10.1038/ng1292-301 [dostęp 2016-12-27] (ang.).
- ↑ Choroby układu nerwowego. Wojciech Kozubski, Paweł P. Liberski (red.). Warszawa: Wydawnictwo Lekarskie PZWL, 2004. ISBN 83-200-2636-9.
- ↑ Natasha J. Caplen i inni, Rescue of polyglutamine-mediated cytotoxicity by double-stranded RNA-mediated RNA interference, „Human Molecular Genetics”, 2, 2002, s. 175–184, DOI: 10.1093/hmg/11.2.175, ISSN 0964-6906, PMID: 11809726 [dostęp 2016-12-27] (ang.).
- ↑ S. Dejager i inni, A Comprehensive Endocrine Description of Kennedy’s Disease Revealing Androgen Insensitivity Linked to CAG Repeat Length, „The Journal of Clinical Endocrinology & Metabolism”, 8, 2002, s. 3893–3901, DOI: 10.1210/jcem.87.8.8780, ISSN 0021-972X [dostęp 2016-12-27].
- ↑ a b c d e f MACHADO-JOSEPH DISEASE; MJD w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ E.C. Twist i inni, Machado Joseph disease maps to the same region of chromosome 14 as the spinocerebellar ataxia type 3 locus., „Journal of Medical Genetics”, 1, 1995, s. 25–31, DOI: 10.1136/jmg.32.1.25, ISSN 1468-6244, PMID: 7897622 [dostęp 2017-01-04] (ang.).
- ↑ André Toulouse i inni, Ribosomal frameshifting on MJD-1 transcripts with long CAG tracts, „Human Molecular Genetics”, 18, 2005, s. 2649–2660, DOI: 10.1093/hmg/ddi299, ISSN 0964-6906, PMID: 16087686 [dostęp 2017-01-04] (ang.).
- ↑ S. Gispert i inni, Chromosomal assignment of the second locus for autosomal dominant cerebellar ataxia (SCA2) to chromosome 12q23–24.1, „Nature Genetics”, 3, 1993, s. 295–299, DOI: 10.1038/ng0793-295 [dostęp 2017-01-04] (ang.).
- ↑ Franca, M. C., Jr., D'Abreu, A., Nucci, A., Lopes-Cendes, I. Muscle excitability abnormalities in Machado-Joseph disease. Arch. Neurol. 65: 525-529, 2008. [PubMed: 18413477, related citations]
- ↑ A Trott i inni, Spinocerebellar ataxias in 114 Brazilian families: clinical and molecular findings, „Clinical Genetics”, 2, 2006, s. 173–176, DOI: 10.1111/j.1399-0004.2006.00656.x, ISSN 1399-0004 [dostęp 2017-01-04] (ang.).
- ↑ Coutinho, P., Andrade, C. Autosomal dominant system degeneration in Portuguese families of the Azores Islands: a new genetic disorder involving cerebellar, pyramidal, extrapyramidal and spinal cord motor functions. Neurology 28: 703-709, 1978. [PubMed: 566869, related citations]
- ↑ Eto, K., Sumi, S. M., Bird, T. D., McEvoy-Bush, T., Boehnke, M., Schellenberg, G. Family with dominantly inherited ataxia, amyotrophy, and peripheral sensory loss: spinopontine atrophy or Machado-Joseph Azorean disease in another non-Portuguese family? Arch. Neurol. 47: 968-974, 1990. [PubMed: 2396938, related citations]
- ↑ Mizerski 2013 ↓.
- ↑ Andrzej Szczeklik (red.) Choroby wewnętrzne. Przyczyny, rozpoznanie i leczenie, tom I. Wydawnictwo Medycyna Praktyczna, 2005. ISBN 83-7430-031-0.
- ↑ a b K. Ziaja, Choroby rzadkie: Dystrofia miotoniczna, czyli choroba Crushmanna-Steinerta [online], Choroby rzadkie [dostęp 2016-12-29] (pol.).
- ↑ Brown T.A.: Genomy. Warszawa: Wydawnictwo Naukowe PWN, 2001. ISBN 83-01-13439-9.
- ↑ a b DYSTROPHIA MYOTONICA 1 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Zuzana Musova i inni, Highly unstable sequence interruptions of the CTG repeat in the myotonic dystrophy gene, „American Journal of Medical Genetics Part A”, 7, 2009, s. 1365–1374, DOI: 10.1002/ajmg.a.32987, ISSN 1552-4833 [dostęp 2016-12-29] (ang.).
- ↑ Harper, P. S., Dyken, P. R. Early-onset dystrophia myotonica: evidence supporting a maternal environmental factor. Lancet 300: 53-55, 1972. Note: Originally Volume II. [PubMed: 4113301, related citations]
- ↑ Antonini, G., Giubilei, F., Mammarella, A., Amicucci, P., Fiorelli, M., Gragnani, F., Morino, S., Ceschin, V., Fragola, P. V., Gennarelli, M. Natural history of cardiac involvement in myotonic dystrophy: correlation with CTG repeats. Neurology 55: 1207-1209, 2000Sign In [online] [dostęp 2016-12-29].
- ↑ P. Turnpenny, C. Clark, K. Kelly, Intelligence quotient profile in myotonic dystrophy, intergenerational deficit, and correlation with CTG amplification., „Journal of Medical Genetics”, 4, 1994, s. 300–305, DOI: 10.1136/jmg.31.4.300, ISSN 1468-6244, PMID: 8071955 [dostęp 2016-12-29] (ang.).
- ↑ Suominen, T., Bachinski, L. L., Auvinen, S., Hackman, P., Baggerly, K. A., Angelini, C., Peltonen, L., Krahe, R., Udd, B. Population frequency of myotonic dystrophy: higher than expected frequency of myotonic dystrophy type 2 (DM2) mutation in Finland. Europ. J. Hum. Genet. 19: 776-782, 2011. [PubMed: 21364698, related citations] [Full text: http://www.nmd-journal.com/article/S0960-8966(03)00092-0/abstract]
- ↑ DH Cho, SJ Tapscott. Myotonic dystrophy: emerging mechanisms for DM1 and DM2. „Biochim Biophys Acta”. 1772 (2), s. 195-204, luty 2007. DOI: 10.1016/j.bbadis.2006.05.013. PMID: 16876389.
- ↑ K. Ziaja, Choroby rzadkie: Choroba Rickera - dystrofia miotoniczna typu 2 [online], Choroby rzadkie [dostęp 2016-12-29] (pol.).
- ↑ DYSTROPHIA MYOTONICA 2; DM2 w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Glossary > Premutation. [w:] Genetics Home Reference [on-line]. ghr.nlm.nih.gov, November 19, 2013. [dostęp 2013-11-23]. (ang.).
- ↑ Janusz Krzyżowski: Leksykon Psychiatrii i Nauk Pokrewnych. Warszawa: Medyk, 2010. ISBN 978-83-89745-68-2.
- ↑ Fragile X Syndrome. [w:] Medical TheFreeDictionary [on-line]. Farlex. [dostęp 2013-11-23]. (ang.).
- ↑ The Merck Manual. Podręcznik diagnostyki i terapii
- ↑ FRAGILE X MENTAL RETARDATION SYNDROME w bazie Online Mendelian Inheritance in Man (ang.)
- ↑ Zespół łamliwego chromosomu X - leczenie, objawy na Zdrowegeny.pl [online], zdrowegeny.pl [dostęp 2016-07-11].
- ↑ a b c d e f g h i j k l m Boczkowski 1990 ↓, s. 138.
- ↑ a b Boczkowski 1990 ↓, s. 132-142.
- ↑ Gary R. Lichtenstein, Stephen B. Hanauer, William J. Sandborn, and The Practice Parameters Committee of the American College of Gastroenterology. Management of Crohn’s Disease in Adults. „The American Journal of GASTROENTEROLOGY”. 104, s. 465–483, 2009. DOI: 10.1038/ajg.2008.168. (ang.).
- ↑ E F Stange, S P L Travis, S Vermeire, C Beglinger i inni. European evidence based consensus on the diagnosis and management of Crohn’s disease: definitions and diagnosis. „GUT. An International Journal of Gastroenterology and Hepatology”. 55(suppl 1), s. i1-i15, 2006. DOI: 10.1136/gut.2005.081950a. (ang.).
- ↑ Leśniowski, A. Przyczynek do chirurgii kiszek. „Medycyna (Warszawa)”. 31, s. 460-464, 483–489, 514-518, 1903.
- ↑ Crohn, BB, Ginzburg, L, Oppenheimer, GD. Regional ileitis; a pathologic and clinical entity. „Journal of the American Medical Association (Chicago)”. 99, s. 1323-1329, 1932.
- ↑ Vermeire S. NOD2/CARD15: relevance in clinical practice. „Best Pract Res Clin Gastroenterol”. 18, s. 569-75, 2004. PMID: 15157828.
- ↑ Hugot J P et al.. Prevalence of CARD15/NOD2 mutations in Caucasian healthy people. „Am J Gastroenterol”. 102, s. 1259-1267, 2007. DOI: 10.1111/j.1572-0241.2007.01149.x. PMID: 17319929.
- ↑ Agata Witanowska, Grażyna Rydzewska: Epidemiologia i przebieg kliniczny choroby Leśniowskiego-Crohna. W: Grażyna Rydzewska, Ewa Małecka-Panas (red): Choroba Leśniowskiego-Crohna – 100 lat diagnostyki i terapii. Poznań: Termedia Wydawnictwa Medyczne, 2008, s. 23–36. ISBN 978-83-89825-53-7.
- ↑ a b Hanauer SB. Inflammatory bowel disease. „N Engl J Med”. 334. 13, s. 841-8, 1996. PMID: 8596552.
- ↑ Mueller MH., Kreis ME., Gross ML., Becker HD., Zittel TT., Jehle EC. Anorectal functional disorders in the absence of anorectal inflammation in patients with Crohn's disease.. „Br J Surg”. Aug;89. 8, s. 1027-31, 2002. DOI: 10.1046/j.1365-2168.2002.02173.x. PMID: 12153630.
- ↑ Hampe, J, Grebe, J, Nikolaus, S, Solberg, C, Croucher, PJ, Mascheretti, S, Jahnsen, J, Moum, B, Klump, B, Krawczak, M, Mirza, MM, Foelsch, UR, Vatn, M, Schreiber, S. Association of NOD2 (CARD 15) with clinical course of Crohn's disease: a cohort study. „Lancet”. 359. 9318, s. 1661-1665, 2002. PMID: 12020527.
- ↑ Wu, S, Lim, KC, Huang, J, Saidi, RF, Sears, CL. Bacteroides fragilis enterotoxin cleaves the zonula adherens protein, E-cadherin. „Proc Natl Acad Sci U S A”. 95. 25, s. 14979-14984, 1998. PMID: 9844001.
Bibliografia
- Witold Mizerski: Tablice Biologiczne. Wydawnictwo Adamantan, 2013. ISBN 978-83-7350-243-7.
- Krzysztof Boczkowski: Zarys genetyki medycznej: podręcznik dla studentów medycyny. Wyd. Wyd. 2. zmienione i uzupełnione. Warszawa: Wydawnictwo Lekarskie PZWL, 1990. ISBN 978-83-200-1475-4. OCLC 25511069.
Linki zewnętrzne
- wortal Stowarzyszenia na Rzecz Dzieci z Zaburzeniami Genetycznymi
- OMIM — Online Mendelian Inheritance in Man, katalog genów człowieka i chorób genetycznych
- Genetic and Rare Diseases Information Center (GARD) Office of Rare Diseases (ORD), National Institutes of Health (NIH)
- CDC’s National Center on Birth Defects and Developmental Disabilities
- Informacje o chorobach genetycznych z Human Genome Project
- Global Genes Project, Genetic and Rare Diseases Organization
